Международный эндокринологический журнал 2 (74) 2016
Вернуться к номеру
Патогенетические особенности язвенной болезни желудка и двенадцатиперстной кишки в сочетании с артериальной гипертензией и сахарным диабетом 2-го типа
Авторы: Сицинская И.А. - Высшее государственное учебное заведение Украины «Буковинский государственный медицинский университет», г. Черновцы, Украина
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
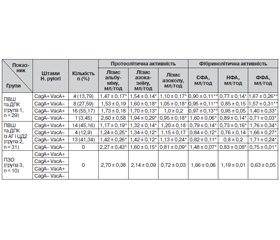
Розвиток та перебіг пептичної виразки шлунка та дванадцятипалої кишки супроводжуються наявністю штамів H. pylori (СagA+ VacA+, СagA+ vacА–, CagA– VacA+, CagA– VacA–), що виявлено у хворих за наявності супутньої патології та коли її немає. У групі хворих на пептичну виразку шлунка та дванадцятипалої кишки в поєднані з артеріальною гіпертензією і цукровим діабетом 2-го типу виявлено штами СagA+ VacA+ у 14 осіб (45,16 %), СagA+ VacA– — у 4 (12,9 %), CagA– VacA+ — у 13 (41,43 %) та в групі хворих на пептичну виразку шлунка та дванадцятипалої кишки — відповідно в 4 (13,79 %), у 8 (27,59 %), у 16 (55,17 %) осіб. Вплив штамів H. pylori супроводжується змінами протеолітичної та фібринолітичної активності. З урахуванням супутньої патології та ролі штамів при розвитку основної патології виявлено вірогідне зниження рівня лізису альбуміну, лізису азоказеїну та підвищення лізису азоколу порівняно зі зниженням сумарної фібринолітичної активності, неферментативної фібринолітичної активності та підвищенням ферментативної фібринолітичної активності. Використання антихелікобактерної базисної терапії та пробіотиків (Lactobacterium, Bifidobacterium) дає позитивний результат.
Развитие и течение язвенной болезни желудка и двенадцатиперстной кишки сопровождаются наличием штаммов H. pylori (СagA+ VacA+, СagA+ vacА–, CagA– VacA+, CagA– VacA–), что обнаружено у больных при наличии сопутствующей патологии и при ее отсутствии. В группе больных пептической язвой желудка и двенадцатиперстной кишки в сочетании с артериальной гипертензией и сахарным диабетом 2-го типа обнаружены штаммы СagA+ VacA+ у 14 человек (45,16 %), СagA+ VacA– — у 4 (12,9 %), CagA– VacA+ — у 13 (41,43 %) и в группе больных пептической язвой желудка и двенадцатиперстной кишки — соответственно у 4 (13,79 %), у 8 (27,59 %), у 16 человек (55,17 %). Влияние штаммов H. pylori сопровождается изменениями протеолитической и фибринолитической активности. С учетом сопутствующей патологии и роли штаммов при развитии основной патологии обнаружено достоверное снижение уровня лизиса альбумина, лизиса азоказеина и повышение лизиса азокола по сравнению со снижением суммарной фибринолитической активности, неферментативной фибринолитической активности и повышением ферментативной фибринолитической активности. Использование антихеликобактерной базисной терапии и пробиотиков (Lactobacterium, Bifidobacterium) дает положительный результат.
The development and course of gastroduodenal peptic ulcer are associated with the strains of H.pylori (сagA+ vacA+, сagA+ vacА–, сagA– vacA+, сagA– vacA–) that was found in patients in the presence of comorbidity and in its absence. In the group of patients with gastroduodenal peptic ulcer combined with hypertension and diabetes mellitus type 2, сagA+ vacA+ strains were found in 14 individuals (45.16 %), сagA+ vacA– — in 4 (12.9 %), сagA– vacA+ — in 13 (41.43 %), and in patients with gastroduodenal peptic ulcer — in 4 (13.79 %), 8 (27.59 %) and 16 (55.17 %) persons, respectively. The impact of H.pylori strains is associated with the changes of proteolytic and fibrinolytic activity. Given the comorbidity and the role of strains in the development of underlying disease, there has been revealed a probable reduction in the level of albumin lysis, azocasein lysis and an increase in azocol lysis compared with reduced total fibrinolytic activity, non-enzymatic fibrinolytic enzyme activity and increased enzymatic fibrinolytic activity. The use of baseline anti-Helicobacter pylori therapy and probiotics (Lactobacterium, Bifidobacterium) provides a positive result.
пептична виразка шлунка, дванадцятипала кишка, артеріальна гіпертензія, цукровий діабет 2-го типу, протеоліз, фібриноліз, штами H. pylori, пробіотики.
язвенная болезнь желудка, двенадцатиперстная кишка, артериальная гипертензия, сахарный диабет 2-го типа, протеолиз, фибринолиз, штаммы H. pylori, пробиотики.
peptic gastric ulcer, duodenum, hypertension, diabetes mellitus type 2, proteolysis, fibrinolysis, strains of H.pylori, probiotics.
Статтю опубліковано на с. 96-100
Вступ
Матеріал і методи
Результати дослідження
Обговорення результатів
Висновки
1. Губергриц Н.Б. Поджелудочная железа и H. pylori / Н.Б. Губергриц // Сучасна гастроентерологія. — 2008. — № 3. — С. 84-89.
2. Жакун І.Б. Helicobacter pylori, запалення та ліпіди / І.Б. Жакун // Сучасна гастроентерол. — 2006. — № 5(31). — С. 16-20.
3. Зак М.Ю. Вплив токсигенних штамів H. pylori на морфологічні зміни в слизовій оболонці шлунка у пацієнтів з хронічним атрофічним гастритом / М.Ю. Зак // Сучасна гастроентерологія. — 2010. — № 5(55) — С. 37-42.
4. Місяченко М.М. Взаємозв’язок порушень ліпідного спектру крові та наявності Нelicobacter pylori / М.М. Місяченко // Акт. пробл. сучасн. мед. — 2013. — Т. 13, № 3. — С. 190-192.
5. Павлов О.Н. Связь инфекции Helicobacter pylori и системного воспаления у больных с нестабильным течением ишемической болезни сердца / О.Н. Павлов // Практ. медицина. Гастроэнтерол. — 2012. — № 3 [электронный ресурс]. — Режим доступа http://pmarchive.ru/svyaz-infekcii-helicobacterpylori-i-sistemnogo-vospaleniya-u-bolnyx-s-nestabilnymtecheniem-ishemicheskoj-bolezn.
6. Amieva M.R., El-Omar E.M. Helicobacter pylori. Взаимодействие хозяина и инфекции / M.R. Amieva, E.M. El-Omar // Therapia. — 2009. — № 1. — С. 8-22.
7. Albaker W.I. Helicobacter pylori infection and its relationship to metabolic syndrome: Is it a myth or fact? / W.I. Albaker // Saudi J. Gastroenterol. — 2011. — Vol. 17. — Р. 165-169.
8. Backert S. The versatility of Helicobacter pylori CagA effector protein functions: the master key hypothesis / S. Backert, N. Tegtmeyer, M. Selbach // Helicobacter. — 2010. — № 15. — Р. 163-176.
9. Baudron C.R. Extragastric diseases and Helicobacter pylori / C.R. Baudron, F. Franceschi // Helicobacter. — 2013. — Vol. 18. — P. 44-51.
10. Kang H.Y. Progression of atrophic gastritis and intestinal metaplasia drives Helicobacter pylori out of the gastric mucosa / H.Y. Kang, N. Kim, Y.S. Park et al. // J. Clin. Gastroenterol. — 2008. — Vol. 42(1). — P. 29-35.
11. Rogha M., Nikvarz M., Pourmoghaddas Z. et al. Is Helicobacter pylori infection a risk factor for coronary heart disease? // ARYA Atheroscleros. — 2012. — Vol. 8. — P. 5-8.
12. Tegtmeyer N. Role of the cag-pathogenicity island encoded type IV secretion system in Helicobacter pylori pathogenesis / N. Tegtmeyer, S. Wessler, S. Backert // FEBS J. — 2011. — № 278. — Р. 1190-202.
13. Cellini L. Searching the point of no return in Helicobacter pylori life: necrosis and/or programmed death? / L. Cellini, I. Robuffo, N.M. Maraldi, G. Donelli // J. Appl. Microbiol. — 2001. — № 90. — Р. 727-732.

/97.jpg)
/99.jpg)