Международный эндокринологический журнал 2 (74) 2016
Вернуться к номеру
Уровни моноцитарного хемоаттрактантного протеина у больных с первичным гипотиреозом
Авторы: Дидушко О.Н. - Ивано-Франковский национальный медицинский университет, г. Ивано-Франковск, Украина
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Мета дослідження — визначити вміст моноцитарного хемоатрактантного протеїну‑1 (МХП‑1) у сечі хворих на первинний гіпотиреоз.
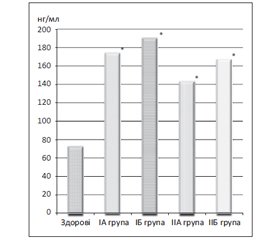
Матеріали і методи. Обстежено 141 хворого з маніфестним гіпотиреозом. З числа обстежених у 71 пацієнта був післяопераційний гіпотиреоз, у 70 — гіпотиреоз на тлі автоімунного тиреоїдиту (АІТ). Пацієнти були розділені на ІА групу, що становили з 35 пацієнтів із гіпотиреозом на ґрунті АІТ без ожиріння; ІБ групу — 35 хворих на АІТ із гіпотиреозом та ожирінням; ІІА групу — 34 хворіх на післяопераційний гіпотиреоз без ожиріння; IІБ групу — 37 хворих на післяопераційний гіпотиреоз з ожирінням.
Результати. В обстежених пацієнтів виявлено вірогідне підвищення рівнів МХП‑1 у всіх групах. При проведенні кореляційного аналізу встановлений прямий кореляційний зв’язок між рівнями МХП‑1 і тиреотропним гормоном, а також рівнем креатиніну в крові та зворотний середньої сили кореляційний зв’язок між швидкістю клубочкової фільтрації та концентрацією МХП‑1 із найбільшим ступенем вираженості при некомпенсованому гіпотиреозі на ґрунті АІТ з ожирінням.
Висновки. Виявлені зв’язки свідчать, що рівень МХП‑1 певною мірою відображає функціональний стан нирок та може бути використаний як доповнення до традиційних методів обстеження хворих.
Цель исследования — определить содержание моноцитарного хемоаттрактантного протеина‑1 (МХП‑1) в моче больных первичным гипотиреозом.
Материалы и методы. Обследован 141 больной с манифестным гипотиреозом. Из числа обследованных у 71 пациента был послеоперационный гипотиреоз, у 70 — гипотиреоз на фоне аутоиммунного тиреоидита (АИТ). Пациенты были разделены на IA группу, состоящую из 35 пациентов с гипотиреозом на почве АИТ без ожирения; ІБ группу — 35 больных АИТ с гипотиреозом и ожирением; ІІА группу — 34 больных послеоперационным гипотиреозом без ожирения; IІБ группу — 37 больных послеоперационным гипотиреозом с ожирением.
Результаты. У обследованных пациентов выявлено достоверное повышение уровней МХП‑1 во всех группах. При проведении корреляционного анализа установлена прямая корреляционная связь между уровнями МХП‑1 и тиреотропного гормона, а также уровнем креатинина в крови и обратная средней силы корреляционная связь между скоростью клубочковой фильтрации и концентрацией МХП‑1 с наибольшей степенью выраженности при некомпенсированном гипотиреозе на почве АИТ с ожирением.
Выводы. Выявленные связи свидетельствуют, что уровень МХП‑1 в определенной степени отражает функциональное состояние почек и может быть использован как дополнение к традиционным методам обследования больных.
Objective of the research — to study the content of monocyte chemoattractant protein‑1 (MCP‑1) in the urine of patients with primary hypothyroidism.
Materials and methods. 141 patients with overt hypothyroidism have been examined. Among them, 71 patients had postoperative hypothyroidism, 70 — hypothyroidism on the background of autoimmune thyroiditis (AIT). Patients were divided: into I A group consisted of 35 patients with hypothyroidism following AIT without obesity; I B group — 35 patients suffering from AIT with hypothyroidism and obesity; II A group — 34 patients with postoperative hypothyroidism without obesity; II B group — patients with postoperative hypothyroidism and obesity.
Results. The surveyed patients had significant increase of MHP‑1 levels in all groups. During correlation analysis, we have established a direct correlation between levels of MHP‑1 and thyroid-stimulating hormone, as well as creatinine levels in the blood and the reverse correlation of medium strength between glomerular filtration rate and concentration of MHP‑1, with the highest severity in the uncompensated hypothyroidism on the background of AIT with obesity.
Conclusions. Identified correlations indicate that the level of MHP‑1 to a certain extent reflects renal function and can be used as a complement to traditional methods of examination of patients.
гіпотиреоз, тиреоїдні гормони, моноцитарний хемоатрактантний протеїн‑1.
гипотиреоз, тиреоидные гормоны, моноцитарный хемоаттрактантный белок‑1.
hypothyroidism, thyroid hormones, monocyte chemoattractant protein‑1.
Статтю опубліковано на с. 87-91
Роботу виконано в рамках науково-дослiдної роботи кафедри ендокринології ДВНЗ «Iвано-Франкiвський нацiональний медичний унiверситет»: «Розробка нових підходів до комплексного лікування гіпотиреозу» (номер держреєстрацiї 0113U 005376; 2013-2018 рр.). Автор гарантує вiдсутнiсть конфлiкту iнтересiв та власної фiнансової зацiкавленостi при виконаннi роботи та написаннi статтi.
Вступ
Матеріали та методи
Результати
/89.jpg)
Обговорення
Висновки
1. Basu G., Mohapatra A. Interactions between thyroid disorders and kidney disease // Indian J. Endocrinol. Metab. — 2012. — Vol. 16(2). — P. 204-213.
2. The monocyte chemoattractant protein‑1 / CCR 2 loop, inducible by TGF-beta, increases podocyte motility and albumin permeability / E.U. Lee, C.H. Chung, C.C. Khoury et al. // Amer. J. Physiol. Renal Physol. — 2009. — Vol. 297(1). — P. 85-94.
3. Chiarelli F., Cipollone F., Mohn A. et al. Circulating monocyte chemoattractant protein‑1 and early development of nephropathy in type 1 diabetes // Diabetes Care. — 2002. — Vol. 25. — P. 1829-1834.
4. Clinical and biochemical implications of low thyroid hormone levels (total and free forms) in euthyroid patients with chronic kidney disease / J.J. Carrero, A.R. Qureshi, J. Axelsson et al. // Journal of Internal Medicine. — 2007. — Vol. 262(6). — P. 690-701.
5. Comparison of serum concentrations of C-reactive protein, TNF-alpha, and IL6 between elderly Korean women with normal and impaired glucose tolerance / K.M. Choi, J. Lee, K.W. Lee et al. // Diabetes Res. Clin. Pract. — 2004. — Vol. 64. — P. 99-106.
6. Decrease in renal function associated with hypothyroidism / P. Stoyanov, J.A.M. Navarro, E.M. Herrero, M.J. Gutierrez Sanchez // Nephrologia. — 2010. — Vol. 30(3). — P. 378-380.
7. Eddy A.A. Progression in chronic kidney disease // Adv. Chronic Kidney Dis. — 2005. — Vol. 12. — P. 353-365.
8. Clinical Management of Thyroid Disease / Ed. by F.E. Wondisford, S. Radovick. — Baltimore, Maryland: John Hopkins University School of Medicine, 2009. — 860 p.
9. Giunti S., Barutta F., Perin P.C., Gruden G. Targeting the MCP‑1/CCR 2 System in diabetic kidney disease // Curr. Vasc. Pharmacol. — 2010. — Vol. 8(6). — P. 849-860.
10. Correlation between severity of thyroid dysfunction and renal function. / J.G. Den Hollander, R.W. Wulkan, M.J. Mantel, A. Berghout // Clin. Endocrinol. — 2005. — Vol. 62. — P. 423-427.
11. Vargas F., Moreno J.M., Rodriguez-Gomez I. et al. Vascular and renal function in experimental thyroid disorders // Eur. J. Endocrinol. — 2006. — Vol. 154. — P. 197-212.
12. Vernon M.A., Mylonas K.J., Hughes J. Macrophages and renal fibrosis // Semin. Nephrol. — 2010. — Vol. 30(3). — P. 302-317.
13. Meuwese C.L., Dekker F.W., Lindholm B. et al. Baseline levels and trimestral variation of triiodothyronine and thyroxine and their association with Mortality in maintenance hemodialysis patients // Clin. J. Am. Soc. Nephrol. — 2012. — Vol. 7. — P. 131-138.
14. Tesch G.H. MCP‑1/CCL2: a new diagnostic marker and therapeutic target for progressive renal injury in diabetic nephropathy // Am. J. Physiol. Renal Physiol. — 2008. — Vol. 294. — P. 697-701.
15. Thyroid function, endothelium, and inflammation in hemodialyzed patients: possible relations? / J. Malyszko, J.S. Malyszko, K. Pawlak, M. Mysliwiec // J. Ren. Nutr. — 2007. — Vol. 17(1). — P. 30-37.
16. Williams T.M., Little M.H., Ricardo S.D. Macrophages in renal development, injury, and repair // Semin. Nephrol. — 2010. — Vol. 30(3). — P. 255-267.