Журнал «Здоровье ребенка» 1 (69) 2016
Вернуться к номеру
Механизм действия активированных азотсодержащих метаболитов в респираторном тракте. Провоспалительное действие (часть 2)
Авторы: Абатуров А.Е. - ГУ «Днепропетровская медицинская академия Министерства здравоохранения Украины»; Волосовец А.П. - Национальный медицинский университет им. А.А. Богомольца, г. Киев; Худяков А.Е. - ГУ «Днепропетровская медицинская академия Министерства здравоохранения Украины»
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
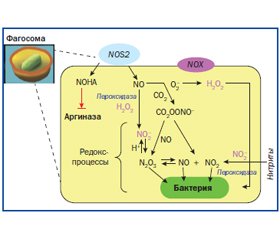
В обзоре литературы изложены современные данные об антибактериальном и противовирусном действии монооксида азота. Подробно рассмотрены бактерицидное действие монооксида азота в фагосоме, участие монооксида азота в развитии гриппозной инфекции. Представлено значение деятельности индуцибeльной изоформы нитрооксидсинтетазы при инфекционных заболеваниях, вызванных различными возбудителями. Показано участие альвеолярных макрофагов в образовании пероксинитрита, влияние монооксида азота на дренажную функцию респираторного тракта, бронходилатирующее и бронхопротекторное действие монооксида азота.
В огляді літератури висвітлені сучасні дані щодо антибактеріальної та противірусної дії монооксиду азоту. Докладно розглянуто бактерицидну дію монооксиду азоту в фагосомі, участь монооксиду азоту в розвитку грипозної інфекції. Наведено значення діяльності індуцибельної ізоформи нітрооксидсинтетази при інфекційних захворюваннях, викликаних різними збудниками. Показано участь альвеолярних макрофагів у синтезі пероксинітриту, вплив монооксиду азоту на дренажну функцію респіраторного тракту, бронходилатуючу та бронхопротекторну дію монооксиду азоту.
The review of literature presents modern data about antibacterial and antiviral effect of nitrogen monoxide. Bactericidal action of nitric monoxide in the phagosome, involvement of nitrogen monoxide in the development of influenza infection are considered in detail. The value of activity of inducible isoform of nitrogen oxide synthetase in infectious diseases caused by various pathogens is presented. The participation of alveolar macrophages in the formation of peroxynitrite, the effect of nitric monoxide on the drainage function of the respiratory tract, bronchodilatory and bronchoprotective action of nitrogen monoxide are shown.
активированные азотсодержащие метаболиты, легкие, провоспалительное действие.
активовані азотумісні метаболіти, легені, прозапальна дія.
activated nitrogen-containing metabolites, lungs, proinflammatory effect.
Статтю опубліковано на с. 160-164
Введение
/161.jpg)
1. Akaike T. Nitric oxide and virus infection / T. Akaike, H. Maeda // Immunology. — 2000. — Vol. 101, № 3. — P. 300-308. — PMID: 11106932.
2. Allain A. Role of nitric oxide in developmental biology in plants, bacteria, and man / A. Allain, V.T. Hoang, G.F. Lasker et al. // Curr. Top. Pharmacol. — 2011. — № 15(2). — Р. 25-33. — PMID: 24563585.
3. Antimicrobial actions of the NADPH phagocyte oxidase and inducible nitric oxide synthase in experimental salmonellosis. I. Effects on microbial killing by activated peritoneal macrophages in vitro / A. Vazquez-Torres, J. Jones-Carson, P. Mastroeni et al. // J. Exp. Med. — 2000. — Vol. 192. — P. 227-236. — PMID: 10899909.
4. Bogdan C. Nitric oxide and the immune response // Nat. Immunol. — 2001. — Vol. 2, № 10. — P. 907-916. — PMID: 11577346.
5. Cuzzocrea S. Effect of inhibitors of nitric oxide in animal models and future directions for therapy in inflammatory disorders // Current. Med. Chem. Anti-inflammatory & Anti-allergy agent. — 2004. — Vol. 3. — P. 261-270. — Doi: 10.2174/1568014043355302.
6. Fang F.C. Antimicrobial reactive oxygen and nitrogen species: concepts and controversies // Nat. Rev. Microbiol. — 2004. — Vol. 2. — P. 820-832. — PMID: 15378046.
7. Fatal outcome of pandemic H1N1 2009 influenza virus infection is associated with immunopathology and impaired lung repair, not enhanced viral burden, in pregnant mice / G. Marcelin, J.R. Aldridge, S. Duan et al. // J. Virol. — 2011. — Vol. 85, № 21. — P. 11208-11219. — Doi: 10.1128/JVI.00654-11. Epub 2011 Aug 24.
8. Flannagan R.S. Antimicrobial mechanisms of phagocytes and bacterial evasion strategies / R.S. Flannagan, G. Cosío, S. Grinstein // Nat. Rev. Microbiol. — 2009. — Vol. 7, № 5. — P. 355-366. — Doi: 10.1038/nrmicro2128.
9. Goodrum K.J. Cytokine Responses to Group B Streptococci Induce Nitric Oxide Production in Respiratory Epithelial Cells / K.J. Goodrum, J. Poulson-Dunlap // Infect. Immun. — 2002. — Vol. 70, № 1. — P. 49-54. — PMID: 11748162.
10. IL-22 mediates mucosal host defense against Gram-negative bacterial pneumonia / S.J. Aujla, Y.R. Chan, M. Zheng et al. // Nat. Med. — 2008. — Vol. 14, № 3. — P. 275-281. — Doi: 10.1038/nm1710. Epub 2008 Feb 10.
11. Li H. Physiological mechanisms regulating the expression of endothelial-type NO synthase / H. Li, T. Wallerath, U. Forstermann // Nitric. Oxide. — 2002. — Vol. 7. — P. 132-147. — PMID: 12223183.
12. Mannick J.B. Immunoregulatory and antimicrobial effects of nitrogen oxides // Proc. Am. Thorac Soc. — 2006. — Vol. 3, № 2. — Р. 161-165. — PMID: 16565425.
13. Mehta D.R. The nitric oxide pathway provides innate antiviral protection in conjunction with the type I interferon pathway in fibroblasts / D.R. Mehta, A.A. Ashkar, K.L. Mossman // PLoS One. — 2012. — Vol. 7, № 2. — P. e31688. — Doi: 10.1371/journal.pone.0031688. Epub 2012 Feb 21.
14. Nathan C. Nitric oxide synthases: roles, tolls, and controls / C. Nathan, Q.W. Xie // Cell. — 1994. — Vol. 78, № 6. — P. 915-918. — PMID: 7522969.
15. Nitric oxide and redox mechanisms in the immune response / D.A. Wink, H.B. Hines, R.Y. Cheng et al. // J. Leukoc. Biol. — 2011. — Vol. 89, № 6. — P. 873-691. — Doi: 10.1189/jlb.1010550. Epub 2011 Jan 13.
16. Nitric oxide inhibits the adenovirus proteinase in vitro and viral infectivity in vivo / W. Cao, M.L. Baniecki, W.J. McGrath et al. // FASEB J. — 2003. — Vol. 17. — P. 2345-2346. — PMID: 14525937.
17. Nitric Oxide in Health and Disease of the Respiratory System / F.L.M. Ricciardolo, P.J. Sterk, B. Gaston, G. Folkerts // Physiol. Rev. — 2004. — Vol. 84, № 3. — P. 731-765. — PMID: 15269335.
18. Nitric oxide synthase 1 as a potential modifier gene of decline in lung function in patients with cystic fibrosis / J. Texereau, S. Marullo, D. Hubert et al. // Thorax. — 2004. — Vol. 59. — P. 156-158. — PMID: 14760158.
19. Oxidant-Antioxidant Balance in Acute Lung Injury / J.D. Lang, P.J. McArdle, P.J. O’Reilly, S. Matalon // Chest. — 2002. — Vol. 122. — P. 314S-320S. — PMID: 12475808.
20. Pacher P. Nitric oxide and peroxynitrite in health and disease / P. Pacher, J.S. Beckman, L. Liaudet // Physiol. Rev. — 2007. — Vol. 87, № 1. — P. 315-424. — PMID: 17237348.
21. Pamer E.G. Tipping the balance in favor of protective immunity during influenza virus infection // Proc. Natl. Acad. Sci. USA. — 2009. — Vol. 106, № 13. — P. 4961-4962. — Doi: 10.1073/pnas.0901574106. Epub 2009 Mar 25.
22. Peroxynitrite inhibition of coxsackievirus infection by prevention of viral RNA entry / E. Padalko, T. Ohnishi, K. Matsushita et al. // Proc. Natl. Acad. Sci USA. — 2004. — Vol. 101. — P. 11731-11736. — PMID: 15286280.
23. Ricciardolo F.L.M. Multiple roles of nitric oxide in the airways // Thorax. — 2003. — Vol. 58. — P. 175-182. — PMID: 12554905.
24. Stamler J.S. Nitrosylation; the prototypic redox-based signaling mechanism / J.S. Stamler, S. Lamas, F.C. Fang // Cell. — 2001. — Vol. 106. — P. 675-683. — PMID: 11572774.
25. The role of iNOS in wound healing / H.P. Shi, D. Most, D.T. Efron et al. // Surgery. — 2001. — Vol. 130. — P. 225-229. — PMID: 11490353.
26. The role of nitric oxide in inflammatory reactions / P. Tripathi, P. Tripathi, L. Kashyap, V. Singh // FEMS Immunol. Med. Microbiol. — 2007. — Vol. 51, № 3. — P. 443-452. — PMID: 17903207.
27. Tripathi P. Nitric oxide and immune response // Indian. J. Biochem. Biophys. — 2007. — Vol. 44, № 5. — P. 310-319. — PMID: 18341206.
28. Vazquez-Torres A. Oxygen-dependent anti-Salmonella activity of macrophages / A. Vazquez-Torres, F.C. Fang // Trends Microbiol. — 2001. — Vol. 9. — P. 29-33. — PMID: 11166240.
29. Wong S. H. Caspases and nitric oxide broadly regulate dendritic cell maturation and surface expression of class II MHC proteins / S.H. Wong, L. Santambrogio, J.L. Strominger // Proc. Natl. Acad. Sci. USA. — 2004. — Vol. 101, № 51. — P. 17783-17788. — PMID: 15598739.
30. Zaki M.H. Nitric oxide-induced nitrative stress involved in microbial pathogenesis / M.H. Zaki, T. Akuta, T. Akaike // J. Pharmacol. Sci. — 2005. — Vol. 98, № 2. — P. 117-129. — PMID: 15937405.
1. Akaike T, Maeda H. Nitric oxide and virus infection. Immunology. 2000 Nov;101(3):300-8. PMID: 11106932.
2. Allain AV, Hoang VT, Lasker GF, Pankey EA, Murthy SN, Kadowitz PJ. Role of nitric oxide in developmental biology in plants, bacteria, and man.Curr Top Pharmacol. 2011;15(2):25-33. PMID: 24563585.
3. Vazquez-Torres A, Jones-Carson J, Mastroeni P, Ischiropoulos H, Fang FC. Antimicrobial actions of the NADPH phagocyte oxidase and inducible nitric oxide synthase in experimental salmonellosis. I. Effects on microbial killing by activated peritoneal macrophages in vitro. J Exp Med. 2000 Jul 17;192(2):227-36. PMID: 10899909.
4. Bogdan C. Nitric oxide and the immune response.Nat Immunol. 2001 Oct;2(10):907-16. PMID: 11577346.
5. Cuzzocrea S. Effect of inhibitors of nitric oxide in animal models and future directions for therapy in inflammatory disorders. Current Med Chem Anti-inflammatory & Anti-allergy agent. 2004;3:261–270. doi: 10.2174/1568014043355302.
6. Fang FC. Antimicrobial reactive oxygen and nitrogen species: concepts and controversies.Nat Rev Microbiol. 2004 Oct;2(10):820-32. PMID:15378046.
7. Marcelin G, Aldridge JR, Duan S, Ghoneim HE, Rehg J, Marjuki H, Boon AC, McCullers JA, Webby RJ. Fatal outcome of pandemic H1N1 2009 influenza virus infection is associated with immunopathology and impaired lung repair, not enhanced viral burden, in pregnant mice. J Virol. 2011 Nov;85(21):11208-19. doi: 10.1128/JVI.00654-11. Epub 2011 Aug 24.
8. Flannagan RS, Cosío G, Grinstein S. Antimicrobial mechanisms of phagocytes and bacterial evasion strategies. Nat Rev Microbiol. 2009 May;7(5):355-66. doi: 10.1038/nrmicro2128.
9. Goodrum KJ, Poulson-Dunlap J. Cytokine responses to group B streptococci induce nitric oxide production in respiratory epithelial cells. Infect Immun. 2002 Jan;70(1):49-54. PMID:11748162.
10. Aujla SJ, Chan YR, Zheng M, Fei M, Askew DJ, Pociask DA, Reinhart TA, McAllister F, Edeal J, Gaus K, Husain S, Kreindler JL, Dubin PJ, Pilewski JM,Myerburg MM, Mason CA, Iwakura Y, Kolls JK. IL-22 mediates mucosal host defense against Gram-negative bacterial pneumonia.Nat Med. 2008 Mar;14(3):275-81. doi: 10.1038/nm1710. Epub 2008 Feb 10.
11. Li H, Wallerath T, Förstermann U. Physiological mechanisms regulating the expression of endothelial-type NO synthase. Nitric Oxide. 2002 Sep;7(2):132-47. PMID:12223183.
12. Mannick JB. Immunoregulatory and antimicrobial effects of nitrogen oxides. Proc Am Thorac Soc. 2006 Apr;3(2):161-5. PMID: 16565425.
13. Mehta DR, Ashkar AA, Mossman KL. The nitric oxide pathway provides innate antiviral protection in conjunction with the type I interferon pathway in fibroblasts.PLoS One. 2012;7(2):e31688. doi: 10.1371/journal.pone.0031688. Epub 2012 Feb 21.
14. Nathan C, Xie QW. Nitric oxide synthases: roles, tolls, and controls. Cell. 1994 Sep 23;78(6):915-8. PMID: 7522969.
15. Wink DA, Hines HB, Cheng RY, Switzer CH, Flores-Santana W, Vitek MP, Ridnour LA, Colton CA. Nitric oxide and redox mechanisms in the immune response. J Leukoc Biol. 2011 Jun;89(6):873-91. doi: 10.1189/jlb.1010550. Epub 2011 Jan 13.
16. Cao W, Baniecki ML, McGrath WJ, Bao C, Deming CB, Rade JJ, Lowenstein CJ, Mangel WF. Nitric oxide inhibits the adenovirus proteinase in vitro and viral infectivity in vivo.FASEB J. 2003 Dec;17(15):2345-6. Epub 2003 Oct 2. PMID: 14525937.
17. Ricciardolo FL, Sterk PJ, Gaston B, Folkerts G. Nitric oxide in health and disease of the respiratory system. Physiol Rev. 2004 Jul;84(3):731-65. PMID: 15269335.
18. Texereau J, Marullo S, Hubert D, Coste J, Dusser DJ, Dall'Ava-Santucci J, Dinh-Xuan AT. Nitric oxide synthase 1 as a potential modifier gene of decline in lung function in patients with cystic fibrosis.Thorax. 2004 Feb;59(2):156-8. PMID: 14760158.
19. Lang JD, McArdle PJ, O'Reilly PJ, Matalon S. Oxidant-antioxidant balance in acute lung injury. Chest. 2002 Dec;122(6 Suppl):314S-320S. PMID: 12475808.
20. Pacher P, Beckman JS, Liaudet L. Nitric oxide and peroxynitrite in health and disease. Physiol Rev. 2007 Jan;87(1):315-424. PMID: 17237348.
21. Pamer EG. Tipping the balance in favor of protective immunity during influenza virus infection. Proc Natl Acad Sci U S A. 2009 Mar 31;106(13):4961-2. doi: 10.1073/pnas.0901574106. Epub 2009 Mar 25.
22. Padalko E, Ohnishi T, Matsushita K, Sun H, Fox-Talbot K, Bao C, Baldwin WM 3rd, Lowenstein CJ. Peroxynitrite inhibition of Coxsackievirus infection by prevention of viral RNA entry. Proc Natl Acad Sci U S A. 2004 Aug 10;101(32):11731-6. Epub 2004 Jul 30. PMID: 15286280.
23. Ricciardolo FL. Multiple roles of nitric oxide in the airways. Thorax. 2003 Feb;58(2):175-82. PMID: 12554905.
24. Stamler JS, Lamas S, Fang FC. Nitrosylation. the prototypic redox-based signaling mechanism.Cell. 2001 Sep 21;106(6):675-83. PMID: 11572774.
25. Shi HP, Most D, Efron DT, Tantry U, Fischel MH, Barbul A. The role of iNOS in wound healing. Surgery. 2001 Aug;130(2):225-9. PMID: 11490353.
26. Tripathi P, Tripathi P, Kashyap L, Singh V. The role of nitric oxide in inflammatory reactions. FEMS Immunol Med Microbiol. 2007 Dec;51(3):443-52. Epub 2007 Sep 27. PMID: 17903207.
27. Tripathi P. Nitric oxide and immune response. Indian J Biochem Biophys. 2007 Oct;44(5):310-9. PMID: 18341206.
28. Vazquez-Torres A, Fang FC. Oxygen-dependent anti-Salmonella activity of macrophages. Trends Microbiol. 2001 Jan;9(1):29-33. PMID: 11166240.
29. Wong SH, Santambrogio L, Strominger JL. Caspases and nitric oxide broadly regulate dendritic cell maturation and surface expression of class II MHC proteins. Proc Natl Acad Sci U S A. 2004 Dec 21;101(51):17783-8. Epub 2004 Dec 14. PMID: 15598739.
30. Zaki MH, Akuta T, Akaike T. Nitric oxide-induced nitrative stress involved in microbial pathogenesis. J Pharmacol Sci. 2005 Jun;98(2):117-29. Epub 2005 Jun 4. PMID: 15937405.

/162_2.jpg)
/162.jpg)