Статья опубликована на с. 88-96
Согласно номенклатуре и определению Комитета экспертов ВОЗ (Nomenclature and definitions, WHO, 1975), термин «обструкция дыхательных путей» обозначает «сужение или окклюзию дыхательных путей в результате скопления материала в просвете, утолщения стенки, сокращения бронхиальных мышц, уменьшения сил ретракции легкого, разрушения дыхательных путей без соответствующей потери альвеолярной ткани и/или компрессии дыхательных путей». Синдром обструкции дыхательных путей (СОДП) в детской практике встречается чрезвычайно часто, что обусловлено многообразием причин его развития, объясняющим трудности его дифференциальной диагностики [2, 17]. По результатам исследований, проведенных на кафедре педиатрии № 1 НМАПО имени П.Л. Шупика в 1997–1998 гг. с использованием международной унифицированной методики ISAAC [8, 13], повторные эпизоды свистящего затрудненного дыхания с удлиненным выдохом (wheezing) встречаются у трети (29,2–32,2 %) детской популяции. Особую сложность представляет дифференциация различных проявлений нарушения проходимости дыхательных путей у детей раннего возраста в качестве главного синдрома, вторичного синдрома и даже ятрогении. Бронхиальная астма (БА), обструктивный бронхит (ОБ), бронхиолит, острый стенозирующий ларинготрахеит, коклюш — заболевания, при которых нарушение проходимости дыхательных путей, прежде всего бронхов, является главным проявлением.
Среди всех случаев СОДП особое место по частоте занимает синдром бронхиальной обструкции (СБО). Под бронхообструкцией как частным проявлением СОДП понимают патологическое состояние, возникающее вследствие нарушения проходимости бронхов с последующим нарастанием сопротивления потоку воздуха во время вентиляции и характеризующееся эпизодами одышки в результате бронхоконстрикции, воспалительной инфильтрации, гиперсекреции и дискринии подслизистых желез, отека и гиперплазии слизистой бронхов [26, 29]. С биологической точки зрения обструкция дыхательных путей имеет защитно-приспособительный характер, препятствуя проникновению различных чужеродных агентов, в т.ч. инфекционных патогенов и аллергенов, в более глубокие отделы легких, в том числе и в альвеолы, таким образом предотвращая развитие пневмонии. В определенной мере она является универсальным механизмом защиты дыхательных путей, хотя и достаточно грубой защиты, повреждающей ткани посредством воспаления, гиперсекреции слизи, мукоцилиарного транспорта, кашля и даже бронхоспазма в случае поражения бронхов. Выявление причин и лечение СБО — ключевой момент в диагностических и терапевтических алгоритмах многих бронхообструктивных заболеваний у детей [27].
Патогенез
При формировании СБО развивается воспаление дыхательных путей с участием эпителиальных и эндотелиальных клеток, гранулоцитов, макрофагов, моноцитов, может быть Т-клеточная активация в ответ на инфекционный антиген или аллерген. В результате воспаления формируется нарушение геометрии мелких бронхов за счет утолщения стенки, закрытия просвета слизью и клеточным детритом, увеличения высвобождения провоспалительных цитокинов, повышения бронхиальной гиперчувствительности, нарушения нейрорегуляторных механизмов в связи с парасимпатической гиперреактивностью [12].
Физиологически важное мукоцилиарное очищение обеспечивается функционированием ресничек мерцательного эпителия, а также оптимальным качеством, количеством и транспортабельностью слизи. В физико-химическом отношении слизь представляет собой сложную структуру полутвердого геля, высокомолекулярные нитевидные полимеры которого при помощи серных и водородных связей образуют трехмерную сетку. С химической точки зрения секрет представляет собой щелочной протеид, который при величине рН 7,5–7,6 превращается из золя в гель. Коллоидная пленка секрета, покрывающая эпителий, вырабатывается в основном бокаловидными клетками и трубчато-альвеолярными железами слизистой оболочки. Мукоцилиарный транспорт осуществляется путем координированного удара ресничек в перицилиарном золевом слое, который складывается из эффективного удара и распрямления. Во время эффективного удара реснички достигают слоя геля и перемещают его наружу. Таким образом, реснички и окружающий слой слизи образуют биологически функциональное единство [23].
Нарушение мукоцилиарного клиренса (процесса очищения дыхательных путей) происходит как при избыточном образовании мокроты, так и при недостаточном, что приводит к застою мокроты (мукостазу), в результате которого страдает дренажная функция бронхов и нарушается вентиляционная функция легких, снижается эффективность защитных механизмов — мукоцилиарного транспорта и кашля, нарастает колонизация бронхов патогенной микрофлорой. Нарушение транспорта мокроты приводит к поддержанию и прогрессии воспаления и бронхообструкции [25].
Одним из клинических проявлений гиперреактивности дыхательных путей является кашель. В формировании кашлевого рефлекса участвуют [25]:
— кашлевые рецепторы, расположенные по ходу гортани, трахеи, бронхов, плевры, слухового прохода, полости носа, околоносовых пазух, глотки, перикарда, диафрагмы, желудка;
— афферентные нервы;
— кашлевой центр, расположенный в продолговатом мозге;
— эфферентные нервы;
— дыхательные мышцы.
У детей раннего возраста в силу морфофункциональных особенностей кашлевой рефлекс несовершенен. Поэтому при инфекциях дыхательных путей у новорожденных и детей первых месяцев жизни кашель часто отсутствует. Кроме того, кашель может быть причиной отказа от еды, срыгивания и рвоты, а в ряде случаев не выполнять дренажной функции [25].
Клинически степень нарушения проходимости бронхов при различной патологии зависит от соотношения отдельных компонентов бронхообструкции, наличия генетически обусловленной гиперреактивности бронхов, особенностей причинных факторов и воспаления. Важнейшими патофизиологическими компонентами острого СБО у детей являются отек слизистой оболочки бронхов, гиперсекреция слизи и бронхоспазм. При затяжном характере СБО развивается гиперплазия слизистой, а при хроническом воспалении, типичном для бронхиальной астмы и бронхолегочной дисплазии, постепенно формируются явления фиброза и склероза, что свидетельствует о структурной перестройке бронхов (ремодуляции) [12].
Чаще всего и клинически наиболее ярко СБО проявляется у детей первых лет жизни, что обусловлено морфофункциональными особенностями органов дыхания: узостью дыхательных путей, недостаточной эластичностью легких, мягкостью хрящей бронхиального дерева, недостаточной ригидностью грудной клетки, склонностью к развитию отеков, гиперсекрецией вязкой слизи, слабым развитием гладкой мускулатуры бронхов [12, 25].
Особое место в формировании повышенной бронхореактивности и развитии СБО занимают нейрорефлекторные механизмы, основой которых является функционирование вегетативной нервной системы. Вегетативные эффекты у детей раннего возраста по-разному представлены в разных органах, склонны к генерализации, очень лабильны, быстро переходят из одной системы в другую [12]. У здоровых детей грудного возраста преобладает тонус парасимпатического отдела вегетативной нервной системы (ваготония), что обусловливает сужение бронхов, вазодилатацию, потоотделение, перистальтику и повышение тонуса органов пищеварения, проявляется пастозностью, развитием отеков и гиперпродукцией густого секрета, гастроэзофагеальным рефлюксом, дискинезией кишечника, способствующими развитию СБО. В условиях ваготонии нарушается нормальный баланс между бронхоконстрикцией и бронходилатацией с вовлечением различных рецепторов. Эта дисфункция может привести к развитию рефлекторного бронхоспазма и гиперреактивности бронхов, влекущих формирование неаллергических механизмов БА.
β2-адренергические рецепторы обильно представлены в дыхательных путях и присутствуют на гладкомышечных клетках, эпителиоцитах, клетках подслизистых желез, многочисленных клетках воспаления, в альвеолах и пресинаптических нервах [7]. Функция β2-адренорецептора зависит от соединения с Gs-белком, стимулируемого аденилатциклазой, повышающей уровень циклического аденозинмонофосфата в клетке, высокое содержание которого, кроме расслабления гладкой мускулатуры бронхов, подавляет выброс медиаторов реакции гиперчувствительности немедленного типа из клеток воспаления (прежде всего из тучных), что важно для детей с атопией. После этого чувствительность β-адренорецептора к дальнейшей стимуляции снижается.
Другая группа рецепторов — мускариновые (холинергические). Из 5 их типов в легких присутствуют М1-, М2- и М3-рецепторы. Тонус мускулатуры бронхов определяется преимущественно парасимпатической (холинергической) иннервацией (ваготония) и значительно усилен при БА. Нейротрансмиттер ацетилхолин, высвобождающийся в нервных окончаниях через холинергические рецепторы, приводит к сокращению гладкой мускулатуры и усиливает секрецию подслизистых желез. Триггеры обострения процесса (гистамин, холодный воздух, физическая нагрузка) инициируют обструкцию прямым воздействием на рецепторы и активацию холинергического пути, усиливая гиперреактивность бронхов. Гладкомышечные клетки способны продуцировать интерлейкины, фактор роста и провоспалительные цитокины, которые могут инициировать, провоцировать или поддерживать воспаление. В ответ на сенсибилизацию в гладкомышечных клетках выделяется γ-интерферон, способный взаимодействовать с М2-рецептором, ингибируя его функцию, что в последующем ведет к увеличению выделения ацетилхолина [7].
Таким образом, анатомо-физиологические особенности органов дыхания и вегетативной ориентации детей раннего возраста обусловливают значительную частоту СБО и характерные особенности его клинических проявлений. Так, ведущим в развитии нарушения проходимости бронхов при ОБ является выраженный отек слизистой бронхов и гиперсекреция вязкой слизи, в отличие от БА, при которой основой нарушения бронхиальной проходимости является бронхоспазм [12]. Вместе с тем свойственное маленьким детям слабое развитие гладких мышц бронхов придает обострению БА ярко выраженную «бронхитическую» окраску, обусловленную гиперпродукцией вязкого секрета. Это маскирует реальную сущность заболевания и затрудняет дифференциальную диагностику с ОБ, хотя у некоторых детей уже на первом году жизни формируются типичные признаки бронхоспазма как главного компонента бронхообструкции [12].
Острая респираторная вирусная инфекция как индуктор и провокатор СБО
Участие вирусных патогенов в развитии астмы и провокации ее обострений уже давно доказано и характерно для детей всех возрастных групп, но наиболее велико их влияние на формирование СБО и особенно бронхиальной астмы у детей раннего возраста. Вирус-индуцированное повреждение эпителия способствует проникновению аллергенов и ирритантов, других вирусов и патогенов. Особое значение респираторные вирусы имеют в развитии дисфункции нервной регуляции тонуса гладкой мускулатуры бронхов в сторону преобладания ваготонии. Вирусы вступают в контакт с нервными окончаниями, повреждают М2-рецепторы, влияют на метаболизм нейропептидов (субстанция Р, нейрокинин А), тем самым повышают холинергическую чувствительность нервных волокон и формируют гиперреактивность дыхательных путей (рис. 1). Кроме того, повышенная невральная активность приводит к выбросу гистамина тучными клетками. С учетом недостаточной плотности β2-рецепторов и преобладающей активности М-холинорецепторов у детей первых месяцев и лет жизни при СБО необходим дифференцированный подход к назначению бронхолитиков [28].
/90.jpg)
Чаще всего в детской практике встречаются варианты СБО, обусловленные инфекционными (обструктивный бронхит, бронхиолит, хронический бронхит, респираторные микоплазмоз и хламидиоз, коклюш) и аллергическими (бронхиальная астма, поллиноз, миграционная стадия аскаридоза и токсокароза, аллергическая реакция на медикаменты — аспирин и другие нестероидные противовоспалительные средства, ингибиторы АПФ, β-адреноблокаторы и др.) факторами.
СБО инфекционного и аллергического генеза в раннем возрасте нередко приходится дифференцировать с различной патологией [12, 13]:
— врожденной патологией бронхолегочного аппарата;
— наследственными и врожденными заболеваниями (муковисцидоз, БЛД, дефицит α1-антитрипсина, первичные иммунодефициты, синдромы «неподвижных ресничек» и Картагенера, идиопатический легочный гемосидероз и фиброзирующий альвеолит);
— патологией гастроэзофагеальной зоны;
— врожденными пороками сердца и магистральных сосудов, кардиомиопатиями;
— патологией периода новорожденности (аспирационный синдром);
— объемными образованиями в грудной клетке;
— другими состояниями (синдром постназального стекания, инородное тело бронхов).
Осложнения СБО в связи с кашлем включают тошноту, рвоту, кровоизлияние в склеры, непроизвольное мочеиспускание, раздражительность, расстройства сна, растяжение межреберных мышц, аспирацию, ателектазы, эмфизему легких, легочную гипертензию, повышение давления в венах большого круга кровообращения, потерю сознания.
Лечение острой (обструктивный бронхит) и обострения хронической (бронхиальная астма) бронхообструкции в идеале должно быть направлено на устранение их причины. Однако многочисленность заболеваний, проявляющихся развитием СБО, преобладающее единство механизмов его формирования при наиболее частых в раннем детстве процессах, необходимость оказания неотложной помощи на различных ее этапах ставят перед врачами задачу разработки и внедрения единого подхода к лечению больных с обструкцией дыхательных путей. В клинической практике основной по значимости является патогенетическая терапия, включающая применение бронхолитиков, противовоспалительных препаратов и мероприятий по улучшению и восстановлению дренажной функции бронхов. Тяжелое течение СБО требует проведения оксигенотерапии, а иногда — ИВЛ. Дети с тяжелым течением заболевания обязательно должны быть госпитализированы [3, 4, 11, 15, 23, 25].
Бронхолитическая терапия
Универсальными бронхолитиками являются симпатомиметики (β-агонисты), стимулирующие β2-адренорецепторы гладкой мускулатуры, что приводит к расширению бронхов. Преимущественную активность в отношении β2-адренорецепторов проявляют селективные β2-агонисты короткого действия сальбутамол и фенотерола гидробромид. При ингаляции только 10–20 % введенной их дозы достигает дистальных отделов бронхов и альвеол. При чрезмерно частом применении селективных β2-агонистов возможно развитие тахикардии, тремора конечностей, головной боли. Максимальная плотность β-адренорецепторов определяется на уровне мелких и средних бронхов. β2-агонисты могут увеличивать мукоцилиарный клиренс, секрецию слизистых желез, продукцию сурфактанта и модулировать холинергическую нейротрансмиссию, однако эти эффекты выражены минимально в сравнении с их действием на гладкую мускулатуру [3, 19]. Для купирования остро возникших нарушений бронхиальной проходимости используют β2-агонисты (формотерол, сальбутамол, фенотерол), антихолинергики (ипратропия бромид), в меньшей степени метилксантины. Влияние бронходилататоров на механизмы развития СБО различно. Так, β2-агонисты и эуфиллин оказывают преимущественное действие на бронхоспазм, а М-холинолитики — на отек слизистой оболочки. Такая неоднородность действия разных бронходилататоров связана с распределением адренорецепторов и М-холинорецепторов в респираторном тракте. В бронхах мелкого калибра, в которых доминирует бронхоспазм, преимущественно представлены β2-адренорецепторы, в средних и крупных бронхах с преобладающим развитием отека слизистой оболочки — холинорецепторы. Этим объясняются необходимость, эффективность и преимущества комбинированной (β2-агонист + М-холинолитик) бронхолитической терапии у детей.
Применение при неотложной помощи фиксированной комбинации ипратропия бромида с фенотерола гидробромидом у детей с тяжелой бронхообструкцией способствует значительному улучшению функции дыхания, уменьшению времени выполнения и числа ингаляций, сокращению частоты последующих обращений [19].
Этапность оказания неотложной помощи при СБО у детей
В современном алгоритме неотложной терапии β2-агонисты представляют первую линию терапии при остром СБО и обструкции бронхов при легкой, среднетяжелой и даже тяжелой БА, обеспечивая обратимость бронхоспазма [32, 35]. Ступенчатое лечение обострений астмы (начинается с первой ступени независимо от того, где лечится пациент — дома, у врача общей практики или в стационаре [11, 35]:
— ингаляции β2-агонистов короткого действия (спейсер): 2–4 вдоха (эквивалентно 200 мкг сальбутамола) каждые 10–20 минут в течение 1 часа; при отсутствии улучшения — госпитализация [11];
— β2-агонисты через небулайзер (могут повторяться каждые 20–30 минут) [35, 36]. Следует особо отметить, что в настоящее время применение сальбутамола в виде раствора для ингаляций разрешено только с 4-летнего возраста. А у детей до 4 лет следует использовать препарат комбинированного действия — Беродуал, раствор для ингаляций, применение которого разрешено с момента рождения;
— комбинация растворов β2-агониста и ипратропия бромида (Беродуала): ингалируется через небулайзер каждые 20–30 минут [4, 16, 24, 35, 36];
— кислород для обеспечения нормальной оксигенации;
— пероральные/внутривенные глюкокортикостероиды: доза преднизолона — 1–2 мг/кг (обычно достаточно 3 дней лечения) [18, 35, 36]. В качестве первой помощи при отсутствии или невозможности введения препаратов кортикостероидов в таблетированной или ампульной форме можно воспользоваться ректальным введением свечи ректодельта (преднизон 100 мг независимо от возраста) — предшественника преднизолона;
— внутривенный β2-агонист: эффективным дополнением при «трудной» астме может быть введение сальбутамола (вентилор) — 15 мкг/кг с последующей инфузией 0,2 мкг/кг/мин при строгом мониторинге частоты сердечных сокращений и состояния ребенка;
— теофиллин (эуфиллин) — препарат резерва, назначается в случае неэффективности всех упомянутых выше медикаментов, перорально, в дозе 5–10 мг/кг/сут за 4 приема, а при тяжелом СБО — внутривенно капельно в суточной дозе до 16–18 мг/кг за 4 введения [3, 10]. У детей с астмой до 6 лет эуфиллин не применяется, а у детей с 6 лет он не рекомендован (GINA (Global Initiative on Asthma, 2014) [37].
Противовоспалительная терапия острой обструкции дыхательных путей проводится ингаляционными глюкокортикостероидами (ИГКС) длительностью 3–4 недели. Преимущество имеет небулайзерная терапия. Дозирование ИГКС зависит от тяжести состояния и возраста больного: чаще назначают низкие и средние дозы. Дети после купирования обострения БА продолжают длительное лечение ИГКС уже в качестве базисной, контролирующей терапии [4, 18].
Улучшение дренажной функции дыхательных путей
Для снижения вязкости секрета и его эвакуации в комплексной терапии СБО применяются различные отхаркивающие средства, при выборе которых необходим индивидуальный подход.
Препараты, влияющие на кашель, можно разделить на противокашлевые и мукоактивные. В дебюте острого воспалительного заболевания органов дыхания чаще возникает сухой кашель, поэтому в это время показаны средства, стимулирующие секрецию; при непродуктивном кашле — средства, разжижающие мокроту, при появлении продуктивного влажного — мукорегуляторы, нормализующие образование и состав секрета [3, 25]. Однако все противокашлевые препараты замедляют освобождение дыхательных путей от секрета, что требует крайне взвешенного подхода при их назначении. Они противопоказаны при всех состояниях, сопровождающихся обильной продукцией мокроты (острый бронхиолит, альвеолит) и легочным кровотечением. При СБО они также противопоказаны [3]. Поскольку у детей, особенно раннего возраста, кашель обусловлен повышенной вязкостью секрета бронхов, нарушением «скольжения» мокроты по ним и недостаточной активностью мерцательного эпителия, основной целью терапии в подобных случаях является разжижение мокроты, снижение ее адгезивности и увеличение тем самым эффективности кашля, а препаратами выбора являются мукорегуляторы.
Мукоактивная терапия
Важным в лечении бронхообструкции является расплавление и разжижение вязкого секрета. Прием медикаментов с дифференцированным воздействием на продукцию секрета, уменьшение вязкости слизи и улучшение функции ресничек позволяют реактивировать нарушенное мукоцилиарное очищение. Лекарственные средства, обладающие подобным эффектом, условно подразделяют на муколитические, секретомоторные, секретолитические и мукорегуляторы (табл. 1) [23].
/93.jpg)
Муколитики изменяют физико-химические свойства секрета путем разрушения полимерных связей бронхиального секрета и уменьшения его вязкости [14]. С этой целью применяются смачиватели, снижающие поверхностное натяжение, или ферменты, вызывающие разрыв дисульфидных связей. Муколитическим действием обладают также препараты, уменьшающие поверхностное натяжение, т.е. воздействующие на гель-фазу отделяемого и разжижающие как мокроту, так и носоглоточный секрет. К этой группе относится карбоцистеин. Муколитическое действие его обусловлено активацией сиаловой трансферазы — фермента бокаловидных клеток слизистой оболочки [23].
Секретомоторными являются лекарственные средства, которые с помощью различных механизмов, в основном путем усиления моторной активности мерцательного эпителия, повышают эффективность мукоцилиарного очищения. Типичными представителями этой группы являются известные как бронхорасширяющие средства стимуляторы β2-адренорецепторов (β2-агонисты). Секретомоторным действием обладают также теофиллин, бензиламины и прежде всего эфирные масла.
Секретолитические препараты улучшают эвакуацию слизи путем изменения характера секрета — повышения его гидратации. Эфирные масла растительного происхождения, экстракты различных растений, производные креозота (гваякол) и синтетические бензиламины, бромгексин и амброксол оказывают секретолитическое действие посредством усиления секреции бронхиальных желез и регулируют метаболизм компонентов секрета (мукорегуляторы).
Классификация мукоактивных препаратов представлена в табл. 1.
Мукоактивные препараты уменьшают вязкость мокроты, улучшают мукоцилиарный транспорт и уменьшают адгезию бактерий (таких как Streptococcus pneumoniae и Haemophilus influenzae) к эпителиальным клеткам дыхательных путей. Их действие не ограничивается только влиянием на компоненты бронхиального секрета. Некоторые из них обладают противовоспалительными, а также прямыми и непрямыми антиоксидантными свойствами [14]. Прямые антиоксидантные свойства мукоактивных препаратов (N-ацетилцистеина, карбоцистеина, амброксола) связаны с их способностью к взаимодействию с электрофильными группами свободных радикалов [27, 28].
Одним из наиболее часто используемых мукоактивных препаратов для лечения детей с СБО является амброксол — лекарственное средство, относящееся к классу мукокинетиков (табл. 1). Амброксол стимулирует синтез и высвобождение сурфактанта из альвеолоцитов II типа. Доказано значение сурфактанта как фактора, снижающего адгезию секрета к бронхиальной стенке и таким образом улучшающего транспорт секрета, а также являющегося механизмом защиты от агрессии микроорганизмов и ирритантов. Кроме того, доказанными свойствами амброксола являются усиление продукции жидкого секрета подслизистыми железами, деполимеризация кислых мукополисахаридов и стимуляция мукоцилиарного транспорта [38].
Антиоксидантные свойства амброксола оценены по его влиянию на продукцию активных форм кислорода, которая изучена с помощью люминол-зависимой хемолюминесценции цельной крови, как спонтанной (СХЛ), так и индуцированной (ИХЛ) [1].
Амброксол проявляет противовоспалительные и антипротеазные свойства, что подтверждается угнетением продукции супероксиданиона молекул и молекул хлорноватистой кислоты из активированных нейтрофилов, эффективным снижением высвобождения эластазы и миелопероксидазы из активированных нейтрофилов и предотвращением инактивации α1-антитрипсина нейтрофилами.
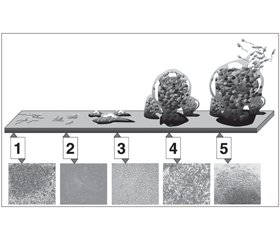
Влияние амброксола на биопленки проявляется в нарушении микроструктуры и толщины биопленок, образованных мукоидными штаммами Pseudomonas aeruginosa, что продемонстрировано электронной микроскопией (рис. 2). Число бактериальных колоний в интубационных трубках у животных, леченных амброксолом, было значительно ниже в сравнении с особями, получавшими физиологический раствор, на 4-й и 7-й день от начала терапии. Цитокиновый ответ, в частности уровень интерферона (INF-γ) и отношение INF-γ к содержанию интерлейкина-10, также был менее выражен после терапии амброксолом. В другом экспериментальном исследовании терапия амброксолом уменьшала толщину биопленок, увеличивала их порозность и снижала среднюю дистанцию диффузии [44]. Кроме того, амброксолу свойственна значительная антагонистическая активность в отношении механизма формирования биопленок.
/93_2.jpg)
Антифибротические свойства амброксола в условиях длительного курса применения (3 мес.) выявлены у больных, получающих лучевую терапию после лобэктомии по поводу рака легкого [1].
Таким образом, среди препаратов, доступных в настоящее время для терапии бронхолегочных заболеваний, амброксол является уникальным средством, обладающим антипротеазными и антиоксидантными эффектами. Он нарушает структуру биопленок, снижает цитокиновый ответ и уменьшает повреждения легких, связанные с легочной инфекцией, а также обладает антифибротическим действием.
Свойства амброксола:
— стимулирует выработку сурфактанта;
— стимулирует продукцию жидкого секрета подслизистыми железами;
— улучшает мукоцилиарный транспорт;
— вызывает деполимеризацию кислых мукополисахаридов;
— повышает концентрацию антибиотиков (β-лактамов, макролидов) в бронхиальном секрете;
— снижает бронхиальную гиперреактивность;
— обладает антиоксидантными свойствами;
— обладает противовоспалительными свойствами;
— снижает продукцию эластазы;
— Нарушает структуру биопленок;
— обладает антифибротическим действием.
Муколитики, в отличие от отхаркивающих средств, разжижают мокроту, воздействуя на молекулу муцина [6]. Их назначают детям при навязчивом кашле с вязкой мокротой. Выраженным эффектом обладает N-ацетилцистеин (АЦЦ), но он используется в основном при хронических процессах с вязкой гнойной мокротой, избыточное разжижение которой может вызвать синдром «затопления» («заболачивания») легких. Доказательных работ в отношении муколитической терапии при хронических и рецидивирующих заболеваниях нижних дыхательных путей у детей немного. Высокие дозы и продолжительный прием АЦЦ снижают продукцию секреторного иммуноглобулина А (sIgA) и лизоцима [1]. Сравнение действия неферментных муколитиков представлено в табл. 2.
Карбоцистеин представляет собой производное цистеина — карбоксиметилцистеин, имеющий ряд совершенно иных характеристик, существенно отличающих его от АЦЦ [6, 32].
Карбоцистеин уменьшает число бокаловидных клеток и снижает секрецию слизи, нормализует количественное соотношение кислых и нейтральных сиаломуцинов секрета, восстанавливает вязкость и эластичность слизи. Он способствует регенерации слизистой дыхательных путей, нормализует ее структуру, активирует деятельность реснитчатого эпителия, что улучшает мукоцилиарный клиренс. Карбоцистеин восстанавливает секрецию иммунологически активного sIgA и количество сульфгидрильных групп компонентов слизи (иммуномодулирующее действие), что особенно важно у детей с повторными респираторными инфекциями и выдвигает карбоцистеины в разряд наиболее современных и перспективных мукоактивных препаратов [32].
В настоящее время доказано противовоспалительное действие карбоцистеина: снижая экспрессию ICAM-1 в легких, он ингибирует развитие риновирусной инфекции, являющейся мощным индуктором синтеза провоспалительных цитокинов, включая ИЛ-1, ИЛ-6 и ИЛ-8. Антиоксидантное действие карбоцистеина обусловлено уменьшением эндосомного окисления в эпителиальных клетках дыхательных путей.
Карбоцистеин повышает эффективность антибактериальной терапии, хорошо сочетается с ИГКС и бронхолитиками. Действие препарата проявляется на всех уровнях респираторного тракта: на уровне как слизистой оболочки бронхиального дерева, так и носоглотки, носовых пазух и среднего уха [32]. Прямым показанием для применения карбоцистеина является кашель с вязкой, трудноотделяемой мокротой [6].
Выбор муколитической терапии определяется характером поражения респираторного тракта, кашля и возрастом ребенка. Так, у новорожденных затяжное и осложненное течение респираторной патологии часто связано с дефицитом продукции и секреции сурфактанта. Учитывая то, что у детей раннего возраста одним из значимых компонентов обструкции бронхов является гиперсекреция вязкой слизи в дыхательных путях, для лечения СБО рекомендуется мукорегулятор амброксола гидрохлорид (лазолван), проявляющий как отхаркивающее, так и мукокинетическое действие, что делает его препаратом выбора в лечении СБО у детей. Особые свойства амброксола позволяют использовать его в детской практике без каких-либо предостережений и возрастных ограничений, начиная с первых дней жизни ребенка, как доношенного, так и недоношенного [13]. Одним из достоинств препарата является способность повышать содержание сурфактанта в легких, с чем связывают противовоспалительное, антиоксидантное и иммуномодулирующее действие, и повышать скорость пассивной диффузии антибиотиков из плазмы в бронхолегочную ткань (антиинфекционный эффект), что особенно важно при лечении СБО бактериального генеза у детей раннего возраста. Добавление к Беродуалу лазолвана через небулайзер со 2–3-го дня острого периода приводит к более быстрому купированию СБО в связи с отличным отхаркивающим эффектом лазолвана, ускорением мукоцилиарного клиренса, быстрой эвакуацией мокроты и улучшением проходимости дыхательных путей [4].
Для воздействия на кашель у детей часто используются средства, стимулирующие отхаркивание (преимущественно фитопрепараты). Однако это не всегда оправданно, поскольку растительные средства нередко вызывают аллергию; их действие непродолжительно, необходимы частые приемы малых доз (каждые 2–3 часа); повышение разовой дозы нередко вызывает тошноту и в ряде случаев рвоту, так как их действие основано на активации гастропульмонального рефлекса. Фитопрепараты увеличивают объем бронхиального секрета, который маленькие дети не в состоянии самостоятельно откашлять, что приводит к дальнейшему нарушению дренажной функции легких и затяжной бронхообструкции.
АЦЦ нежелательно назначать пациентам с СБО и астмой в связи с тем, что в 30 % случаев при этом отмечается усиление бронхоспазма [11, 12].
Появление препаратов с фиксированной комбинацией амброксола и карбоцистеина стало новым шагом в терапии многих бронхообструктивных заболеваний [31] и расширило возможности мукоактивной терапии. Именно к данной группе относится сбалансированная муколитическая комбинация Милистан сироп от кашля, в состав которой входит 15 мг амброксола и 100 мг карбоцистеина. Способ применения и дозы препарата Милистан сироп от кашля: детям до 2 лет — по 2,5 мл 2 раза в сутки внутрь, в возрасте 2–6 лет — по 2,5 мл 2–3 раза в сутки, 6–12 лет — по 5 мл 2–3 раза в сутки. Длительность лечения — до 5–7 дней.
Показаниями к применению сиропа Милистан являются острые и хронические заболевания дыхательных путей, сопровождающиеся образованием трудноотделяемого секрета, хронический обструктивный бронхит, пневмония, бронхиальная астма с затрудненным отделением мокроты, бронхоэктатическая болезнь, респираторный дистресс-синдром у грудных детей (в составе комплексной терапии для стимуляции синтеза сурфактанта). Кроме того, препарат применяют при муковисцидозе, до и после проведения бронхоскопии, при воспалительных заболеваниях среднего уха и околоносовых пазух [9]. Другая форма препарата — Милистан от кашля в таблетках (30 мг амброксола гидрохлорида и 200 мг карбоцистеина в 1 таблетке) показан при острых и хронических бронхолегочных заболеваниях, сопровождающихся нарушением бронхиальной секреции и ослаблением продвижения слизи, и назначается детям от 12 лет и взрослым по 1 таблетке 3 раза в день курсом 7–10 дней [5, 10, 15, 20].
Заключение
Необходимо отметить, что, назначая больному ту или иную терапию, важно оценить не только ее эффективность и безопасность, но и простоту использования, а также комплайентность. В настоящее время для купирования острого СБО у детей раннего возраста инфекционного или аллергического генеза требуется комплексное применение медикаментов, воздействующих на все значимые звенья патогенеза бронхообструкции (бронхоспазм, воспаление, нарушение эвакуации секрета) с учетом их непосредственного механизма действия и возрастных особенностей ребенка. Эффективная мукоактивная терапия у детей должна заключаться в улучшении дренажной функции бронхов и восстановлении проходимости дыхательных путей, устранении раздражения слизистой бронхов. Улучшению дренажной функции бронхов способствует также активная пероральная регидратация, массаж, постуральный дренаж, дыхательная гимнастика. В качестве питья лучше использовать щелочные минеральные воды, дополнительный суточный объем жидкости составляет около 50 мл/кг веса ребенка.
Список литературы
1. Авдеев С.Н. Значение мукоактивных препаратов в терапии хронической обструктивной болезни легких [Текст] / С.Н. Авдеев // Пульмонология. — 2001. — № 4. — С. 118-124.
2. Визель А.А. Бронхиальная астма и хроническая обструктивная болезнь легких: от общих синдромов к унификации лечения [Текст] / А.А. Визель, И.Ю. Визель // Пульмонология. — 2007. — Т. 9, № 1. — С. 22-25.
3. Волков А.В. Противокашлевые, муколитические и отхаркивающие средства. Что выбрать? [Текст] / А.В. Волков // Здоров’я України. — 2009, тематичний номер, жовтень. — С. 37.
4. Геппе Н.А. Ингаляционная небулайзерная терапия заболеваний респираторной системы у детей: Практическое руководство для врачей / Н.А. Геппе. — М.: КолоритСтудио, 2008. — 82 с.
5. Дука Е.Д. Современные подходы к симптоматической терапии острых заболеваний органов дыхания у детей [Текст] / Е.Д. Дука, А.А. Ефанова // Новости медицины и фармации. — 2007. — № 4 (208). — Режим доступа: http://www.mif-ua.com/archive/article/3266
6. Ермакова И.Н. Карбоцистеин (Флюдитек) в комплексной терапии рецидивирующих респираторных инфекций нижних дыхательных путей у детей [Текст] / И.Н. Ермакова, Ю.Л. Мизерницкий // Земский врач. — 2012. — № 5. — С. 12-16.
7. Зайцева О.В. Бронхообструктивный синдром в практике педиатра. Роль ингаляционной бронхолитической терапии [Текст] / О.В. Зайцева // Новости медицины и фармации. — 2008. — № 19. — С. 12-13.
8. Зайцева С.В. Синдром бронхиальной обструкции у детей [Текст] / С.В. Зайцева, О.А. Муртазаева // Трудный пациент. — 2012. — Т. 10, № 2-3. — С. 34-39.
9. Інструкція для медичного застосування лікарського засобу Мілістан cироп від кашлю (Milistan syrup anticoug).
10. Інструкція для медичного застосування лікарського засобу Мілістан від кашлю (Milistan anticough).
11. Клінічні настанови з діагностики і лікування бронхіальної астми у дітей [Текст] // Здоров’я України. — 2010, тематичний номер, жовтень. — С. 39-41.
12. Ласица О.И. Современные аспекты этиопатогенеза, клиники, диагностики и дифференциальной диагностики бронхиальной астмы у детей раннего возраста: Методич. рекомендации / О.И. Ласица, Е.Н. Охотникова. — К., 2000. — 31 с.
13. Ласиця О.Л. Бронхообструктивний синдром у дітей раннього віку та особливості муколітичної терапії [Текст] / О.Л. Ласиця, О.М. Охотнікова // Педіатрія, акушерство та гінекологія. — 2004. — № 2. — С. 27-31.
14. Лечение респираторных заболеваний: акцент на мукорегуляцию // ЭФ. Пульмонология и оториноларингология. — 2012. — № 4. — С. 46-57.
15. Майданник В.Г. Эффективность применения препарата Милистан от кашля при острых бронхитах у детей (4-я фаза клинических исследований) [Текст] / В.Г. Майданник // Здоровье ребенка. — 2006. — № 3 (3). — Режим доступа: http://www.mif.ua.com/archive/article/857
16. Мизерницкий Ю.Л. Диагностика и принципы терапии острой бронхиальной обструкции у детей [Текст] / Ю.Л. Мизерницкий // Педиатрия. — 2008. — № 1. — С. 77-80.
17. Мизерницкий Ю.Л. Дифференциальная диагностика и принципы дифференцированной терапии бронхообструктивного синдрома при острой респираторной инфекции у детей [Текст] // Земский врач. — 2010. — № 3. — С. 5-10.
18. Наказ МОЗ України № 767 від 27.12.2005 «Протокол діагностики та лікування алергічних хвороб у дітей». — 14 с.
19. Овсянников Д.Ю. Бронхообструктивный синдром у детей [Текст] / Д.Ю. Овсянников // Астма и аллергия. — 2014. — № 1. — С. 13-17.
20. Овчаренко Л.С. Рациональная мукотропная терапия острого обструктивного бронхита у детей [Текст] / Л.С. Овчаренко, А.А. Вертегел, Т.Г. Андриенко и др. // Новости медицины и фармации. — 2007. — № 15 (221). — Режим доступа: http://www.mif-ua.com/archive/article/2984
21. Охотникова Е.Н. Этот многоликий и коварный бронхообструктивный синдром! [Текст] / Е.Н. Охотникова // Клиническая иммунология. Аллергология. Инфектология. — 2011. — № 3. — С. 13-22.
22. Охотникова Е.Н. Бронхообструктивный синдром инфекционного и аллергического генеза у детей: сложности дифференциальной диагностики и выбора муколитической терапии [Текст] / Е.Н. Охотникова // Современная педиатрия. — 2012. — № 2 (42). — С. 76-80.
23. Принципы этиопатогенетической терапии острых синуситов: методические рекомендации / Х.Т. Абдулкеримов, Т.И. Гаращенко, В.И. Кошель и др.; под ред. С.В. Рязанцева. — СПб.: Полифорум Групп, 2014. — 40 с.
24. Ревякина В.А. Новые возможности комбинированного препарата Беродуал Н у детей с аллергическим ринитом и бронхиальной астмой [Текст] / В.А. Ревякина, П.Л. Виленчик, О.Ф. Лукина, Е.В. Бондаренко // Педиатрия (прил. Сonsilium medicum). — 2007. — № 2. — С. 67-69.
25. Симонова О.И. Муколитики для детей: сложные вопросы, важные ответы // Вопросы современной педиатрии. — 2014. — Т. 13, № 1. — С. 26-32.
26. Сорока Ю.А. Муколитическая терапия в педиатрической практике [Текст] / Ю.А. Сорока // Клінічна педіатрія. — 2010. — № 1 (22). — С. 10-15.
27. Тодоріко Л.Д. Особливості бронхообструктивного синдрому у хворих на туберкульоз легенів [Текст] / Л.Д. Тодоріко, І.О. Сем’янів // Клінічна імунологія. Алергологія. Інфектологія. — 2012. — № 1-2 (50-51). — С. 48-51.
28. Царькова С.А. Клинические и фармакоэкономические аспекты оказания неотложной помощи детям с острой обструкцией дыхательных путей [Текст] / С.А. Царькова, Т.В. Тарина, Ф.Д. Ваисов, А.В. Бушуев // Скорая медицинская помощь. — 2004. — № 1. — С. 45-47.
29. Царькова C.А. Беродуал в лечении бронхообструктивного синдрома: классика и современность [Текст] / С.А. Царькова, И.В. Лещенко // Пульмонология. — 2007. — № 4. — С. 96-99.
30. Шмелев Е.И. Бронхообструктивный синдром и его коррекция у больных туберкулезом легких [Текст] / Е.И. Шмелев // Concilium medicum. — 2007. — № 4. — С. 5-7.
31. Юлиш Е.И. Рациональная муколитическая терапия в комплексе лечения бронхолегочных заболеваний в детском возрасте [Текст] / Е.И. Юлиш // Здоровье ребенка. — 2012. — № 8 (43). — С. 12-15.
32. Юлиш Е.И. Патогенетические обоснования назначения муколитических средств при респираторных заболеваниях у детей [Текст] / Е.И. Юлиш // Здоровье ребенка. — 2015. — № 1 (60). — С. 12-15.
33. Diagnosis and treatment of asthma in childhood: a PRACTALL consensus report [Теxt] // Allergy. — 2008. — № 63. — Р. 5-34.
34. Duijvestijn Y.C. Acetylcysteine and carbocysteine for acute upper and lower respiratory tract infections in pediatric patients without chronic broncho-pulmonary disease [Теxt] / Y.C. Duijvestijn, N. Mourdi, J. Smucny et al. // Cochrane Database Syst Rev. — 2009. — Vol. 1. — CD003124.
35. Duijvestijn Y.C.M. Acetylcysteine and carbocysteine for acute upper and low respiratory tract infections in paediatric patients without chronic broncho-pulmonary disease (Review) [Теxt] / Y.C.M. Duijvestijn, N. Mourdi, J. Smuchny et al. // Cochrane Database Syst. Rev. — 2010. — Vol. 9. — P. 1-22.
36. Global Initiative for Asthma: Revised, 2003. www.ginaasthma.org
37. Global Initiative for Asthma: Revised, 2011. www.ginaasthma.org
38. Global Initiative for Asthma: Revised, 2014. www.ginaasthma.org
39. Rogers D.F. Mucoactive agents for airway mucus hypersecretory diseases [Теxt] / D.F. Rogers // Respir. Care. — 2007. — № 52. — Р. 1176-1193.
40. Varelogianni G., Oliynyk I., Roomans G.M., Johannesson M. The effect of N-acetylcysteine on chloride efflux from airway epithelial cells [Теxt] / G. Varelogianni, I. Oliynyk, G.M. Roomans, M. Johannesson // Cell. Biol. Int. — 2010. — Vol. 34 (3). — P. 245-252.
/90.jpg)

/93.jpg)
/93_2.jpg)
/94.jpg)