Статья опубликована на с. 105-106
Магний является жизненно важным элементом, который находится во всех тканях организма и необходим для нормального функционирования клеток. Магний участвует в более чем 300 реакциях обмена веществ, в регуляции передачи нервных импульсов и в сокращении мышц, оказывает спазмолитическое и антиагрегантное действие. Его присутствие важно для метаболизма углеводов и жиров при производстве энергии, синтеза белков, ферментов и антиоксидантов, регулирования обмена холестерина, он сохраняет устойчивый ритм сердца, способствует нормализации давления, обеспечивает нормальное функционирование иммунной системы и метаболизм костной ткани. Однако примерно 80 % людей не получают магний в необходимых количествах [1, 2].
В последние годы внимание ученых и врачей-практиков привлекают магнийсодержащие соединения, которые представляются перспективными с точки зрения лечения гиперфосфатемии у пациентов с хронической болезнью почек (ХБП). Сегодня есть ряд исследований, которые доказывают, что фосфатсвязующие, содержащие комбинацию карбоната магния и ацетат кальция препараты весьма эффективны при терминальной стадии хронической почечной недостаточности (ХПН), а также имеют хороший профиль переносимости [5, 7].
Ниже мы приводим описание клинического случая.
Пациентка А., 49 лет. Диагноз: ХБП 5-й стадии, хронический пиелонефрит в стадии ремиссии, нефросклероз, артериальная гипертензия III степени, 3-й стадии, IV стадия риска ХПН-4, уремия, анемия, нетяжелое течение. Сопутствующие заболевания: желчнокаменная болезнь, калькулезный холецистит. 24.12.2015 перенесла тиреоидэктомию. Левосторонний многоузловой зоб III степени, субклинический гипотиреоз, третичный гиперпаратиреоз.
Справка: третичный гиперпаратиреоз (МКБ-10: Е00–Е07) представляет собой автономную гиперпродукцию паратгормона гиперплазированными паращитовидными железами (ПЩЖ) или формирование аденомы ПЩЖ при длительно существующем вторичном гиперпаратиреозе. В данном случае речь идет не о постепенном формировании автономии (по механизму гиперфункция → гиперплазия → опухоль) с нарушением физиологической отрицательной обратной связи между уровнем кальция и избыточной продукцией паратгормона, а о возникновении несоответствия между высоким уровнем паратгормона и снижением потребности в нем. Такая ситуация возникает, например, после трансплантации почки при ХПН, осложненной вторичным гиперпаратиреозом.
Пациентка поступила в терапевтическое отделение на нефрологическую койку в связи с повышением креатинина и мочевины после операции по поводу тиреоидэктомии. Согласно выписке из городской клинической больницы № 3 Киевского центра эндокринной хирургии, креатинин составил 400 ммоль/л, мочевина — 12,5 ммоль/л; после оперативного вмешательства креатинин увеличился до 663 ммоль/л, мочевина — до 22,1 ммоль/л.
При поступлении пациентка жаловалась на головную боль с высоким артериальным давлением (АД) (220/110 мм рт.ст.), судороги в ногах, тошноту, сильную слабость. Ниже приведены результаты обследования в стационаре.
По данным ультразвукового исследования. Почка правая: контур неровный, расположение обычное, дыхательная экскурсия снижена. Линейные размеры уменьшены: ширина — 32 мм, длина — 64 мм, толщина — 28 мм. Паренхима не визуализируется, образования не определяются, лоханка смешанного типа, не расширена, передне-задний размер — 18 мм; чашечки расширены до 7–9 мм, стенки чашечно-лоханочной системы (ЧЛС) уплотнены, конкременты не определяются. Почка левая: контур неровный, нечеткий, расположение обычное, дыхательная экскурсия сохранена. Линейные размеры: ширина — 51 мм, длина — 98 мм, толщина — 32 мм. Паренхима неоднородная, повышенной эхогенности, на полюсах 10–11 мм, средний сегмент — 12–14 мм, истончена. Паренхимо-синусовое отношение 1,6 : 1 — не нарушено, кортико-медуллярная дифференцировка сглажена. Образования: визуализируются жидкостные образования от 12–14 мм; ЧЛС смешанного типа, не расширена, мочеточники шириной до 1,7 мм, визуализируются на протяжении 10 мм от лоханочно-мочеточникового сегмента, конкременты не определяются, мочевой песок — умеренное количество.
Больной была подобрана гипотензивная терапия согласно стадии ХБП. Кроме того, были назначены: кетостерил — 4 таблетки 3 раза/день; кальций-Д3 никомед — 1 таблетка 2 раза/день; L-тироксин — 150 мкм 1 раз/сутки (утром!); леркамен — 20 мг на ночь; заксон — 6 мг утром, 4 мг вечером; сорболонг — 4 капсулы в день; дюфалак — 1 доза 2–3 раза/день; магнерот — 1 таблетка 2 раза/день.
Через два дня приема магнерота больная перестала предъявлять жалобы на судороги в ногах, на четвертый день от начала лечения у больной нормализовались показатели АД (максимальное АД — 150/100 мм рт.ст., минимальное — 120/80 мм рт.ст.) [3].
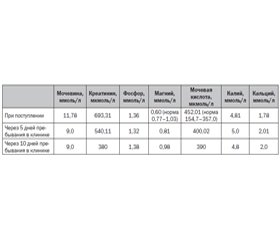
На пятый день от начала терапии биохимические анализы значительно улучшились (табл. 1).
Сохранялась слабость на фоне высоких показателей тиреотропного гормона (5,17), в связи с чем была увеличена дозировка L-тироксина до 150 мкг в сутки (утром).
После приема магнерота состояние больной несколько улучшилось (прошли судороги), незначительно снизился уровень мочевой кислоты, был достигнут целевой уровень АД.
На 02.02.2016 (10-й день пребывания в стационаре) пациентка отмечала улучшение общего состояния, что подтверждается данными биохимических исследований (табл. 1).
Клинический аспект
Обращает на себя внимание низкое содержание магния в крови, которое может быть связано с уремической гастропатией, приводящей к значительному снижению всасывания магния из кишечника. Возможно, снижение содержание магния у представленной в клиническом наблюдении пациентки связано с диетой «Стол № 9», то есть с ограничением приема белка до 30 г/сутки на фоне приема кетостерила, когда потребление магния снижается. Вместе с тем известно, что даже при ХБП-5 почка все равно способна выводить магний, что может влиять на его обмен. Однако нормализация содержания магния в крови после приема магнерота указывает на зависимость от его поступления в организм. Количество магния оротата, которое поступило в организм больной при приеме препарата в течение пяти дней, составило 5000 мг, за десять дней приема — 10 000 мг. Данная ситуация требует дальнейшего изучения ввиду того, что большая часть пациентов с ХБП 5-й стадии, не получающих диализ, согласно литературным данным, имеют гипермагниемию.
Конфликт интересов: не заявлен.
Комментарий патофизиолога
Роль магния в жизнедеятельности организма в норме и особенно при патологии представляет большой интерес. Применение препаратов магния в клинике не всегда теоретически обосновано. Важно, что автор связывает применение магнерота со снижением его концентрации в крови, нормализация последнего после приема препарата сопровождается позитивными изменениями сердечно-сосудистой системы, в частности, снижением АД. Вместе с тем причины снижения концентрации магния при ХПН не установлены, что обосновывает необходимость изучения обмена магния у больных ХПН, в частности при ХПН-4, -5.
А.И. Гоженко, д.м.н., проф.

/106.jpg)