Статья опубликована на с. 77-88
Введение
После инфекций дыхательных путей инфекции мочевых путей (ИМП) занимают второе место по частоте бактериальных инфекций у женщин. В большинстве случаев (80 %) эти инфекции являются неосложненными (нИМП) [1, 2]. Распространенные симптомы нИМП включают частое мочеиспускание, неотложные позывы к мочеиспусканию, дизурию и боль в надлобковой области, в то время как боль внизу спины, боку, пояснице и лихорадка часто рассматривают как симптомы пиелонефрита. Острые нИМП характеризируются отсутствием структурных и функциональных патологий мочевых путей, тогда как заболевания почек и сопутствующие состояния повышают риск осложнений ИМП с более серьезным исходом [3]. Наиболее частыми уропатогенами являются кишечная палочка (E.coli), стафилококки, энтерококки и энтеробактерии, включая Klebsiella spp. Острыми нИМП обычно занимаются врачи общей практики на амбулаторном приеме. В исследованиях нИМП, как правило, сделан акцент на бактериологии, резистентности к препаратам и бактериологических исходах лечения антибиотиками, хотя новые руководства по лечению ИМП требуют эрадикации как бактериурии, так и симптомов [4, 5]. Во избежание нерационального применения антибиотиков их следует назначать при сочетании симптоматики с бактериурией [6, 7].
Известно, что многие женщины с нИМП не сразу обращаются за медицинской помощью, а выжидают время и самостоятельно используют домашние средства [8]. Ход развития нелеченых нИМП уже был описан в нескольких исследованиях, при этом частота разрешения симптоматики составляла до 50 % по прошествии трех дней [1, 3, 6, 7]. В ходе хорошо спланированного исследования Ferry et al. было отмечено спонтанное излечение в ходе первой недели у 28 % пациентов и еще у 37 % — в течение 5–7 недель [7]. В пилотном исследовании Bleidorn et al. сообщали о не меньшей эффективности ибупрофена по сравнению с ципрофлоксацином в отношении влияния на симптомы на 4-й день терапии; однако у одной трети пациенток, получавших ибупрофен, отмечался рецидив в течение первой недели [6]. Таким образом, недостаточно доказательств эффективности альтернативных методов лечения или возможности самоизлечения при нИМП. В связи с возрастающей частотой резистентности к антибиотикам все большую актуальность приобретает как оптимизация противомикробных препаратов, так и разработка альтернативных методов лечения.
Канефрон® Н, растительный лекарственный препарат, содержащий траву золототысячника, корни любистка и листья розмарина, был разработан для лечения острых и хронических инфекций мочевых путей, а также профилактики мочекаменной болезни [9]. Отдельные компоненты препарата обладают спазмолитическими, диуретическими, противовоспалительными и противомикробными свойствами [9]. Трава золототысячника, содержащая ксантоны, оказывает антибактериальное и антихолинергическое действие [10, 11] и, как правило, используется в качестве вспомогательного средства для выведения почечных камней, а также с диуретической целью [12–14]. Корни любистка, содержащие фуранокумарины, обладают спазмолитическими и диуретическими свойствами [15, 16] и применяются при воспалении нижних отделов мочевых путей [15]. Листья розмарина содержат дитерпены, полифенолы и фенолы и оказывают антиоксидантное, антибактериальное, противовирусное, противовоспалительное, спазмолитическое и противосудорожное действие [17, 18], поддерживают почечную экскрецию и диурез [4, 14, 19, 20]. В систематическом обзоре 17 клинических исследований с участием 3115 пациентов Канефрон® Н продемонстрировал свою эффективность в лечении и профилактике ИМП в сравнении со стандартной терапией как у взрослых пациентов, так и у детей, а также обеспечивал снижение частоты рецидивов [21]. Сообщалось лишь об одном нежелательном явлении (НЯ) (кожная сыпь). Было сделано заключение о том, что Канефрон® Н оказывает благоприятное воздействие на течение инфекционных и воспалительных процессов в мочевых путях. Однако из-за неудачного дизайна некоторых из этих исследований достоверность полученных в них результатов остается неясной [21].
Цель настоящего исследования заключалась в оценке безопасности и терапевтического действия препарата Канефрон® Н для лечения нИМП без применения антибиотиков.
Методы исследования
Данное открытое неконтролируемое многоцентровое интервенционное клиническое исследование было проведено в 9 украинских центрах в октябре 2011 — июне 2012 г.
Исследование состояло из 7-дневного периода лечения препаратом Канефрон® Н и периода наблюдения до дня 37. Были запланированы три визита: в день 0 (визит 1: включение в исследование, начало лечения), в день 7 ± 1 день (визит 2: окончание лечения) и в день 37 ± 1 день (визит 3: окончание исследования). При наличии сохраняющихся или усугубляющихся симптомов допускался прием антибактериальных препаратов, а прием препарата Канефрон® Н прекращали (рис. 1).
/79.jpg)
Тяжесть симптомов нИМП ежедневно оценивали сами пациентки, занося данные в дневники, и исследователь во время каждого визита (рис. 1), отмечая наблюдения в ИРК. Следующие симптомы нИМП оценивали по 5-балльной шкале (табл. 1): дизурия, частое мочеиспускание, неотложные позывы к мочеиспусканию, острое развитие недержания мочи или его усугубление, никтурия, боль или дискомфорт в нижней части живота или в области лобка, а также повышение температуры тела (лихорадка). Для оценки клинического исхода (клиническое излечение, улучшение, лечение неэффективно) оценивали только три основных симптома — дизурию, частоту мочеиспускания и неотложные позывы к мочеиспусканию. Шкала симптомов была составлена на основании нескольких руководств по лечению урологических заболеваний [6, 22–24].
Оцениваемые симптомы нИМП включали дизурию, частое мочеиспускание, неотложные позывы к мочеиспусканию, острое развитие недержания мочи или его усугубление, никтурию, боль и дискомфорт в нижней части живота или надлобковой области, а также повышение температуры тела. Оцениваемые симптомы нИМП для включения в исследование и оценки клинического исхода (клиническое излечение, улучшение, лечение неэффективно) — только основные симптомы: дизурия, частое мочеиспускание и неотложные позывы к мочеиспусканию.
Изучаемые лабораторные показатели включали общий анализ крови, биохимический анализ крови (визит 1 и 2), анализ средней порции мочи (удельный вес, рН, лейкоциты, эритроциты, нитриты, глюкоза, белок, кетоновые тела, уробилиноген, билирубин, кровь; тест-полоски Combur 10 (Roche, Германия) для экспресс-анализа мочи) и стандартное микробиологическое исследование в центральной лаборатории (визиты 1, 2 и 3).
В исследование были включены 125 пациенток (полная выборка для анализа (FAS)). Из них 105 пациенток были отнесены к выборке пациентов, выполнивших требования протокола (PPS, рис. 2).
Исследование было проведено в соответствии с Хельсинкской декларацией, правилами Надлежащей клинической практики Международной конференции по гармонизации (ICH-GCP). Для стандартизации результатов исследования использовалась центральная лаборатория.
Основные критерии включения, характеристика пациентов
Подписанное информированное согласие; пациенты женского пола в возрасте от 18 до 65 лет, пришедшие на амбулаторный прием; наличие острых симптомов нИМП (цистит) на визите скрининга с суммарным показателем по шкале симптомов не менее 6: дизурия (боль во время мочеиспускания), частое мочеиспускание (поллакиурия), неотложные позывы (табл. 1); развитие симптомов не более чем за 6 дней до момента скрининга; отсутствие грудного вскармливания, отрицательный тест на беременность во время скрининга и готовность применять эффективные методы контрацепции.
Основные критерии исключения
Признаки, указывающие на осложненные ИМП, пиелонефрит (лихорадка ≥ 38 °C, боль в пояснице, озноб, дрожь) и/или сопутствующий вульвовагинит; состояния, приводящие к осложненным инфекциям (заболевания почек, патологии мочевых путей, операции на мочевых путях в анамнезе, катетеризация мочи и т.д.); хронические инфекции мочевых путей, требующие проведения пиелограммы, ультразвукового исследования и цистоскопии с внутривенным введением контраста; признаки тяжелого, прогрессирующего и неконтролируемого системного заболевания, представляющего угрозу для жизни (с вовлечением эндокринных желез, легких, сердца, нервной системы, головного мозга, почек, печени, крови и желудочно-кишечного тракта); другие острые инфекционные заболевания, требующие применения антибиотиков; подтвержденная ИМП в течение 4 недель до включения в исследование; применение антибиотиков, иммунодепрессантов и иммуностимуляторов в течение 4 недель до включения в исследование.
Были запрещены к применению в качестве сопутствующей терапии препараты, содержащие листья розмарина, корни любистка и траву золототысячника, помимо исследуемого препарата, противовоспалительные препараты, спазмолитики, растительные препараты и добавки, клюквенный сок, сборы для лечения заболеваний почек и мочевого пузыря. Допускалось применение парацетамола в качестве основного обезболивающего средства для облегчения боли.
Исследуемый лекарственный препарат (ИЛП), дозировка и путь введения
ИЛП Канефрон® Н в драже применялся перорально в течение 7 дней подряд, по два драже три раза в день (как указано в утвержденной инструкции по применению лекарственного препарата).
Определения
Исходя из оценки симптомов суммарный балл (от 0 до 12) рассчитывали только на основании основных симптомов — дизурии, частоты мочеиспусканий и неотложных позывов к мочеиспусканию. Было определено, что как респондеров (пациент с результатом терапии, оцененным как клиническое излечение) будут рассматривать пациентов с проявлениями основных симптомов не более чем «слабовыраженные» («1») с максимальным суммарным баллом 3. Число дней от начала лечения до момента оценки соответствующего симптома как «не более тяжелого, чем слабовыраженный» определяли как продолжительность каждого симптома.
Для оценки ранних рецидивов использовались следующие критерии: пациент должен был быть признан респондером, то есть ответить на лечение к дню 7, и в дальнейшем у него должно было происходить усугубление симптомов в период наблюдения (достижение суммарного балла ≥ 6), по результатам микробиологического анализа должно было быть обнаружено ≥ 104 колониеобразующих единиц (КОЕ/мл). Для определения числа респондеров (клиническое излечение) и ранних рецидивов требовалась оценка исследователя, тогда как длительность симптомов определяли с помощью дневников пациентов.
Для получения более подробной информации проводился последующий (post hoc) анализ полученных результатов с разделением пациентов, не ответивших на лечение (нереспондеров), на две категории — пациенток с ослаблением выраженности симптомов (но не достигших излечения) и пациенток с неэффективным лечением. В данной классификации респондеров обозначали как пациенток с клиническим излечением. Улучшение подтверждалось на основании достижения суммы баллов < 6, но при отсутствии критериев, соответствующих клиническому излечению. При клинической неэффективности лечения сумма баллов составляла ≥ 6 (табл. 2). Поскольку методы центральной лаборатории для определения числа бактерий были достаточно чувствительны для выявления даже более низких значений этого показателя по сравнению с теми, которые предполагались при разработке протокола, было принято решение изменить критерий выраженной бактериурии с 104 КОЕ/мл на более чувствительный порог в 103 КОЕ/мл.
Конечные точки исследования
Первичная конечная точка — частота нежелательных реакций на препарат во время 7-дневного лечения симптомов нИМП препаратом Канефрон® Н. НР определялась как любое неблагоприятное медицинское событие, начавшееся во время лечения препаратом Канефрон® Н и имеющее причинно-следственную связь с данным лечением. Нежелательные явления (НЯ) оценивали с помощью непрямого опроса пациентки на каждом визите, по жалобам пациенток или выявляли при физикальном обследовании, а также по результатам лабораторных анализов.
Вторичные конечные точки включали число респондеров (клиническое излечение) на день 7, тяжесть симптомов нИМП на дни 7 и 37, длительность симптомов, долю пациентов, потребовавших лечения антибиотиками до дня 7, и число пациентов с ранним рецидивом.
Статистика
Первичную конечную точку — частоту НР в течение 7-дневного лечения препаратом Канефрон® Н — оценивали методами описательной статистики. Оценки статистической гипотезы первичной и вторичных конечных точек не были запланированы; размер выборки обсуждался в отношении точности ожидаемого количества НР. Были рассчитаны доверительные интервалы по методу Клоппера — Пирсона для показателя частоты.
Оценка тяжести симптомов основывалась на 5-балльной шкале (табл. 1). Данные были проанализированы методами описательной статистики. Изменения тяжести симптомов нИМП по сравнению с исходными значениями анализировали с помощью критерия Уилкоксона. Результаты измерения основных показателей жизнедеятельности, физического обследования и лабораторных анализов были также проанализированы методами описательной статистики.
Выборка для оценки безопасности состояла из пациенток, получивших хотя бы одну дозу исследуемого препарата, в то время как полная выборка для анализа (FAS) включала в себя всех пациенток из выборки безопасности, сообщавших о достижении хотя бы одной конечной точки эффективности. Все пациентки из выборки FAS без значимых нарушений протокола были включены в выборку PPS.
С помощью post hoc анализа были проведены следующие расчеты: сравнение суммарных баллов, определенных пациентками и исследователями описательным методом, с построением кривой Каплана — Мейера. В случае выраженной бактериурии анализировали спектр уропатогенов. При диагностировании «неидентифицированной бактериурии» или «отсутствия роста» проведение бактериального анализа не представлялось возможным. Для проведения последующего post hoc анализа полученных результатов использовали выборку FAS.
Вопросы этики
Разрешение на проведение клинического исследования было получено от уполномоченных органов Украины, а также перед началом клинического исследования было получено положительное заключение Центральной комиссии по вопросам этики Министерства здравоохранения Украины, соответствующего независимого комитета по этике. Письменное информированное согласие было получено у всех пациенток до включения в исследование.
Результаты
В данное открытое нерандомизированное многоцентровое интервенционное исследование, проводившееся в 9 украинских центрах, были включены 125 пациенток европеоидной расы (средний возраст — 43,8 года) с диагнозом нИМП: 83 пациентки (66,4 %) страдали острой нИМП, у 42 (33,6 %) диагностировали обострение рецидивирующей инфекции. Пациентки продемонстрировали превосходную комплайентность (средний показатель — 101,8 %). Лишь 3 женщины из 122, завершивших фазу лечения, не соответствовали диапазону комплайентности 80–120 % по числу драже, которые они должны были принять. В связи с серьезным нарушением протокола 20 пациенток были исключены из выборки PPS. В связи с этим PPS составили 105 человек (табл. 3). Ни одна из пациенток не выбыла в связи с переходом на терапию антибиотиками до 3-го дня.
/81.jpg)
Канефрон® Н обладал безопасностью и хорошей переносимостью. Было зарегистрировано 19 НЯ и ни одного серьезного НЯ (СНЯ). Одиннадцать (8,8 %) пациенток из 125 имели по меньшей мере одно НЯ, чаще всего головную боль (4,0 %) и вздутие живота (1,6 %). Ни одно из НЯ не было связано с приемом препарата. Таким образом, первичная конечная точка исследования — частота НР в ходе 7-дневного лечения препаратом Канефрон® Н — составила 0 % с 95% доверительным интервалом (ДИ) Клоппера — Пирсона между 0,0 и 2,9 % в выборке оценки безопасности.
По окончании 7-дневного периода лечения 71,2 % пациенток из выборки FAS (табл. 4) и 70,8 % из PPS соответствовали критериям клинического излечения. Частота клинического излечения на день 37 составила 85,6 % (FAS) и 85,8 % (PPS). Частота клинического излечения была выше у более молодых пациенток (≤ 45 лет; частота излечения 80,9 % на день 7 и 94,1 % на день 37), чем у пациенток старше 45 лет (частота излечения 59,7 % на день 7 и 75,4 % на день 37) (FAS; табл. 4). На день 7 среднее улучшение (среднее изменение по сравнению с исходными значениями, FAS) суммарного балла дизурии, частого мочеиспускания и неотложных позывов к емочеиспусканию составило –5,4 на день 7 и –6,6 на день 37 по сравнению со средним исходным показателем 7,3 (рис. 3). Средние изменения отдельных симптомов на день 7/37 (FAS) по сравнению с днем 0 составили: –1,9/–2,3 (дизурия); –1,8/–2,4 (частое мочеиспускание); –1,6/–1,9 (неотложные позывы к мочеиспусканию); –0,4/–0,5 (недержание мочи); –0,8/–1,1 (никтурия) и –1,0/–1,2 (боль). Все изменения от исходных значений были статистически значимыми (p < 0,001).
/82.jpg)
Отмечались лишь незначительные различия между оценками симптомов исследователями и пациентками (рис. 3). Кривая Каплана — Мейера на рис. 4 демонстрирует долю респондеров (отсутствие симптомов и симптомы не тяжелее «слабовыраженных») в период исследования, указывая на быстрое уменьшение симптомов у пациентов с отсутствием симптомов дизурии, частого мочеиспускания и неотложных позывов тяжелее «слабовыраженных» в первые дни лечения (FAS).
Длительность симптомов составила в среднем 5,1 дня (частое мочеиспускание), 3,5 дня (дизурия), 2,9 дня (неотложные позывы), 2,4 дня (никтурия), 1,7 дня (боль) и 0,9 дня (недержание). Число нереспондеров, то есть пациенток с улучшением или клинической неэффективностью лечения (табл. 2), снижалось в ходе 7-дневного лечения, и до дня 37 переходило в пользу доли пациенток с клиническим излечением (табл. 4; FAS).
Повышения температуры тела не отмечалось ни у одной пациентки ни на день 7, ни на день 37. Трем пациенткам из 125 потребовались антибиотики в течение 7-дневного периода лечения. По прошествии 7 дней ни у одной из пациенток не был зарегистрирован рецидив заболевания. Клинически выраженных тенденций в лабораторных анализах не отмечалось (общий анализ крови, биохимический анализ крови), равно как и в основных показателях жизнедеятельности и результатах физикального обследования. Среди пациенток, завершивших исследование, ни одна не получала антибиотикотерапии.
У пациенток, демонстрирующих положительные результаты, отмечалось отчетливое снижение, в частности, эритроцитов, в особенности числа эритроцитов, лейкоцитов и нитритов в моче. Доля пациентов с отсутствием лейкоцитов в моче увеличилась с 17,6 % (день 0) до 70,4 % (день 7) и 77,6 % (день 37). На день 37 у 93,6 % пациентов не были обнаружены нитриты в моче и у 80 % отсутствовали эритроциты (экспресс-проба, табл. 5, FAS).
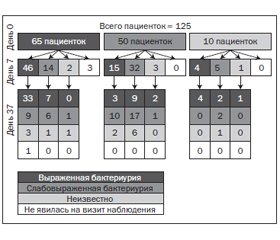
Из 65 пациенток с выраженной бактериурией в 0-й день лишь у 40 отмечалось ≥ 103 КОЕ/мл до дня 37. Однако из 50 пациенток без выраженной бактериурии у 14 развилась значимая бактериурия к 37-му дню. Из 10 человек с неидентифицированной бактериурией в день 0 у 7 отмечалась выраженная бактериурия на день 37 (рис. 5).
Таким образом, общее число пациенток с выраженной бактериурией и бактериальным спектром осталось практически неизменным в день 0, 7 и 37, а E.coli являлась наиболее распространенным уропатогеном, за ней следовали Enterococci (табл. 6).
Частота клинического излечения пациенток с уровнем < 103 КОЕ/мл в день 0 составляла 88,0 % в день 7 и 98,0 % в день 37, тогда как частота излечения у пациенток с уровнем ≥ 103 КОЕ/мл в день 0 составила 62,9 % в день 7 и 98,0 % в день 37 и была значительно ниже (p < 0,005). В группе < 103 КОЕ/мл количество пациенток с клинической неэффективностью лечения составило 1 (2,0 %) на день 7 и 0 (0,0 %) в день 37, тогда как число пациентов с клинической неэффективностью лечения в группе ≥ 103 КОЕ/мл составляло 7 (11,3 %) на день 7 и 4 (6,5 %) на день 37 (табл. 7).
Обсуждение
В течение одного года 11 % женщин переносят не менее одного эпизода ИМП, и более чем у половины из них за всю жизнь случается один или несколько эпизодов инфекций [25]. Каждый год в Соединенных Штатах острый цистит является причиной 3,6 млн визитов женщин в возрасте 18–75 лет к специалистам. В связи с этим прямые затраты составляют 1,6 млрд долларов [25]. Большинство острых инфекций нижних отделов мочевых путей (острый бактериальный цистит) протекают без осложнений. Для них нехарактерны признаки и симптомы инфекций верхних отделов мочевых путей (лихорадка, озноб, боли в пояснице) или другие проявления, указывающие на высокий риск инфекций верхних отделов мочевых путей или осложненных инфекций (сахарный диабет, беременность, иммуносупрессия, пиелонефрит в анамнезе, структурные аномалии мочевых путей). После первичной инфекции у многих женщин возникают спорадические либо частые рецидивы. E.coli вызывает 70–90 % эпизодов острых нИМП, реже рецидивы вызывает Staphylococcus saprophyticus, в основном у молодых девушек. Стандартное лечение включает в себя антибактериальную терапию, при которой частота побочных реакций составляет 7–40 % для триметоприма, 0–40 % для нитрофурантоина, 7–21 % для норфлоксацина и 13 % для ципрофлоксацина [25]. Длительность лечения антибиотиками по данному показанию, как правило, непродолжительная: в плацебо-контролируемом клиническом исследовании отмечалось выраженное быстрое благоприятное влияние на течение симптомов и бактериологические показатели при лечении нИМП нитрофурантоином в течение 3 дней по сравнению с плацебо. После последующего 2-недельного периода наблюдения не отмечалось статистически значимых различий [21]. Кроме того, применение антибиотиков может принести вред пациенткам с бессимптомной бактериурией. В исследовании, проведенном Cai и соавторами [26], было сделано заключение, что нецелесообразно применять антибиотики у молодых пациенток с бессимптомной бактериурией из-за возможного защитного эффекта колонизирующих бактерий. Рассматривается возможность только симптоматического лечения острых нИМП. Bleidorn и соавторы получили аналогичные результаты при применении ибупрофена и ципрофлоксацина в отношении исхода симптоматики заболевания в пилотном исследовании; однако у одной трети пациенток из группы ибупрофена в течение первой недели отмечался рецидив [5].
Таким образом, необходимы альтернативные методы лечения, помимо антибиотиков. Клюква, давно предлагаемая для профилактики острого цистита, содержит проантоцианидины, которые подавляют присоединение уропатогенов к эпителию [27]. 200–500 мг клюквенного сока или таблетки с его концентратом снижают риск симптоматических рецидивов на 12–20 %, однако данный метод не подходит для лечения нИМП [28].
Что касается текущего статуса способов лечения нИМП, данное исследование было проведено с целью оценки профиля безопасности препарата Канефрон® Н и влияния неантибактериальной терапии на ход нИМП. Порог выраженной бактериурии варьирует между 103 и 105 КОЕ/мл в зависимости от уропатогенов, пола пациента и типа пробы мочи [7], поэтому для данного исследования были выбраны пороги 104 и 103 КОЕ/мл. Критерии включения и исключения хорошо соответствовали заданному показанию, о чем свидетельствует то, что лишь 2,4 % пациентов принимали антибиотики.
В исследовании частота излечения при применении препарата Канефрон® Н составляла 71,2 % после 7 дней лечения и 85,6 % после 37 дней наблюдения (FAS, n = 125), что было намного выше, чем показатели, установленные для спонтанного выздоровления [6–8, 21–26]. Это говорит об эффективности препарата Канефрон® Н. Трехдневное лечение нитрофурантоином не привело к значимым различиям в симптоматике по сравнению с пациентками, не получавшими лечения, по прошествии 14 дней [21]. Напротив, симптоматический и противовоспалительный эффект сохранялся до 4 недель после окончания 7-дневного лечения препаратом Канефрон® Н (рис. 4, табл. 4 и 5).
В недавно проведенном метаанализе 464 исследований нИМП у женщин частое мочеиспускание и дизурия имели положительную корреляцию с бактериурией [29], что подтверждает симптоматический и противовоспалительный эффект препарата Канефрон® Н в данном исследовании. С другой стороны, бессимптомная бактериурия не всегда требует применения антибиотиков, даже у пациентов с рецидивирующим циститом [3, 26].
При ИМП микроорганизм, присоединяясь к уротелию мочевого пузыря, вызывает воспалительную реакцию. Возникает гиперактивность мочевого пузыря, что обусловливает частое мочеиспускание и боль. Канефрон® Н обладает существенной антиадгезивной и противовоспалительной активностью, вероятно модулируя гиперактивность мочевого пузыря, облегчая его функцию и препятствуя адгезии E.coli, что подтверждалось в ходе нескольких экспериментов in vitro и in vivo [30, 31]. Бактериальный спектр у пациенток с выраженной бактериурией практически не менялся в ходе лечения и периода наблюдения в данном исследовании (табл. 6), что говорит об отсутствии прямого антимикробного эффекта препарата. Это может свидетельствовать в пользу концепции о процессе иммунной адаптации между уроэпителием и присоединяющимся микроорганизмом. Быстрое разрешение симптомов нИМП при лечении препаратом –Канефрон® Н подтверждает предположение о том, что многочисленные фармакодинамические цели данного препарата подходят для лечения нИМП.
Заключение
Канефрон® Н обладал хорошей переносимостью и был безопасен. О развитии НР и СНЯ не сообщалось. Частота полного излечения составила 71,2 % на день 7 и 85,6 % на день 37 (FAS, n = 125). О значительном улучшении свидетельствовали как суммарный балл, так и балльная оценка каждого отдельного симптома на день 7 и день 37. Лишь 2,4 % пациенток потребовались антибиотики в ходе 7-дневного лечения. Ни у одной пациентки из числа тех, для кого было отмечено клиническое излечение на день 7, не были зарегистрированы рецидивы до дня 37. Дальнейшее разрешение симптомов продолжалось в течение 4 недель после окончания лечения в отличие от многих антибактериальных препаратов. Поскольку данное исследование было проведено с целью оценки безопасности препарата Канефрон® Н, невозможно определенно заявлять о его эффективности, однако быстрое разрешение симптомов нИМП при лечении данным препаратом говорит о его эффективности, что нуждается в дальнейшем изучении. В данном исследовании сделан акцент на безопасном применении и возможности использования неантибактериального терапевтического подхода в виде препарата Канефрон® Н, и оно служит обоснованием к проведению крупномасштабного контролируемого клинического исследования с целью подтверждения роли данного препарата в лечении острых нИМП.
Конфликт интересов
Дмитрий Иванов, Татьяна Костиненко, Лилия Мартынюк и Николай Колесник — исследователи в данном исследовании, спонсором которого выступила компания «Бионорика СЕ», Ноймаркт, Германия.
Дмитрий Иванов также является представителем-лектором компании «Бионорика».
Дмитрий Абрамов-Соммарива, Катрин Мориц и Херберт Эскеттер являлись сотрудниками компании «Бионорика».
Курт Г. Набер: «Базилеа» (исследователь, консультант), «Байер» (представитель), «Бионорика» (исследователь, консультант, научные публикации, лектор), «Берингер Ингельхайм» (консультант), «Кубист/МСД» (консультант), «Даичи Санкио» (представитель, научные публикации), «Галенус» (консультант), «Лео Фарма» (консультант, представитель), «Мелинта» (консультант), «МерЛион» (исследователь, консультант, научные публикации), «ОМ Фарма/Вифор» (исследователь, консультант, лектор, научные публикации), «Паратек» (консультант), «Ремпекс Фарм» (консультант), «Розен Фарма» (исследователь, консультант, научные публикации, лектор), «Сионоги» (консультант), «Замбон» (исследователь, консультант, лектор).
Авторы
КН, ДАС, ГЭ и КМ планировали дизайн исследования, проводили анализ и обзор результатов исследования. ДИ, НК, ТК и ЛМ выполняли клиническую часть исследования и сбор данных. Все авторы ознакомились и утвердили конечную версию статьи.
Признательность
Мы хотим выразить признательность всем участвующим клиническим сайтам за их ответственное и успешное выполнение данного клинического исследования.
Колесник Николай, государственное предприятие «Институт нефрологии НАМН Украины», ул. Дегтяревская, 17-Б, 04050, Киев, Украина.
Лесовой Владимир, Региональный клинический центр урологии и нефрологии им. В.И. Шаповала, Московский проспект, 195, 61037, Харьков, Украина.
Пирогов Виктор, Национальный институт урологии Национальной академии медицинских наук Украины, ул. Ю. Коцюбинского, 9а, 04053, Киев, Украина.
Антонян Игорь, заведующий кафедрой урологии ХМАПО на базе кафедры урологии поликлиники «Доктор Алекс», ул. Воробьева, 4, 61057, Харьков, Украина.
Иванов Дмитрий, коммунальное предприятие Киевского областного совета «Киевская областная клиническая больница», ул. Багговутовская, 1, 04107, Киев, Украина.
Костиненко Татьяна, Центр нефрологии и диализа, Николаевская областная клиническая больница, ул. Киевская, 1, 54058, Николаев, Украина.
Мартынюк Лилия, кафедра нефрологии Тернопольского медицинского университета, Тернопольская областная клиническая больница, ул. Клиническая, 1, 46002, Тернополь, Украина.
Люлько Алексей, заведующий кафедрой урологии Запорожской медицинской академии последипломного образования (ЗМАПО), урологический кабинет Запорожской областной клинической больницы, ул. Ореховское шоссе, 10, 69600, Запорожье, Украина.
Костев Федор, заведующий кафедрой урологии/нефрологии Одесского государственного медицинского университета, урологический отдел № 1/№ 2, больница № 10, ул. Малиновского, 61, 65074, Одесса, Украина.
Мы выражаем признательность контрактно-исследовательской организации «Харрисон клиникал рисерч» за огромный вклад в разработку проекта.
Мы благодарим Jorg Michael Schierholz, Штарнберг, Германия, за его поддержку в медицинских и научных вопросах, а также неоценимые комментарии в процессе подготовки рукописи.
Мы очень благодарны Christine Neubauer, Martina Holler, Mirjam Rittmeyer, Patrick Dubovy, Hubert Steindl, «Бионорика СЕ», Ноймаркт, Германия, за расширенную поддержку в проведении исследования и успехе рукописи.
Учреждения
1Киевская областная клиническая больница, 04107, г. Киев, ул. Багговутовская, 1
2Бионорика СЕ, Кершенштейнер, 11-15, 92318, Ноймаркт, Германия
3Прелат-Отто-Мюллер-Плац 2, 50670, Кельн, Германия
4Центр нефрологии и диализа, Николаевская областная больница, ул. Киевская, 11, 54058, Николаев, Украина
5Тернопольская областная клиническая больница, ул. Клиническая, 1, 46002, Тернополь, Украина
6Институт нефрологии НАМН Украины, ул. Дегтяревская, 17-В. 04050, Киев, Украина
7Карл-Бикледер Штрассе 44с, 94315, г. Штраубинг, Германия
Список литературы
1. Little P., Moore M.V., Turner S., Rumsby K., Warner G., Lowes J.A. et al. Effectiveness of five different approaches in management of urinary tract infection: randomised controlled trial // BMJ. — 2010. — № 340. — Р. 199. — Doi:10.1136/bmj.c199.
2. Dingermann T., Loew D. Urologika // Phytopharmakologie. — Stuttgart. Wiss. Verlagsgesellschaft Stuttgart, 2003. — Р. 250-258.
3. Wagenlehner F.M.E., Weidner W., Naber K.G. An update on uncomplicated urinary tract infections in women // Current Opintion in Urology. — 2009. — № 19. — Р. 368-74.
4. S3 Guideline (S3 Leitlinie) AWMF-Register-Nr. 043/044 Harnwegsinfektionen Epidemiologie, Diagnostik, Therapie und Management unkomplizierter bakterieller ambulant erworbener Harnwegsinfektionen bei erwachsenen Patienten.
5. Scottish intercollegiate Guidelines network (SIGN) management of suspected urinary tract infecftions in adult // A national clinical guideline, SIGN Publication. — 2006. — № 88.
6. Bleidorn J., Gagyor I., Kochen M.M., Wegscheider K., Hummers-Pradier E. Symptomatic treatment (ibuprofen) or antibiotics (ciprofloxacin) for uncomplicated urinary tract infection? — Results of a randomized controlled pilot trial // BMC Medicine. — 2010. — № 8. — Р. 30.
7. Ferry S.A., Holm S.E., Stenlund H., Lundholm R., Monsen T.J. The natural course of uncomplicated lower urinary tract infection in women illustrated by a randomized placebo controlled study // Scand. J. Inf. Dis. — 2004. — № 36. — Р. 296-301.
8. Jolleys J.V. The reported incidence of urinary symptoms in women in one rural general practise // Brit. J. Gen. Pract. — 1990. — № 40. — Р. 335-7.
9. Naber K.G. Efficacy and safety of the phytotherapeutic drug Canephron® N in prevention and treatment of urogenital and gestational disease: review of clinical experience in eastern europe and central asia // Research and reports in Urology. — 2013. — № 5. — Р. 39-46.
10. EMEA, HMPC. Community herbal monograph on Centaurium erythraea rafn, herba. EMEA/HMPC/105536/2008, 12 March 2009.
11. European Scientific Cooperative on Phytotherapy (ESCOP), Centaurii herba (Centaury herb) // ESCOP Monographs. 2nd ed. — Stuttgart-New York: Thieme Verlag, 2003. — Р. 70-73.
12. Blaschek W., Ebel S., Hackenthal E., Holzgrabe U., Keller K., Reichling J., Schulz V. Centaurium // Hager Handbook. 6th ed. — Stuttgart. Wissenschaftliche Verlagsgesellschaft mbH, 2007 — Р. 159-168.
13. Claisse R. Drogues de la Pharmacopee traditionelle de la ragion de Rabat-Sale // Plantes medicinales et phytotherapie. — 1989. — T. XXIII, № 4. — Р. 315-331.
14. Fournier. Centauree Jaune // Le livre des Plantes Medicinales et Veneneuses de France. — 1947. — Р. 324-327.
15. German Commission E monograph for Levistici radix // Bundesanzeiger. — 1 June 1990. — № 101.
16. Willuhn G. Levistici radix, Liebstockelwurzel / Еd. by –Wi–chtl M. // Teedrogen. 4th ed. — Stuttgart. Wiss. Verlagsgesellschaft, 2002. — Р. 335-337.
17. EMA, HMPC. Community herbal monograph on Rosmarinus officinalis L., folium. EMA/HMPC/13633/2009, 15 July 2010.
18. European Scientific Cooperative on Phytotherapy (ESCOP), Rosmarini folium (Rosemary leaf) // ESCOP Monographs. 2nd ed. — Stuttgart-New York: Thieme Verlag, 2003. — Р. 429-436.
19. British Herbal Medicines Association. Rosmarinus. // British Pharmacopoeia. — 1983. — Р. 180-181.
20. Fluck. Romarin // Petit Guide panoramique des Herbes Medicinales. — 1973. — Р. 124.
21. Christaensen T.C., De Meyere M., Verschraegen G., Peersmann W., Heytens S., De Maeseneer J.M. Randomized controlled trial of nitrofurantoin versus placebo in the treatment of uncomplicated urinary tract infection in adult women // Brit. J. Gen. Pract. — 2002. — № 52. — Р. 729-43.
22. Rubin R.H., Beam Jr T.R., Stamm W.E. An Approach to Evaluating Antibacterial Agents in the Treatment of Urinary Tract Infection // Clin. Infect. Dis. — 1992. — № 14. — S246-51.
23. Malterud K., Baerheim A. Peeing Barbed Wire. Symptom Experiences in Women With Lower Urinary Tract Infection // Scand. J. Prim. Health Care. — 1999. — № 17. — Р. 49-53.
24. Falagas M.E., Kotsantis I.K., Vouloumanou E.K., Rafailidis P.I. Antibiotics versus placebo in the treatment of women with uncomplicated cystitis: a metaanalysis of randomized controlled trials // J. Infect. — 2009. — № 58(2). — Р. 91-102.
25. Fihn SD: Acute uncomplicated urinary tract infection in wo–men // NEJM. — 2003. — № 349(3). — Р. 259-266.
26. Cai T., Mazzoli S., Mondaini N., Meacci F., Nesi G., Delia C. et al. The Role of Asymptomatic Bacteriuria in Young Women With Recurrent Urinary Tract Infections: To Treat or Not to Treat? // Clin. Infect. Dis. — 2012. — № 55(6). — Р. 771-7.
27. Foo L.Y., Lu Y., Howell A.B., Vorsa N. A-type proanthocyanidine trimers from cranberry that inhibit adherence of uropathogenic P-fimbiriated E.coli // J. Nat. Prod. — 2000. — № 63. — Р. 1225-1228.
28. Kontiokari T., Sundquist K., Nuutine M., Pokka T., Koskela M. Randomised trial of cranberry-lingonberry juice and Lactobacillus GG drink for the prevention of urinary tract infections in women // BMJ. — 2001. — № 322. — Р. 1571.
29. Bent S., Nallamothu B.K., Simel D.L., Fihn S.D., Saint S. Does these women have an acute uncomplicated UTI? // JAMA. — 2002. — № 287. — Р. 2701-10.
30. Brenneis C., Kunstle G., Haunschild J. Spasmolytic activity of Canephron N® on the contractility of rat and human isolated urinary bladder. — Abstract 2012, 13th International Congress of the Society for Ethnopharmacology.
31. Kunstle G., Brenneis C., Haunschild J. Efficacy of Canephron® N against bacterial adhesion, inflammation and bladder hyperactivity. — Abstract 2013, 28th European Association of Urology Congress (poster presentation). Poster No. 671, Session 55: From bench to bedside in pain and OAB.
Впервые опубликовано в журнале Clinical Phytoscience. — 2015. — № 1(7)
/79.jpg)
/79_3.jpg)
/79_2.jpg)
/81.jpg)
/84.jpg)

/80.jpg)
/82.jpg)
/82_2.jpg)
/83.jpg)
/84_2.jpg)
/85.jpg)