Статтю опубліковано на с. 47-52
Міжнародна спільнота вже переступила поріг в 1,5 млрд осіб з надлишковою вагою, серед яких майже 700 млн мають ожиріння. Така поширеність надмірної ваги сприяла появі нових проблем у сучасній медицині — ураження багатьох органів і систем організму внаслідок метаболічних ускладнень, а також появі несприятливого фону для перебігу хронічних неінфекційних захворювань внутрішніх органів.
Останні роки характеризуються пильною увагою до захворювань печінки, серед яких особливе місце належить неалкогольній жировій хворобі печінки (НАЖХП), що доволі часто є складовою метаболічного синдрому. Патогенетична багатофакторність патології та клінічна неоднорідність проявів захворювання надає проблемі сучасного звучання, забезпечує формування нових поглядів на її перебіг та розробку схем терапії [1, 2].
Виникнення НАЖХП в осіб з надмірною вагою або ожирінням визначає напрямки діагностичного пошуку, що пов’язані з порушеннями всіх видів обміну, імунними та генетичними абераціями. Тобто неалкогольна жирова хвороба печінки є як наслідком цих змін, так і потенційним стимулятором їх появи, що може як забезпечувати тяжкість перебігу захворювання, так й впливати на його прогноз [3, 4].
Печінка є органом, що бере активну участь в імунній відповіді, а також підтримує тканинний і середовищний гомеостаз. Вона бере безпосередню участь в імунній відповіді: поряд із макрофагами та В-лімфоцитами виробляє термолабільні білки, що є складовою системи комплементу, а також інші білки гострої фази [5]. Їй притаманна регуляторна функція щодо імуноглобулінів А і Е; вона бере участь у процесах гемопоезу; визначає систему гемокоагуляції (фібриноген, фактори протромбінового комплексу, серинові протеїнази, вітамін К), імунну реактивність (купферівські клітини печінкової строми) тощо [6]. Надлишкова вага та ожиріння дещо змінюють функцію печінки через додаткове навантаження на орган і тим самим призводять до зміни відповіді на виникнення патології. Постійне напруження органа змінює послідовність та повноту відповіді при розвитку хронічного запалення, що в першу чергу призводить до збою в імунній системі [7–9].
Доведено, що розвиток хронічного запального процесу в організмі або його системі підпорядковано загальним законам імунної відповіді, у який провідна роль належить про- и протизапальним цитокінам. Їх відношення визначають стадію патологічного процесу (активна, неактивна), глибину ураження та можливість формування ускладнень. Вироблення цитокінів також забезпечує й багато клінічних проявів захворювання, що доволі часто дозволяє визначати патологію [6, 10].
На сьогодні визначено більше ніж 100 імунологічно активних цитокінів, що входять до складу універсальної біологічної комунікаційної системи, яка ініціює та регулює запальні імунні й метаболічні процеси, що відбуваються при різних захворюваннях внутрішніх органів. Цитокіни тісно взаємопов’язані між собою, що сприяє формуванню єдиної й цілісної системи — цитокінової мережі, у межах якої прояви окремих цитокінів суттєво модифіковані. Цитокіни, зокрема інтерлейкіни, забезпечують взаємодію клітин усередині органа та зв’язок між органами як у фізіологічних умовах, так і внаслідок дії різних патогенних факторів. Кінцевий результат біологічного ефекту інтерлейкінів визнається їх вмістом, часовою послідовністю синтезу різноманітних цитокінів, мікрооточенням, їх взаємодією між собою та з іншими біологічно активними речовинами, такими як гормони, фактори росту. У комплексі з останніми інтерлейкіни створюють біологічну мультисистему, що реалізує міжклітинні комунікації на різних рівнях. Тобто, з одного боку, цитокіни викликають корисну запальну реакцію, що сприяє обмеженню пошкодження тканини, а з іншого боку, надмірна їх продукція може бути ще більш небезпечною, ніж первинний стимул, що призвів до розвитку запального процесу [11].
Іншим напрямком хронічного запалення є ушкодження клітинних мембран унаслідок порушень у системі перекисного окиснення ліпідів — антиоксидантний захист, що характеризується збільшенням продукції реактогенних вільних радикалів, ураженням ліпідно-білкової основи біомембран з порушенням функціональної активності імунокомпетентних клітин, ендотеліоцитів і клітин крові (Христич T.M., 2012).
Cтруктурними компонентами ліпідів, що входять до складу клітинних мембран, є жирні кислоти (ЖК). За своєю структурою ЖК поділяються на насичені (НЖК) (мають тільки одинарні зв’язки між атомами вуглецю) та ненасичені (ННЖК): мононенасичені (МНЖК) (з одним подвійним зв’язком) та поліненасичені (ПНЖК) (з двома та більше подвійними зв’язками). До основних НЖК ліпідів відносять масляну, міристинову, пальмітинову, стеаринову, арахінову, бегенову та лігноцеринову кислоти. До складу МНЖК входять пальмітоолеїнова та олеїнова кислоти. ПНЖК прийнято розглядати у контексті їх належності до родини ω-3 та ω-6 кислот (отримали таку назву за локалізацією подвійного зв’язку відносно вуглецевого атому метильної групи), що обумовлене виключною важливістю даних ЖК у життєдіяльності організму та неможливістю ендогенного синтезу де–яких із них. Синтез ЖК відбувається в печінці, жировій тканині, стінці кишечника, легенях, нирках, судинах, речовині головного мозку та кістковому мозку. ЖК синтезуються в організмі з продуктів розпаду вуглеводів, а також надходять з їжею, що особливо стосується незамінних кислот (лінолевої, α-ліноленової та арахідонової) [12].
В останні десятиріччя отримані дані, що свідчать про специфічне значення окремих ЖК та їх роль як біо–маркерів функціонального стану організму. Так, НЖК та мононенасичена олеїнова кислота, перетворюючись у реакціях β-окислення в мітохондріях, постачають клітинам основну кількість АТФ. МНЖК є продуктом ендогенного синтезу в організмі та мають нейтралізуючий вплив на реакції окислювального стресу. ПНЖК виконують у клітинах структурну та регуляторну функції: беруть участь у формуванні мембрани клітин та пов’язаних з мембраною клітинних функцій. Окрім структурно-функціональної організації клітини, ЖК підтримують активність багатьох метаболічних реакцій та регулюють різні фізіологічні процеси на біохімічному рівні. Однією з важливих функцій ПНЖК є їх використання як субстрату для синтезу ейкозаноїдів (простагландинів, лейкотрієнів, простациклінів, тромбоксанів), що беруть участь у регулюванні імунного статусу, запальних реакцій, судинного тонусу, агрегації тромбоцитів та процесів гемокоагуляції . Крім того, від ПНЖК залежить утворення інших біологічно активних речовин (ліпоксинів, резольвінів та протектинів). Вважають, що омега-3 ПНЖК покращують функцію ендотелію, мають протизапальний ефект, модулюють Т- та В-клітинну імунну відповідь, активність протеїнкінази С, утворення вільних радикалів та перекисне окиснення ліпідів, секрецію лімфокінів та клітинну проліферацію, а також їм притаманні гіполіпідемічні, антиаритмічні, антикоагулянтні та гіпотензивні властивості [6, 11, 13].
Зміни складу ЖК у фосфоліпідах (ФЛ) мембран стають причиною порушення їх важливих параметрів: рідинності, мікров’язкості та забезпечення функціональної активності інтегрованих протеїнів. Це стосується рецепторів, систем передачі сигналу до цитозолю, активності транспортерів та піноцитозу. Кожна молекула ФЛ містить два залишки ЖК — насичену та ненасичену ЖК, що зазнають термодинамічних перетворень. Двошарові структури з НЖК формують ригідну фазу; а структури з ННЖК, навпаки, утворюють більш рідинну фазу. При цьому збільшення кількості подвійних зв’язків у ЖК більш істотно змінює властивості біомембрани. Стійкий ліпідний дисбаланс, що виникає при тривалій дії патогенного чинника, може порушувати специфічні функції клітин та викликати розвиток хронічного патологічного процесу.
Мета роботи: визначення клініко-патогенетичних ланок поєднаного перебігу ожиріння та бронхіальної астми в умовах формування НАЖХП.
Матеріали та методи дослідження
Під спостереженням перебували 27 хворих на НАЖХП, що перебігала в поєднанні з бронхіальною астмою, та 23 пацієнти з ізольованою БА. Вік хворих коливався від 27 до 49 років та в середньому по групах становив (34,6 ± 5,3) року та (35,7 ± 4,9) року відповідно. Тривалість анамнезу БА реєструвалася в межах 5–17 років. Усі хворі знаходилися в стадії ремісії захворювання та мали 2-гу (12 осіб) або 3-тю стадію (15) хвороби. До групи контролю увійшли 20 практично здорових осіб, групи були порівнянні за статтю та віком.
Діагноз НЖХП було встановлено з урахуванням даних об’єктивного та додаткових методів дослідження, що відповідало класифікації МКХ-10 (шифр К 76.0 — жирова дегенерація печінки). Тривалість анамнезу захворювання була в межах 4–15 років.
Оцінка трофологічного стану проводилася за даними індексу маси тіла (ІМТ) за формулою Кетле, що дозволило визначити ожиріння І ст. у 10 пацієнтів (37,0 %) та ІІ ст. — у 17 осіб (63,0 %).
Стан вуглеводного обміну оцінювали за показниками рівня глюкози в сироватці крові натще, глікозильованого гемоглобіну (HbA1c) — глюкозооксидантний метод (набор реактивів «Діабет-тест») та вмісту імунореактивного інсуліну — імуносорбентний сандвіч-метод (набор реактивів DRG, Німеччина).
Показники ліпідного обміну включали концентрацію загального холестерину та тригліцеридів сироватки крові, а також ліпопротеїдів високої (ЛПВЩ) і низької щільності (ЛПНЩ) — ферментативний метод, стандартні набори реактивів.
Показники прозапальної ланки цитокінів вивчали за вмістом ІЛ-1 та ІЛ-6, протизапальної — ІЛ-2 і ІЛ-4. Уміст цитокінів визначали імуноферментним методом з використанням сертифікованих в Україні тест-систем виробництва ТОВ «Протеїновий контур» (ProCon), Санкт-Петербург, Росія.
Cумарне значення насичених, ненасичених і поліненасичених жирных кислот визначали за методом С.Г. Гичка та співавт. [13].
Статистична обробка отриманих результатів проводилася на персональному комп’ютері за допомогою ліцензійних програм Microsoft Excel та Statistica 6.0. При цьому виконувалось обчислення середніх величин (М), їх помилки (m) із застосуванням непараметричних методів статистики (критерій Манна — Уїтні). Відмінності у показниках вважалися вірогідними при р < 0,05.
Результати та їх обговорення
При ультразвуковому дослідженні печінки у хворих основної групи було встановлено збільшення органа в середньому на (1,6 ± 0,4) см, підвищення її ехогенності та наявність осередків жирової дистрофії.
Верифікація діагнозу НАЖХП була підставою для визначення стану показників індикаторних ферментів. Так, у хворих на ізольовану БА вміст АСТ у сироватці крові становив (0,46 ± 0,01) ммоль/л/год при нормі (0,42 ± 0,01) ммоль/л/год. У той же час даний показник в осіб основної групи дорівнював (0,76 ± 0,01) ммоль/л/год (р < 0,05). Показник АЛТ також перевищував конт–рольні результати ((0,45 ± 0,01) ммоль/л/год) та становив (0,50 ± 0,01) ммоль/л/год і (0,80 ± 0,01) ммоль/л/год відповідно (р < 0,05).
Вірогідних змін у показниках пігментного обміну за вмістом загального білірубіну та його фракцій виявлено не було.
Уміст загального білка сироватки крові також коливався в межах норми як у осіб основної групи ((60,91 ± 0,11) г/л), так і в групі порівняння — (0,69 ± 0,12) г/л.
Дослідження показників вуглеводного обміну виявило, що рівень глюкози натще в групі осіб із БА дорівнював (5,70 ± 0,11) ммоль/л, а при приєднанні ожиріння — (6,90 ± 0,12) ммоль/л (р < 0,05 щодо норми). Причому коливання зазначеного показника в основ-ній групі хворих з урахуванням стадії ожиріння визначено не було, що, ймовірно, пов’язано з невеликою кількістю осіб з І ст. ожиріння — 10 пацієнтів. Рівень імунореактивного інсуліну (ІРІ) натще в контрольній групі становив (21,3 ± 2,8) мкОд/мл, в основній групі — (31,4 ± 2,4) мкОд/мл та групі порівняння — (23,1 ± 1,7) мкОд/мл. Через 2 години після проведеного тесту — (29,3 ± 2,1) мкОд/мл, (49,8 ± 3,1) мкОд/мл і (31,9 ± 2,1) мкОд/мл відповідно. При цьому рівень ІРІ мав пряму кореляційну залежність від ІМТ (r = 0,64, p < 0,05). Також встановлено, що в осіб основної групи визначені вірогідно вищі показники HbA1c ((8,30 ± 0,21) %, р < 0,05) проти групи порівняння ((5,0 ± 0,3) %) та контролю ((4,57 ± 0,12) %).
Рівень загального холестерину сироватки крові (ЗХС) при коморбідності БА та ожиріння дорівнював (5,89 ± 0,20) ммоль/л при нормі (4,49 ± 0,20) ммоль/л, р < 0,05. У той же час при ізольованому перебігу БА ЗХС практично не перевищував показники норми — (4,67 ± 0,20) ммоль/л. Рівень тригліцеридів характеризувався вірогідно вищими значеннями в основній групі — (2,20 ± 0,12) ммоль/л проти групи порівняння — (1,54 ± 0,20) ммоль/л та норми — (1,40 ± 0,13) ммоль/л. А рівень ліпопротеїнів високої щільності вірогідно знижувався — (1,7 ± 0,2) ммоль/л та (2,30 ± 0,18) ммоль/л відповідно при нормі (2,7 ± 0,2) ммоль/л.
Отже, група хворих з коморбідною патологією, яка призвела до формування НАЖХП, характеризується порушенням ліпідного та вуглеводного обміну, що підтверджує участь печінки в метаболічних змінах у організмі.
Стан цитокінової мережі пацієнтів основної групи характеризувався збільшенням показників прозапальної ланки. Так, рівень ІЛ-1 у хворих з коморбідністю захворювань дорівнював (46,4 ± 3,1) нг/мл, у групі порівняння становив (32,1 ± 2,7) нг/мл проти (26,0 ± 1,6) нг/мл у групі контролю. Вміст ІЛ-6 було підвищено до (65,8 ± 3,7) нг/мл та (47,8 ± 3,1) нг/мл відповідно (норма — (42,5 ± 2,5) нг/мл), р < 0,05. Протизапальна ланка цитокінів характеризувалася вірогідним підвищенням рівня ІЛ-2 у групі з коморбідною патологією порівняно з контролем — (29,9 ± 1,8) нг/мл (при нормі (12,0 ± 0,5) пг/мл, р < 0,05) проти (18,8 ± 1,5) пг/мл у групі порівняння (рис. 1).
/50.jpg)
Основною точкою дії ІЛ-2 є стимуляція насамперед Т-хелперів 1-го типу. Збільшення його концентрації, мабуть, є наслідком дії бактеріального агента, що зберігається в організмі в хронічних вогнищах інфекції. При цьому часте рецидивування БА веде до формування вторинного імунодефіциту і тим самим до автоімунного ушкодження, що забезпечує безперервність процесу.
У той же час вміст ІЛ-4 в осіб основної групи було зменшено до (21,5 ± 1,9) пг/мл при показниках групи порівняння (29,7 ± 1,7) пг/мл та контролю (32,7 ± 2,4) пг/мл (р < 0,05). Тобто, незважаючи на те що ураження печінки у хворих з ожирінням та БА відбувається у вигляді стеатогепатозу, визначено порушення цитокінової ланки імунітету, що можна розглядати як несприятливий фактор щодо прогресування патологічного процесу в органі. Як було визначено, в обстежених хворих БА знаходилася в стадії клінічної ремісії, однак підвищення показників цитокінової ланки імунітету мало місце. При цьому при деталізації анамнестичних даних щодо загострення БА у хворих на НАЖХП було встановлено, що загострення бронхолегеневої патології у таких осіб відбувається частіше, ніж за відсутності ураження печінки (у середньому в 1,4–1,6 раза), і не завжди пов’язане з дією екзогенних факторів. Якщо брати до уваги, що прозапальні цитокіни виробляють не тільки жирова тканина й печінка, але й судини та слизова оболонка бронхів, то їх підвищення в сироватці крові може бути тим предиктором, що запускає запальний процес в інших органах — саме бронхах. Тобто приєднання ожиріння сприяло активації прозапальних цитокінів як цілісної системи і тому може розглядатися як один із факторів, що провокує «безпричинне» загострення бронхолегеневої патології.
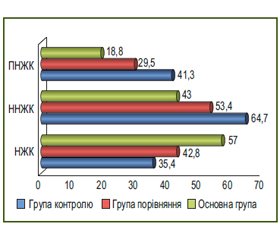
При вивченні сумарних показників жирних кислот також визначено порушення в їх величинах. Рівень Σ НЖК в обох групах хворих вірогідно зменшувався — до (35,2 ± 3,7) % в основній групі та (42,8 ± 3,9) % у групі порівняння при нормі (57,0±1,4) %), р < 0,05. Показник Σ ННЖК був вірогідно збільшений і становив (64,7 ± 5,1) % та (53,4 ± 3,5) % відповідно при контрольних значеннях (43,0 ± 1,3) %, р < 0,05; вміст Σ ПНЖК дорівнював (41,3 ± 3,2) % і (29,5 ± 2,8) % проти норми (18,8 ± 1,3) %, р < 0,05.
Тобто у хворих із БА та при її поєднанні з ожирінням відбувається ураження біомембран як результат порушення кількісного складу та відношень жирних кислот і, тим самим, активації процесів перекисного окиснення ліпідів. Такі зміни в показниках ЖК провокують порушення екскреції ейкозаноїдів. Останні, у свою чергу, беруть участь у реалізації ангіоспастичного синдрому, тобто судинних реакцій та гемодинамічних порушень. У такому разі можна припустити, що дисбаланс синтезу ейкозаноїдів може впливати на формування рефрактерних до терапії форм бронхіальної астми. Іншим несприятливим результатом порушеного синтезу ейкозаноїдів може бути прогресування ендотеліальної дисфункції, наслідком якої є прогресування патологічного процесу в бронхолегеневій системі, а також формування ускладнень з боку серцево-судинної системи [14–16]. У такому разі дисбаланс у біомембранах клітин есенціальних ЖК формує високий потенціал запалення та є предиктором розвитку ускладнень.
У хворих основної групи визначена пряма кореляційна залежність між вмістом ІЛ-1 та ННЖК (r = 0,64, p < 0,05), ІЛ-6 і ННЖК (r = 0,71, p < 0,05); показниками даних інтерлейкінів та ПНЖК (r = 0,57 та r = 0,61 відповідно, p < 0,05) та обернена залежність між рівнем означених цитокінів та показниками НЖК (r = –0,52 та r = –0,59 відповідно, p < 0,05). Також при кореляційному аналізі встановлено вірогідний зв’язок між показником ІЛ-4 та вмістом НЖК (r = 0,41, p < 0,05) та обернений — між ІЛ-4 та ННЖК (r = –0,52, p < 0,05) та ПНЖК (r = –0,68, p < 0,05).
Висновки
При поєднаному перебігу бронхіальної астми та ожиріння виникають умови для формування стеатогепатозу, що може сприяти прогресуванню патологічного процесу.
Формування неалкогольної жирової хвороби печінки в пацієнтів з бронхіальною астмою та ожирінням супроводжується змінами в показниках ліпідного (гіперліпідемія) та вуглеводного (порушення толерантності до глюкози) обмінів, що сприяє запуску метаболічного синдрому.
Поєднання БА та ожиріння з формуванням стеатогепатозу перебігає з порушенням вироблення жирних кислот, що призводить до ураження клітинної мембрани та екскреції ейкозаноїдів. Наслідком таких змін може стати прогресування ендотеліальної дисфункції та формування ускладнень з боку серцево-судинної системи.
Наявність НАЖХП у пацієнтів з коморбідністю БА та ожиріння сприяє змінам у показниках цитокінової ланки імунітету, що характеризується активацією прозапальних (ІЛ-1, ІЛ-2, ІЛ-6) її компонентів. Означені зміни в імунній системі та порушення синтезу ейкозаноїдів можуть забезпечити прогресування бронхолегеневої патології та формування тяжкої стадії захворювання.

/50.jpg)