Международный эндокринологический журнал 8 (72) 2015
Вернуться к номеру
Изменения костной ткани и их возрастные различия у женщин, больных диффузным токсическим зобом
Авторы: Герасименко Л.В. - Государственное учреждение «Институт проблем эндокринной патологии им. В.Я. Данилевского НАМН Украины», г. Харьков
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
З метою вивчення факторів ризику, що сприяють формуванню структурно-функціональних порушень кісткової тканини при тиреотоксикозі, та оцінки діагностичної цінності рентгеноморфометричного дослідження й ультразвукової денситометрії при ранньому виявленні остеопоротичних процесів було обстежено 170 жінок репродуктивного віку та періоду менопаузи, насамперед з діагнозом «дифузний токсичний зоб», які були розділені на три підгрупи залежно від вираженості остеопоротичних змін (хворі на дифузний токсичний зоб без змін у кістковій тканині, хворі на дифузний токсичний зоб з остеопенією і хворі на дифузний токсичний зоб з остеопорозом). Групу контролю становили здорові жінки обох вікових груп, які були розподілені на ті самі підгрупи.
Встановлено, що рентгенографічний метод виявлення остеопоротичних порушень у жінок різного віку, хворих на дифузний токсичний зоб (з визначенням індексів деформації хребців — Рохліна, Шармазанової; метакарпального індексу) дозволяє оцінити стан кісткової тканини на першому етапі дослідження, при цьому не належить до найбільш високоінформативних.
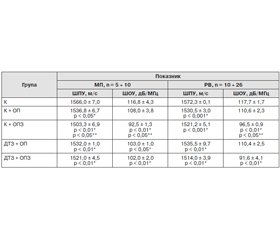
Оцінка показників мінеральної щільності кісткової тканини за допомогою ультразвукової остеоденситометрії є більш сучасним та інформативним методом. Виявлено, що при остеопенії та остеопорозі втрачається щільність п’яткової кістки у жінок обох вікових груп як при дифузному токсичному зобі, так і без нього, але відсоток втрати щільності залежить як від віку, так і від наявності дифузного токсичного зоба. У репродуктивному віці мінеральна щільність кісткової тканини при остеопенії не ускладнюється наявністю дифузного токсичного зоба, але при остеопорозі факт наявності тиреопатології робить додатковий внесок у структуру кістки.
У жінок, які знаходяться в періоді менопаузи, втрата щільності п’яткової кістки має ту ж спрямованість, що і у жінок репродуктивного віку.
Доведено, що зниження щільності п’яткової кістки у жінок до стадії остеопенії не залежить від діагнозу «дифузний токсичний зоб». Але більш серйозні зміни щільності, на рівні остеопорозу, не пов’язані із захворюванням на дифузний токсичний зоб, спостерігаються в групі жінок менопаузального періоду. Дифузний токсичний зоб нівелює ці вікові відмінності за даним показником: і в репродуктивному віці, і в періоді менопаузи втрата щільності при остеопорозі становить близько 35 %. Тобто виявлення первинних порушень мінеральної щільності кісткової тканини, ймовірно, може запобігти розвитку подальшої деструкції кісткової тканини, яка пов’язана з тиреоїдних статусом. А нормалізація останнього, можливо, також зупинить процес деструкції кісткової тканини.
Виявлено, що при зниженні мінеральної щільності кісткової тканини в групах з остеопенією та остеопорозом у жінок як із дифузним токсичним зобом, так і без нього в п’ятковій кістці були встановлені статистично вірогідні відмінності з контролем за індексом щільності кістки, за швидкістю поширення ультразвуку і зміною параметрів широкосмугового ослаблення ультразвуку, що вказує на зміну кількості, розмірів і просторової орієнтації кісткових трабекул у досліджуваній кістці в обстежених пацієнтів.
При аналізі мінеральної щільності кісткової тканини за Т-критерієм була встановлена вікова відмінність між групами жінок без тиреопатології, але з остеопорозом.
С целью изучения факторов риска, способствующих формированию структурно-функциональных нарушений костной ткани при тиреотоксикозе, и оценки диагностической ценности рентгеноморфометрических исследований и ультразвуковой денситометрии при раннем выявлении остеопоротических процессов было обследовано 170 женщин репродуктивного возраста и периода менопаузы, прежде всего с диагнозом «диффузный токсический зоб», которые были разделены на три подгруппы в зависимости от выраженности остеопоротических изменений (больные с диффузным токсическим зобом без изменений в костной ткани, больные с диффузным токсическим зобом и остеопенией и больные с диффузным токсическим зобом и остеопорозом). Группу контроля составили здоровые женщины обеих возрастных групп, которые были распределены на такие же подгруппы.
Установлено, что рентгенографический метод обнаружения остеопоротических нарушений у женщин разного возраста, больных диффузным токсическим зобом (с определением индексов деформации позвонков — Рохлина, Шармазановой; метакарпального индекса) позволяет оценить состояние костной ткани на первом этапе исследования, при этом не относится к наиболее высокоинформативным.
Оценка показателей минеральной плотности костной ткани с помощью ультразвуковой остеоденситометрии является более современным и информативным методом. Обнаружено, что при остеопении и остеопорозе теряется плотность пяточной кости у женщин обеих возрастных групп как при диффузном токсическом зобе, так и без него, но процент потери плотности зависит как от возраста, так и от наличия диффузного токсического зоба. В репродуктивном возрасте минеральная плотность костной ткани при остеопении не осложняется наличием диффузного токсического зоба, но при остеопорозе факт наличия тиреопатологии вносит дополнительный вклад в структуру кости.
У женщин, находящихся в периоде менопаузы, потеря плотности пяточной кости имеет ту же направленность, что и у женщин репродуктивного возраста.
Доказано, что снижение плотности пяточной кости у женщин до стадии остеопении не зависит от диагноза «диффузный токсический зоб». Но более серьезные изменения плотности, на уровне остеопороза, не связанные с заболеванием диффузного токсического зоба, наблюдаются в группе женщин менопаузального периода. Диффузный токсический зоб нивелирует эти возрастные различия по данному показателю: и в репродуктивном возрасте, и в периоде менопаузы потеря плотности при остеопорозе составляет около 35 %. То есть выявление первичных нарушений минеральной плотности костной ткани, вероятно, может предотвратить развитие дальнейшей деструкции костной ткани, связанной с тиреоидным статусом. А нормализация последнего, возможно, также остановит процесс деструкции костной ткани.
Обнаружено, что при снижении минеральной плотности костной ткани в группах с остеопенией и остеопорозом у женщин как с диффузным токсическим зобом, так и без него в пяточной кости были установлены статистически достоверные различия с контролем по индексу плотности кости, по скорости распространения ультразвука и изменению параметров широкополосного ослабления ультразвука, что указывает на изменение количества, размеров и пространственной ориентации костных трабекул в исследуемой кости у обследованных пациентов.
При анализе минеральной плотности костной ткани по
Т-критерию была установлена возрастная разница между группами женщин без тиреопатологии, но с остеопорозом.
The aim of the research was to study the risk factors which favor formation of structural and functional disorders of osseous tissue at thyrotoxicosis and to estimate diagnostic value of x-ray morphometric examination and ultrasound densitometry at early identification of osteoporotic processes. We examined 170 females of reproductive age and at menopausal period, first of all with diagnosis of diffuse toxic goiter. All these women were divided into three subgroups depending on the intensity of their osteoporotic changes (the patients with diffuse toxic goiter without evidence of changes in bone tissue; the patients with diffuse toxic goiter and osteopenia; and the patients with diffuse toxic goiter and osteoporosis). A control group included the healthy women of the both age groups which were divided into the same subgroups.
It has been established that radiographic method which is used to reveal osteoporotic changes in women of different age groups with diffuse toxic goiter (including determination of indexes of the vertebrae deformation such as Rokhlin index, Scharmazanova index, metacarpal index) allows evaluate the condition of the bone tissue on the first stage of examination. Nevertheless, this method doesn’t pertain to the most highly informative techniques.
The evaluation of mineral density indexes of bone tissue by ultrasound osseous densitometry is more modern and informative method. The present study revealed that osteopenia and osteoporosis are associated with loss of the density of the heel bone in females of the both age groups, either in case of presence of diffuse toxic goiter or without it. Nevertheless the percentage share of the density loss depends both on age and presence of diffuse toxic goiter.
In reproductive age the mineral density of the bone tissue in osteopenia is not complicated with diffuse toxic goiter but in osteoporosis the fact of presence of thyroid pathology additionally impact the bone structure.
Loss of density of the heel bone in menopausal women shows the same tendency as in the women of reproductive age.
It has been proved that decrease in density of the heel bone up to stage of osteopenia does not depend on the diagnosed diffuse toxic goiter. Meanwhile, the more serious changes in density connected with the degree of osteoporosis have no correlation with the diffuse toxic goiter, and are observed in the age group of menopausal women.
The diffuse toxic goiter balances these age differences in the mentioned parameter: both in reproductive period and in menopausal period the loss of density in osteoporosis is of approximately 35 %. So identification of primary impairment of mineral density of the bone tissue is likely to help in prevention of the development of the further destruction in bone tissue which is connected with thyroid status. It may be supposed that normalizing of the thyroid state may stop the process of destruction in the bone tissue.
It has been revealed that in the groups of patients with osteopenia and osteoporosis the reduced mineral density of the bone tissue is associated with certain statistically significant differences in bone density in the women of both subgroups (with diffuse toxic goiter and without it) as well as in the velocity of ultrasound transmission and changes of wide-band ultrasound reduction. The revealed data indicate the changes in quantity, sizes and dimensional orientation of bone trabecules in the examined bone in the above mentioned patients being observed.
The analysis of mineral density of the bone tissue by T-score parameter allowed reveal certain age differences among the groups with no thyroid pathology but with osteoporosis.
дифузний токсичний зоб, остеопенія, остеопороз, мінеральна щільність кісткової тканини, репродуктивний вік, менопаузальний період.
диффузный токсический зоб, остеопения, остеопороз, минеральная плотность костной ткани, репродуктивный возраст, менопаузальный период.
diffuse toxic goiter, osteopenia, osteoporosis, mineral density of the bone tissue, reproductive age, menopausal period.
Статтю опубліковано на с. 107-112
Вступ
Матеріали та методи
Результати дослідження
Висновки
1. Modeling the effect of levothyroxine therapy on bone mass density in postmenopausal women: a different approach leads to new inference / B. Mohammadi, V. Haghpanah, S. Mohammad [et al.] // Theor. Biol. Med. Model. — 2007. — Vol. 4. — P. 23.
2. Assessment of four biochemical markers of bone metabolism in postmenopausal osteoporosis / N. Majkic-Singh, M. Ilic, S. Ignjatovic [et al.] // Clin. Lab. — 2002. — Vol. 48(7–8). — Р. 407.
3. Bone turnover мarкer reductions after 24 months of treatment with risedronate: results from thе risedronate male osteoporosis study / S. Boonen, Р. Gamero, С.-Y. Guo [et al.] // Seventh European Congress on Clinical and Economic Aspects of Osteoporosis and Osteoarthritis: Osteoposis international, 28–31 March. 2007, Porto. — Portugal. — 2007. — Vol. 18(Suppl. 1). — S. 24.
4. Bone Loss in Thyroid Disease: Role of Low TSH and High Thyroid Hormone / E. Abe, L. Sun, J. Mechanick [et al.] // Ann. N.Y. Acad. Sci. — 2007. — Vol. 1116. — Р. 383-391.
5. Relationship between subclinical thyroid dysfunction and femoral neck bone mineral density in women / W.Y. Lee, K.W. Oh, E.J. Rhee [et al.] // Arch. Med. Res. — 2006. — Vol. 37(4). — P. 511-516.
6. Pantazi H. The Endocrine Society Changes in Parameters of Bone and Mineral Metabolism during Therapy for Hyperthyroidism / H. Pantazi, P.D. Papapetrou // J. Clin. Endocrinol. Metabol. — 2000. — Vol. 85. — Р. 1099-1106.
7. Favorable clinical heart and bone effects of anti-thyroid drug therapy inendogenous subclinical hyperthyroidism / S. Buscemi, S. Verga, S. Cottone [et al.] // J. Endocrinol Invest. — 2007. — Vol. 30(3). — P. 230-235.
8. On behalf of the European Society for Clinical and Economic Aspects of osteoporosis and Osteoarthritis (ESCEO) European guidance for the diagnosis and management of osteoporosis in postmenopausal women / J.A. Kanis, N. Burlet, C. Cooper [et al.] // Osteoporos. Int. — 2008. — Vol. 19. — P. 399-428.
9. Lewiecki E.M. Bone-density testing interval and transition to osteoporosis [Text] / E.M. Lewiecki, P.D. Miller, J.P. Bilezikian // N. Engl. J. Med. — 2012. — Vol. 366. — P. 1546-1547.
10. World Health Organization. Assessment of osteoporosis at the primary health care level // WHO, Geneva, 2008.
11. Adachi J.D. Impact of prevalent fractures on quality of life: baseline results from the global longitudinal study of osteoporosis in women / J.D. Adachi // Mayo Clin. Proc. — 2010. — Vol. 85, № 9. — P. 806-813.
1. Mohammadi B, Haghpanah V, Mohammad S. Modeling the effect of levothyroxine therapy on bone mass density in postmenopausal women: a different approach leads to new inference. Theor Biol Med Model. 2007; 4: 23.
2. Majkic-Singh N, Ili M, Ignjatovic S. Assessment of four biochemical markers of bone metabolism in postmenopausal osteoporosis. Clin Lab. 2002; 48 (7-8):407.
3. Boonen S, Gamero P, Guo C-Y. Bone turnover мarкer reductions after 24 months of treatment with risedronate: results from thе risedronate male osteoporosis study. Seventh European Congress on Clinical and Economic Aspects of Osteoporosis and Osteoarthritis: Osteoposis international, 28-31 March. 2007, Porto. 2007;18:24.
4. Abe E, Sun L, Mechanick J. Bone Loss in Thyroid Disease: Role of Low TSH and High Thyroid Hormone. Ann N Y Acad Sci. 2007; 1116: 383-91.
5. Lee WY, Oh KW, Rhee EJ. Relationship between subclinical thyroid dysfunction and femoral neck bone mineral density in women. Arch Med Res. 2006; 37 (4): 511-6.
6. Pantazi H. The Endocrine Society Changes in Parameters of Bone and Mineral Metabolism during Therapy for Hyperthyroidism. J. Clin. Endocrinol. Metabol. 2000; 85; 1099-106.
7. Buscemi S, Verga S, Cottone S. Favorable clinical heart and bone effects of anti-thyroid drug therapy inendogenous subclinical hyperthyroidism. J. Endocrinol Invest. 2007; 30 (3): 230-5.
8. Kanis JA, Burlet N, Cooper C On behalf of the European Society for Clinical and Economic Aspects of osteoporosis and Osteoarthritis (ESCEO) European guidance for the diagnosis and management of osteoporosis in postmenopausal women. Osteoporos. Int. 2008; 19: 399-428.
9. Lewiecki EM. Bone-density testing interval and transition to osteoporosis. N. Engl. J. Med. 2012; 366:1546-7.
10. World Health Organization. Assessment of osteoporosis at the primary health care level / WHO, Geneva, 2008.
11. Adachi JD. Impact of prevalent fractures on quality of life: baseline results from the global longitudinal study of osteoporosis in women. Mayo Clin. Proc. 2010; 85: 806-13.

/109.jpg)
/110.jpg)