Статья опубликована на с. 33-41
Введение
Заболевания сердечно-сосудистой системы на протяжении многих лет лидируют в рейтинге основных причин смертности населения промышленно развитых стран. По мнению специалистов, одной из важных причин несоответствия ожидаемой эффективности современных методов терапии реальным результатам является недостаточное соблюдение принципов оптимальной терапии при выборе схем лечения.
Оптимальная медикаментозная терапия предполагает назначение комбинации препаратов, позволяющей достичь максимального положительного результата при минимальном риске развития побочных эффектов и осложнений. К сожалению, зачастую стремление к достижению указанной эффективности ограничивается назначением стандартных схем лечения без учета индивидуальных особенностей взаимодействия, метаболизма, биодоступности, скорости и полноты обезвреживания и выведения лекарственных средств. В то же время именно эти факторы, в особенности в условиях коморбидной патологии, оказывают решающее влияние как на эффективность, так и на безопасность назначенной терапии.
Основным органом, регулирующим состояние фармакокинетики и фармакодинамики препаратов и определяющим характер межлекарственных взаимодействий, является печень. В печени в том числе происходит метаболизм практически всех основных классов препаратов, входящих в стандарты лечения кардиоваскулярной патологии: антитромбоцитарных препаратов и антикоагулянтов, бета-адреноблокаторов, значительного числа ингибиторов АПФ и блокаторов рецепторов к ангиотензину II, антагонистов кальциевых каналов.
В свою очередь, патогенез основных заболеваний сердечно-сосудистой системы сопряжен с изменением структурно-функционального состояния печени — от 60 до 95 % пациентов с дислипидемией, ожирением, атеросклерозом, сахарным диабетом (СД) 2-го типа имеют стеатогепатоз либо стеатогепатит, классифицируемые на сегодняшний день как неалкогольная жировая болезнь печени (НАЖБП) [5, 16]. Результатами многочисленных длительных наблюдений доказано, что НАЖБП не просто сопровождает кардиоваскулярную патологию: избыточное накопление жира в печени, активация свободнорадикального окисления, воспаление приводят к деструктивным изменениям гепатоцитов, нарушающим нормальное функционирование органа. Это в дальнейшем усугубляет нарушение обменных процессов и способствует прогрессированию основного заболевания. Достаточно традиционным сценарием прогрессирования НАЖБП при кардиоваскулярных заболеваниях является развитие фиброза и цирроза печени — крайне прогностически неблагоприятных состояний, значительно ухудшающих качество и уменьшающих продолжительность жизни больных [7]. Наиболее высокий риск развития цирроза печени имеют женщины старше 45 лет с метаболическим синдромом, СД 2-го типа, артериальной гипертензией (АГ) и признаками синдрома цитолиза при проведении лабораторных исследований [14].
В связи со сказанным очевидно, что важной составляющей терапевтических мероприятий при лечении ИБС, СД 2-го типа, особенно осложненных АГ, является коррекция функционального состояния печени.
Современные подходы к профилактике и лечению НАЖБП включают: снижение массы тела, восстановление чувствительности к инсулину (метформин), коррекцию липидного обмена (статины) и использование гепатопротекторов [6]. Если первые три пункта в большинстве случаев учитываются кардиологами и эндокринологами, то с выбором гепатопротектора, как правило, возникают трудности, связанные с отсутствием четких рекомендаций по выбору препарата и широким спектром представителей данного класса лекарственных средств.
Следует отметить, что на сегодняшний день общепринятой классификации гепатопротекторов не существует. В зависимости от химической структуры и происхождения выделяют несколько групп гепатопротекторов [1]:
— препараты растительного происхождения;
— препараты животного происхождения;
— препараты, содержащие эссенциальные фосфолипиды (ЭФЛ);
— аминокислоты или их производные;
— витамины-антиоксиданты и витаминоподобные соединения;
— препараты разных групп.
Чаще всего в клинической практике применяются средства растительного происхождения (до 54 %), в то время как на фосфолипидные препараты приходится 16 %, а на другие средства, в том числе синтетические, органопрепараты и препараты аминокислот — 30 % от общего количества «истинных» гепатопротекторов [2].
Бытует мнение, что любое средство, представляемое как гепатопротектор, априори эффективно и безопасно в профилактике и лечении любого заболевания. В то же время практика показывает, что далеко не для всех препаратов данного класса существуют убедительные доказательства улучшения гистологической картины печени [3]. Кроме того, при назначении гепатопротектора пациентам с различными соматическими заболеваниями следует учитывать наличие плейотропных эффектов, способствующих оптимизации терапии основного заболевания.
С учетом вышеизложенного при выборе гепатопротектора для больных с кардиоваскулярной патологией заслуживает внимания препарат Гепа-Мерц® («Мерц Фарма ГмбХ и Ко, КГаА»), обладающий наряду с доказанным гепатопротекторным эффектом (стимулирующим воздействием на неактивные или пораженные клетки печени, усиливающим репаративные процессы и энергообмен в клетках печени) способностью улучшать энергетические процессы в органах и тканях, в т.ч. в миокарде, и замедлять прогрессирование кардиоваскулярной патологии в связи с наличием доказанных эндотелиопротекторных свойств.
Столь широкий спектр эффективности обеспечивают этому препарату входящие в его состав аминокислоты L-орнитин и L-аспартат. Введение в организм указанных аминокислот и включение их в цикл Кребса — основной источник выработки энергии у человека — приводит к активации синтеза макроэргических молекул, усилению обменных процессов и возрастанию энергетического потенциала миокарда, уменьшению зависимости клеток от получения энергии путем анаэробного гликолиза. Указанный метаболический эффект крайне важен для больных с кардиоваскулярной патологией, поскольку нарушение энергообмена является патогенетическим механизмом заболеваний сердечно-сосудистой системы и значительно ухудшает их прогноз.
Еще одним аргументом в пользу целесообразности назначения оригинального L-орнитина-L-аспартата данной категории пациентов является наличие плейотропных (дополнительных) эндотелиопротекторных свойств, связанных с повышением уровня L-аргинина — субстрата для синтеза NO, являющегося основным маркером функциональной состоятельности эндотелия. На сегодняшний день доказано, что повышение уровня L-аргинина в плазме крови способствует улучшению клинического течения ишемической болезни сердца (ИБС), артериальной гипертензии (АГ), сердечной недостаточности, СД, а также повышает эндотелиопротекторную эффективность ингибиторов АПФ, статинов, антагонистов кальция и др. [19]. Таким образом, назначение препарата Гепа-Мерц® пациентам с кардиоваскулярной патологией патогенетически обосновано.
Кроме того, данный препарат обладает выраженными дезинтоксикационными свойствами, что крайне важно для пациентов с развившейся сердечной недостаточностью. Известно, что длительное снижение сократительной способности миокарда либо нарушение насосной функции сердца при диастолической дисфункции приводят к повышению давления в нижней полой вене и печеночных венах и застою крови в печени. В этих условиях в печени развивается гипоксическая дегенерация гепатоцитов, гидростатический цитолиз, гипертензия желчных путей, замедление секреции и экскреции желчи, тромбоз в синусоидах, что приводит к поступлению эндотоксинов из кишечника через воротную вену, формированию портокавальных анастомозов, аммиачному эндотоксикозу.
Развитие аммиачной интоксикации у пациентов с тяжелой кардиоваскулярной патологией, осложненной сердечной недостаточностью, — проявление не только печеночной недостаточности, но и признак системного эндотоксикоза, поскольку длительная системная полиорганная гипоксия, сопровождающая хроническую сердечную недостаточность (ХСН), приводит к активации процессов брожения и избыточному синтезу аммиака в кишечнике, нарушению образования глутамата в мозге, снижению дезинтоксикационной функции почек [15, 17].
Формирующийся интоксикационный синдром клинически проявляется минимальной печеночной энцефалопатией (МПЭ), которая проявляется замедлением психомоторной деятельности, снижением концентрации внимания, ухудшением тонкой моторики, нарушением зрительных функций [15]. Стертая клиническая картина МПЭ не всегда привлекает внимание врачей, однако своевременно не леченная МПЭ в течение трех лет у 60 % пациентов приводит к выраженной печеночной энцефалопатии [10].
Уменьшения проявлений аммиачной интоксикации, учитывая ее системный характер, достигают с помощью нескольких классов препаратов: антибиотиков — для снижения избыточной контаминации микрофлоры ободочной кишки, пробиотиков (лактулоза) — для уменьшения образования аммиака в толстом кишечнике и L-орнитина-L-аспартата (Гепа-Мерц®) — с целью улучшения метаболизма аммиака [4, 9, 16].
Каждый из указанных препаратов обладает достаточной эффективностью в устранении интоксикационного синдрома при эндогенной интоксикации, однако при наличии комплексной кардиоваскулярной патологии [18], осложненной сердечной недостаточностью у больных с СД 2-го типа, предпочтение следует отдать оригинальному L-орнитину-L-аспартату, который, кроме выраженной детоксикационной активности, обладает представленными выше плейотропными свойствами [8].
Дезинтоксикационные свойства оригинального препарата L-арнитина-L-аспартата (Гепа-Мерц®) связаны с активацией орнитинового цикла синтеза мочевины (цикл Кребса — Хензелейта), протекающего в перипортальных гепатоцитах, в результате которого токсические азотсодержащие продукты распада, в первую очередь аммиак, преобразуются в нетоксическую водорастворимую мочевину — главный конечный продукт белкового обмена, которая, в свою очередь, выделяется почками [12].
Орнитин включается в цикл мочевины в качестве субстрата (на этапе синтеза цитруллина), увеличивает активность и продукцию фермента карбамоилфосфатсинтетазы (первого фермента цикла мочевины), под действием которого в присутствии N-ацетилглутаминовой кислоты аммиак превращается в карбамоилфосфат, из которого после ряда последовательных пре–вращений образуются молекулы мочевины, способные эффективно выводиться из организма.
Аргинин также включается в цикл Кребса — Хензелейта на этапе синтеза аргининсукцината и дополняет стимулирующее влияние орнитина на цикл синтеза мочевины, участвует в связывании аммиака в перивенозной крови, гепатоцитах, мозге, других тканях [11].
Согласно представленным данным, препарат Гепа-Мерц® имеет несколько механизмов влияния на организм: оказывает гепатопротекторное, дезинтоксикационное, антиоксидантное, метаболическое действие, а также обладает эндотелиопротекторными свойствами, что предполагает высокую эффективность препарата у пациентов с комплексной кардиоваскулярной патологией, СД 2-го типа и хронической сердечной недостаточностью.
Цель исследования — изучение влияния препарата Гепа-Мерц® на функциональное состояние печени, эндотелия, реологические свойства крови, состояние капиллярного кровотока, маркеры эндотоксикоза, а также клиническое состояние пациентов с комплексной кардиоваскулярной патологией, сахарным диабетом 2-го типа и хронической сердечной недостаточностью.
Материал и методы
Дизайн исследования предполагал изучение динамики показателей функционального состояния печени, эндотелия, реологических свойств крови, состояния капиллярного кровотока, маркеров эндотоксикоза до введения препарата Гепа-Мерц®, после первой (первый день терапии) и пятой (пятый день терапии) инфузий препарата в разовой дозе 10 мл (1 ампула).
Обследовано 45 больных в возрасте 60–74 лет (средний возраст 68,4 ± 4,2 года) с диагнозом: ИБС: стабильная стенокардия напряжения II–III ФК, ХСН IIA–IIБ ст. с систолической дисфункцией левого желудочка (основная группа), которые находились на стационарном лечении в кардиологическом отделении ГУ «Институт геронтологии им. Д.Ф. Чеботарева НАМН Украины».
Методом случайной выборки эти больные были разделены на две группы: первая группа (15 пациентов) получала стандартную терапию, соответствующую рекомендациям Украинской ассоциации кардиологов по лечению ХСН, второй группе (30 больных), согласно дизайну исследования, стандартную терапию ХСН дополнили назначением оригинального преперата L-арнитина-L-аспартата в виде инфузий в дозе 10 мл 1 раз в сутки. Обследование проводилось через сутки после первой инфузии и по окончании курсового лечения — пяти инфузий.
Отбор в группы проводился на основании тщательного сбора анамнеза, а также данных текущих клинических, инструментальных и лабораторных обследований (ЭКГ, ЭхоКГ, анализ крови и мочи). Клиническое обследование пациентов проводили в соответствии с принятыми стандартами диагностики ИБС и СН (Рекомендации Украинской ассоциации кардиологов по диагностике и лечению сердечно-сосудистых заболеваний, Киев, 2013 г.).
Функциональное состояние эндотелия (ФСЭ) оценивали методом лазерной допплеровской флоуметрии (ЛДФ) на двухканальном лазерном допплеровском флоуметре ЛАКК-2 (Россия) на средней трети внутренней поверхности предплечья [8].
Агрегационную активность тромбоцитов венозной крови изучали на двухканальном лазерном анализаторе агрегации тромбоцитов 230LA («Биола», Москва) турбодиметрическим методом. Оценивали уровень спонтанной и индуцированной агрегации тромбоцитов.
Реологические свойства крови исследовали с помощью ротационного вискозиметра АКР-2 (Россия) при скоростях сдвига 10 с–1 , 20 с–1, 50 с–1 , 100 с–1, 200 с–1 с расчетом индекса деформируемости эритроцитов (ИДЭ) и индекса агрегации эритроцитов (ИАЭ). Индекс агрегации эритроцитов рассчитывался как частное показателя вязкости крови при скорости сдвига 20 с–1 и вязкости крови при скорости сдвига 100 с–1. Индекс деформируемости является соотношением показателя вязкости крови при скорости сдвига 100 с–1 и при скорости сдвига 200 с–1.
Состояние микроциркуляции бульбарной конъюнктивы изучали с применением телевизионной щелевой лампы фирмы Zeiss (Германия). Изображения регистрировали с помощью прикладных компьютерных программ и в дальнейшем обрабатывали данные с помощью компьютерной программы, разработанной сотрудниками института (Писарук А.В., Чеботарев Н.Д., 2002).
Также анализировали полученные путем морфометрического анализа показатели системы микроциркуляции, которые обрабатывали по балльной шкале (Малая Л.Т., Волков В.С., 1977), что позволяет характеризовать качественно-количественные изменения микроциркуляторного русла [9]. Учитывали изменения микрососудов, а также внесосудистые и внутрисосудистые изменения. Отдельно рассчитывали сосудистый конъюнктивальный индекс, внесосудистый конъюнктивальный индекс и внутрисосудистый конъюнктивальный индекс, а также общий конъюнктивальный индекс, который равен сумме баллов всех индексов.
Уровень молекул средней массы определяли с использованием трихлоруксусной кислоты (ТХУ). К 0,6 мл сыворотки добавляли 0,3 мл 10% ТХУ, перемешивали, инкубировали в течение 5 мин при –20 °С. После этого центрифугировали в течение 20 мин при 1700 g. К 0,5 мл супернатанта добавляли 4,5 мл дистиллированной воды. Измерения проводили при длинах волн 280 и 254 нм. Затем проводили расчет индекса распределения путем деления результатов оптической плотности, полученных при 280 нм, на показатель оптической плотности при 254 нм. Нормальное значение ИР составляет 1,4 у.е.
Состояние клеток организма оценивали по показателям индекса индукции апоптоза. Для определения уровня апоптоза по анексиновому методу выделяли мононуклеарные клетки крови больных на градиенте плотности фикол-урографин (d = 1,077). Для определения индекса индукции апоптоза отбирали по 105 мононуклеарных клеток. В одну из пробирок добавляли индуктор апоптоза и инкубировали на питательной среде при 37 °С в течение 18 часов.
Исследование уровня апоптоза анексиновым методом проводили на проточном цитометре PAS (Partec, Германия) с использованием набора для определения апоптоза Annexin V-FITC Apoptosis detection Kit I (BD Bioscience Pharmingen, США).
Полученные данные обработаны с помощью пакета прикладных программ Statistica 6.0 StatSoft USA. Рассчитывали средние значения показателей и их ошибки (М ± m). Достоверность различий между группами оценивали по t-критерию Стьюдента для независимых выборок. Достоверными считались различия при p < 0,05.
Результаты
Согласно полученным результатам, первая инфузия препарата Гепа-Мерц® привела к достоверному снижению уровня печеночных ферментов (табл. 1).
И хотя для кардиоваскулярной патологии не характерен выраженный синдром цитолиза и уровень указанных показателей в группе обследования незначительно превышал нормативные показатели, представленные данные могут быть расценены как положительное влияние препарата на функциональное состояние гепатоцитов, уменьшение застойных явлений в желчных путях.
Также на фоне терапии препаратом Гепа-Мерц® достоверно снижался уровень фибриногена, СРБ, общего холестерина и триглицеридов (табл. 1), что подтверждает высокую гепатопротекторную и противовоспалительную эффективность препарата.
Увеличение объемной скорости кровотока кожи на пике создания реактивной гиперемии, проявляющееся с первой инфузии и достигающее клинически значимых значений на фоне курсового приема препарата, свидетельствует об улучшении сосудодвигательной функции эндотелия и подтверждает наличие эндотелиопротекторного эффекта препарата Гепа-Мерц® (табл. 2).
Одновременно с улучшением функционального состояния эндотелия терапия препаратом Гепа-Мерц® способствовала значительному уменьшению вязкости крови, агрегационной активности эритроцитов и улучшению эластичности их мембран (табл. 3).
Указанные изменения состояния показателей гемоваскулярного гомеостаза, связанные с восстановлением баланса молекулярных компонентов плазмы, жидкостных свойств мембран форменных элементов крови и защитных свойств эндотелия, стали предпосылкой к увеличению перфузионного кровотока органов и тканей, оцененного по показателю микроциркуляции и данным капилляроскопии. Уровень показателя микроциркуляции до лечения составил 2,6 перф.ед., после первой инфузии увеличился до 3,2 перф.ед. и после курсового лечения достиг 3,5 перф.ед.
Об улучшении капиллярного кровотока на фоне терапии оригинальным L-орнитином-L-аспартатом свидетельствуют также результаты капилляроскопии бульбарной конъюнктивы и ногтевого ложа, согласно которым при введении препарата наблюдалось увеличение скорости и гомогенизация кровотока (рис. 1), значительное уменьшение застойных явлений в капиллярах, выраженности перикапиллярного отека. Улучшение гемореологических показателей привело к уменьшению внутрисосудистого конъюнктивального индекса.
Также терапия препаратом Гепа-Мерц® способствовала снижению артериоло-венулярного соотношения, что свидетельствует об уменьшении спазма артериол и застойных явлений в венулах (табл. 4).
С учетом того, что системная капилляротрофическая недостаточность является ведущей причиной гибели больных с тяжелой сердечной недостаточностью, наблюдающееся на фоне терапии препаратом Гепа-Мерц® увеличение показателя микроциркуляции, свидетельствующее об увеличении количества эритроцитов, проходящих в единицу времени через единицу ткани, подтверждает возможность усиления метаболических процессов в тканях не только за счет участия компонентов препарата в метаболических циклах, но и в связи с увеличением доставки кислорода в ишемизированные органы и ткани.
Уменьшение уровня тканевой гипоксии и улучшение функционального состояния гепатоцитов на фоне терапии оригинальным L-орнитином-L-аспартатом способствовали снижению выраженности эндогенной интоксикации, о чем свидетельствует динамика молекул средней массы (МСМ): до лечения уровень МСМ280 был равен 0,346 у.е., а после прохождения курса — 0,304 у.е. (рис. 2).
Исследование уровня МСМ254 показало ту же динамику изменений, что и для МСМ280, однако изменения были более выраженными и после лечения уровень МСМ254 снижался до контрольного значения. Так, уровень МСМ254 до лечения был равен 0,522 у.е., а после лечения — 0,417 у.е. (рис. 3).
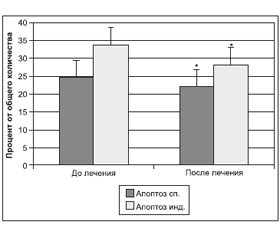
Как известно, основным механизмом клеточной гибели при хронической гипоксии и интоксикации является апоптоз. Очевидно, что улучшение кровоснабжения при одновременном снижении уровня эндогенной интоксикации и токсического воздействия свободных радикалов создает условия для улучшения жизнеспособности тканей организма, что проявляется снижением активности апоптоза клеток. На фоне терапии препаратом Гепа-Мерц® наблюдалось достоверное снижение спонтанного и индуцированного апоптоза мононуклеаров, а также индекса апоптоза, характеризующего потенциальную жизнеспособность клеток (рис. 4, 5).
Не исключено, что последнее является свидетельством потенциальной возможности положительного влияния препарата на продолжительность жизни данной категории больных.
В пользу этого заключения свидетельствует улучшение клинического состояния обследованных пациентов. Об этом свидетельствует увеличение показателей теста с 6-минутной ходьбой, уменьшение длительности ишемии и количества экстрасистол по данным суточного мониторирования ЭКГ, а также снижение балла Миннесотского опросника, характеризующего качество жизни пациентов (табл. 5).
Обсуждение
Результаты проведенного исследования свидетельствуют о целесообразности включения препарата Гепа-Мерц® в терапию больных с комплексной кардиоваскулярной патологией и сахарным диабетом 2-го типа.
Полученные результаты подтверждают возможность влияния препарата Гепа-Мерц® на функциональные нарушения работы печени у пациентов с комплексной кардиоваскулярной патологией и СД 2-го типа.
Клинически это проявляется улучшением состояния обследованных пациентов: увеличением показателей теста с 6-минутной ходьбой на 10 %, уменьшением длительности ишемии на 68 % и количества экстрасистол по данным суточного мониторирования ЭКГ более чем на 100 %, а также снижением балла Миннесотского опрос–ника, характеризующего качество жизни пациентов.
Лабораторно эффективность препарата Гепа-Мерц® подтверждается изменениями показателей функционального состояния печени (по сравнению с исходными цифрами) при пятидневном курсе терапии по 10 мл (1 ампула в сутки): снижением АЛТ на 44 %, АСТ — на 35 %, ГГТ — на 37 %, ЩФ — на 30 %, СРБ — на 230 %, ФГ — на 32 %, увеличением МНО на 12 %, снижением уровня общего холестерина на 19 %, уровня триглицеридов — на 32 %.
Также возможность эндотелиопротекторного эффекта препарата Гепа-Мерц®, влияния на микроциркуляцию и повышение перфузионного кровотока органов и тканей подтверждена увеличением обьемной скорости кровотока в среднем на 20–25 %, уменьшением вязкости крови, агрегационной активности эритроцитов и улучшением эластичности их мембран в среднем на 20–35 %. Это позволило увеличить перфузионный кровоток органов и тканей, оцененный по показателю микроциркуляции и данным капилляроскопии. Уровень увеличения показателя микроциркуляции повысился после первой инфузии на 19 % и на пятый день терапии — на 26 %.
Уровень эндогенной интоксикации при использовании минимальной терапевтической дозы препарата Гепа-Мерц®, 10 мл в сутки внутривенно, понизился на 12 %, что свидетельствует об уменьшении тканевой гипоксии и улучшении функционального состояния гепатоцитов. Также подтверждается возможность активизации метаболических процессов в тканях не только за счет участия компонентов препарата Гепа-Мерц® в метаболических циклах, но и в связи с увеличением доставки кислорода в ишемизированные органы и ткани.
На фоне терапии препаратом Гепа-Мерц® наблюдалось достоверное снижение спонтанного и индуцированного апоптоза мононуклеаров, а также индекса апоптоза, характеризующего потенциальную жизнеспособность клеток, до 30 %.
С учетом того, что клинический эффект препарата Гепа-Мерц® начинает проявляться с первой инфузии, пациентам с кардиоваскулярной патологией может быть назначен короткий курс препарата в суточной дозе 10 мл 1 раз в сутки на протяжении пяти дней терапии с дальнейшим переводом на гранулированную форму оригинального L-орнитина-L-аспартата.
Выводы
1. Уже первая инфузия препарата Гепа-Мерц® приводит к достоверному снижению уровня печеночных ферментов.
2. На фоне терапии препаратом Гепа-Мерц® достоверно снижается уровень фибриногена, СРБ, общего холестерина и триглицеридов, что подтверждает высокую гепатопротекторную и противовоспалительную эффективность препарата.
3. Уровень эндогенной интоксикации при использовании минимальной терапевтической дозы препарата Гепа-Мерц® снижается на 12 %, что свидетельствует об уменьшении тканевой гипоксии и улучшении функционального состояния гепатоцитов.
4. На фоне терапии препаратом Гепа-Мерц® наблюдается достоверное снижение спонтанного и индуцированного апоптоза мононуклеаров, а также индекса апоптоза, характеризующего потенциальную жизнеспособность клеток, до 30 %.
/37.jpg)

/36.jpg)
/37_2.jpg)
/38_2.jpg)
/38.jpg)
/39.jpg)
/39_2.jpg)