Статья опубликована на с. 91-97
В связи с увеличением числа пострадавших в результате террористических актов, локальных военных конфликтов, авиакатастроф, природных катаклизмов и техногенных аварий наблюдается увеличение спинального травматизма более чем в 200 раз за 70-летний период [1, 3, 14, 22]. Анализ эпидемиологических исследований позволяет прогнозировать дальнейший рост числа травмированных в 10 раз ежегодно [2, 4, 11, 24].
По данным J. Bamford и соавт. [8], в мирное время средняя частота позвоночно-спинномозговой травмы (ПСМТ) составляет 7,4 случая на 10 тысяч населения в год. Годовой расход на спинальную травму в США достигает 2 млрд долларов, поскольку, по данным R. Martin и соавт. [15], насчитывается до 200 000 больных, получивших инвалидность в результате повреждений позвоночника и спинного мозга. К наиболее значительной утрате трудоспособности приводит развитие нижней спастической параплегии [5, 6, 9, 21].
Высокая смертность, инвалидизация, дорогостоящее лечение и реабилитация приводят к значительному экономическому ущербу и требуют поиска новых данных о возможностях восстановления утраченной функции спинного мозга после его повреждения [10, 14, 16, 25].
Благодаря достижениям фармакологии, реабилитации и нейрохирургии в последние годы значительно увеличилась продолжительность жизни спинальных больных и изменилось качество их жизни. Однако, несмотря на огромный научный прогресс, достигнутый в этой области, множество вопросов касательно изучения тактики ведения пациентов со спинальной травмой и возможностей восстановления функции поврежденного спинного мозга остаются нерешенными.
Особенности патологии двигательной системы у больных с травматической болезнью спинного мозга требуют специализированного методического подхода как к вопросам восстановления утраченных функций, так и к принципам расширения использования сохранившихся [13]. Следует также отметить необходимость проведения максимально ранней реабилитации [7, 12].
Сложность и неоднозначность синдрома нижнего спастического парапареза, выступающего на первый план при травме спинного мозга, объясняется комплексом многих причин различной патофизиологической направленности: размозжением и компремированием тканей мозга, геморрагическими и ишемическими сосудистыми расстройствами, транснейрональными изменениями, воспалительными и аутоиммунными реакциями, грубой функциональной дезорганизацией интегративных функций всей нервной системы, а также вторичными дегенеративными процессами в нервных стволах, мышцах, коже, внутренних органах и костно-суставном аппарате [4, 9, 13, 16, 19, 24]. Спастичность при поражении спинного мозга (спинальная спастичность) в значительной степени определяется ослаблением тормозных влияний на интернейроны, что приводит к распространению поступающего в спинной мозг возбуждения по афферентным волокнам на другие уровни (вверх и вниз), вызывая двигательный ответ во многих отделах конечности [14, 20].
При проведении клинической диагностики необходимо учитывать не только исходное состояние системы движения, но и факторы, способствующие повышению уровня компенсации, а также выявлять причины, препятствующие этому. Перед началом реабилитационных мероприятий клиницист должен четко сформировать ответы на следующие вопросы: насколько возможно восстановление функции? как восстановить нарушенную функцию? что лимитирует процесс восстановления? Наиболее частым фактором, лимитирующим восстановление, кроме психологических причин, является наличие нижнего спастического парапареза, в связи с чем необходимы тщательное изучение и анализ возможности снижения гипертонуса паретичных мышц.
Спастичность мышц проявляется высоким динамическим тонусом, мышечными спазмами, непроизвольными движениями парализованных конечностей (реже — туловища) и их клонической активностью (низкоамплитудные ритмические движения). Она наблюдается как при полном поперечном поражении спинного мозга, так и при частичном поражении нисходящих трактов.
Единого мнения о природе спастичности при миелопатиях не выработано. Наиболее популярно представление о ней как проявлении патологически усиленного стретч-рефлекса (рефлекс на растяжение). Нейроны, лишенные в результате поражения нисходящих проводящих путей супраспинальных влияний, а из-за снижения двигательной активности — сенсорной стимуляции, становятся гиперчувствительны к любым стимулам.
Стимулами, провоцирующими спастичность, являются: прикосновение к коже (сенсорное раздражение), изменение положения конечности (длины мышц), эмоциональное возбуждение (гуморальные влияния). Спастичность повышается также при обострении мочевой инфекции и пролежнях [20]. Некоторые пациенты научаются расценивать проявления спастичности как сигнал неблагополучия, аналогичный боли, в зоне отсутствия чувствительности. У больных с синдромом нижнего спастического парапареза любое нарушение целостности кожных покровов, особенно в области стопы и голени, является «курковой» (триггерной) зоной с низким порогом механического раздражения, которое вызывает непроизвольные двигательные рефлексы спинального автоматизма. Например, незначительная потертость стоп при неверном подборе обуви является причиной безуспешности постановки больного на ноги, так как при надавливании на эту потертость возникает сгибательный (флексорный) рефлекс, препятствующий стоянию. В этом случае попытка поставить больного путем жесткой фиксации суставов приводит к значительному повышению мышечного тонуса, что делает невозможным дальнейшую кинезиотерапию. Иногда даже слишком тугая шнуровка ботинок вызывает спастическое сокращение мышц. Курковыми зонами особенно часто становятся трофические язвы и рубцы после их заживления. Поэтому санация дерматологических расстройств зачастую является абсолютно необходимой прелюдией перед проведением намеченной кинезиотерапевтической программы [12].
Если центральный парез сохраняется в течение длительного времени (несколько месяцев и более), то могут возникнуть структурные изменения сегментарного аппарата спинного мозга (укорочение дендритов альфа-мотонейронов и коллатеральный спрaутинг афферентных волокон, входящих в состав задних корешков), которые обусловливают прогрессирование спастичности. Также развиваются вторичные изменения в паретичных мышцах, сухожилиях и суставах, которые усиливают двигательные расстройства и сопротивление, возникающее в мышце при ее растяжении, что необходимо учитывать при оценке мышечного тонуса в парализованных конечностях. Кроме того, негативной стороной спастичности является формирование порочного положения в суставах. Неконтролируемые насильственные движения спастического характера создают риск потери равновесия при поддержании вертикальной позы, при неполных плегиях спастическая активность затрудняет произвольные движения, в том числе ходьбу. Спастичность считается чрезмерной и требует специального лечения, если она вызывает боль, препятствует произвольным движениям, систематически нарушает ночной сон, является причиной переломов костей [17].
С другой стороны, некоторое повышение мышечного тонуса может иметь компенсаторное значение при параличе. Умеренная спастичность при миелопатиях предотвращает атрофию мышц, позволяет поддерживать вертикальную позу при дополнительной внешней поддержке. Поэтому прежде чем назначать лечение, необходимо решить, насколько сильно требуется снизить мышечный тонус конечности, чтобы предотвратить чрезмерное расслабление и затруднение вертикализации (нарушение постуральной устойчивости). Для этого следует оценить, усугубляет ли спастичность нарушение жизнедеятельности пациента, беспокоят ли больного мышечные спазмы либо боль, связанная со спастичностью мышц, в какой степени гипертонус разгибателей нижних конечностей способствует устойчивости вертикальной позы пациента. Добиваться снижения мышечного тонуса необходимо в первую очередь в тех случаях, когда спастичность существенно снижает уровень жизнедеятельности больного либо сопровождается болевым синдромом. При этом надо помнить о том, что в ряде случаев повышение тонуса мышц-разгибателей ног служит фактором, облегчающим стояние и ходьбу [18, 23].
Выбор пассивной выжидательной тактики вследствие фатального прогноза при выраженной мышечной гипертонии приводит к общей гипокинезии больного [20], образованию стойких функциональных сдвигов в нервной системе, что значительно затрудняет дальнейший восстановительный процесс. Больной, получив весьма пессимистическую информацию, либо впадает в глубокую депрессию, либо полностью утрачивает доверие к врачу и ищет альтернативу в самолечении. Следовательно, генеральная тактика восстановительного лечения заключается в четкой диагностике оставшихся двигательных возможностей, комплексном лечении имеющихся расстройств, активном контроле за временем достижения максимально возможного для данного больного уровня компенсации нарушенных функций и затем — в проведении мероприятий по социальной реабилитации.
Основой врачебной тактики при тяжелом поражении спинного мозга является принцип постепенного перехода от примитивных синергий к высокодифференцированному произвольному движению. Процесс перехода от синергии к произвольному движению всегда связан со способностью больного к волевому торможению, которое отсекает от онтогенетической синергической заготовки излишние для данной координации фрагменты. Поэтому произвольное торможение должно формироваться раньше или одновременно с произвольной активацией. Таким образом, обучение больного произвольному расслаблению паретичных мышц — не менее важная задача, чем тренировка произвольного управления мышечным сокращением. Переход от синергии к произвольному движению в наиболее общем виде может быть обозначен следующей формулой: от синергии — через произвольное торможение — к произвольному движению. Однако в связи со сложными комплексными механизмами формирования мышечной спастичности значительно повышенный тонус мышц сводит на нет все попытки произвольного расслабления и значительно усложняет возможности проведения пассивной гимнастики. При увеличении силы воздействия против мышечного гипертонуса возникает риск микроповреждений мягких тканей, что в условиях сниженной трофики приведет к микрооссификации и еще большему затруднению реабилитации в дальнейшем. При наличии гипертонуса отмечается развитие вторичных дистрофических изменений в мышцах-антагонистах. Кроме того, гипертонус мышц может маскировать скрытые остаточные движения.
Таким образом, повышение мышечного тонуса существенно влияет на процесс восстановления нарушенных функций. Высокая спастичность препятствует реализации сохраненных функций и улучшению нарушенных. Учитывая развитие спинальных автоматизмов и выраженной мышечной спастичности, у пациентов со спинальной травмой проведение реабилитационных мероприятий без предварительного медикаментозного воздействия практически невозможно. Исходя из этого, при наличии спастического паралича перед началом реабилитации и кинезиотерапии, необходимо подключить препараты, уменьшающие мышечную спастичность, что позволит увеличить вначале объем пассивных, а затем и активных движений, выявить сохранившуюся мышечную силу, замаскированную под воздействием выраженного гипертонуса мышц-антагонистов.
Основное требование, предъявляемое к лечебным воздействиям, — их безболезненность, поскольку боль усиливает спастичность мышц. Важно также тщательно контролировать функцию тазовых органов (предупреждение инфекции мочеполовых путей), своевременно выполнять мероприятия по профилактике контрактур и пролежней.
Для лечения спастичности можно использовать лекарственные средства внутрь или парентерально. Антиспастические средства, уменьшая мышечный тонус, могут улучшить двигательные функции, облегчить уход за обездвиженным больным, снять болезненные мышечные спазмы, усилить действие лечебной физкультуры и вследствие этого предупредить развитие контрактур.
Комплекс лечебных мероприятий по устранению спастичности включает:
— медикаментозные средства;
— ортезирование;
— физиотерапевтические процедуры (местное применение холода или тепла, электростимуляция периферических нервов и спинного мозга);
— массаж;
— лечебную гимнастику;
— медикаментозные блокады;
— хирургические вмешательства.
Выбор методов воздействия определяется строго индивидуально в зависимости от локализации и степени спастического паралича, а также с учетом финансовых и технических возможностей реабилитационного учреждения. Использование различных методов лечения спастичности (антиспастические средства, местное введение ботулинического токсина) во всех случаях должно сочетаться с физиотерапией, лечебной гимнастикой. Эти методы не заменяют лечебную гимнастику, составляющую основу реабилитации больного с двигательными нарушениями, а представляют интегральную часть комплексной терапии у многих больных с центральным спастическим парезом или параличом конечности.
Для предотвращения чрезмерного снижения тонуса в условиях сниженной силы мышц при нижнем спастическом парапарезе целесообразно использовать препараты с обратимым механизмом действия и дозированной силой воздействия. При выборе антиспастических препаратов учитывают в основном способность тормозить полисинаптические рефлексы (уменьшение спастики), с оказанием при этом наименьшего влияния на моносинаптические (сила мышцы), и лучшую переносимость.
Основными препаратами, используемыми для снижения мышечного тонуса, являются миорелаксанты. По механизму действия различают миорелаксанты центрального (влияют на синаптическую передачу возбуждения в центральной нервной системе) и периферического действия (угнетают прямую возбудимость поперечнополосатых мышц).
Для оценки влияния на качество реабилитации, возможности увеличения объема активных и пассивных движений, а также уровень социальной адаптации было проведено исследование препарата толперизон (Мидостад Комби). Наличие у данного препарата инъекционной формы выпуска открывает новые границы в реабилитации пациентов со спинальной травмой, позволяя улучшить социальную адаптацию и повысить качество жизни. Толперизон (Мидостад Комби) относится к миорелаксантам центрального действия аминокетоновой группы. Механизм действия связан с регуляцией функции каудальной части ретикулярной формации. При этом угнетается повышенная рефлекторная возбудимость спинного мозга. Препарат также влияет на периферические нервные окончания. Является Н-холинолитиком. Толперизон обладает стабилизирующим действием на мембраны в первичных афферентных волокнах и двигательных нейронах, что обусловлено влиянием на рефлекторную деятельность спинномозговых синапсов. Вторично замедляет выход медиаторов вследствие торможения процесса поступления Са2+ в синаптические структуры нервных волокон. Воздействие на ретикулоспинальный путь проявляется замедлением процессов возбуждения. Препарат также обладает местноанестезирующим действием (за счет содержания лидокаина). Имеет незначительно выраженный спазмолитический и адреноблокирующий эффекты, за счет чего улучшается перфузия тканей. В отличие от тизанидина и баклофена толперизон (Мидостад Комби) не влияет на кору головного мозга, тем самым сохраняя в полном объеме уровень бодрствования, на фоне его приема сохраняется способность к выполнению быстрых и точных движений, что положительным образом влияет на процесс реабилитации [17, 23].
Целью плацебо-контролируемого исследования явилось изучение влияния толперизона (Мидостад Комби) на выраженность спастичности по шкале Эшворта и индекс ходьбы Хаузера через 14 дней лечения (в сравнении с плацебо). Дополнительные цели исследования включали изучение влияния препарата на мышечную силу, объем активных движений, амплитуду миограммы покоя, индекс Бартел и общее впечатление врача и больного о лечении, а также степень тяжести ПСМТ, оцененную по шкале Франкеля, переносимость и безопасность.
Материалы и методы
При включении в исследование все пациенты подписали информированное согласие. В исследование было включено 40 человек (22 мужчины и 18 женщин) с закрытой стабильной умеренно тяжелой позвоночно-спинномозговой травмой грудного отдела без признаков полного поперечного повреждения спинного мозга. У всех пациентов отмечался нижний спастический парапарез, 40 % из них были отнесены к группе С (больные с неполным нарушением чувствительности, имеются слабые движения, но сила мышц недостаточна для ходьбы), 60 % — к группе D (больные с неполным нарушением чувствительности ниже уровня травмы, имеются движения, сила мышц достаточна для ходьбы с посторонней помощью) по шкале Франкеля.
Все пациенты находились в раннем восстановительном периоде: 20 % через 3 месяца, 35 % — через 4 месяца, 25 % — через 6 месяцев, 30 % — через 8 месяцев после перенесенной травмы.
Пациенты были рандомизированы в две группы. Первой группе вводили толперизон (Мидостад Комби) внутримышечно по 1 мл (100 мг) два раза в сутки в течение 14 дней, второй группе — плацебо (NaCl 0,9% по 1 мл два раза в сутки в течение 14 дней). Пациенты обеих групп получали кинезиотерапию, ЛФК, массаж и физиотерапевтическое лечение.
Для исследования мышечной силы использовали шестибалльный мышечный тест Ловетта (от 0 до 5 баллов). При тестировании по шкале Ловетта проводили изучение простых движений, выполняемых в одной плоскости. При необходимости конечность исследовали в специальном антигравитационном положении, при котором действие силы тяжести направлено перпендикулярно оси тестируемого движения.
Объем активных движений в суставах нижних конечностей (тазобедренном, коленном и голеностопном) измерялся с помощью угломера в градусах.
Исследование мышечного тонуса осуществлялось посредством пальпации мышцы (оценка ее механико-эластических свойств) и на основании рефлекторной сократимости мышц. Пальпация проводится путем повторных сжиманий мышцы пальцами врача или же давления рукой на брюшко мышцы сверху.
Степень спастичности оценивали по модифицированной шкале спастичности Эшворта (по D. Wade, 1992): 0 баллов — нет повышения мышечного тонуса, спастичность; 1 балл — легкое повышение мышечного тонуса, проявляющееся в виде небольшого сопротивления при сгибании и разгибании сегмента конечности; 2 балла — незначительное повышение тонуса в виде сопротивления, возникающего после выполнения не менее половины движения; 3 балла — умеренное повышение тонуса на протяжении всего движения, не затрудняющее пассивных движений; 4 балла — значительное повышение тонуса, затрудняющее выполнение пассивных движений; 5 баллов — сегмент конечности фиксирован в положении сгибания или разгибания.
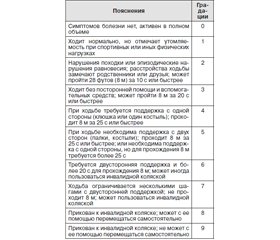
Для оценки способности к передвижению был использован индекс ходьбы Хаузера (S. Hauser, 1983; D. Wade, 1992), отражающий как мобильность больного, так и его потребность во вспомогательных средствах передвижения (табл. 1). Результаты, полученные при тестировании, являются дополнительными количественными критериями оценки способностей передвижения.
Активность жизнедеятельности определяли по шкале Бартел (D. Barthel, 1955), основанной на оценке 10 функций, отличающихся по степени независимости больного при их выполнении (от полностью независимо выполняемых до полностью зависимых от посторонней помощи — суммарная оценка варьирует от 0 до 100 баллов).
Всем пациентам проводилась электронейромиография нижних конечностей.
Исследования были выполнены в первый день до начала лечения и на 15-й день после окончания курса медикаментозной и кинезиотерапии в группах.
Результаты
У обследованных пациентов в ногах был выявлен умеренный парез. При этом объем активных движений в тазобедренном суставе — в пределах17,4 ± 2,1°, в коленном — 24,7 ± 2,5°, голеностопном — 17,1 ± 2,1°, при выраженном парезе в тазобедренном суставе — в пределах 7,6 ± 2,5°, в коленном — 8,8 ± 3,6°, голеностопном — 6,4 ± 1,2°; при резко выраженном парезе в тазобедренном суставе — в пределах 5,2 ± 1,6°, в коленном — 5,4 ± 3,1°, голеностопном — 5,2 ± 1,3°.
Результаты исследования показали, что Мидостад Комби достоверно (р < 0,0001) уменьшает спастичность после спинальной травмы.
Как видно из табл. 2, через 2 недели лечения снижение спастичности на 1 балл и более отмечалось у большинства (75,9 %) больных, принимавших Мидостад Комби, и менее чем у половины (41,1 %) пациентов в группе плацебо.
/96.jpg)
Положительный эффект сохранялся на протяжении всего периода терапии. В конце исследования в группе больных, получавших Мидостад Комби, спастичность уменьшилась по шкале Эшворта на 3 балла в 3 % случаев, на 2 балла — в 25 % и на 1 балл — в 50 %. По результатам исследования также выявлена тенденция (р = 0,032) к улучшению ежедневной активности больных, получавших Мидостад Комби. В конце лечения препаратом Мидостад Комби увеличилось расстояние, которое пациенты проходили за 2 мин. После завершения исследования установлено, что Мидостад Комби уменьшает степень инвалидизации больных, оцениваемую по индексу Бартел. В среднем общий показатель по индексу Бартел увеличился на 6,1 балла в группе пациентов, получавших Мидостад Комби, и только на 2,7 балла в группе плацебо. Общая оценка эффективности лечения больными и врачами была достоверно выше в группе препарата Мидостад Комби (р < 0,001).
Полученные при электронейромиографии данные показали, что при легком и умеренном парезах амплитуда миограммы покоя варьирует от 20 до 40 мкВ, а при резко выраженном снижении силы и повышении мышечного тонуса может превышать 100 мкВ.
Отмечена хорошая переносимость и высокая безопасность толперизона (Мидостад Комби) у больных с ПСМТ. Побочные эффекты в группе пациентов, леченных толперизоном (Мидостад Комби), и в группе плацебо были статистически сопоставимы. Ни один больной не прекратил лечение вследствие побочных эффектов, прием препарата Мидостад Комби не сопровождался седативным эффектом. Применение толперизона (Мидостад Комби) обусловливает не только снижение степени спастичности, но и улучшение повседневной активности больных, облегчение самообслуживания при отсутствии нежелательных явлений, что выгодно отличает его от других антиспастических средств.
Выводы
Было отмечено снижение гипертонуса мышц, облегчение совершения произвольных активных движений.
При ведении больного со спастичностью после спинальной травмы важно оценить возможности лечения: улучшение двигательных функций, уменьшение болезненных спазмов, облегчение ухода за больным и др. Чем меньше степень пареза и сроки с момента травмы, тем более вероятно улучшение двигательных функций.
Ведущую роль в лечении нижнего спастического парапареза играет комплексная система реабилитации, включающая лечебную гимнастику, направленную на тренировку утраченных движений, самостоятельного стояния и ходьбы, а также на профилактику прогрессирования спастичности и развития контрактур. Для получения оптимальных результатов реабилитационные мероприятия необходимо начинать уже в первые дни заболевания. При применении толперизона (Мидостад Комби) улучшается ежедневная двигательная активность больного, его адаптация к повседневной жизни, при этом не возникают существенные побочные эффекты.
Список литературы
1. Дзяк Л.А., Сальков М.М., Зорін М.О., Тітов Г.І. Актуальні питання організації надання медичної допомоги, діагностики та лікування бойової хребетної та хребетно-спинномозкової травми // Український нейрохірургічний журнал. — 2015. — № 1.
2. Леонтьев М.А. Эпидемиология спинальной травмы и частота полного анатомического повреждения спинного мозга / М.А. Леонтьев // Актуальные проблемы реабилитации инвалидов. — Новокузнецк, 2011. — С. 37-38.
3. Морозов И.Н., Млявых С.Г. Эпидемиология позвоночно-спинномозговой травмы (обзор) // Медицинский альманах. — 2011. — № 4. — С. 157-159.
4. Поліщук М.Є., Корж Н.А., Фіщенко В.Я. Пошкодження хребта і спинного мозку (механізми, клініка, діагностика, лікування). — К.: Книга плюс, 2001. — 388 с.
5. Поліщук М.Є. Сучасні принципи діагностики та лікування хворих з хребетно-спинномозковою травмою: Метод. реком. / Поліщук М.Є. — К., 2006. — 36 с.
6. Симонова І.А. Епідеміологія хребетно-спинномозкової травми і організація медичної допомоги постраждалим: Автореф. дис… канд. мед. наук. — СПб., 2000. — 24 с.
7. Цимбалюк В.І. Результати відновного хірургічного лікування хворих з наслідками повного ушкодження спинного мозку / Цимбалюк В.І., Ямінський Ю.А. // Український нейрохірургічний журнал. — 2011. — № 3. — С. 14-20.
8. Bamford J.A., Mushahwar V.K. Intraspinal microstimulation for the recovery of function following spinal cord injury // Brain Res. — 2011. — 194. — 227-239.
9. Becker D., Sadowsky C., McDonald J. Restoring function after spinal cord injury // Neurologist. — 2003. — 9. — 1-15.
10. Dulin J., Kovacs L., Ramm S. et al. Evaluation of sedative effects of single and repeated doses of 50 mg and 150 mg tolperisone hydrochloride. Results of a prospective, randomized, double-blind, placebo-controlled trial // Pharmacopsychiatry. — 1998. — 31. — 137-42.
11. Graupe D., Cerrel-Bazo H., Kern H., Carraro U. Walking performance, medical outcomes and patient training in FES of innervated muscles for ambulation by thoracic-level complete paraplegics // Neurol. Res. — 2008. — 30. — 123-130.
12. Guidelines for the Acute Medical Management of Severe Traumatic Brain Injury in Infants, Children and Adolescent // Pediatric Crit. Care Med. — 2012. — Vol. 13, № 1.
13. Hillen B.K., Abbas J.J., Jung R. Accelerating locomotor recovery after incomplete spinal injury // Ann. N.Y. Acad. Sci. — 2013 Mar. — 1279. — 164-174.
14. Hubli M., Dietz V. The physiological basis of neurorehabilitation — locomotor training after spinal cord injury // J. Neuroeng. Rehabil. — 2013. — 10. — 15-17.
15. Martin R., Sadowsky C., Obst K., Meyer B. Functional Electrical Stimulation in Spinal Cord Injury // Top. Spinal Cord Inj. Rehabil. — 2012. — 18 (1). — 28-33.
16. McDonald J., Becker D., Sadowsky C., Jane J., Conturo T., Schultz L. Late recovery following spinal cord injury. Case report and review of the literature // J. Neurosurg. — 2002. — 97. — 252-265.
17. Melka A., Haimanot R.T. Tolperisone HCl (Mydocalm): A Randomized Double-blind and Placebo Controlled Drug Trial // International Conference on Lathyrus and Lathyrism (Book of Abstracts). — Addis Abeba, Ethiopia, 1995. — 31-2.
18. Meythaler J.M., Guin-Renfroe S., Johnson A. et al. Prospective assessment of tizanidine for spasticity due to acquired brain injury // Arch. Phys. Med. Rehabil. — 2001. — 82. — 1155-63.
19. National Center for Injury Prevention and Control. Data elements for Emergency Department system. — Atlanta, USA: CDCP, 2011. — 180 p.
20. Roy R.R., Harkema S.J., Engerton V.R. Basic concepts of activity-based interventions for improved recovery of motor function after spinal cord injury // Arch. Phys. Med. Rehabil. — 2012. — 93 (9). — 1487-1497.
21. Saltiel P. et al. Muscle synergies encoded within the spinal cord: Evidence from focal intraspinal NMDA iontophoresis in the frog // Journal of Neurophysiology. — 2001. — 85. — 605-619.
22. Tee J.W., Chan P.C., Rosenfeld J.V., Gruen R.L. Dedicated Spine Trauma Clinical Quality Registries: A Systematic Review // Global Spine J. — 2013 Dec. — 3 (4). — 265-272.
23. Stamenova P., Koytchev R., Kuhn K. et al. A randomized, double-blind, placebo-controlled study of the efficacy and safety of tolperisone in spasticity following cerebral stroke // Eur. J. Neurol. — 2005. — 12. — 453-61.
24. Vrbova G., Slawinska U. Summary of strategies used to repair the injured spinal cord // Dimitrijevic M.R., Kakulas B.A., McKay W.B., Vrbova G., editors. Restorative neurology of spinal cord injury. — New York: Oxford University Press, 2011. — 93-133.
25. Ward A.B. A summary of spasticity management — a treatment algorithm // Eur. J. Neurol. — 2002. — 9 (Suppl. 1). — 48-52.
/95.jpg)

/96.jpg)