Журнал «Здоровье ребенка» 7 (67) 2015
Вернуться к номеру
Иммуногенетические аспекты противовоспалительной терапии острого обструктивного бронхита у детей раннего возраста
Авторы: Абатуров А.Е., Русакова Е.А. - ГУ «Днепропетровская медицинская академия МЗ Украины»
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
Метою дослідження було удосконалення лікування гострого обструктивного бронхіту в дітей раннього віку шляхом оптимізації протизапальної терапії на підставі оцінки її клініко-імунологічної та молекулярно-генетичної ефективності. Матеріали та методи. Проведено комплексне обстеження 80 дітей віком від 6 місяців до 3 років, хворих на гострий обструктивний бронхіт. Пацієнти були розподілені на дві групи: діти першої групи (n = 40) отримували системні глюкокортикостероїди, діти другої групи (n = 40) — інгаляційні глюкокортикостероїди. До початку лікування й після закінчення терапії в усіх дітей досліджено вміст IFN-γ, IL-4 та IL-13 у сироватці крові за допомогою імуноферментного аналізу, концентрацію загального IgE — за допомогою електрохемілюмінесцентного імуноаналізу. Рівень експресії фактора транскрипції NF-κB у лімфоцитах периферійної крові визначався методом проточної цитометрії. Результати. Фактор транскрипції NF-κB, практично однаково впливаючи на концентрації IFN-γ та IgE у сироватці крові, визначає особливості запалення, переважно локального характеру, при гострому обструктивному бронхіті. Терапія глюкокортикостероїдами призводить до зникнення впливу NF-κB на вміст прозапальних цитокінів. Інгаляційні глюкокортикостероїди, крім того, сприяють зниженню концентрації IgE в сироватці крові та інгібіції активності прозапальних внутрішньоклітинних каскадів, що при високих клінічній ефективності та профілі безпеки обґрунтовує доцільність їх застосування при лікуванні гострих обструктивних бронхітів у дітей раннього віку як препаратів патогенетичної терапії.
Целью исследования было усовершенствование лечения острого обструктивного бронхита у детей раннего возраста путем оптимизации противовоспалительной терапии на основании оценки ее клинико-иммунологической и молекулярно-генетической эффективности. Материалы и методы. Проведено комплексное обследование 80 детей в возрасте от 6 месяцев до 3 лет с острым обструктивным бронхитом. Пациенты были распределены в две группы: дети первой группы (n = 40) получали системные глюкокортикостероиды, дети второй группы (n = 40) — ингаляционные глюкокортикостероиды. До начала лечения и после окончания терапии у всех детей определялись концентрации IFN-γ, IL-4 и IL-13 в сыворотке крови с помощью иммуноферментного анализа, содержание общего IgE — с помощью электрохемилюминесцентного иммуноанализа. Уровень экспрессии фактора транскрипции NF-κB в лимфоцитах периферической крови исследовали методом проточной цитометрии. Результаты. Фактор транскрипции NF-κB, практически одинаково влияя на концентрации IFN-γ и IgE в сыворотке крови, определяет особенности воспаления, преимущественно локального характера, при остром обструктивном бронхите. Глюкокортикостероидная терапия способствует исчезновению влияния NF-κB на содержание провоспалительных цитокинов. Ингаляционные глюкокортикостероиды, кроме того, приводят к снижению концентрации IgE в сыворотке крови и ингибированию активности провоспалительных внутриклеточных каскадов, что при высоких клинической эффективности и профиле безопасности обосновывает целесообразность их применения при лечении острых обструктивных бронхитов у детей раннего возраста в качестве препаратов патогенетической терапии.
The objective of the study was to improve the treatment of acute obstructive bronchitis in infants by optimizing the anti-inflammatory therapy based on the evaluation of its clinical, immunological and molecular genetic efficiency. Materials and methods. We have carried out a comprehensive examination of 80 children aged 6 months to 3 years with acute obstructive bronchitis. Patients were divided into two groups: children of the first group (n = 40) received systemic glucocorticosteroids, children of the second group (n = 40) were treated with inhaled glucocorticosteroids. Before and after the treatment, in all children we have studied the content of IFN-γ, IL-4 and IL-13 in the blood serum using enzyme linked immunosorbent assay, the concentration of total IgE — by means of electrochemiluminescent immunoassay. The level of expression of the transcription factor NF-κB in peripheral blood lymphocytes was determined using flow cytometry. Results. Transcription factor NF-κB, having almost the same effect on the concentration of IFN-γ and IgE in the blood serum, determines the characteristics of inflammation, mainly local, in acute obstructive bronchitis. Glucocorticosteroid therapy leads to the disappearance of NF-κB influence on the content of proinflammatory cytokines. Inhaled glucocorticosteroids, in addition, help to reduce the concentration of IgE in the blood serum and inhibition of the activity of pro-inflammatory intracellular cascades that, at high clinical efficacy and safety profile, justifies the appropriateness of their use in the treatment of acute obstructive bronchitis in infants as pathogenetic therapy.
гострий обструктивний бронхіт, імунний статус, глюкокортикостероїди, діти раннього віку.
острый обструктивный бронхит, иммунный статус, глюкокортикостероиды, дети раннего возраста.
acute obstructive bronchitis, immune status, glucocorticosteroids, infants.
Статтю опубліковано на с. 41-45
Лікування гострого обструктивного бронхіту (ГОБ) у дітей раннього віку залишається однією з актуальних проблем педіатрії через труднощі вибору оптимальної схеми фармакотерапії, що обумовлено гетерогенністю генезу даного захворювання [7, 9].
Матеріали та методи
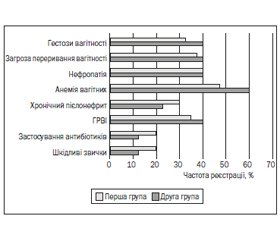
Результати дослідження та їх обговорення
/42.jpg)
/43.jpg)
Висновки
1. Абатуров А.Е., Волосовец А.П., Юлиш Е.И. Индукция молекулярных механизмов неспецифической защиты респираторного тракта. — К.: Приватна друкарня ФО-П Сторожук О.В., 2012. — 240 с.
2. Антомонов М.Ю. Математическая обработка и анализ медико-биологических данных [Текст] / М.Ю. Антомонов. — К.: Фірма малого друку, 2006. — 558 с.
3. Геппе Н.А. Современные подходы к выбору медикаментозного комплекса неотложной терапии обструктивного синдрома при заболеваниях органов дыхания у детей и подростков / Н.А. Геппе, А.Б. Малахов // Эффективная фармакотерапия. Педиатрия. — 2012. — № 1. — С. 32-36.
4. Зайцева С.В. Терапия острого обструктивного синдрома у детей с острыми респираторными заболеваниями / С.В. Зай–цева, С.Ю. Снитко, О.В. Зайцева [и др.] // Лечащий врач. — 2013. — № 11. — С. 50-55.
5. Локшина Э.Э. Ингаляционная терапия респираторных заболеваний у детей / Э.Э. Локшина, О.В. Зайцева, С.В. Зайцева // Практическая пульмонология. — 2012. — № 4. — С. 41-45.
6. Мизерницкий Ю.Л. Дифференциальная диагностика и дифференцированная терапия острой бронхиальной обструкции при ОРИ у детей раннего возраста / Ю.Л. Мизерницкий // Практическая медицина. — 2014. — № 9(85). — С. 82-88.
7. Соловьева Н.А. Бронхообструктивный синдром у детей грудного возраста / Н.А. Соловьева, Н.А. Ильенкова, С.В. Смирнова // Российский педиатрический журнал. — 2014. — № 4. — С. 32-38.
8. Чернышева О.Е. Острые бронхиты у детей / О.Е. Чернышева, Л.Л. Поповиченко // Здоровье ребенка. — 2009. — № 6. — С. 69-75.
9. Швец Е.А. Клинико-иммунологические характеристики при синдроме бронхиальной обструкции у детей. / Е.А. Швец, В.Г. Савватеева, Е.И. Васильева // Сибирский медицинский журнал. — 2010. — № 2. — С. 8-11.
10. Batra S. Nuclear factor-κB: a key regulator in health and disease of lungs / S. Batra, G. Balamayooran, M.K. Sahoo // Arch. Immunol. Ther. Exp. (Warsz). — 2011. — Vol. 59, № 2. — P. 335-51.
11. Deepak P. Interleukin-13-induced type II polarization of inflammatory macrophages is mediated through suppression of nuclear factor-kappaB and preservation of IkappaBalpha in a T-cell lymphoma / P. Deepak, S. Kumar, A. Acharya // Clin. Exp. Immunol. — 2007. — Vol. 149, № 2. — P. 378-86.
12. Imanifooladi A.A. The role of nuclear factor kappa B in inflammatory lung disease / A.А. Imanifooladi, S. Yazdani, M.R. Nourani // Inflamm. Allergy Drug Targets. — 2010. — Vol. 9, № 3. — P. 197-205.
13. Wu L.C. Targeting IgE production in mice and humans / L.C.Wu, H. Scheerens // Curr. Opin. Immunol. — 2014. — Vol. 31. — P. 8-15.
1. Abaturov AE, Volosovets AP, Yulish EI. [Induction of molecular mechanisms of nonspecific protection of the respiratory tract]. Kiev: Private Printing FO-P Storozhuk OV; 2012. 240 p. Russian.
2. Antomonov MYu. [Mathematical processing and analysis of medical and biological data]. Kiev: Firm small print; 2006. 558 p. Russian.
3. Geppe NA, Malakhov AB. [Modern approaches to the choice of a complex medical emergency treatment of obstructive syndrome for respiratory diseases in children and adolescents]. Effective Pharmacotherapy. Pediatrics. 2012;1:32-36. Russian.
4. Zaitseva SV, Snitko SYu, Zaitseva OV, Lokshina EE. [Treatment of acute obstructive syndrome in children with acute respiratory infections]. Lechaschii Vrach Journal. 2013;11:50-55. Russian.
5. Lokshina EE, Zaitseva OV, Zaitseva SV. [Inhalation therapy of respiratory diseases in children]. Practical Pulmonology. 2012;4:41-45. Russian.
6. Mizernickij YuL. [Differential diagnosis and differentiated treatment of acute bronchial obstruction at ARI in infants]. Practical Medicine. 2014; 9(85):82-88. Russian.
7. Solovieva NA, Ilyenkova NA, Smirnova SV. [Bronchial obstruction in infants]. Russian Journal of Pediatrics. 2014;4:32-38. Russian.
8. Chernyshova OE, Popovychenko LL. [Acute bronchitis in children]. Child’s Health. 2009;6:69–75. Russian.
9. Shvets EA, Savvateeva VG, Vasilyeva EI. [Clinical and immunological characteristics of the syndrome of bronchial obstruction in children]. Siberian Journal of Medicine. 2010;2:8-11. Russian.
10. Batra S, Balamayooran G, Sahoo MK.Nuclear factor- κB: a key regulator in health and disease of lungs. Arch. Immunol. Ther. Exp. (Warsz).2011 Oct;59(2):335–51. doi: 10.1007/s00005-011-0136-z.
11. Deepak P, Kumar S, Acharya A. Interleukin-13-induced type II polarization of inflammatory macrophages is mediated through suppression of nuclear factor-kappaB and preservation of IkappaBalpha in a T cell lymphoma. Clin. Exp. Immunol.2007 Aug;149(2):378-86. doi: 10.1111/j.1365-2249.2007.03427.x.
12. Imanifooladi AA, Yazdani S, Nourani MR. The role of nuclear factor kappa B in inflammatory lung disease. Inflamm. Allergy Drug Targets.2010 Jul;9(3):197–205. doi: 10.2174/187152810792231904
13. Wu LC, Scheerens H. Targeting IgE production in mice and humans. Curr. Opin. Immunol.2014 Dec;31:8-15. doi: 10.1016/j.coi.2014.08.001.

/43_3.jpg)
/44.jpg)