Статья опубликована на с. 44-48
Рост количества аллергических заболеваний, прежде всего бронхиальной астмы (БА), отмечаемый в последнее десятилетие, рассматривается как проблема мирового уровня. Проявления бронхиальной астмы у детей обусловлены хроническим воспалительным процессом в дыхательных путях, гиперреактивностью бронхов, отеком слизистой оболочки, сдвигами в продукции бронхиального секрета с появлением густой вязкой слизи в просвете, приводящими к нарушению бронхиальной проходимости с приступами затрудненного дыхания [5].
Многочисленные фундаментальные исследования механизмов патогенеза, разработка новых селективных лекарственных препаратов, создание специальных программ Всемирной организации здравоохранения приводят к улучшению течения заболевания, однако не всегда удается взять под контроль заболеваемость бронхиальной астмой у детей [1], что может быть обусловлено ремоделированием дыхательных путей.
Астма сопровождается не только бронхоспазмом, но и необратимыми структурными изменениями бронхов, которые называют ремоделированием дыхательных путей. В результате воспалительного процесса, развивающегося при бронхиальной астме под воздействием специфических и неспецифических факторов, в том числе и вирусных инфекций, происходят морфологические и функциональные изменения во всех структурах бронхов [2].
Несмотря на то что в последние годы достигнут определенный прогресс в выявлении основных закономерностей, определяющих ремоделирование дыхательных путей при бронхиальной астме, эта проблема остается нерешенной [7]. Отсутствуют исследования о влиянии персистирующих внутриклеточных инфекций на процессы ремоделирования дыхательных путей у детей, а также о возможностях коррекции данного патологического процесса с помощью лекарственных средств.
Одной из проблем диагностики процессов воспаления и ремоделирования дыхательных путей при бронхиальной астме у детей является необходимость использования инвазивной волоконно-оптической бронхоскопии с биопсией. Однако рядом исследователей были проведены комплексный анализ и корреляция между признаками воспаления и ремоделирования, выявленными при бронхоскопии, компьютерной томографии, изу-чении биоптата, и уровнем маркеров воспаления и ремоделирования в мокроте и сыворотке крови, а также подтверждена равнозначность данных исследований [4].
Целью работы явилось определение влияния персистирующих внутриклеточных инфекций, в частности цитомегаловирусной, инфекции, вызванной вирусом простого герпеса І–ІІ типов, вирусом Эпштейна — Барр, Сhlamydophila pneumoniae и Mycoplasma pneumoniaе, на процессы ремоделирования дыхательных путей при бронхиальной астме.
Материалы и методы исследования
Проведено обследование 328 детей в возрасте от 1 до 15 лет с персистирующим течением бронхиальной астмы, находившихся на стационарном и/или амбулаторном лечении в городской детской клинической больнице № 2 и центральной городской клинической больнице № 3 г. Донецка на протяжении 2008–2014 годов.
У всех детей диагностика характера и формы персистирующих внутриклеточных инфекций включала два этапа. На первом этапе определялся уровень иммуноглобулинов классов М и G в сыворотке крови к вирусу простого герпеса І–ІІ типов, цитомегаловирусу, вирусу Эпштейна — Барр, Сhlamydophila pneumoniae и Mycoplasma pneumoniaе методом иммуноферментного анализа с использованием коммерческих тест-систем фирмы «Вектор-Бест» (г. Новосибирск, Россия). В случае обнаружения специфических антител проводилось биологическое исследование на наличие ДНК возбудителя в соскобе слизи со слизистой оболочки ротоглотки и мокроте методом полимеразной цепной реакции. Для выявления фрагмента ДНК инфекционных агентов в биологических средах использовали набор реагентов «Цитопол», «Герпол», «Эбарпол», «Пневмопол-Хл-КТ», «Полимик 1» научно-производственной фирмы «Литех» (г. Москва, Россия).
Нами были изучены уровни различных медиаторов ремоделирования бронхов в сыворотке крови детей, больных бронхиальной астмой, инфицированных внутриклеточными возбудителями, при активном и латентном течении инфекционного процесса, а также неинфицированных пациентов. В частности, определялись уровни фермента металлопротеиназы-9 (ММР-9), специфического тканевого ингибитора ММР-9 — TIMP-1, трансформирующего фактора роста β (TGF-β), эндотелина-1, аутоантител к коллагену III типа с помощью стандартных тест-систем, рассчитывался индекс фиброзирования TIMP-1/ММР-9.
Для определения уровня аутоантител человека к коллагену третьего типа методом иммуноферментного анализа использовалась стандартная тест-система «ИМТЕК» (г. Москва). Количественная оценка уровней цитокина TGF-β1, ММР-9 и ее ингибитора TIMP-1 выполнялась методом сэндвич-варианта твердофазного иммуноферментного анализа с применением стандартных коммерческих наборов реактивов Platinum ELISA фирмы eBioscience (США). Уровень эндотелина-1 определяли методом прямого иммуноферментного анализа с помощью тест-системы Biomedica Medizinprodukte GmbH& Co KG (г. Вена, Австрия). Исследования проводили в Центральной научно-исследовательской лаборатории Донецкого национального медицинского университета им. М. Горького.
Результаты и их обсуждение
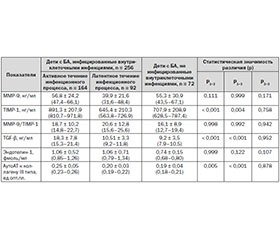
По результатам исследования показано (табл. 1, 2), что уровень фермента эндопептидазы ММР-9 в сыворотке крови детей, как инфицированных (основная, или І группа), так и не инфицированных внутриклеточными возбудителями (группа сравнения, или ІІ группа), двукратно превышал показатели практически здоровых детей. Не было выявлено статистически значимой разницы данного параметра у пациентов основной группы и группы сравнения.
В случае активного течения инфекции у пациентов I группы уровень ММР-9 был выше, чем при латентном течении инфекционного процесса, статистическая разница р значимо не отличалась и составила 0,111. Не отмечалось статистической разницы показателя ММР-9 у детей с бронхиальной астмой с активным течением инфекционного внутриклеточного процесса и пациентов с бронхиальной астмой, не инфицированных внутриклеточными инфекциями, а также у наблюдаемых пациентов с латентным течением инфекции и неинфицированных детей.
/46.jpg)
Повышение активности матричных металлопротеиназ приводит к ремоделированию дыхательных путей за счет их способности гидролизировать все компоненты экстрацеллюлярного матрикса: коллагены, проколлагены, протеогликаны, эластин, фибронектин, ламинин, а также адгезивные и другие белки соединительной ткани, а денатурировать фибриллярные коллагены [8]. Кроме того, ММР-9 участвует в ангиогенезе дыхательных путей, а также способна активировать TGF-β1, приводящий к суб-эпителиальному фиброзу [9].
В физиологических условиях происходит продукция незначительного количества металлопротеиназы, а их регуляция осуществляется специфическими тканевыми ингибиторами металлопротеиназ. Подавление ММР-9 происходит под действием TIMP-1.
Результаты исследования показали, что уровень TIMP-1 в сыворотке крови детей, больных бронхиальной астмой, как инфицированных, так и не инфицированных внутриклеточными возбудителями, был более чем в 7 раз выше, чем в группе практически здоровых детей. Статистически значимой разницы данного показателя у пациентов основной группы и группы сравнения не выявлено.
Повышение в сыворотке крови уровня TIMP-1, связанное с хронической бронхиальной обструкцией, свидетельствует об определенном контроле и регулировании чрезмерной активности ММР-9. Более объективное значение имеет определение уровня соотношения TIMP-1/MMP-9 как маркера фиброза, склероза тканей, влияющего на толщину стенки дыхательных путей у пациентов с бронхиальной астмой [10]. Нарушение баланса между матриксными металлопротеиназами и их тканевыми ингибиторами приводит к эмфизематозным изменениям в легких при данном заболевании [8].
При обследовании детей, больных бронхиальной астмой, было выявлено, что индекс фиброзирования TIMP-1/ММР-9 в сыворотке крови пациентов с бронхиальной астмой, инфицированных внутриклеточными возбудителями, более чем в 5 раз превышал данный показатель в группе здоровых детей. У пациентов, не инфицированных внутриклеточными инфекциями, соотношение TIMP-1/ММР-9 статистически значимо не отличалось от показателей основной группы и практически здоровых детей. Увеличение соотношения TIMP-1/ММР-9 отображает ремоделирование дыхательных путей вследствие хронического воспалительного процесса при бронхиальной астме у детей за счет субэпителиального осаждения коллагена [8]. Длительный дисбаланс TIMP-1/ММР-9 приводит к утолщению дыхательных путей и ограничению воздушного потока, что усугубляет течение бронхиальной астмы у детей [10].
Повышенная выработка металлопротеиназ приводит к активации факторов роста, в частности профибротического TGF-β1 [6], который рассматривается как иммунопатологическая молекула при заболеваниях, связанных с избыточным фиброзом [3]. Нами было выявлено повышение данного фактора роста как в основной группе детей, так и в группе сравнения. У пациентов, не инфицированных внутриклеточными инфекциями, уровень данного цитокина был в 2 раза выше, чем у здоровых детей, однако статистическая разница р при этом равнялась 0,067. При определении уровня TGF-β1 в основной группе пациентов с активным и латентным течением внутриклеточных персистирующих инфекций было выявлено их статистически значимое различие.
Таким образом, повышение концентраций TGF-β1 связано с прогрессированием фиброза и ремоделированием дыхательных путей у пациентов с бронхиальной астмой. Инфицирование внутриклеточными инфекциями усугубляет этот процесс, особенно в случае активного течения.
Противовоспалительная активность TGF-β1 проявляется в супрессии продукции провоспалительных цитокинов, ингибировании активности макрофагов и клеточного деления Т- и В-лимфоцитов и активизации пролиферации фибробластов. Поэтому гиперпродукция TGF-β1, особенно в основной группе детей с активным течением инфекционного процесса, обусловлена снижением активации клеток иммунной системы, направленных на ограничение воспалительной реакции, что приводит к поддержанию хронического воспаления и замыкает круг патологических процессов в дыхательных путях.
При бронхиальной астме наблюдаются изменения сосудов, включающие ангиогенез, расширение сосудов, микроваскулярную проницаемость, продукцию факторов роста, адгезию клеток, трансмиграцию и фильтрацию, увеличение кровотока вследствие расширения резистентных артерий и увеличения количества сосудов, коррелирующие со степенью тяжести заболевания [3]. Однако существуют биологически активные вещества, способные вызывать сужение сосудов. К ним относится эндотелин-1, который является наиболее мощным вазоконстриктором и продуцируется сосудистым эндотелием в дыхательных путях при бронхиальной астме под действием фактора некроза опухоли α. Действие эндотелина-1 многогранно и заключается в способности вызывать бронхоконстрикцию, усиливать реакцию бронхов на ингалируемые антигены, увеличивать приток воспалительных клеток, продукцию цитокинов, участвовать в формировании отека и в процессах ремоделирования дыхательных путей, ускорять хемотаксис, адгезию и активацию нейтрофилов, стимулировать развитие фиброза субэпителиального слоя стенки бронхов и образование хемоаттрактанта для лейкоцитов [3].
При обследовании наблюдаемых нами детей выявлено, что уровень эндотелина-1 был статистически значимо выше (p < 0,001) в сыворотке крови у больных бронхиальной астмой, как инфицированных, так и не инфицированных внутриклеточными инфекциями, по сравнению со здоровыми детьми. Статистически значимого различия в показателях детей основной группы и группы сравнения выявлено не было.
Уровень аутоантител к коллагену ІІІ типа является показателем, определяющим прогноз при бронхолегочной патологии у детей. В результате хронического воспаления, лежащего в основе ремоделирования дыхательных путей при бронхиальной астме, формируется субэндотелиальный фиброз вследствие нарушения обмена коллагена аутоиммунного характера. Данный иммунохимический тест имеет высокую информативность, диагностическую и прогностическую значимость, характеризует воспалительную реакцию на всех ее этапах, в том числе на ранних, и свидетельствует о ремоделировании дыхательных путей, вызванном дезорганизацией коллагеновых волокон.
В ходе обследования детей с бронхиальной астмой в основной группе и группе сравнения отмечалось статистически значимое (p < 0,001) повышение уровня аутоантител к коллагену ІІІ типа по сравнению с практически здоровыми детьми. Статистическая разница (p < 0,001) выявлена и у пациентов из основной группы и группы сравнения, что свидетельствует о влиянии внутриклеточного инфицирования на усугубление субэпителиального фиброза у больных бронхиальной астмой. Превалирование показателей при активном течении инфекционного процесса над показателями, определяемыми при латентном течении, также статистически отличалось.
Повышение уровня аутоантител к коллагену ІІІ типа при бронхиальной астме у детей, протекающей на фоне различного течения инфекционного процесса, вызванного внутриклеточными возбудителями, и без инфицирования, указывает на дезорганизацию коллагеновых структур, особенно при активном течении инфекции.
Выводы
Таким образом, в процессе исследования были получены данные, свидетельствующие о патологическом воздействии персистирующих внутриклеточных инфекций, в частности цитомегаловирусной, инфекции, вызванной вирусом простого герпеса І–ІІ типов, вирусом Эпштейна — Барр, Сhlamydophila pneumoniae и Mycoplasma pneumoniaе, особенно при активном их течении, на процессы ремоделирования дыхательных путей при бронхиальной астме. Эти изменения обусловливают необходимость проведения не только базисной терапии заболевания, но и этиопатогенетического лечения, что позволит уменьшить процессы ремоделирования дыхательных путей, снизить тяжесть заболевания и инвалидизацию.
Список литературы
1. Антипкін Ю.Г. Сучасні погляди на етіопатогенез, клініко-діагностичні та лікувально-профілактичні особливості перебігу запального процессу при неспецифічних захворюваннях органів дихання у дітей (огляд літератури) / Ю.Г. Антипкін, Т.Г. Надточій // Перинатология и педиатрия. — 2011. — № 1(45). — С. 19-23.
2. Недельская С.Н. Диагностика бронхиальной астмы у детей раннего возраста: возможности, проблемные вопросы, дифференциальная диагностика / С.Н. Недельская, Д.А. Ярцева // Здоровье ребенка. — 2013. — № 2(45). — С. 26-32.
3. Ненартович И.А. Ремоделирование бронхов при бронхиальной астме и возможности его коррекции / И.А. Ненартович, В.Ф. Жерносек // Рецепт. — 2010. — № 3(71). — С. 77-89.
4. Стройкова Т.Р. Клинико-диагностическое значение аутоантител к коллагену III типа при бронхолегочных заболеваниях у детей: Автореф. дис... канд. мед. наук: спец. 14.00.09 «Педиатрия» / Т.Р. Стройкова. — Астрахань, 2009. — 20 с.
5. Уманець Т.Р. Клініко-анамнестичні особливості фенотипів бронхіальної астми у дітей / Т.Р. Уманець // Перинатология и педиатрия. — 2011. — № 2(46). — С. 69-71.
6. Doğu F. Serum transforming growth factor-β (TGF-β), matrix metalloproteinase-2 (MMP-2), matrix metalloproteinase-9 -(MMP-9) and tissue inhibitors of metalloproteinase (TIMP-1) levels in childhood asthma / F. Doğu, A. Yildiran, D. Loğlu // Turk. J. Med. Sci. — 2008. — № 38 (5). — Р. 415-419.
7. Fixman E.D. Basic mechanisms of development of airway structural changes in asthma / E.D. Fixman, A. Stewart, J.G. Martin // Eur. Respir. J. — 2007. — Vol. 29. — P. 379-389.
8. Hegazy L. Circulating MMP-9 and TIMP-1 in acute exacerbations and after remission induced by oral corticosteroids in asthmatic children / L. Hegazy, Abu El Hana Salwa // Egypt J. Pediatr. Allergy Immunol. — 2006. — № 4(1). — Р.23-29.
9. Kraus-Filarska M. Metalloproteinases and airway remodeling in asthma / M. Kraus-Filarska, M. Kosinska, A. Tomcowicz // Adv. Clin. Exp. Med. — 2007. — Vol. 16, № 3. — Р. 417-423.
10. Matrix metalloproteinases in respiratory diseases: from pathogenesis to potential clinical implications / S. Oikonomidi, K. Kostikas, I. Tsilioni [et al.] // Cur. Med. Chem. — 2009. — Vol. 16, №. 10. — Р. 1214-1228.

/45.jpg)
/46.jpg)