Статтю опубліковано на с. 33-41
Робота є фрагментом науково-дослідної роботи відділу клінічної фізіології та патології опорно-рухового апарату ДУ «Інститут геронтології імені Д.Ф. Чеботарьова НАМН України» за темою «Розробка комплексної програми діагностики, профілактики та лікування дефіциту й недостатності вітаміну D у хворих старших вікових груп з патологією кістково-м’язової системи» (№ держреєстрації 0112U000526).
Вступ
За останні роки чимало робіт присвячено вивченню механізмів розвитку порушень структурно-функціонального стану кісткової тканини у людей різного віку та статі внаслідок значного поширення цієї патології. Порушення мінеральної щільності кісткової тканини (МЩКТ) як причина інвалідизації і смертності хворих через переломи кісток, за даними Всесвітньої організації охорони здоров’я, посідає четверте місце у світі за поширеністю після серцево-судинних, онкологічних захворювань і цукрового діабету [12, 16]. Таке значуще місце пояснюється постійно зростаючою поширеністю остеопорозу і величезними витратами, пов’язаними з лікуванням остеопоротичних переломів.
У результаті досліджень, проведених останніми роками, встановлено, що тиреоїдні гормони впливають на метаболізм кісткової тканини, зумовлюючи виникнення остеопорозу [15]. Найбільш вивченим є питання про вплив надмірної продукції гормонів на кістку, тоді як проблема профілактики та лікування остеопорозу в осіб із гіпотиреозом залишається до кінця не вивченою.
Проведено багато досліджень, присвячених вивченню клінічної значущості маркерів кісткового ремоделювання при захворюваннях скелета. Однак вивчення цих показників при патології щитоподібної залози (ЩЗ) обмежено окремими спостереженнями. Лише у декількох працях продемонстрована гіпокальціємія й гіпофосфатемія у пацієнтів із нелікованим первинним гіпотиреозом [14]. У більшості робіт [4, 11] розглядаються особливості порушення метаболізму кісткової тканини при гіперфункції ЩЗ і терапії левотироксином в супресивних дозах, тоді як питання вивчення кісткового ремоделювання при декомпенсованому та компенсованому в замісних дозах гіпотиреозі в літературі висвітлене недостатньо й концептуально не розроблене.
Недостатньо відомостей про динаміку стану кісткової тканини в процесі компенсації функціонального стану ЩЗ, потребує уточнення взаємозв’язок маркерів кісткової резорбції і кісткоутворення з вираженістю остеопенії та остеопорозу при гіпотиреозі на фоні терапії препаратами тиреоїдних гормонів.
Тиреотоксикоз призводить до прискореного метаболізму кісткової тканини. Збільшена активність остео–кластів сприяє підвищенню показників мінерального обміну та кісткового ремоделювання, а посилення активності остеобластичної функції збільшує вміст маркерів кісткоутворення [9]. Гіпотиреоз спричинює вповільнення кісткоутворення та кісткової резорбції, а ступінь змін у величині маркерів кісткової формації і кісткової резорбції залежить від тяжкості та тривалості захворювання [8]. Актуальність проблеми гіпотиреозу в клінічній практиці лікарів різних спеціальностей обумовлена тим, що за умов дефіциту тиреоїдних гормонів, необхідних для нормального функціонування практично кожної клітини, розвиваються тяжкі порушення в усіх без винятку органах і системах [6].
Попри проведені в минулі роки дослідження, чіткого пояснення механізму розвитку метаболічної остеопатії, що асоціюється з патологією ЩЗ, на сьогодні немає.
Мета дослідження — встановити вплив функціонального стану ЩЗ на характеристики кісткової тканини за даними ультразвукової денситометрії і лабораторних методів дослідження, розробити алгоритм своєчасної діагностики остеопенії та остеопорозу.
Матеріали та методи
З метою оцінки впливу функції ЩЗ на кісткову тканину в дослідження було включено 168 пацієнтів репродуктивного віку (від 19 до 48 років) з різними тиреоїдними захворюваннями. Середній вік обстежених (17 (10,1 %) чоловіків і 151 (89,9 %) жінка) становив 37,23 ± 4,79 року. Для виявлення впливу функції ЩЗ результати дослідження пацієнтів із тиреопатіями порівнювали з аналогічними показниками 25 здорових осіб контрольної групи. Всі групи обстежених не відрізнялися за статтю і віком.
Першу групу дослідження сформували 27 жінок із дифузним нетоксичним зобом (ДНЗ) зі збереженою функцією ЩЗ (стан еутиреозу, показники вмісту тиреотропного гормона (ТТГ) і вільного тироксину (вТ4) статистично значуще не відрізнялися від даних групи контролю).
До другої групи увійшло 36 пацієнтів із синдромом тиреотоксикозу, що розвинувся внаслідок дифузного токсичного зоба (ДТЗ). На момент обстеження вперше виявлений ДТЗ або його рецидив спостерігався в усіх хворих при рівні ТТГ 0,07 ± 0,02 мкМО/мл. Тривалість від моменту появи перших ознак захворювання до часу обстеження становила в середньому 5 (2–11) місяців. Хворі отримували тиреостатичну терапію в індивідуально підібраних дозах. Для уточнення впливу тривалості тиреотоксикозу на кістковий обмін групу хворих на ДТЗ було розподілено на дві підгрупи. Принцип поділу ґрунтувався на даних медіани часу появи перших ознак захворювання або його рецидиву — 5 місяців. До першої підгрупи увійшли 17 осіб із тривалістю захворювання в середньому 3 (2–4) місяці, друга підгрупа — 19 хворих зі стажем тиреотоксикозу 10,4 (6–15) місяця.
Третю групу становили 19 пацієнтів віком 32,16 ± 6,28 року, які перенесли тиреоїдектомію з приводу раку ЩЗ і перебувають на супресивній терапії левотироксином у дозі 155,25 ± 49,72 мкг/добу впродовж 4,85 ± 3,57 року. Рівень ТТГ на час обстеження становив 0,06 ± 0,03 мкМО/мл.
До четвертої групи увійшли 32 хворі на гіпотиреоз, які отримували замісну терапію препаратами тиреоїдних гормонів упродовж 2,27 (1,00–4,83) року в дозі 68,75 ± 35,28 мкг/добу.
П’ята група — хворі з уперше виявленим гіпотирео–зом — була представлена 29 жінками. Для уточнення впливу тяжкості гіпотиреозу ця група хворих була розподілена на дві підгрупи: 14 осіб із субклінічним (ТТГ — 9,04 ± 3,38 при нормальних показниках вТ4) і 15 хворих — із явним гіпотиреозом (ТТГ — 11,76 ± 4,82 при зниженому вТ4). Шоста (контрольна) група представлена 20 здоровими особами.
Характеристика досліджуваних груп за віком, індексом маси тіла (ІМТ) і показником, що характеризує функціональний стан ЩЗ, наведена в табл. 1.
Для уточнення впливу віку на метаболізм кісткової тканини всі досліджувані групи були розподілені на підгрупи залежно від віку пацієнтів: 19–30 років і 31–48 років. Поділ на підгрупи проводився щодо віку досягнення піка кісткової маси (20–30 років) і збереження її плато [2].
Отримана інформована згода обстежених на дослідження та пов’язані з ними процедури.
Критерії виключення з дослідження: наявність інших захворювань з боку ендокринної системи, тяжка супутня патологія з боку нирок, печінки, серцево-судинної системи, захворювання сполучної тканини (ревматоїдний артрит, системний червоний вовчак, системна склеродермія та ін.), злоякісні новоутворення в анамнезі, зловживання алкоголем, ІМТ нижче від 20 кг/м2.
Функціональний стан ЩЗ оцінювали за допомогою визначення базальних концентрацій ТТГ і вТ4 в сироватці крові імуноферментним методом за допомогою реактивів фірми DRG (Німеччина) на автоматичному аналізаторі iEMS Reader MF фірми ThermoLabsystems (Фінляндія). Нормальні значення ТТГ відповідали 0,23–4,0 мкМО/мл, вТ4 — 10,2–23,2 пмоль/л.
Серед маркерів кісткоутворення визначали рівень остеокальцину (нормальні величини 11,0–43,0 нг/мл).
Стан резорбції відображав рівень β-ізомера C-кінцевого телопептиду колагену І типу (β-СТх) в сироватці крові (нормальні величини < 0,573 нг/мл) у лабораторії відділу клінічної фізіології та патології опорно-рухового апарату ДУ «Інститут геронтології імені Д.Ф. Чеботарьова НАМН України». Маркери кісткового ремоделювання вивчали за допомогою хемілюмінесцентного методу на імуноферментному аналізаторі Eleсsys 2010 (Roche Diagnostics, Німеччина) за допомогою тест-систем cobas.
Крім того, стан кісткового метаболізму оцінювали за концентрацією в сироватці крові лужної фосфатази (ЛФ) (нормальні величини 26–117 Од/л), неорганічного фосфору (нормальні значення від 0,81 до 1,45 ммоль/л) і загального кальцію — від 2,15 до 2,58 ммоль/л.
Для оцінки структурно-функціонального стану кісткової тканини використовували метод ультразвукової денситометрії за допомогою кількісного кісткового ультрасонометра Sahara (Hologic Inc., model 04874, 2008) на п’ятковій кістці, що складається з трабекулярної (губчастої) кісткової тканини. Сьогодні ультразвукова денситометрія — інформативний і безпечний методом скринінгу для виявлення пацієнтів із груп ризику остеопорозу, зважаючи на широку доступність, низьку вартість, відсутність іонізуючого випромінювання для пацієнта.
Визначали такі показники: швидкість поширення ультразвуку через кістку (ШПУ, м/с), що залежить від її щільності та еластичності; широкосмугове ослаблення ультразвукового сигналу (ШОУ, дБ/МГц), що відображає не тільки щільність кісткової тканини, а й кількість, розміри та просторову орієнтацію трабекул; індекс міцності кісткової тканини (ІМ, %), що вираховується комп’ютером на підставі показників ШПУ та ШОУ й відображає стан губчастої кісткової тканини пацієнта, який обстежується, щодо категорії дорослих людей віком 20 років; Т-показник, що відображає, на яку частку середнього квадратичного відхилення відрізняється ІМ кісткової тканини пацієнта, який обстежується, порівняно з умовно здоровими дорослими людьми віком 20 років; Z-показник, що відображає, на яку частку середнього квадратичного відхилення відрізняється ІМ кісткової тканини пацієнта, який обстежується, порівняно з віковою нормою.
Остеопороз діагностували за Т-критерієм при зниженні щільності кісткової тканини більше ніж на 2,5 стандартного відхилення від показників умовно здорових 20-річних молодих дорослих людей, а остеопенію — при зниженні щільності кісткової тканини на 1,1–2,4 стандартного відхилення [5].
Статистична обробка отриманих результатів проводилася з використанням програм SPSS 11,5. Вірогідність відмінностей показників між порівнянними групами встановлювали за допомогою непараметричного критерію Манна — Уїтні, t-критерію Стьюдента, заздалегідь перевіривши нормальність розподілу показників шляхом використання критерію Шапіро — Уїлка. Використовували методи варіаційної статистики з обчисленням середнього арифметичного М і стандартного відхилення SD. Кореляційний аналіз проводили за методом Пірсона. Критичний рівень значущості при перевірці статистичних гіпотез у цьому дослідженні вважали меншим від 0,05.
Дослідження проведені відповідно до Гельсінської декларації Всесвітньої медичної асоціації про етичні принципи проведення наукових медичних досліджень за участю людини і наказу МОЗ України № 281 від 01.11.2000 р.
Результати
У 148 осіб із патологією ЩЗ за даними ультразвукової денситометрії зміни показників МЩКТ виявлені у 59 (39,9 %) випадках, із них остеопенія — у 45 (30,4 %), остеопороз — у 14 (9,5 %). При цьому частота порушень вірогідно збільшувалася в усіх групах хворих із порушеннями функціонального стану ЩЗ (табл. 2).
За відсутності функціональних порушень ЩЗ у пацієнтів із ДНЗ не відзначалося порушення ремоделювання кісткової тканини: зберігалася швидкість формування кістки, що характеризується нормальними показниками вмісту в крові остеокальцину і ЛФ. Показники фосфорно-кальцієвого обміну (кальціємія, фосфоремія) також відповідали нормальним значенням.
Відсутність змін кісткового метаболізму у хворих на ДНЗ, за даними ультразвукової денситометрії, не призводила до порушень показників кісткової міцності: ШПУ, ШОУ, ІМ, Т-критерію і Z-критерію, а отже, і до збільшення частоти формування остеопенії та остеопорозу порівняно з групою контролю.
За даними біохімічного дослідження в групі пацієнтів із ДТЗ виявлена активація резобції кістки, про що свідчить збільшення рівня маркера кісткової резорбції — β-CTх. Одночасно з прискоренням резорбції у хворих на ДТЗ спостерігалося посилення кісткоутворення, що знайшло своє відображення у збільшенні в крові остеокальцину і ЛФ.
Аналіз результатів динаміки рівнів маркерів ремоделювання кістки у хворих на ДТЗ показав, що посилення кісткоутворення не компенсує різкого підвищення кісткової резорбції. Так, спостерігалося збільшення в 1,7 раза вмісту β-CTх, при цьому рівень остеокальцину зріс лише у 1,2 раза. Отже, процес резорбції кістки перевищує кісткоутворення. Тому кісткова тканина у пацієнтів із ДТЗ у стані декомпенсації зазнає посиленої резорбції, що сприяє розвитку остеопенії та остеопорозу.
Нами встановлено зв’язок гіперпродукції гормонів ЩЗ із тенденцією до негативного кальцієвого балансу. Вміст кальцію в крові збільшився порівняно з аналогічним показником контрольної групи, але без статистично значущої різниці (р > 0,05). Вміст фосфору в крові у хворих на ДТЗ не змінився щодо відповідного показника осіб контрольної групи.
Прискорення процесу ремоделювання кістки сприяло вірогідному зниженню всіх показників міцності кістки за даними ультразвукової денситометрії порівняно з контрольною групою. При цьому середні значення T-критерію відповідали остеопенії, а Z-критерію — нормі (з тенденцією до її нижньої межі).
Посилення швидкості ремоделювання кістки через переважання резорбції спричинило вірогідне збільшення порушення МЩКТ до 50 % внаслідок як остеопенії (38,9 %), так і остеопорозу (11,1 %) порівняно з контрольною групою.
Показники міцності кістки за Z-критерієм у пацієнтів із ДТЗ віком від 19 до 30 років вірогідно нижчі, ніж в осіб віком від 31 до 48 років, які досягнули піка кісткової маси.
Частота остеопенії у хворих на ДТЗ віком 19–30 років становила 46,7 %, випадків остеопорозу не було. Одночасно у хворих віком 31–48 років остеопенія виникала у 33,3 %, остеопороз — у 19,0 % випадків.
Як бачимо, надмірна продукція тиреоїдних гормонів справляє більш виражений негативний вплив на міцність кісткової тканини у пацієнтів, які не досягли віку досягнення піка кісткової міцності, ніж в осіб віком понад 31–48 років.
Нами проаналізовано результати дослідження впливу тривалості перебігу тиреотоксикозу. Швидкість резорбції, що оцінюється за рівнем β-CTх, у хворих із тривалістю тиреотоксикозу понад 6 місяців була вищою порівняно з аналогічним показником у пацієнтів із тривалістю тиреотоксикозу до 6 місяців (р < 0,01). Встановлена позитивна лінійна залежність між рівнем β-CTх і тривалістю декомпенсації ДТЗ (вперше виявленого і рецидиву) (r = 0,64; р < 0,001), що підтверджує негативний вплив тривалості тиреотоксикозу на стан кісткового обміну у таких хворих. У проведеному дослідженні не отримано вірогідних відмінностей вмісту остеокальцину залежно від тривалості захворювання (р = 0,39). Прискорення рівня резорбції у хворих із більш тривалим перебігом тирео–токсикозу не призвело до зниження показників міцності кісткової тканини ШПУ, ШОУ, ІМ, Т-критерію і Z-критерію порівняно з пацієнтами із тривалістю захворювання до 6 місяців.
Для уточнення впливу тяжкості гіпотиреозу загальну групу хворих (n = 29) було розподілено на дві підгрупи, до яких увійшли 14 пацієнтів із субклінічним (ТТГ — 8,82 ± 3,04 мкМО/мл, вТ4 — 13,17 ± 2,21 пмоль/л) і 15 — з явним гіпотиреозом (ТТГ — 11,07 ± 4,72 мкМО/мл, вТ4 — 7,48 ± 1,92 пмоль/л).
На думку окремих авторів [8, 14], у пацієнтів із маніфестним гіпотиреозом кісткове ремоделювання уповільнену в 2–3 рази. У проведеному дослідженні у хворих на явний гіпотиреоз виявлено вірогідне зниження рівня β-CTх (р < 0,05) порівняно з контрольною групою. Нами встановлений вплив тяжкості гіпотиреозу на швидкість резорбції кісткової тканини (r = –0,48; р < 0,05). В осіб із субклінічним гіпотиреозом рівень β-CTх не змінився (р > 0,05). Отримані результати свідчать про зниження рівня остеокальцину у хворих як на явний гіпотиреоз (9,63 ± 2,79 нг/мл; р < 0,05), так і на субклінічний гіпотиреоз (13,11 ± 3,06 нг/мл; р < 0,05) порівняно з аналогічним показником у групі конт–ролю. При цьому знижена функція ЩЗ не призвела до будь-яких змін кальцієвого і фосфорного балансу.
Зниження швидкості ремоделювання кістки сприяло частішому формуванню порушень МЩКТ у хворих на явний гіпотиреоз із тривалим перебігом порівняно з контрольною групою. Остеопенія виявлялася у 18,8 %, остеопороз — у 9,4 % випадків. У хворих із уперше виявленим субклінічним гіпотиреозом зниження міцності кістки до стану остеопенії відзначалося у 7,1 % випадків.
Встановлено, що показники кісткової міцності у пацієнтів із явним гіпотиреозом віком 31–48 років відповідали нормальним значенням. Кореляційний аналіз показав відсутність лінійної залежності частоти ОПС у хворих на явний гіпотиреоз від віку (r = 0,24; р > 0,05). У пацієнтів із субклінічним гіпотиреозом віком 31–48 років показники кісткової міцності відповідали нормальним значенням і не залежали від вікового чинника.
Отже, наші дослідження показали, що у хворих на явний гіпотиреоз відзначається зниження швидкості ремоделювання кістки, що проявилося в зниженні рівня маркерів кісткової резорбції і кісткового формування (остеокальцину). У свою чергу, зниження ремоделювання кісткової тканини сприяло зниженню міцності кістки з формуванням остеопенії та остеопорозу. У пацієнтів з явним гіпотиреозом виявлена негативна лінійна залежність показників міцності кістки від рівня ТТГ. Посилення тяжкості гіпотиреозу сприяло як зниженню резорбції і кісткоутворенню, так і збільшенню частоти остеопенії і погіршенню показників ультразвукової денситометрії п’яткової кістки.
Нами вивчена залежність стану кісткового метаболізму у пацієнтів після оперативного лікування з приводу раку ЩЗ, які отримували супресивні дози препаратів тиреоїдних гормонів. Дані про вплив часткового екзогенного пригнічення секреції ТТГ на кісткову тканину в осіб репродуктивного віку неоднозначні. Одні автори вважають, що таке лікування несприятливо впливає на МЩКТ [7], але в інших роботах повідомлялося про відсутність негативного ефекту [1].
Отримані нами результати свідчать про те, що екзогенне пригнічення ТТГ, зумовлене прийомом супресивної тиреоїдної терапії, призводить до росту активності остеокластів і виявляється у збільшенні рівня маркера кісткової резорбції β-CTх у 1,37 раза. Також спостерігається тенденція до посилення остеобластичної активності, яка характеризувалася збільшенням рівня остеокальцину в 1,18 раза. Активність ЛФ у хворих цієї групи не змінилася. Слід відзначити, що тенденція переважання прискорення резорбції кістки над її формуванням не призвела до появи гіперкальціємії. Однак спостерігалася тенденція до збільшення рівня фосфору в крові.
Аналіз показників кісткової міцності у пацієнтів третьої групи на фоні супресивних доз препаратів тиреоїдних гормонів вказує на той факт, що їх зниження відбулося за рахунок показника ШПУ. Відомо, що ШПУ характеризує здебільшого стан кортикальної кістки, що дозволяє стверджувати про більш виражений вплив лікування супресивними дозами препаратів тиреоїдних гормонів насамперед на кортикальну частину п’яткової кістки. Іншим підтвердженням більш вираженого впливу екзогенної супресії ТТГ на кортикальну кістку є наявність позитивної лінійної залежності між рівнем β-CTх, ЛФ і ШПУ (r = 0,69; p < 0,05); (r = 0,63; p < 0,05) відповідно.
Нами встановлено збільшення частоти порушень МЩКТ у пацієнтів з екзогенним пригніченням ТТГ порівняно з особами контрольної групи (р < 0,05) за рахунок зниження міцності кістки до стану остеопорозу у 15,8 %, остеопенії — у 42,1 % випадків.
Значний інтерес становить вивчення впливу замісної терапії препаратами тиреоїдних гормонів на виникнення остеопенії та остеопорозу у хворих на первинний гіпотиреоз. Дані літератури свідчать, що така замісна терапія збільшує темпи кісткового ремоделювання [6].
Замісна терапія левотироксином не призвела до зміни ремоделювання кістки попри те, що рівні β-CTх (маркери кісткової резорбції) збільшилися в 1,32 раза (р < 0,05). Також не відзначалося змін кісткоутворення, що характеризуються рівнем маркера кісткової формації — остеокальцину (р > 0,05), ЛФ (р > 0,05). У той же час при вивченні залежності швидкості резорбції від величини рівнів ТТГ і вТ4 відзначалася негативна лінійна кореляція між рівнем β-CTх і ТТГ (r = –0,35; р < 0,05) і позитивна лінійна кореляція з вТ4 (r = 0,57; р < 0,05). Також виявлена негативна лінійна залежність між остеокальцином і рівнем ТТГ (r = –0,37; р < 0,05) і позитивна лінійна залежність із рівнем вТ4 (r = 0,44; р < 0,05).
Показники кісткової міцності щодо піка кісткової щільності та середніх значень для певного віку і статі були знижені до стану остеопенії. Наявність зниження показників кісткової міцності за Z-критерієм свідчить, що у хворих на гіпотиреоз негативний вплив замісної терапії на кісткову міцність відбувається незалежно від вікових змін.
Замісна терапія препаратами тиреоїдних гормонів у нашому дослідженні сприяла порушенню МЩКТ у 28,2 % випадків, із них у 9,4 % міцність кістки знижувалася до стану остеопорозу і у 18,8 % випадків — до остеопенії.
Попри відсутність відмінностей кісткового обміну в різних вікових підгрупах дослідження виявило статистичні відмінності в значеннях Z-критерію (р < 0,05). У підгрупі хворих віком 19–30 років показники кісткової міцності за Z-критерієм наближалися до показників, що характеризують остеопенію, а в підгрупі осіб 31–48 років ці показники за Z-критерієм відповідали нормі. Проте при порівнянні показників міцності кістки стосовно середніх значень пікової кісткової маси у двох вікових підгрупах вірогідні відмінності в значеннях ШПУ, ШОУ, T-критерію (р > 0,05) не виявлені.
Отже, застосування замісної терапії препаратами тиреоїдних гормонів в осіб до досягнення піка кісткової міцності (19–30 років) призводить до більш виражених змін показників кісткової міцності. При оцінці результатів ультразвукової денситометрії встановлено, що частота остеопенії та остеопорозу у двох вікових підгрупах 19–30 років і 31–48 років не відрізнялася.
При дослідженні впливу дози препаратів замісної терапії методом визначення кореляційної залежності нами встановлена відсутність лінійної залежності рівня маркерів ремоделювання кістки β-CTх (r = 0,16; p = 0,42) і ЛФ (r = 0,03; р = 0,78) від дози препарату і наявність позитивної лінійної залежності рівня маркера кісткоутворення від дози левотироксину (r = 0,36; р < 0,05).
Для встановлення впливу тривалості прийому замісної терапії препаратами тиреоїдних гормонів ми розподілили пацієнтів четвертої групи на дві підгрупи: першу (n = 17) — з прийомом левотироксину до трьох років (44,00 ± 11,30 мкг/добу) і другу (n = 15) — з прийомом левотироксину понад 3 роки (103,42 ± 16,56 мкг/добу). Результати дослідження показали, що зі збільшенням тривалості прийому левотироксину резорбція кістки посилилася. Так, показник β-CTх збільшився від 0,532 ± 0,063 нг/мл у пацієнтів, які отримували левотироксин до трьох років, до 0,683 ± 0,071 нг/мл в осіб, які отримували левотироксин понад 3 роки і більше. При цьому у хворих, які отримували левотироксин понад 3 роки, рівень маркера кісткової резорбції β-CTх статистично вірогідно відрізнявся від відповідного показника групи контролю (р < 0,05).
За результатами дослідження встановлено, що у хворих на фоні прийому левотироксину у дозі понад 75 мкг/добу показник резорбції β-CTх був підвищений порівняно з аналогічним показником контрольної групи. Однак це не вплинуло на зниження показників міцності кістки ШПУ, ШОУ, Т-критерію, Z-критерію. Також нами не виявлено збільшення частоти формування остеопенії та остеопорозу у хворих, які отримували левотироксин у дозі понад 75 мкг/добу (108,24 ± 11,53 мкг/добу) порівняно з підгрупою хворих, які отримували менше 75 мкг/добу (42,76 ± 8,27 мкг/добу) левотироксину (р = 0,28).
Отже, у хворих на гіпотиреоз, які перебувають на замісній терапії препаратами тиреоїдних гормонів, рівень ремоделювання кістки не змінюється. Однак при збільшенні тривалості терапії левотироксином понад 3 роки, а також дози левотироксину (понад 75 мкг/добу) спостерігається прискорення резорбції кістки, що призводить до зниження міцності кістки і розвитку остеопенії та остеопорозу. Призначення такого лікування у молодому віці (19–30 років) є чинником, що збільшує ризик формування остеопенії.
На підставі наявності статистично значущих відмінностей у частоті формування остеопенії та остеопорозу і середніх значень показників кісткової міцності у пацієнтів із порушенням функціонального стану ЩЗ порівняно з представниками контрольної групи можна дійти висновку про доцільність використання скринінгового дослідження п’яткової кістки методом ультразвукової денситометрії для виявлення зниження МЩКТ і зменшення частоти порушень МЩКТ у хворих із тиреопатіями.
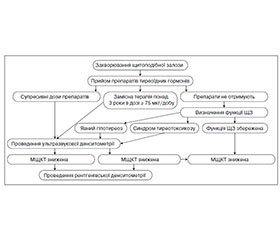
Отримані результати обґрунтовують доцільність розробки стратегій ранньої діагностики, а також первинної і вторинної профілактики остеопорозу у пацієнтів із тиреоїдною патологією. Нами розроблений алгоритм ранньої діагностики остеопенії та остеопорозу у пацієнтів із захворюваннями ЩЗ (рис. 1).
/39.jpg)
До групи ризику розвитку остеопенії та остеопорозу слід включити хворих із різними формами тиреопатій зі зміненим функціональним станом ЩЗ, а також пацієнтів, які отримують замісну і супресивну терапію. Ультразвукова денситометрія п’яткової кістки показана пацієнтам із тиреоїдною патологією, які належать до групи ризику, на першому етапі обстеження з метою виключення формування остеопенії та остеопорозу. Встановлення порушення МЩКТ за даними ультразвукової денситометрії п’яткової кістки є підставою для проведення двохенергетичної рентгенівської абсорбціометрії осьового скелета (поперековий відділ хребта і проксимальний відділ стегнової кістки) з метою оцінки вираженості остеопенії та остеопорозу, ризику переломів і призначення своєчасних і адекватних профілактичних або лікувальних заходів.
Обговорення
Гіперпродукція тиреоїдних гормонів, за даними багатьох досліджень, призводить до дисбалансу в системі кісткового ремоделювання в напрямку переважання резорбції і, як наслідок, до втрати МЩКТ і підвищення ризику переломів [3]. За даними проведеного нами дослідження, в групі пацієнтів із ДТЗ спостерігалася активація резобції кістки, що виявилося у вигляді збільшення рівня маркера кісткової резорбції β-CTх. Отримані результати відповідають даним досліджень інших авторів [10]. Дисбаланс процесів резорбції і кісткоутворення розглядається як причина розвитку остео–порозу при тиреотоксикозі, оскільки процеси резорбції кістки перевищують кісткоутворення.
Відомо, що втрата кісткової маси у хворих на тиреотоксикоз більш виражена у людей молодшого віку, що пов’язано з активнішим метаболізмом кісткової тканини [13]. Зниження показників міцності кістки в різних вікових підгрупах хворих на ДТЗ сприяло збільшенню частоти випадків остеопенії з 33,3 % у хворих, вік яких становив 31–48 років, до 46,7 % випадків остеопенії в підгрупі хворих віком 19–30 років. Отримані результати дозволяють припустити, що тиреотоксикоз більш виражено негативно впливає на міцність кісткової тканини у пацієнтів, які не досягли віку досягнення піка кісткової міцності, ніж в осіб після досягнення піка міцності кістки.
З огляду на те, що нами досліджувалася п’яткова кістка, отримані результати свідчать про вплив тирео–їдної гіперфункції на периферичний відділ скелета і переважно на трабекулярну структуру кістки. Розвиток тиреотоксикозу у молодому віці (до 30 років) збільшує ризик формування остеопенії у хворих на ДТЗ. Негативний вплив тривалості тиреотоксикозу у пацієнтів із ДТЗ встановлений тільки на стан кісткового ремоделювання. Зареєстровані нами зміни кісткового метаболізму свідчать про більшу роль активації резорбції кістки в розвитку остеопенії та остеопорозу у хворих із тривалістю тиреотоксикозу понад 6 місяців.
На сьогодні вплив зниженої функції ЩЗ на показники МЩКТ вивчений недостатньо, зважаючи на мале число досліджень. Продемонструвати вплив гіпотиреозу на стан кісткової тканини нелегко через те, що ці хворі зазвичай похилого віку і мають багато додаткових чинників схильності до остеопорозу.
Зниження швидкості ремоделювання кістки у хворих на явний гіпотиреоз призвело до статистично вірогідного зниження показників кісткової міцності до значень остеопенії (табл. 2). Однак у групі хворих на субклінічний гіпотиреоз показники міцності кістки перебували в межах нормальних значень і не мали відмінностей від аналогічних показників групи конт–ролю.
Встановлене нами статистично вірогідне зниження показників кісткової міцності і збільшення частоти остеопенії та остеопорозу свідчить про те, що метод ультразвукової денситоментрії здатний ефективно оцінювати ризик переломів у пацієнтів, які отримують супресивну терапію препаратами тиреоїдних гормонів. Екзогенне пригнічення ТТГ слід розцінювати як чинник, що призводить до підвищення ризику переломів у пацієнтів із тиреопатіями.
За даними літератури, у пацієнтів із функціональними змінами ЩЗ здебільшого зазнає змін аксіальний відділ скелета [4]. У проведеному нами дослідженні за допомогою ультразвукової денситометрії зареєстровано зміни кісткової міцності, зумовлені наявністю порушень функціонального стану ЩЗ у периферичному відділі скелета (п’ятковій кістці).
Проведене дослідження має певні обмеження з огляду на незначну кількість пацієнтів. Однак нами вперше здійснена спроба комплексного підходу до оцінки стану кісткового метаболізму у хворих із патологією ЩЗ, що включає ультразвукову денситометрію і лабораторні методи дослідження.
Висновки
1. В осіб із патологією ЩЗ, за даними ультразвукової денситометрії, зміни показників МЩКТ виявлені в 59 (39,9 %) випадках, із них остеопенія — в 45 (30,4 %), остеопороз — у 14 (9,5 %). Частота остеопенії та остеопорозу вірогідно збільшувалася в усіх групах хворих із порушеннями функціонального стану ЩЗ. За відсутності функціональних порушень у пацієнтів із ДНЗ не відзначалося порушення ремоделювання кісткової тканини.
2. Основним чинником, що призводить до зниження кісткової міцності у пацієнтів із тиреопатіями, є надмірна або недостатня продукція тиреоїдних гормонів, а також лікування супресивними дозами левотироксину. На стан кісткового метаболізму не впливає субклінічний гіпотиреоз, а також тривалість і прийом низьких (менше 75 мкг/сут) доз замісної терапії левотироксином.
3. Найбільш виражена зміна кісткового ремоделювання відбувається у пацієнтів із тиреотоксикозом і проявляється посиленням резорбції і кісткового формування. Лікування супресивними дозами левотироксину сприяє як активації резорбції, так і формуванню кістки, а замісні дози призводять до збільшення швидкості резорбції при збереженні швидкості формування кістки. Явний гіпотиреоз сприяє зниженню резорбції і формування кісткової тканини.
Інформація про конфлікт інтересів
Автор декларує відсутність явних і потенційних конфліктів інтересів, пов’язаних із публікацією статті.

/35.jpg)
/36.jpg)
/39.jpg)