Статья опубликована на с. 25-30
Одним из наиболее серьезных и обсуждаемых вопросов в медицине на современном этапе является вопрос об обоснованности антибиотикотерапии. Благодаря открытию Александром Флемингом пенициллина визитной карточкой XX века является победа над многими инфекционными заболеваниями, которые раньше уносили миллионы жизней. В первые десятилетия использования антибиотикотерапия была настолько эффективной, что казалось, найдена панацея. Это привело к массовому и порой необоснованному использованию антибактериальных препаратов. И действительно, практическому врачу психологически легче назначить антибиотик, чем его не назначать. При этом все большее предпочтение стали отдавать препаратам, обладающим способностью угнетать как можно более широкий спектр возбудителей, не разбирая, патогенные они или относятся к необходимым для человеческого организма. Со временем радужные надежды стали рассеиваться. Появилось понятие «антибиотикорезистентность». Стало очевидным что, во-первых, полная победа над микроорганизмами невозможна, во-вторых, антибактериальная терапия не такая уж безобидная.
Наблюдение показало, что во время или после приема антибиотиков от 3 до 30 % всех больных отмечают неблагоприятные последствия. Наиболее часто встречаются аллергические реакции и расстройства со стороны пищеварительной системы, от легких и быстро проходящих до тяжелых, значительно нарушающих состояние. Нарушения со стороны желудочно-кишечного тракта особенно часто отмечаются у детей и лиц пожилого возраста. При этом появляются жалобы на вздутие, колющие и тянущие боли в животе. Иногда эти симптомы сопровождаются интоксикационным синдромом, что проявляется повышением температуры. Появление слизи и крови в стуле чаще всего свидетельствует о развитии антибиотик-ассоциированного колита, который еще называют псевдомембранозным. При эндоскопическом осмотре толстого кишечника обнаруживаются специфические мембраны, состоящие из фибрина, они плотно спаяны со стенкой кишечника и, по сути, замещают его значительные дефекты.
Большинство современных антибиотиков могут стать причиной кишечного дисбактериоза, хотя действие каждого из них имеет определенные особенности.
В частности, ампициллин в значительной степени подавляет рост как аэробной, так и анаэробной микрофлоры, тогда как амоксициллин, лишь минимально подавляя активность большинства нормальных кишечных микроорганизмов, приводит к некоторому увеличению популяции представителей рода Enterobacteriaceae [1].
Пероральные цефподоксим, цефпрозил и цефтибутен определенно обусловливают рост численности представителей рода Enterobacteriaceae в кишечнике, а применение цефиксима ведет к значительному снижению количества анаэробных микроорганизмов.
Важно, что большинство цефалоспоринов вызывают рост численности энтерококков и С.difficile.
Фторхинолоны в значительной степени угнетают рост микробов рода Enterobacteriaceae и в меньшей степени — энтерококков и анаэробных микроорганизмов, не способствуя при этом росту грибов и С.difficile [1, 2].
Наиболее тяжелым и даже угрожающим жизни состоянием, связанным с антибиотик-ассоциированным дисбактериозом кишечника, является так называемый С.difficile-ассоциированный колит, вызванный избыточным размножением в кишечнике С.difficile. Последний в норме выявляют при бактериологическом исследовании у 1–3 % здоровых лиц, но более чем у 20 % пациентов, получающих антибактериальную терапию.
У некоторых больных на фоне угнетения нормальной флоры вследствие приема антибиотиков происходит лавинообразный рост популяции С.difficile с изменением его токсигенных свойств, в том числе повышением синтеза энтеротоксина А и цитотоксина В. Результатом этого становится тяжелое поражение слизистой оболочки толстой кишки.
Чаще всего С.difficile-ассоциированный колит развивается при применении клиндамицина или линкомицина, полусинтетических пенициллинов, реже — цефалоспоринов с широким спектром антибактериального действия. Наиболее тяжелой формой С.difficile-ассоциированного колита является псевдомембранозный колит, летальность при котором достигает 30 % [3–5].
Каков механизм развития дисбиотических состояний при приеме антибиотиков? Это непосредственное токсическое воздействие антибактериального препарата на слизистую кишечника с частичной потерей способности энтероцитов усваивать углеводы, жиры и развитием гиперосмолярности кишечного химуса, нарушением всасывания воды и развитием диареи. Как правило, такая осмотическая диарея сопровождается увеличением газообразования в кишечнике, снижением рН до кислой реакции. Некоторые антибиотики (например, макролиды) могут обладать непосредственным стимулирующим действием на перистальтику кишечника. Наконец, не исключены аллергические реакции на антибиотик в стенке кишечника. Все эти причины ведут к формированию неспецифической (идиопатической) антибиотик-ассоциированной диареи (ААД), так как на доказательном уровне основной патогенетический фактор выделить трудно. Главными чертами такой диареи являются отсутствие значимых воспалительных и деструктивных изменений в кишечнике, скоропроходящий характер при отсутствии рецидивов. В настоящее время подобную диарею рекомендовано относить к классу К91.9 по Международной классификации болезней 10-го пересмотра (МКБ-10). Другой механизм возникновения ААД связан с развитием кишечной инфекции C.difficile и поражением кишечника клостридиальными токсинами. Чаще всего развивается колит, вызванный C.difficile (А04.7 по МКБ-10), который может значительно варьировать по тяжести проявлений — от субклинических и болевых форм, когда выявляются лишь токсины в кишечном содержимом, до тяжелой водянистой диареи и псевдомембранозного колита. Содержание C.difficile в кишечнике на высоте инфекционного процесса может быть так велико, что достигает 40 % от всей массы кишечной флоры. В патогенезе диареи участвуют секреторные, осмотические и инвазивные механизмы. Достаточно постоянно выявляется скрытая кровь в стуле. Источник инфекции — больной человек. Заражение легко возникает в условиях больничного стационара, где контаминация спорами C.difficile очень высока, учитывая, что споры устойчивы к действию большинства дезинфицирующих препаратов. Распространено и носительство клостридий. Неконтролируемый рост численности и проявление токсигенных свойств у C.difficile, вероятнее всего, происходит в момент ослабления сдерживающего влияния неизвестных симбионтных микроорганизмов кишечника, которые элиминируются во время лечения антибиотиками.
Первый год жизни ребенка, и особенно первые его месяцы, являются наиболее уязвимыми с точки зрения развития любого дисбактериоза кишечника, в том числе антибиотик-ассоциированного [6–8]. Это связано с тем, что в это время происходит первичное формирование кишечной микрофлоры, что в сочетании с незрелостью иммунной системы делает ее весьма неустойчивой ко многим экзогенным факторам. Факторы, обеспечивающие благоприятные условия для формирования нормальной микрофлоры кишечника, способствуют профилактике антибиотик-ассоциированного дисбактериоза не только в этот возрастной период, но, в большей или меньшей степени, на протяжении дальнейшей жизни ребенка.
Антибиотикотерапия, даже обоснованная, у детей первого года жизни может привести к тяжелому дисбактериозу кишечника, однако у детей более старшего возраста и даже у взрослых она может серьезно нарушить уже сформированный кишечный биоценоз.
Обычно лечение включает следующие направления: снижение избыточного микробного обсеменения тонкой кишки и восстановление нормальной микрофлоры.
В лечении ассоциированного с антибиотиками дисбактериоза кишечника в настоящее время ключевое положение занимают пробиотики — препараты, содержащие микроорганизмы, которые оказывают положительное влияние на кишечный микробиоценоз.
В этом отношении хотелось бы процитировать высказывание Томаса Томпкинса, научного руководителя института Rosell-Lallemand, на съезде педиатров Украины: «Нет никакого противоречия, когда пробиотик назначается одновременно с антибиотиком».
Если пробиотик принимать с 1-го дня антибиотикотерапии, бифидо- и лактобактерии сохраняют собственную микрофлору и берут часть ее функций на себя — расщепляют углеводы, белки и жиры, оказывают детоксикационное (разгружают работу печени и почек) и противоаллергическое действие. Пробиотики рекомендовано применять с первого до последнего дня приема антибиотика с разбросом по времени приема пробиотика и антибиотика в 2–3 часа. Кроме того, нужно учитывать, что антибиотики абсорбируются в верхних отделах тонкого кишечника и полностью всасываются в среднем через 2 ч с момента приема. Пробиотическим микроорганизмам, чтобы восстановить свою жизнедеятельность, необходимо более длительное время, чаще всего около 5–6 ч. Именно за этот период они достигают толстого кишечника, в связи с чем антибиотик и пробиотик не взаимодействуют. Важно учитывать также, что многие из лактобацилл обладают природной видовой нечувствительностью ко многим антибиотикам. Это свойство не нужно путать с пенетрантностью генов антибиотикорезистентности, например способностью вырабатывать бета-лактамазы.
Нельзя не вспомнить, что основоположником концепции пробиотиков стал И.И. Мечников, получивший за многочисленные работы, посвященные микробиоценозу, Нобелевскую премию в области медицины в 1908 г. Впервые он установил, что некоторые микроорганизмы обладают свойством подавлять рост холерного вибриона, в то время как другие — стимулируют.
Учитывая растущую устойчивость многих бактерий к антибиотикам, нельзя игнорировать уникальную возможность представителей индигенной микрофлоры подавлять их рост. Так, бифидобактерии препятствуют размножению и росту стафилококков, в том числе антибиотикоустойчивых, вытесняют и выводят из организма, способны подавлять их развитие. Лактобактерии являются прямыми конкурентами клебсиелл, угнетают их рост и выводят их из организма. Кроме того, лактобактерии выделяют целый комплекс биологически активных веществ, которые оказывают ингибирующий эффект в отношении палочки Коха.
В настоящее время изучено большое количество микроорганизмов, которые широко применяются в повседневной медицинской практике в составе пробиотических препаратов и продуктов питания. Основными критериями являются безопасность и выраженные пробиотические свойства, которые должны быть доказаны в двойных слепых плацебо-контролируемых исследованиях. Этот «экзамен» прошли Bacterium bifidum, Lactobacillus acidophilus, Lactobacillus GG, Lactobacillus fermentum, Strepto (Entero) coccus faecium SF68, Saccharomyces boulardii, Bifidobacterium bifidum, Lactobacillus plantarum, Lactobacillus casei, Bifidobacterium breve, Lactococcus lactis, Lactobacillus rhamnosus, Streptococcus thermophilus, Lactobacillus helveticus, Bifidobacterium longum.
Кроме того, микроорганизмы, находящиеся в пробиотическом препарате, должны соответствовать требованиям FDA и Комиссии по стандартам качества и безопасности пищевых продуктов и лекарств Всемирной организации здравоохранения, иметь генетический паспорт.
В норме количество микроорганизмов в желудочно-кишечном тракте возрастает от желудка к толстому кишечнику. Именно поэтому в случае каких-либо нарушений микрофлоры очень важно, чтобы необходимые бактерии попадали к месту патологического очага. Однако агрессивные условия внешней среды (температура, влажность и т.д.) могут негативно сказаться на активности пробиотика. Более того, при попадании в организм на пути полезных бактерий встречаются как минимум 3 барьера: кислая среда желудочного сока, соли желчных кислот и ферменты поджелудочной железы, под воздействием которых полезные бактерии могут погибнуть. А для оказания пробиотического эффекта микроорганизмы, находящиеся в составе пробиотического препарата, с минимальными потерями должны преодолеть верхние отделы пищеварительного тракта, в связи с чем возникает необходимость размещения их в рН-чувствительной капсуле.
Пробиотиком, который соответствует перечисленным выше требованиям, является Бифитен, представляющий собой уникальную комбинацию 9 штаммов пробиотических бактерий повышенной эффективности. Суммарно — не менее 4,5 × 109 КОЕ (табл. 1).
/28.jpg)
Важная особенность препарата Бифитен заключается в том, что он является синбиотиком, представляющим собой комбинацию из пробиотиков и пребиотиков, в которой пробиотики и пребиотики оказывают взаимно усиливающее действие на физиологические функции и процессы обмена веществ в организме человека. Пробиотики, попадая в кишечник, нормализуют микробный баланс, подавляя патогенные микроорганизмы и восстанавливая качественный и количественный состав микрофлоры. К сожалению, через достаточно короткий промежуток времени они погибают, и состав микрофлоры снова меняется в худшую сторону, а патогенные микроорганизмы размножаются, разрушая микрофлору. Именно поэтому в синбиотике, помимо пробиотиков, содержатся пребиотики, которые служат питательной средой, энергетическим ресурсом и одновременно средством защиты пробиотиков от внешней среды, что увеличивает продолжительность их жизни и активность. Благодаря пребиотику полезные бактерии (пробиотики), входящие в состав препарата Бифитен, обеспечены питанием, помогающим им размножаться и нормализовать баланс микрофлоры кишечника.
Продуктами жизнедеятельности (метаболитами) находящихся в препарате Бифитен бифидобактерий (Bifidobacterium bifidum, breve, longum) являются молочная, уксусная, муравьиная и янтарная кислоты, аминокислоты и белки, витамины В1, В2, К, никотиновая, пантотеновая и фолиевая кислоты, пиридоксин, цианокобаламин, которые всасываются в кишечнике и используются макроорганизмом. Они способствуют всасыванию ионов кальция, железа, витамина D, угнетают рост патогенной микрофлоры, поддерживают процессы пристеночного пищеварения, способствуют уменьшению pН питательной массы в толстом кишечнике, а также могут снижать степень развития канцерогенеза, обусловленного болезнетворной микрофлорой.
Лактобактерии (Lactobacillus plantarum, casei, rhamnosus, helveticus и Lactococcus lactis) продуцируют молочную кислоту, спирт, лизоцим, перекись водорода, интерфероны, усиливают рост бифидобактерий. Выделяя вещества с естественными антибактериальными свойствами, препятствуют избыточному размножению ряда бактерий, периодически поступающих в кишечник с пищей или относящихся к категории сопутствующей флоры и способных вызвать развитие инфекции в случае снижения защитных сил (резистентности) макроорганизма. Они могут подавлять разложение гнилостных и гноеродных бактерий, продуктами жизнедеятельности которых являются сильнодействующие отравляющие вещества: аммиак, амины, фенол, индол, скатол. Эти вещества переносятся в кровь, и их обезвреживание оказывает большую нагрузку на печень.
Входящий в состав препарата Бифитен стрептококк термофильный (лат. Streptococcus thermophilus; также называемый Streptococcus salivarius thermophilus или Streptococcus salivarius subsp. thermophilus) — вид грамположительных факультативно анаэробных бактерий. Относится к группе молочнокислых бактерий, сбраживающих углеводы с образованием молочной кислоты. Поглощает и перерабатывает лактозу (молочный сахар), поэтому применяется при лактазной недостаточности, оказывает подкисляющее действие, обеспечивая бактерицидный эффект в отношении патогенных микроорганизмов, а также способен синтезировать и выделять полисахариды. Расщепляет казеин, окисляет нитраты до нитритов.
Нужно не забывать, что эпителиальная (выстилающая) поверхность кишечника, заселенная микробами-симбионтами, рассматривается как «колыбель» иммунной системы.
Именно благодаря такой комбинации бактерий, такому симбиозу микроорганизмов в пробиотике Бифитен он имеет повышенную эффективность в сравнении с продуктами, в состав которых входит один вид бактерий.
Важной особенностью препарата Бифитен является кислотоустойчивость капсулы, что достигнуто благодаря технологии MURE (Multi Resistant Encapsulation). MURE — это инновационная запатентованная технология инкапсуляции. При производстве капсулы используется специальное покрытие, которое защищает содержимое капсул препарата Бифитен, сохраняет их жизнеспособность даже при воздействии агрессивных факторов внешней и внутренней среды. Инкапсуляция увеличивает выживаемость бактерий в желудочно-кишечном тракте благодаря тому, что входящие в Бифитен лакто- и бифидобактерии не подвержены воздействию кислоты желудочного сока, солей желчных кислот и ферментов поджелудочной железы и оказывают свое влияние непосредственно в очаге нарушения микрофлоры кишечника. Это способствует их лучшей адаптации (колонизации — пролиферации) в кишечнике, что гарантирует высокую биологическую активность и эффективность живых штаммов бактерий, содержащихся в препарате Бифитен. Благодаря этой технологии Бифитен можно хранить без использования холодильника.
Эффективность технологии MURE, которая применяется при производстве препарата Бифитен, была подтверждена в исследовании «In vitro comparative study of stability and disintegration of capsules produced with the use of the MURE technology versus other probiotic capsules, in simulated gastric environment» («Сравнительное исследование устойчивости капсул, произведенных с использованием MURE технологии, и других пробиотических капсул, в условиях, повторяющих кислую среду желудка»), автор Jacek Piątek, MD, PhD, Chair of Human Physiology of the Korol Marcinkowski Medical University (Poznań, Poland). Цель исследования — проверить выживаемость бактерий в ряде пробиотических препаратов, присутствующих на рынке, в условиях моделирования среды желудочного сока в зависимости от технологии приготовления капсул.
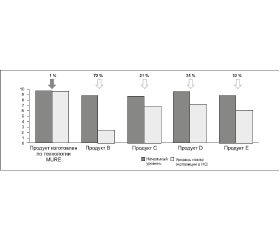
Был исследован пробиотик в капсулах MURE (в Украине называется Бифитен) и 4 других пробиотика, представленных на польском рынке, после 1 ч воздействия 0,1М раствором HCl с рН 1,2. Установлено, что активность бактерий, находящихся в пробиотике, изготовленном с применением технологии MURE, снижалась всего на 1 %, в то время как в других — на 72, 21, 25 и 32 % соответственно, что показано на рис. 1.
По результатам исследования продемонстрирована лучшая выживаемость микроорганизмов, содержащихся в продукте, изготовленном по технологии MURE, по сравнению с другими имеющимися на рынке продуктами. Перечисленные особенности позволяют выделить Бифитен в ряду пробиотиков для коррекции дисбактериоза кишечника различного происхождения.
Таким образом, даже обоснованное использование антибиотиков может привести к развитию серьезного дисбактериоза кишечника, в то время как совместное применение с пробиотиками позволяет снизить риск ассоциированного с антибиотиками дисбактериоза или уменьшить его тяжесть. В случае развития антибиотик-ассоциированного дисбактериоза кишечника у детей показано назначение пробиотиков, эффект которых может быть усилен энтеросорбентами. Развитие C.difficile-ассоциированного колита требует особой терапевтической тактики, включающей применение специфических антибактериальных препаратов, но также не исключающей пробиотики.
/28.jpg)

/29.jpg)