Международный неврологический журнал 5 (75) 2015
Вернуться к номеру
Ефективність застосування препарату Нуклео Ц.М.Ф. Форте у комплексному лікуванні хворих на розсіяний склероз
Авторы: Мяловицька О.А., Карнаух Ю.Д. - Національний медичний університет ім. О.О. Богомольця; Міська клінічна лікарня № 4, м. Київ
Рубрики: Неврология
Разделы: Справочник специалиста
Версия для печати
В роботі наведені дані клініко-неврологічного та електронейроміографічного обстеження 30 хворих на розсіяний склероз та оцінка терапевтичної ефективності препарату Нуклео Ц.М.Ф. Форте в комплексному лікуванні хворих на розсіяний склероз.
В работе приведены данные клинико-неврологического и электронейромиографического обследования 30 больных рассеянным склерозом и оценка терапевтической эффективности препарата Нуклео Ц.М.Ф. Форте в комплексном лечении больных рассеянным склерозом.
The article presents the data of clinical-neurological and electroneuromyography examination of 30 patients with multiple sclerosis and evaluation of therapeutic efficacy of Nucleo C.M.P. Forte in the comprehensive treatment of patients with multiple sclerosis.
розсіяний склероз, Нуклео Ц.М.Ф. Форте, електронейроміографія.
рассеянный склероз, Нуклео Ц.М.Ф. Форте, электронейромиография.
multiple sclerosis, Nucleo C.M.P. Forte, electroneuromyography.
Статья опубликована на с. 151-156
Серед захворювань нервової системи розсіяний склероз (РС) з його мінливим перебігом посідає одне з провідних місць за поширеністю та становить особливу складність щодо можливостей терапії. Незважаючи на те, що дослідження РС тривають понад півтора століття, проблема РС й досі залишається актуальною [1]. У всьому світі нараховується понад три мільйони хворих на РС. Тенденція до значного збільшення поширеності захворювання зберігається у різних регіонах Європи та Америки. Упродовж останніх 70 років вона збільшилась у 5 разів [2]. Підвищилась поширеність не лише в історично сформованих зонах Північного та Західного регіонів, але й у Центральному, Східному та Південному регіонах [3]. Викликає стурбованість зростання захворюваності серед осіб молодого віку, що спричиняє їх ранню інвалідизацію у найбільш працездатному віці [5].
Значення автоімунних та імунопатологічних реакцій у патогенезі РС у наш час не викликає сумнівів. Загальноприйнятою залишається думка, що РС є багатофакторним захворюванням, в ініціюванні і розвитку якого беруть участь вірусна інфекція, генетична схильність, що реалізується полігенною системою, яка відповідає за формування імунної відповіді та певного виду метаболізму, а також географічні фактори [10].
Основним патофізіологічним механізмом РС є демієлінізація. Спільною рисою для всіх типів демієлінізації є розвиток запальних реакцій різного ступеня вираженості за участю активованих Т-клітин, макрофагів та мікроглії, що підтверджує ключову роль імунопатологічних реакцій в ініціації та розвитку демієлінізуючого процесу. Основними факторами ураження у цих хворих є прозапальні цитокіни та активні форми кисню, що продукуються макрофагами, мікроглією [12].
За висновками дослідників, аксональне пошкодження зустрічається на різних етапах демієлінізуючого процесу, як у гострих і хронічних активних вогнищах, так і у незміненій білій речовині. При цьому на ранніх етапах захворювання спостерігається так зване аксональне розщеплення, тоді як на пізніх — дегенерація Тюрка — Валлера. Одним із ранніх маркерів аксонального пошкодження є імуногістохімічна ідентифікація в гострих бляшках РС амілоїдного попередника протеїну [13].
У периферичній нервовій системі (ПНС) процес руйнування мієліну розвивається через автоімунний процес, індуктором якого є реакція макрофагів на мієлінасоційований глікопротеїн. Найбільш виражена деструкція мієліну виникає в ділянках перехватів Ранв’є та насічок Шмідта — Лантермана. В тих же ділянках виникає і найбільш виражена деструкція аксонів [14].
З огляду на складність патогенезу РС його лікування залишається однією з найбільш складних проблем клінічної неврології. Це спонукає невропатологів до постійного пошуку нових шляхів терапії РС, що сприяло б зменшенню вираженості клінічної симптоматики та запобіганню прогресуючому перебігу захворю- вання.
Комплексна терапія хворих на РС з ураженням ПНС повинна включати як патогенетичні засоби лікування РС, що сприяють зниженню гостроти процесу, відновленню неврологічних функцій, так і симптоматичні засоби.
У літературі існують дані щодо застосування в неврологічній практиці препарату Нуклео Ц.М.Ф. Форте, який завдяки специфічним нуклеотидам — цитидину монофосфату й уридину монофосфату — має здатність підвищувати щільність нервових волокон, збільшуючи діаметр периферичних нервових волокон та покращуючи їх провідність [9]. Завдяки поєднанню цитидину монофосфату та уридину трифосфату цей препарат забезпечує фосфатні групи, необхідні для об’єднання моносахаридів із церамідами для утворення цереброзидів і фосфатидних кислот, які є основою сфінгомієліну та гліцерофосфоліпідів, що сприяє відновленню мієлінової оболонки, компонентами якої є фосфоліпіди та гліколіпіди, відновленню проведення нервового імпульсу, зменшенню запалення, болю та парестезій, підвищенню щільності та провідності нервового волокна. Отже, Нуклео Ц.М.Ф. Форте виявляє трофічні властивості та сприяє регенерації аксонів нервової тканини [9].
Експериментальні дослідження засвідчили чітке підвищення потреби в піримідинових нуклеотидах при ураженнях периферичних нервів [15], а також той факт, що застосування нуклеотидів уридину монофосфату й цитидину монофосфату значно прискорює регенерацію нервових шляхів після травматичного руйнування тканини [14, 16]. Встановлено, що застосування піримідинових нуклеотидів впливає на синтез нуклеїнової кислоти і мієлінових оболонок, а також на метаболічні шляхи, які продукують енергію. Нервові клітини не здатні синтезувати ці нуклеотиди, оскільки для них не вистачає відповідних запасів ферментів [1].
Матеріали та методи
На базі Центру з вивчення розсіяного склерозу м. Києва (міської клінічної лікарні № 4) проведено клініко-неврологічне та електронейроміографічне обстеження 30 хворих на розсіяний склероз (14 чоловіків, 16 жінок) віком від 25 років до 55 років.
Усі хворі мали вірогідний діагноз РС за критеріями Мак-Дональда [McDonald et al., 2010] [8]. Ступінь тяжкості хворих оцінювався за шкалою EDSS, ступінь тяжкості ураження периферичної нервової системи — за шкалою NRS. Одинадцять пацієнтів мали ремітуючо-прогредієнтний перебіг (36,6 %), 14 — ремітуючий перебіг (46,6 %), 5 — вторинно-прогредієнтний перебіг розсіяного склерозу (16,6 %). За шкалою EDSS 13 (43,3 %) хворих мали оцінку 3,5–4,5 бала, 14 (46,6 %) хворих — 5,0–6,5 бала, 3 (10 %) пацієнти — 7–8 балів.
Всі хворі розподілені на основну та контрольну групи: відповідно 20 та 10 хворих.
Основну групу становили 10 чоловіків та 10 жінок, серед них 10 хворих за шкалою EDSS мали оцінку 3,5–4,5 бала, 8 хворих — 5,0–6,5 бала, 2 хворі — 7–8 балів. Ремітуючий перебіг захворювання діагностований у 12 хворих, ремітуючо-прогредієнтний — в 5, вторинно-прогредієнтний у 3 випадках. В основній групі хворі отримували препарат Нуклео Ц.М.Ф. Форте в ін’єкціях (6 внутрішньом’язових щоденно) та перорально (по 1 капсулі 3 рази на добу), крім базисної терапії (антиагреганти, нейропротектори, вітаміни групи В, Е, ноотропи).
Контрольну групу становили 4 чоловіки та 6 жінок, серед них 3 хворі за шкалою EDSS мали оцінку 3,5–4,5 бала, 6 хворих — 5,0–6,5 бала, 1 хворий — 7 балів. Ремітуючий перебіг захворювання зареєстрований у 2 хворих, ремітуючо-прогредієнтний — в 6, вторинно-прогредієнтний — у 2 випадках. У контрольній групі хворі отримували базисну терапію.
У процесі дослідження на 1, 6 та 36-й день визначались артеріальний тиск, артеріальний пульс, проводили оцінку неврологічного статусу, оцінку за шкалами EDSS, NRS, переносимості лікування. У 1-й та 36-й дні проводились загальний клінічний аналіз крові, стимуляційна електронейроміографія.
Лікування здійснювалося під контролем динамічного спостереження за загальним станом хворого.
Лікування препаратом Нуклео Ц.М.Ф. Форте свідчило про значне відновлення неврологічних функцій у 20 % хворих за шкалою NRS, помірне відновлення — у 25 %, незначне відновлення — у 50 %, відсутність ефекту — у 5 %, погіршення стану не зафіксовано.
Результати клінічного обстеження свідчили про більш позитивну динаміку неврологічних змін у пацієнтів, які отримували даний препарат, порівняно з конт-рольною групою. Результати клініко-неврологічного обстеження хворих обох груп до та після лікування препаратами піримідинових нуклеотидів наведено в табл. 1.
У контрольній групі зареєстровано незначне відновлення неврологічних функцій за шкалою NRS у 60 % хворих, помірне відновлення — у 20 %, значне відновлення — у 10 %, відсутність ефекту — у 10 %, погіршення стану не зафіксовано.
В основній групі гіперрефлексія спостерігалась у 14 хворих, зменшилась у 6, зникла у 5, залишилась у 3 хворих. Анізорефлексія відзначалась у 18 хворих, зменшилась у 8, залишилась у 5 хворих, зникла у 5 хворих. Гіпорефлексія спостерігалась у 6 хворих, зменшилась у 2, зникла у 2, залишилась у 2 хворих. Арефлексія відзначалась в 1 випадку, після лікування зменшилась. Клонуси стоп спостерігались у 7 хворих, зменшились у 3, зникли в 1, залишились у 3 хворих.
У контрольній групі гіперрефлексія спостерігалась у 10 хворих, зменшилась у 4, залишилась у 6 хворих. Анізорефлексія спостерігалась у 12 хворих, зменшилась у 4, зникла в 1, залишилась у 7 хворих. Гіпорефлексія спостерігалась у 5 хворих, зменшилась у 2, зникла в 1, залишилась у 2 хворих. Арефлексія не спостерігалась. Клонуси стоп спостерігались в 11 хворих, зменшились у 4, залишились у 6 хворих, зникли в 1 хворого.
До лікування в основній групі центральний тетрапарез спостерігався у 2 хворих, трипарез — у 3 хворих, геміпарез — в 11 хворих, периферичний парез — у 4 хворих. Після лікування центральний тетрапарез зменшився в 1 хворого, не змінився в 1 хворого; трипарез зменшився у 2 хворих, в 1 не змінився; геміпарез зник у 5 хворих, зменшився у 4, не змінився у 2 хворих; периферичний парез зменшився у 2, зник у 2 хворих.
У контрольній групі центральний тетрапарез спостерігався у 3 хворих, трипарез — у 3 хворих, геміпарез — у 4 хворих, периферичний парез не спостерігався. Після лікування центральний тетрапарез зменшився в 1 хворого, не змінився у 2 хворих; трипарез зменшився в 1 хворого, у 2 не змінився; геміпарез зменшився в 1, не змінився у 3 хворих.
Патологічні стопні розгинальні рефлекси в основній групі спостерігались у 7 хворих, зменшились у 5, залишились у 2 хворих. Патологічні стопні згинальні рефлекси та патологічні кистьові рефлекси не спостерігались. У 2 хворих спостерігалось зниження підошовних рефлексів, причому після лікування в 1 випадку підошовні рефлекси відновились, в 1 підвищились.
У контрольній групі патологічні стопні розгинальні рефлекси спостерігались в 11 хворих, зменшились у 2, залишились у 8 хворих, зникли в 1 хворого. Патологічні стопні згинальні рефлекси та патологічні кистьові рефлекси спостерігались в 1 хворого, після лікування не змінились. Зниження підошовних рефлексів не спостерігалось.
Зниження м’язового тонусу в основній групі спостерігалось у 2 хворих, після лікування регресувало. Підвищення м’язового тонусу в основній групі спостерігалось у 8 хворих, після лікування зникло в 1, зменшилось у 4, залишилось у 3 хворих.
У контрольній групі зниження м’язового тонусу не спостерігалось. Підвищення м’язового тонусу в конт-рольній групі спостерігалось у 4 хворих, після лікування зменшилось у 2, залишилось у 2 хворих.
Під впливом проведеного лікування спостерігалося покращення неврологічної симптоматики з боку рефлекторної сфери. Сухожильні та періостальні рефлекси регресували дуже повільно, особливо це було виражено з боку ахіллових рефлексів. Однак і до проведеного лікування у 8 (40,0 %) хворих основної групи та 4 хворих контрольної групи (40,0 %) ахіллові рефлекси були вже зниженими.
Вібраційна чутливість в основній групі порушена у 20 хворих (100 %), після лікування не змінилась у 7, поліпшилась у 12, відновилась в 1 хворого. В контрольній групі вібраційна чутливість порушена у 10 хворих (100 %), після лікування не змінилась у 8, поліпшилась у 2 хворих.
Розлади поверхневої чутливості за провідниковим типом в основній групі діагностовані у 15 хворих, після лікування зменшилась гіпестезія в 11 хворих, зникла в 1, залишилась у 3 хворих. У контрольній групі розлади поверхневої чутливості за провідниковим типом в основній групі діагностовані у 9 хворих, після лікування зменшилась гіпестезія у 6 хворих, залишилась у 3 хворих.
В обстежених хворих відзначалися гіпералгезія, алодинія та гіперпатія переважно в дистальних відділах кінцівок, що в процесі лікування поступово зменшувалися.
У 20 (100 %) хворих основної групи до лікування спостерігалися зміни м’язово-суглобового відчуття, після лікування відзначалося зменшення проявів у 5 (25,0 %) хворих, зникнення в 1 (5,0 %) та залишилися без змін у 14 (70,0 %); у контрольній групі до лікування відзначалося у 10 (100 %), після лікування зменшення проявів — в 1 (10,0 %) хворого, без змін — у 9 (90,0 %) хворих. Після проведеної терапії в обстежених хворих спостерігалося зменшення болючості нервових стовбурів при пальпації.
Під впливом проведеної комплексної терапії в обстежених хворих відзначено регрес порушень з боку черепно-мозкових нервів: зменшення центрального парезу м’язів обличчя та язика — у 5 (25,0 %) хворих основної групи та у 2 (10,0 %) хворих контрольної групи. Зниження конвергенції та акомодації до лікування відзначалося у 15 (75,0 %) хворих основної групи, після терапії зменшення проявів відзначено у 9 (45,0 %), зникнення — в 1 (5,0 %), без змін — у 5 (25,0 %); у контрольній групі до лікування — у 9 (90,0 ), після спостерігалося зменшення проявів у 4 (40,0 %), зникнення — в 1 (10,0 %) та без змін — у 4 (40,0 %).
При первинному неврологічному дослідженні у 17 (85,0 %) хворих основної групи та 8 (80,0 %) хворих контрольної групи спостерігався середньоамплітудний горизонтальний ністагм. Так, після проведеної терапії у пацієнтів основної групи відзначено зменшення проявів у 14 (70,0 %), зникнення — у 3 (15,0 %); у 2-й групі зменшення проявів — у 7 (70,0 %), зникнення — в 1 (10,0 %).
Проведене комплексне лікування хворих сприяло зменшенню координаторних порушень. Так, на початку терапії атаксія в позі Ромберга була визначена в 11 (55,0 %) хворих основної групи та у 8 (80,0 %) хворих контрольної групи, а промахування при виконанні пальце-носової та колінно-п’яткової проб — відповідно у 10 (50,0 %) та 7 (70,0 %), після лікування спостерігалася значна позитивна динаміка. В основній групі промахування зменшилось у 5, зникло у 2, залишилось у 3 хворих. У контрольній групі промахування зменшилось у 2, залишилось у 5 хворих. Атаксія в позі Ромберга в основній групі зменшилась у 6, зникла у 2, залишилась у 3 хворих; у контрольній групі — зменшилась у 2, залишилась у 5 хворих. Також спостерігалося покращення інтелектуально-мнестичної функції у 5 (25,0 %) хворих основної групи та у 4 (40,0 %) хворих контрольної групи.
Інтенційний тремор в основній групі спостерігався у 6 (30 %) хворих, після лікування зменшився у 3, зник в 1, залишився у 2 хворих. У контрольній групі інтенційний тремор спостерігався у 6 (60 %) хворих, після лікування зменшився у 2, залишився у 4 хворих.
Скандоване мовлення в основній групі виявлене у 3 (15 %) хворих, після проведення курсу лікування в одному випадку мовлення поліпшилось, у другому не змінилось. У контрольній групі скандоване мовлення виявлене в 1 (10 %) хворого, після лікування — не змінилось.
Порушення ходи за типом атактичної спостерігалось в 1 хворого контрольної групи, після лікування зменшилось.
Порушення сечовипускання в основній групі за типом імперативних позивів спостерігалось у 6 хворих, зменшилось у 3, зникло в 1 хворого, залишилось у 2 хворих. У контрольній групі порушення сечовипускання за типом імперативних позивів спостерігалось у 2 хворих, зменшилось в 1, залишилось в 1 хворого.
Порушення сечовипускання в основній групі за типом періодичного нетримання сечі виявлено у 6 хворих, після проведення курсу лікування залишилось у 3, зменшилось у 2, зникло в 1 хворого. Порушення сечовипускання в контрольній групі за типом періодичного нетримання сечі виявлено у 6 хворих, після проведення курсу лікування залишилось у 4, зменшилось у 2 хворих.
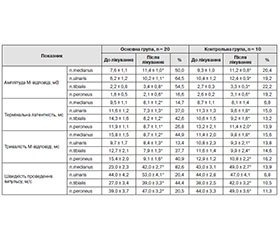
Результати електронейроміографічного обстеження хворих обох груп до та після лікування препаратами піримідинових нуклеотидів наведено в табл. 2.
Після використання препарату піримідинових нуклеотидів Нуклео Ц.М.Ф. Форте в основній групі в середньому амплітуда М-відповіді збільшилась на 46,4 ± 3,1 %, термінальна латентність зменшилась на 30,3 ± 2,7 %, тривалість М-відповіді зменшилась на 34,2 ± 4,2 %, швидкість проведення імпульсу збільшилась на 41,9 ± 3,4 %. Так, по n. medianus амплітуда М-відповіді в основній групі до лікування становила 7,6 ± 1,1 мВ, після лікування збільшилась до 11,4 ± 1,0 мВ, по n. ulnaris становила 6,2 ± 1,2 мВ, після лікування збільшилась до 10,2 ± 1,1 мВ, по n. tibialis становила 2,2 ± 0,8 мВ, після лікування збільшилась до 3,4 ± 0,8 мВ, по n. peroneus становила 1,8 ± 0,5 мВ, збільшилась до 2,1 ± 0,6 мВ. Термінальна латентність по n. medianus становила до лікування 9,5 ± 1,1 мс, зменшилась до 8,1 ± 1,2 мс, по n. ulnaris до лікування була 11,6 ± 1,2 мс, зменшилась до 7,3 ± 1,3 мс, по n. tibialis до лікування становила 14,3 ± 1,6 мс, зменшилась до 8,2 ± 1,2 мс, по n. peroneus до лікування була 11,9 ± 1,1 мс, зменшилась до 8,7 ± 1,1 мс. Тривалість М-відповіді по n. medianus становила до лікування 15,8 ± 1,5 мс, зменшилась до 8,7 ± 1,2 мс, по n. ulnaris була до лікування 9,7 ± 1,7 мс, зменшилась до 8,4 ± 1,3 мс, по n. tibialis становила до лікування 12,7 ± 2,1 мс, зменшилась до 7,9 ± 1,3 мс, по n. peroneus була до лікування 15,4 ± 2,0 мс, зменшилась до 9,1 ± 1,6 мс. Швидкість проведення імпульсу по n. medianus до лікування — 23,0 ± 2,3 м/с, після лікування збільшилась до 42,0 ± 2,7 м/с, по n. ulnaris до лікування — 44,0 ± 4,2 м/с, після лікування збільшилась до 53,0 ± ± 4,1 м/с, по n. tibialis до лікування — 27,0 ± 3,4 м/с, після лікування збільшилась до 39,0 ± 3,3 м/с, по n. peroneus до лікування — 39,0 ± 3,7 м/с, після лікування збільшилась до 47,0 ± 3,2 м/с.
У контрольній групі в середньому амплітуда М-відповіді збільшилась на 20,2 ± 1,3 %, термінальна латентність зменшилась на 12,2 ± 1,6 %, тривалість М-відповіді зменшилась на 15,0 ± 1,4 %, швидкість проведення імпульсу збільшилась на 10,6 ± 2,2 %. Так, по n. medianus амплітуда М-відповіді в контрольній групі до лікування становила 9,3 ± 1,0 мВ, після лікування збільшилась до 11,2 ± 0,8 мВ, по n. ulnaris — 10,4 ± ± 1,2 мВ, після лікування збільшилась до 12,4 ± 0,9 мВ, по n. tibialis — 2,7 ± 0,3 мВ, після лікування збільшилась до 3,3 ± 0,3 мВ, по n. peroneus — 2,6 ± 0,2 мВ, після лікування збільшилась до 3,1 ± 0,6 мВ. Тривалість М-відповіді по n. medianus становила до лікування 11,4 ± 1,1 мс, зменшилась до 9,8 ± 1,4 мс, по n. ulnaris до лікування — 10,8 ± 1,3 мс, зменшилась до 9,3 ± 1,8 мс, по n. tibialis до лікування — 11,6 ± 1,5 мс, зменшилась до 9,9 ± 1,8 мс, по n. peroneus до лікування — 12,9 ± 2,1 мс, зменшилась до 9,8 ± 2,0 мс. Термінальна латентність по n. medianus становила 8,7 ± 2,0 мс до лікування, зменшилась до 8,1 ± 1,8 мс, по n. ulnaris — 11,3 ± 2,3 мс до лікування, зменшилась до 9,6 ± 2,1 мс, по n. tibialis — до лікування 10,6 ± 1,4 мс, зменшилась до 9,2 ± 2,4 мс, по n. peroneus — до лікування 13,2 ± 1,2 мс, зменшилась до 11,4 ± 2,2 мс. Швидкість проведення імпульсу по n. medianus до лікування становила 45,0 ± 3,1 м/с, після лікування збільшилась до 49,0 ± 2,7 м/с, по n. ulnaris до лікування — 47,0 ± 2,8 м/с, після лікування збільшилась до 49,0 ± 4,1 м/с, по n. tibialis до лікування — 38,0 ± ± 2,5 м/с, після лікування збільшилась до 43,0 ± 3,2 м/с, по n. peroneus до лікування — 42,0 ± 3,3 м/с, після лікування збільшилась до 47,0 ± 3,6 м/с.
Проведені електроміографічні дослідження показали більш значне відновлення функціонального стану нервових волокон, що спостерігалося в основній групі, завдяки призначенню препарату нуклеотидів.
Дані, наведені у табл. 1 і 2, свідчать про те, як змінювалась тяжкість стану хворих під впливом лікування. Результати клінічного та електронейроміографічного обстеження говорять про більш позитивну динаміку неврологічних змін у пацієнтів, які отримували препарат Нуклео Ц.М.Ф. Форте, порівняно з контрольною групою.
Таким чином, більш вірогідні відмінності в динаміці лікування відзначалися у хворих основної клінічної групи порівняно з показниками у пацієнтів контрольної групи, про що свідчать дані за неврологічною шкалою NRS.
У пацієнтів обох клінічних груп під час лікування спостерігалась добра переносимість лікування та відсутність побічних ефектів. Перед початком курсу лікування хворому подавали загальні відомості про цей метод, пояснювали його сприятливий вплив і нешкідливість.
Висновки
Таким чином, за результатами проведеного дослідження отримано вірогідні відмінності клінічних даних хворих (р < 0,05). Ці відмінності більш виражені у пацієнтів основної групи, які отри- мували комплексне лікування з призначенням препарату –Нуклео Ц.М.Ф. Форте. Застосування препарату –Нуклео Ц.М.Ф. Форте є безпечним, оскільки побічних ефектів та випадків непереносимості не зафіксовано. Відповідно до цього рекомендовано включити препарати нуклеотидів, а саме Нуклео Ц.М.Ф. Форте, до схеми комплексного лікування у хворих на розсіяний склероз.
1. Віничук С.М., Мяловицька О.А. Розсіяний склероз // Навчальний посібник. — К., 2001. — С. 12-13.
2. Віничук С.М. Розсіяний склероз. Діагностика та лікування проявів втоми / С.М. Віничук, О.О. Копчак. — К.: Наукова думка, 2007. — 135 с.
3. Віничук С.М. Поширеність розсіяного склерозу в різних регіонах України. Особливості перебігу та лікування / С.М. Віничук, П.П. Уніч, В.В. Клименко, М.М. Прокопів // Український медичний часопис. — 2000. — № 6(20). — С. 51-54.
4. Мяловицька О.А. Оцінка терапевтичної ефективності препарату Нуклео Ц.М.Ф. Форте у лікуванні уражень периферичної нервової системи у хворих на розсіяний склероз / О.А. Мяловицька, Ю.Д. Карнаух // Ліки України. — 2008. — № 8(124). — С. 92-97.
5. Столяров И.Д. Нейропсихологические нарушения при рассеянном склерозе / И.Д. Столяров, Б.А. Осетров // Рассеянный склероз. — СПб., 2002. — С. 66-76.
6. Нуклео Ц.М.Ф. Форте. Монографія Фермер Інтернаціонал С.А. Гран ВІА Карлос, 9406028 Барселона, Іспанія.
7. Одинак М.М. Новые подходы к антиоксидантной терапии при рассеянном склерозе / М.М. Одинак, Г.Н. Бисага, И.В. Зарубина // Журнал невропат. и психиатр. им. С.С. Корсакова. — 2002. — Т. 1. — С. 72-75.
8. Рассеянный склероз: клинические аспекты и спорные вопросы / Под ред. А. Томпсона, К. Полмана, З. Хольфельда: Пер. с англ. — СПб.: Политехника, 2001.
9. Шамич Л.Ф. Сучасні аспекти клініко-інструментальної діагностики та комплексного лікування хворих на алкогольну полінейропатію / Л.Ф. Шамич // Практична медицина. — 2002. — № 3. — С. 130-135.
10. Bitsch A. Tumour necrosis factor alfa mRNA expression in early multiple sclerosis lesion: correlation with demyelinating activity and oligodendrocyte pathology / [A. Bitsch, T. Kuhlmann, C. Da Costa et al.] // Glia. — 2000. — Vol. 29. — P. 366-375.
11. Cameron N.E. Potential therapeutic approaches to the treatment or prevention of diabetic neuropathy: evidence from experimental studies / N.E. Cameron, M.A. Cotter // Diabet. Med. — 1993. — Vol. 10. — Р. 593-605.
12. Feasby T.E. Central lesion in chronic inflammatory demyelinating polyneuropathy: in MRY study / [T.E. Feasby, A.F. Hahn, W.J. Koopman et al.] // J. Neurology. — 1990. — Vol. 40. — P. 476-478.
13. Good J.L., Chechrenama M., Mayer R.F., Koski C.L. Pulse cyclophosphamide therapy in chronic inflammatory demyelinating polyneuropathy // Neurology. — 1998 Dec. — Vol. 51(6). — P. 1735-8 [Medline].
14. Hedding-Eckering M. Therapie peripherer Nerveni sionen mit Pyrimidinnukleotiden // Allgemeinarzt. — 2001. — Vol. 223. — P. 1184-1187.
15. Waksman B.N. Allergic neuritis: An experimental disease of rabbits induced by the injection of peripheral nervous tissue and adjuvants / B.N. Waksman, R.D. Adams // J. Exp. Med. — 1995. — Vol. 102, № 5. — P. 213-235.
16. Wood D.D. Acute multiple sclerosis (Marburg Type) is assocsated with developmentally immature myelin basic protein / D.D. Wood, J.M. Bilbao, P. O'Connors, M.A. Moscarello // Ann. Neurol. — 1996. — Vol. 40. — P. 18-24.

/152.jpg)
/155.jpg)