Международный неврологический журнал 5 (75) 2015
Вернуться к номеру
Новые возможности мультимодальной фармакотерапии острого периода ишемического инсульта
Авторы: Дзяк Л.А., Зозуля О.А., Клигуненко Е.Н., Кущ Е.А. - ГУ «Днепропетровская медицинская академия МЗ Украины»
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
Статья посвящена одной из наиболее актуальных проблем неврологии — ишемическим инсультам. Среди препаратов, уменьшающих частоту и тяжесть постинсультных проявлений, все большее внимание привлекает амантадин. Данный препарат, благодаря способности активно стимулировать выделение дофамина из нейрональных депо, увеличивать чувствительность дофаминергических рецепторов к нейромедиатору при параллельной стабилизации специфических глутаматергических рецепторов, прерывает нарастание выброса глутамата, чем подавляет глутаматную эксайтотоксичность. Это способствует сокращению зоны пенумбры, уменьшает сопутствующий ишемии и гипоксии нейромедиаторный дисбаланс, снижает энергетическую, белковую, электролитную дисрегуляцию, то есть оказывает прямое церебропротективное действие. Приведены данные исследования влияния амантадина сульфата в инфузионной и таблетированной формах выпуска (ПК-Мерц) на динамику неврологического дефицита и функциональное состояние больных в остром периоде ишемического инсульта.
Стаття присвячена одній з найбільш актуальних проблем неврології — ішемічному інсульту. Серед препаратів, що зменшують частоту і тяжкість постінсультних проявів, все більшу увагу привертає амантадин. Даний препарат, завдяки здатності активно стимулювати виділення дофаміну з нейрональних депо, збільшувати чутливість дофамінергічних рецепторів до нейромедіатора при паралельній стабілізації специфічних глутаматергічних рецепторів, перериває наростання викиду глутамату і цим пригнічує глутаматну ексайтотоксичність. Це сприяє скороченню зони пенумбри, зменшує супутні ішемію і гіпоксію, нейромедіаторний дисбаланс, знижує енергетичну, білкову, електролітну дизрегуляцію, тобто справляє пряму церебропротективну дію. Наведено дані дослідження впливу амантадину сульфату в інфузійній і таблетованій формах випуску (ПК-Мерц) на динаміку неврологічного дефіциту і функціональний стан хворих у гострому періоді ішемічного інсульту.
The article deals with one of the most urgent problems of neurology — ischemic strokes. Among drugs that reduce the incidence and severity of post-stroke symptoms, increasing attention is attracted by amantadine. This preparation, due to the ability to actively stimulate dopamine release from neural pool, to increase the sensitivity of dopaminergic receptors to neurotransmitters in parallel stabilization of specific glutamatergic receptors, interrupts the increase in glutamate release that suppresses glutamate excitotoxicity. This helps to reduce the penumbra zone, reduces neurotransmitter imbalance associated with ischemia and hypoxia, reduces energy, protein, electrolyte dysregulation, that is having a direct cerebroprotective effect. The data of studies on the effect of amantadine sulfate in infusion and tablet dosage form (PK-Merz) on the dynamics of neurological deficit and functional status of patients with acute ischemic stroke are presented.
ишемический инсульт, пенумбра, церебропротекция, амантадина сульфат.
ішемічний інсульт, пенумбра, церебропротекція, амантадину сульфат.
ischemic stroke, penumbra, сerebroprotection, amantadine sulfate.
Статья опубликована на с. 39-44
Инсульт — одна из ведущих причин смерти среди взрослых [1]. Ежегодно в мире от инсульта умирает больше людей, чем от СПИДа, туберкулеза и малярии, вместе взятых [2]. В 2005 году мировая заболеваемость инсультом составила 16 млн случаев, и ожидается, что к 2030 году она достигнет 23 млн случаев в год. Это связано с постарением населения и экспоненциальным ростом заболеваемости вследствие удвоения ее с каждым десятилетием после 55 лет [3]. Так, если среди лиц моложе 45 лет частота инсульта составляет 0,1–0,3 на 1000 человек в год, то у лиц старше 75 лет она достигает 12–20 случаев на 1000 человек в год [4–6].
Вместе с тем инсульт выступает ведущей причиной серьезной утраты функциональной состоятельности без скидок на возраст, пол, этническое происхождение или страну [7]. И если геморрагическая трансформация и отек головного мозга приводят к смерти в течение первой недели заболевания, то пневмонии, инфекции различной локализации, тромбоэмболические осложнения усугубляют течение отдаленных медицинских осложнений инсульта, которые проявляются развитием тревоги (14 %), депрессии (16 %), когнитивных нарушений (56 %), повторного инсульта (9 %), эпилептических припадков (3 %) и потенциально могут быть предотвращены [8, 9]. Считается [10, 11], что применение превентивных мультимодальных стратегий, направленных на улучшение восстановления после инсульта, является наиболее перспективным. Среди них — ранняя физическая активность и фармакотерапия. Последняя может быть направлена на поврежденные нейроны, глиальные клетки, сосуды, на повышение содержания нейромедиаторов: серотонина, дофамина, норадреналина.
Среди препаратов, уменьшающих частоту и тяжесть постинсультных проявлений, все большее внимание привлекает амантадин [12], позиционируемый ранее только как противопаркинсоническое средство. Теоретическим обоснованием применения амантадина сульфата в инфузионной и таблетированной формах выпуска [13, 14] является способность препарата активно стимулировать выделение дофамина из нейрональных депо, увеличивать чувствительность дофаминергических рецепторов к нейромедиатору при параллельной стабилизации специфических глутаматергических рецепторов. Последнее прерывает нарастание выброса глутамата, чем подавляет глутаматную эксайтотоксичность, лежащую в основе запуска патобиохимических механизмов постишемического каскада. Это способствует сокращению зоны пенумбры, уменьшает сопутствующий ишемии и гипоксии нейромедиаторный дисбаланс, снижает энергетическую, белковую, электролитную дисрегуляцию, т.е. оказывает прямое церебропротективное действие.
Цель работы: изучение влияния амантадина сульфата в инфузионной и таблетированной формах выпуска (ПК-Мерц) на динамику неврологического дефицита и функциональное состояние больных в остром периоде ишемического инсульта.
Материалы и методы
Проведено комплексное клинико-неврологическое и лабораторное обследование 40 больных (26 мужчин и 14 женщин) с острым ишемическим инсультом (ИИ) в возрасте от 48 до 75 лет (средний возраст — 61,3 ± 0,8 года). Диагноз острого ИИ устанавливали по данным неврологической клинической симптоматики, а также компьютерной томографии (компьютерный томограф Toshiba Action 16 TSX-031A).
Основной причиной острого ИИ у 77,5 % пациентов были артериальная гипертензия, сахарный диабет, у 20 % — нарушения сердечного ритма, у 10 % больных в анамнезе было сопутствующее хроническое заболевание легких, 7,8 % пациентов имели вредные привычки (курение, злоупотребление алкоголем).
В зависимости от проводимой терапии больные были разделены на две группы. В 1-ю (контрольную) группу вошло 14 пациентов (средний возраст 63,5 ± 5,3 года). Они получали стандартную терапию (приказ МЗ Украины № 602 от 03.08.2012 г. «Сучасні принципи діагностики та лікування хворих із гострим ішемічним інсультом та ТІА») в течение 28 дней от начала заболевания. Во 2-ю (опытную) группу было включено 26 больных (средний возраст 58,6 ± 4,7 года). Все они на фоне стандартной терапии получали амантадина сульфат в инфузионной и таблетированной формах выпуска (ПК-Мерц) по схеме ступенчатой терапии. Препарат начинали вводить не позже чем через 12 часов от начала заболевания в/в 2 раза в сутки со скоростью 30 капель в 1 минуту в дозе 400 мг (2 флакона по 500 мг) в течение 3 дней. Затем переходили на таблетированную форму препарата, назначая его в дозе 200 мг 2 раза в сутки с 4-х по 10-е сутки, 200 мг 1 раз в сутки — с 11-х по 28-е сутки заболевания.
Критерии включения пациентов в группы клинического обследования: возраст > 18 лет, рандомизация в пределах 12 часов после развития острого ИИ, наличие очаговых симптомов, характерных для острого ИИ; данные нейровизуализации, подтверждающие диагноз острого ИИ; исходный уровень неврологического дефицита от 8 до 13 баллов по шкале NIHSS, нарушение сознания 9–12 баллов по ШКГ.
Критерии исключения: начало заболевания ранее чем за 12 часов до поступления в клинику, наличие при нейровизуализации лакунарного инсульта, инфаркта мозжечка, субарахноидального, внутримозгового или внутрижелудочкового кровоизлияния, исходный уровень неврологического дефицита менее 8 или более 13 баллов по шкале NIHSS, нарушения сознания менее 8 или более 12 баллов по ШКГ, сопутствующий острый инфаркт миокарда, нестабильная стенокардия, декомпенсированная сердечная недостаточность.
Степень нарушения неврологических функций оценивали во время госпитализации, через 1 сутки проведения интенсивной терапии, на 3-и, 5, 7, 14 и 21-е сутки лечения по шкале NIHSS. Это позволяло оценить динамику регресса неврологического дефицита у больных. Начиная с 7-х суток заболевания по индексу Бартел оценивали уровень ежедневной жизненной активности (функциональный статус), глобальный статус — по модифицированной шкале Ренкина (МШР). На 21-е сутки проводили короткое обследование когнитивных функций по шкале MMSE (Mini-Metral State Examination).
Изучали стандартные лабораторные тесты: клинический анализ крови и мочи, печеночный и почечный комплексы, коагулограмму, электролиты, белок и сахар крови. Ежедневно записывали ЭКГ, контролировали сатурацию смешанной крови кислородом.
Терапевтическую эффективность ПК-Мерца оценивали на 21-й день лечения по объему восстановления неврологических функций в баллах по шкале NIHSS, МШР: высокая эффективность — регресс неврологического дефицита более чем на 4 балла по NIHSS, восстановление жизнедеятельности по МШР — более чем 1 балл; умеренная эффективность — регресс неврологического дефицита по шкале NIHSS на 4 балла, восстановление жизнедеятельности по МШР на 1 балл; отсутствие эффекта — уменьшение неврологического дефицита по шкале NIHSS менее чем на 4 балла и отсутствие динамики по МШР.
Для описания первичной базы данных использовали результаты описательной статистики. В случаях нормального закона распределения данных статистические характеристики были представлены в виде: объема выборки (n — количество наблюдений), среднего арифметического (М), стандартной ошибки среднего (m), 95% доверительного интервала для среднего (95% ДИ). Отличия считали статистически значимыми при р < 0,05.
Результаты и их обсуждение
При поступлении у больных выявлены очаговые неврологические симптомы, которые появились остро в течение первых часов заболевания. Так, по шкале Fast у пациентов регистрировались нарушения речи, парез мимической мускулатуры, слабость руки (преимущественно слева). У 75 % пациентов выявлена дисфагия в виде нарушения глотания. В целом исходный уровень нарушения неврологических функций по шкале NIHSS составлял 10,5 ± 1,4 балла, не имел достоверного различия по группам и подтверждал наличие умеренно тяжелого ИИ. Уровень нарушения сознания по ШКГ соответствовал глубокому оглушению — сопору (10,6 ± 1,4 балла в 1-й группе, 10,8 ± 1,7 балла — во 2-й).
При нейровизуализации головного мозга у всех пациентов был исключен геморрагический инсульт. На КТ диагностированы ишемические очаги: у 70 % пациентов в системе средних мозговых артерий (лобная, теменная и височная доли), у 30 % — поражение артерий вертебробазилярной системы на различных уровнях (ствол). Межгрупповые отличия по локализации патологического процесса были недостоверными.
Анализ результатов лечения показал, что при стандартной терапии острого ИИ до 5 суток наблюдения нарушения сознания и неврологических функций сохранялись на уровне, близком к исходному (рис. 1).
К 7-м суткам наблюдения у больных этой группы уровень сознания восстанавливался до умеренного оглушения (13,2 ± 0,5 балла по ШКГ), а дефицит неврологических функций был стабильным — 8,0 ± 1,5 балла (р = 0,001) по шкале NIHSS, снижаясь до 4,8 ± 0,2 балла к 21-м суткам.
На фоне применения амантадина сульфата (ПК-Мерц) по схеме ступенчатой терапии мы отмечали ускоренный регресс неврологической симптоматики. Так, у больных 2-й группы уровень сознания восстанавливался до нормы (14,5 ± 0,5 балла по ШКГ) уже с 4-х суток от начала заболевания. К этому сроку степень неврологического дефицита сокращалась до 4,6 ± 0,1 балла (р = 0,001) по NIHSS, продолжая прогрессивно уменьшаться до 1,5 ± 0,1 балла к 21-м суткам. Это сопровождалось достоверным (р = 0,001) увеличением силы мышц верхней конечности (рис. 2) и восстановлением движения нижней группы мимических мышц (рис. 3). С 3-х суток наблюдения на фоне инфузии амантадина сульфата достоверно уменьшалась выраженность дизартрии: с 1,7 ± 0,3 балла при поступлении до 1,1 ± 0,1 балла, тогда как при стандартной терапии исходная выраженность дизартрии в ходе наблюдения не изменялась.
Сравнительный анализ эффективности мультимодальной фармакотерапии показал, что на 21-е сутки заболевания у больных, получавших амантадина сульфат (ПК-Мерц) по ступенчатой схеме, уровень ежедневной жизненной активности, или функциональный статус (табл. 1), соответствовал минимальному ограничению и достоверно превышал уровень контрольной группы.
Одновременно мы отмечали достоверно лучшую сохранность когнитивных функций (по шкале MMSE) на фоне ускоренного восстановления глобального статуса (по МШР) к 21-м суткам наблюдения.
Параллельный анализ состояния витальных функций и гомеостатического метаболизма выявил следующее (табл. 2).
Исходная артериальная гипертензия (160,0 ± 8,3 мм рт.ст. у больных в 1-й группе, 178,6 ± 7,2 мм рт.ст. — во 2-й группе) эффективно корригировалась в первые сутки пребывания больных в отделении интенсивной терапии при сохранении гипердинамического типа кровообращения на протяжении всего периода наблюдения без достоверных межгрупповых различий. Исходная тахикардия (до 96,0 ± 5 уд. в 1 мин) на фоне инфузии амантадина сульфата достоверно уменьшалась до репрезентативной нормы со вторых суток интенсивной терапии и сохранялась на этом уровне весь срок наблюдения. Причем интервал QТ на фоне инфузии амантадина сульфата не выходил за пределы нормы. Показатели сатурации крови кислородом, улучшаясь в процессе лечения, не имели достоверных межгрупповых различий. Введение амантадина сульфата достоверно не влияло на скорость нормализации уровня гликемии в крови.
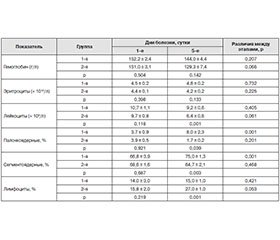
На фоне в/в введения амантадина сульфата достоверно (р = 0,001) увеличивалась скорость разрешения исходного лейкоцитоза (табл. 3).
Так, на 5-е сутки наблюдения при стандартном лечении количество лейкоцитов снижалось с 10,7 ± 1,1 × × 109/л до 9,2 ± 0,6 • 109/л, тогда как у больных 2-й группы в эти сроки наблюдения количество лейкоцитов в крови соответствовало 6,4 ± 0,6 • 109/л. Введение амантадина сульфата способствовало ускоренному восстановлению сниженного уровня лимфоцитов с 5-х суток острого ИИ. Так, при поступлении пациентов в клинику количество лимфоцитов в их крови снижалось до 14,0 ± 3,0 % в 1-й группе и 15,8 ± 2,0 % — во 2-й. К 5-м суткам наблюдения при стандартной терапии их количество достоверно не отличалось от исходного уровня (15,0 ± 1,0 %), а на фоне введения амантадина сульфата мы отмечали достоверный рост (р = 0,001) лимфоцитов до 27,0 ± 1,0 % (р = 0,053 к исходному уровню).
Введение амантадина сульфата достоверно не влияло на скорость восстановления биохимических показателей функций почек (уровень креатинина) и печени (билирубин, общий белок, мочевина, трансаминазы крови).
Таким образом (табл. 1), высокая скорость восстановления сознания, ускоренный регресс неврологической симптоматики, качественная стабилизация витальных функций способствовали достоверному сокращению длительности пребывания больных в отделении интенсивной терапии на 2,5 койко-дня, общей госпитализации — на 3,8 койко-дня.
Выводы
Результаты проведенного клинического исследования показали, что:
— ступенчатая терапия амантадина сульфатом (ПК-Мерц) в инфузионной и таблетированной формах выпуска, начатая в первые 12 часов от начала острого ишемического инсульта:
– сокращает сроки и глубину расстройств сознания;
– ускоряет регресс неврологической симптоматики;
– достоверно повышает показатели неврологических функций и качество жизни пациентов в целом;
– сокращает сроки пребывания в отделении ИТ и общей госпитализации;
— ПК-Мерц необходимо вводить в первые 12 часов от начала заболевания в/в 2 раза в сутки со скоростью 30 капель в 1 минуту в дозе 400 мг (2 флакона по 500 мг) в течение 3 дней заболевания. Затем переходить на таблетированную форму препарата, назначая его в дозе 200 мг 2 раза в сутки с 4-х по 10-е сутки, 200 мг 1 раз в сутки — с 11-х по 28-е сутки заболевания;
— безопасность применения амантадина сульфата (ПК-Мерц) в инфузионной и таблетированной формах выпуска достоверно не отличается от полученных данных при проведении стандартной терапии.
1. Asdaghi N., Butcher K.S., Hill M.D. Risks and benefits of thrombolysis in the ederly // International Jurnal of Stroke. — 2012. — Vol. 7, Issue 2. — Р. 142-149.
2. Kaste M., Norring B. From the World Stroke Day to the World Stroke Campaign one in six: act now! // International Journal of Stroke. — 2010. — V. 5, Issue 5. — Р. 342-343.
3. Strong K., Mathers C. Bonita R. Prenenting stroke: saving lives around the World // Lancet neurol. — 2007. — V. 6. —
Р. 182-187.
4. Bamford J., Sandercock P., Dennis M., Burn J., Warlow C. A prospective study of acute cerebrovascular disease in the community: the Oxfordshire Community Stroke Project -1981-86. Incidence, case fatality rates and overall outcome at one year of cerebral infarction, primary intracerebral and subarchnoid haemorrhage // Neurol. Neurosurg Psychiatry. — 1990. — 53. — 16-22.
5. Wolg P.A., D’Agostino R.B., Belanger A.J., Kannei W.B. Probability of stroke: a risk profile from the Framingham Study // Stroke. — 1991. — 22. — 312-8.
6. Feigin V.L., Laws C.M., Bennett D.A., Anderson C.S. Stroke epidemiology a review of population-based studies of incidence prevalence and case-fatality in the late 20th century // Lancet Neurol. — 2003. — 2. — 43-53.
7. World Bank. Word Development Report. 1993 Investing in Health. — New York: Oxford University Press, 1993.
8. Early mortality following stroke: a prospective review / Silver F.L., Norris J.W., Lewis A.J., Hachinski V.C. // Stroke. — 1984. — Vol. 15. — P. 492-496.
9. Medical and neurological complications of ischemic stroke: experience from the RANTTAS trial. RANTTAS Investigators / Johnston K.C., Li J.Y., Lyden P.D., Hanson S.K., Feasby T.E., –Adams R.J., Faught R.E., Haley E.C. // Stroke. — 1998. — Vol. 29, № 2. — Р. 447-453.
10. Medical complications after stroke: a multicenter study / Langhorne P., Stott D.J., Robertson L., MacDonald J., Jones L., McAlpine C., Dick F., Taylor G.S., Murray G. // Stroke. — 2000. — Vol. 31, № 6. — Р. 123-1229.
11. Interrelationship Among Common Medical Complications After Acute Stroke: Pneumonia Plays an Important Role / R. Ji, D. Wang, H. Shen, Y. Pan, G. Liu, P. Wang, Y. Wang, H. Li, Y. Wang // Stroke. — 2013. — Vol. 44. — Р. 3436-
3444.
12. The Neurologic Complications of Ischemic Stroke / NI. Ose-mone // US Pharm. — 2013. — Vol. 38, № 1. — Р. 1-5.
13. Новые направления в патогенетической терапии инсульта / С.А. Румянцева, Н.Г. Беневольская // Атмосфера. Нервные болезни: журнал для практических врачей. — 2006. — № 4. — С. 29-34.
14. Применение агонистов NMDA-рецепторов ПК-Мерц в остром периоде инсульта / Кривонос О.В., Амосо-
ва Н.А., Смоленцева И.Г. // Журнал неврологии и психиатрии им. С.С. Корсакова. — 2009. — 109, 4. — С. 72-74.

/41.jpg)
/42.jpg)
/43.jpg)