Журнал «Здоровье ребенка» (62) 2015. Тематический выпуск "Детская гастроэнтерология"
Вернуться к номеру
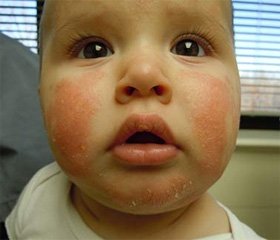
Ферментопатия как причина кожных проявлений атопии у детей
Авторы: Лимаренко М.П. — Донецкий национальный медицинский университет им. М. Горького, г. Красный Лиман
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
Статья посвящена ферментопатиям как одной из возможных причин атопического дерматита у детей. Функциональные нарушения органов пищеварения приводят к всасыванию неполноценно расщепленных компонентов пищи, особенно белков, и тем самым способствуют сенсибилизации организма к различным видам аллергенов. При атопическом дерматите у детей встречаются следующие функциональные нарушения органов пищеварения: рефлюксы, дискинезии, заболевания слизистой оболочки, холестаз, относительная панкреатическая недостаточность, дисбиоз кишечника. Задача врача состоит в углубленном обследовании таких пациентов и назначении комплексной терапии атопического дерматита с учетом выявленных изменений со стороны желудочно-кишечного тракта.
Стаття присвячена ферментопатіям як однієї з можливих причин атопічного дерматиту в дітей. Функціональні порушення органів травлення призводять до всмоктування неповноцінно розщеплених компонентів їжі, особливо білків, і тим самим сприяють сенсибілізації організму до різних видів алергенів. При атопічному дерматиті в дітей зустрічаються такі функціональні порушення органів травлення, як рефлюкси, дискінезії, захворювання слизової оболонки, холестаз, відносна панкреатична недостатність, дисбіоз кишечника. Завданням лікаря є поглиблене обстеження таких пацієнтів та призначення комплексної терапії атопічного дерматиту з урахуванням виявлених змін з боку органів шлунково-кишкового тракту.
The article deals with fermentopathy as one of the possible causes of atopic dermatitis in children. Functional disorders of the digestive organs lead to the absorption of inadequately broken down food components, especially proteins, and thereby to organism sensitization to different types of allergens. Children with atopic dermatitis have the following functional disorders of the digestive organs: reflux, dyskinesia, diseases of the mucous membrane, cholestasis, relative pancreatic insufficiency, intestinal dysbiosis. The doctor’s task consists in the in-depth examination of these patients, and in the administration of combined therapy for atopic dermatitis in view of the identified changes in the gastrointestinal tract.
ферментопатия, атопический дерматит, дети.
ферментопатія, атопічний дерматит, діти.
fermentopathy, atopic dermatitis, children.
Статья опубликована на с. 93-96
Атопический дерматит (АД) — это аллергическое воспаление кожи, в основе которого лежат генетически обусловленные иммунные механизмы, приводящие к повреждению всех слоев эпидермиса [1]. АД страдает до 20 % детского населения мира [1, 2]. Наличие сопутствующих заболеваний желудочно-кишечного тракта (ЖКТ) у ребенка с аллергией является часто встречающейся ситуацией в практике врача-педиатра. Функциональные нарушения органов пищеварения приводят к всасыванию неполноценно расщепленных компонентов пищи, особенно белков, и тем самым способствуют сенсибилизации организма к различным видам аллергенов. При АД у детей встречаются следующие функциональные нарушения органов пищеварения: рефлюксы, дискинезии, заболевания слизистой оболочки, холестаз, относительная панкреатическая недостаточность, дисбиоз кишечника и др. [5, 11].
Известно, что поджелудочная железа является крупнейшей и важнейшей железой пищеварительной системы и одновременно важнейшей железой внутренней секреции, принимающей участие в регуляции углеводного обмена. Она секретирует в кровь (эндокринная функция) гормоны — инсулин (эссенциальный для жизни), глюкагон, гастрин, соматостатин, панкреатический полипептид, амилин; продуцирует в пищеварительный тракт (экзокринная функция) ферменты, которые участвуют в гидролизе всех питательных веществ.
Ферментами панкреатического сока являются амилаза, панкреатическая липаза, протеазы. Амилаза секретируется поджелудочной железой и слюнными железами. Обе ее формы имеют приблизительно одинаковую активность и участвуют в расщеплении крахмала и гликогена. Панкреатическая липаза катализирует расщепление триглицеридов пищи до двух жирных кислот и моноглицерида. Действует она вместе с желчными кислотами и колипазой поджелудочной железы. Протеазы синтезируются железой в виде предшественников, которые активируются в двенадцатиперстной кишке энтерокиназой. В результате действия пептидаз (трипсин, химотрипсин, эластаза, карбоксипептидаза) образуются олигопептиды, расщепляющиеся в дальнейшем с помощью ферментов щеточной каемки, а также свободные аминокислоты [3].
Методы оценки экзокринной функции поджелудочной железы разделяют на прямые (обычно зондовые) и косвенные (беззондовые). Прямые методы связаны с непосредственным определением активности ферментов в дуоденальном содержимом, а косвенные — с оценкой процессов переваривания стандартных субстратов. К прямым методам относятся определение активности панкреатических ферментов в крови — амилазы, липазы, трипсина и определение активности панкреатических ферментов в моче — амилазы, липазы. Повышение активности сывороточной амилазы в два и более раза в сочетании с увеличением липазы и трипсина (или одного из них) является достоверным тестом обострения хронического панкреатита [3]. Однако нормальные показатели концентрации ферментов в крови и моче не дают основания исключить диагноз хронического панкреатита. В таких случаях применяют провокационный тест — определение активности ферментов до и после стимуляции. Наиболее широко используют определение амилазы в крови после стимуляции панкреозимином или глюкозой, а также уровень амилазы в моче на фоне стимуляции прозерином. После введения раздражителей наблюдается феномен «уклонения» ферментов (гиперферментемия), что свидетельствует о поражении ткани поджелудочной железы или препятствии для оттока панкреатического сока [3, 4].
К прямым методам относят секретин-холецистокининовый тест, являющийся золотым стандартом определения внешнесекреторной функции поджелудочной железы. Данный тест обладает высокой точностью, однако широкое его применение невозможно из-за ряда недостатков: высокой стоимости секретина и холецистокинина, необходимости зондирования пациента, длительности процедуры, необходимости внутривенного введения препаратов и, как следствие, возможности побочных реакций [4].
К косвенным методам относят копрологическое исследование. Повышение количества нейтрального жира, соединительной ткани, мышечных волокон и/или крахмала указывает на снижение экзокринной функции поджелудочной железы. На точность данного метода влияют следующие факторы: объем выделяемой в просвет кишечника желчи, качественный состав желчи, состояние моторики кишечника, наличие воспалительных процессов в тонкой кишке, терапия ферментными препаратами.
В современных условиях альтернативой дорогостоящему и инвазивному секретин-холецистокининовому тесту является определение эластазы-1 в кале [4, 6]. Фермент эластаза-1, продуцируемый поджелудочной железой, не метаболизируется в кишечнике, и его активность в кале объективно отражает экзокринную функцию органа. Данный метод имеет большую специфичность и чувствительность — более 90 %. В отличие от косвенных тестов определение эластазы-1 можно проводить, не отменяя препараты заместительной терапии. Определение эластазы-1 показано во всех случаях, когда предполагается экзокринная недостаточность поджелудочной железы, и во всех случаях, когда предполагается применение препаратов панкреатических ферментов, т.к. позволит избежать необоснованного их назначения.
На связь АД с заболеваниями органов ЖКТ, в том числе ферментопатиями, указывают многие авторы в своих публикациях. L. Lange et al. [10] предлагают экзему, начавшуюся у ребенка с 3-месячного возраста, рассматривать как один из главных симптомов синдрома Швахмана — Даймонда (аутосомно-рецессивного заболевания, характеризующегося недостаточностью поджелудочной железы, нейтропенией, нарушением хемотаксиса нейтрофилов, апластической анемией, тромбоцитопенией, метафизарным дизостозом и задержкой физического развития).
В своем сообщении K. Pellegrino et al. [12] описывают 8-летнего мальчика, у которого после употребления трески через 5 минут развились анафилактическая реакция и обострение панкреатита. Начата специфическая иммунотерапия. Симптомы заболеваний купировались у ребенка через 7 дней. Из анамнеза известно, что с годовалого возраста мальчик страдал АД и хронической диареей. В 4 года у ребенка диагностирован рецидивирующий панкреатит.
Н.Л. Аряев и соавт. [2] обследовали 29 детей в возрасте от 2,5 до 18 месяцев с АД. Манифестация кинических признаков поражения пищеварительного тракта, особенно поджелудочной железы, проявлялась у этих пациентов болью в животе (кишечной коликой), срыгиванием, рвотой, метеоризмом, частыми жидкими испражнениями. Как наиболее эффективный метод авторами отмечена комплексная терапия АД с включением ферментного препарата пангрол 10 000.
Е.Н. Охотникова и соавт. [5] при обследовании 45 детей в возрасте от 3 до 16 лет с аллергическими заболеваниями кожи нарушения со стороны органов пищеварения выявили у 94 % пациентов. Применение препарата мезим форте 10 000 в комплексной терапии аллергических поражений кожи способствовало быстрому исчезновению болевого абдоминального и диспептического синдромов, положительно влияло на купирование аллергической симптоматики.
Следует отметить, что к кишечным ферментопатиям относят: целиакию, дисахаридазную недостаточность (лактазную недостаточность, сахаразную-изомальтазную недостаточность), нарушение транспортных систем энтероцита (глюкозо-галактозная мальабсорбция и др.).
Целиакия — хроническое генетически детерминированное заболевание, характеризующееся стойкой непереносимостью глютена (белка, содержащегося в пшенице, ржи и ячмене) с развитием атрофии слизистой оболочки тонкой кишки и связанного с ней синдрома мальабсорбции. Особого интереса и внимания заслуживают ассоциированные с целиакией заболевания, такие как герпетиформный дерматит (дерматит Дюринга), сахарный диабет І типа, аутоиммунный тиреоидит, аутоиммунный гепатит, первичный билиарный цирроз печени, системная красная волчанка, склеродермия, ревматоидный артрит, миастения, алопеция, атаксия, кардиомиопатии.
Обязательными методами диагностики целиакии являются: выяснение семейного анамнеза по целиакии, непереносимости злаковых, чаще берущей начало в середине первого года жизни, характерная клиническая картина, эндоскопия и биопсия залуковичного отдела двенадцатиперстной кишки (тонкого кишечника) с последовательным гистоморфологическим исследованием (в активную стадию целиакии выявляют хронический атрофический еюнит), серологические тесты, HLA-типирование, видеокапсульная эндоскопия (по возможности) [6].
К дополнительным методам (по показаниям) диагностики целиакии относят: печеночные пробы, общий белок и белковые фракции, глюкозу крови либо гликозилированный гемоглобин, электролиты и микроэлементы сыворотки крови, фекальную эластазу-1, копрограмму (характерна стеаторея ІІ типа), ультразвуковое исследование органов ЖКТ и щитовидной железы, колоноскопию, рентгенологическое исследование тонкой кишки (энтероклизис), денситометрию костей для ранней диагностики остеопороза [6].
Герпетиформный дерматит (дерматит Дюринга), так называемая кожная форма целиакии, характеризуется папуловезикулезной сыпью с выраженным зудом. Сыпь наблюдается преимущественно на разгибательной поверхности конечностей, туловище, шее, волосистой части головы. Практически у 100 % больных с герпетиформным дерматитом наблюдаются характерные для целиакии морфологические изменения в слизистой оболочке кишечника, определяется весь спектр серологических маркеров, а сама сыпь представлена отложением в базальном слое дермы депозитов антиглиадиновых антител (IgA). Кожные проявления имеют обратимый характер при исключении из пищевого рациона глютена.
Необходимо подчеркнуть, что радикального лечения целиакии нет. Больным показана пожизненная безглютеновая диета с исключением продуктов, содержащих рожь, пшеницу, ячмень, овес. Содержание глиадина должно составлять не более 20 мг на 100 г пищи в сутки. В активную стадию заболевания в питании используют смеси-гидролизаты. Вспомогательная терапия включает: препараты железа, фолиевой кислоты, заместительную терапию ферментами поджелудочной железы, препараты кальция, витамин D, бисфосфонаты, кальцитонин. При тяжелом течении назначают преднизолон — 10–20 мг в сутки, парентеральное питание (внутривенное введение альбумина и др.), проводят коррекцию водно-электролитного баланса. При герпетиформном дерматите в терапию включают диафенилсульфон и дапсон (50–100 мг в сутки).
Лактазная недостаточность — это врожденное или приобретенное снижение активности расщепляющего молочный сахар (лактозу) фермента лактазы в тонкой кишке. Заболевание может протекать скрыто или манифестно.
Диагностика лактазной недостаточности основывается на диетодиагностике, определении общего содержания углеводов в кале. Достоинствами данного метода являются дешевизна и доступность, ограничениями — то, что пациент должен получать адекватное количество лактозы в питании. Больным лактазной недостаточностью возможно проведение гликемического нагрузочного теста с лактозой, определение рН кала, определение экскреции короткоцепочечных жирных кислот, генетическое исследование. Кроме того, используют водородные дыхательные тесты. Диагностика мальабсорбции по данным теста проводится по изменению концентрации водорода в выдыхаемом воздухе после приема изучаемого углевода. Диагноз лактазной недостаточности устанавливается при повышении концентрации водорода после приема лактозы более 20 ppm. Золотым стандартом диагностики лактазной недостаточности является определение активности лактазы в биоптатах слизистой оболочки тонкой кишки [6].
В коррекции лактазной недостаточности применяют индивидуальный подход. Назначают препараты фермента лактазы. В питании ограничивают лактозу: исключают цельное молоко и молочные продукты, используют низколактозные и безлактозные смеси.
M. Ho et al. [8] в клиническом обзоре, посвященном пищевой аллергии, указывают, что в последнее время возросла частота не-IgE-опосредованных реакций, характеризующихся клиническими проявлениями от атопического дерматита до целиакии.
В своих исследованиях O. Rudzeviciene et al. [13] при обследовании 144 детей в возрасте от 1,5 до 24 месяцев с атопическим дерматитом лактазную недостаточность выявили у 40,9 % пациентов. Риск развития лактазной недостаточности был выше, если дети находились на грудном вскармливании только до 1 месяца, по сравнению с детьми, находившимися на грудном вскармливании до 4–6 месяцев. Лактазная недостаточность чаще встречалась у детей, чьи матери также страдали этим заболеванием (66,7 %), по сравнению с пациентами, чьи матери были здоровы (41,1 %).
I.A. Cazzato et al. [7] обследовали 178 пациентов с никель-контактной аллергией, имеющих кожный синдром. По данным водородного дыхательного теста лактазная недостаточность определялась у 74,7 % больных, а в группе контроля — в 6,6 % случаев.
T. Hutyra et al. [9] обследовали 87 детей в возрасте от 7 месяцев до 18 лет с пищевой аллергией. Лактазную недостаточность выявили у 10 % пациентов в возрасте до 5 лет и у 26 % больных старше 5 лет.
Таким образом, заболевания органов желудочно-кишечного тракта, в том числе ферментопатии, часто ассоциированы с атопическим дерматитом у детей. Задача врача состоит в проведении углубленного обследования органов пищеварительной системы у таких пациентов и назначении комплексной терапии атопического дерматита с учетом выявленных изменений.
1. Аряев Н.Л., Клименко В.А. Атопический дерматит у детей. — К., 2006. — 150 с.
2. Аряев Н.Л., Шевченко И.М., Кузьменко И.В., Титкова Е.В. Панкреатические ферменты в комплексной терапии атопического дерматита у детей // Современная педиатрия. — 2011. — № 5 (39). — С. 200–203.
3. Белоусов Ю.В. Заболевания поджелудочной железы у детей: панкреатит или панкреатопатия? // Здоров’я України. — 2004. — № 96.
4. Губергриц Н.Б. Возможности лабораторной диагностики заболеваний поджелудочной железы // Экспериментальная и клиническая гастроэнтерология. — 2008. — № 7. — С. 93–101.
5. Охотникова Е.Н., Меллина К.В., Ткачева Т.Н., Волгина И.Е. Место ферментных препаратов в схемах лечения аллергических заболеваний кожи у детей // Современная педиатрия. — 2011. — № 6 (40). — С. 177–182.
6. Передерий В.Г., Ткач С.М. Практическая гастроэнтерология. — Винница, 2011. — С. 47–54.
7. Cazzato I.A., Vadrucci E., Cammarota G., Minelli M., Gasbarrini A. Lactose intolerance in systemic nickel allergy syndrome // Immunopathol. Pharmacol. — 2011. — № 24 (2). — Р. 535–537.
8. Ho M.H., Wong W.H., Chang C. Clinical spectrum of food allergies // Clin. Rev. Allergy Immunol. — 2012. — № 16. — Р. 16.
9. Hutyra T., Iwańczak B. Determination of lactose intolerance frequency in children with food allergy // Pol. Merkur. Lekarski. — 2008. — № 25 (148). — Р. 340–344.
10. Lange L., Simon T., Ibach B., Rietschel E. Shwachman-diamond syndrome as cause of infantile eczema associated with failure to thrive // Klin. Pediatr. — 2009. — № 221 (2). — Р. 89–92.
11. Lofgren S., Krol A. New therapies in pediatric dermatology // Curr. Opin. Pediatr. — 2011. — Vol. 23, № 4. — P. 399–402.
12. Pellegrino K., D'Urbano L.E., Artesani M.C., Riccardi C., Mancini S., Bella S., Alghisi F., Cavagni G. Severe reaction in a child with asymptomatic codfish allergy: food challenge reactivating recurrent pancreatitis // Ital. J. Pediatr. — 2012. — № 38. — Р. 16.
13. Rudzeviciene O., Narkeviciute I., Eidukevicius R. Lactose malabsorption in young Lithuanian children with atopic dermatitis // Acta Paediatr. — 2004. — № 93 (4). — Р. 482–486.