Международный неврологический журнал 1 (71) 2015
Вернуться к номеру
Шляхи оптимізації лікування при інсомнії на тлі цереброваскулярної патології
Авторы: Тріщинська М.А. - Національна медична академія післядипломної освіти імені П.Л. Шупика, кафедра неврології № 1, м. Київ
Рубрики: Неврология
Разделы: Справочник специалиста
Версия для печати
У статті наведені сучасні погляди на причини, патогенез та лікування порушень сну у пацієнтів із вегетативними розладами на початкових стадіях порушення мозкового кровообігу. Вегетативна дисфункція тісно пов’язана з синдромом інсомнії, і тому пошук причин та лікування цих станів нерозривно пов’язані. Існує консенсус стосовно застосування антидепресантів як для корекції симптомів вегетативної дисфункції, так і для покращення якості сну. Тразодон зарекомендував себе як препарат, що вірогідно зменшує симптоми тривоги та інсомнії, які досить часто є першими й основними проявами початкових стадій цереброваскулярної патології.
В статье представлены современные взгляды на причины, патогенез и лечение нарушений сна у пациентов с вегетативными расстройствами на начальных стадиях нарушений мозгового кровообращения. Вегетативная дисфункция тесно связана с инсомнией, и поэтому поиск причин и лечение этих состояний неразрывно связаны. Существует консенсус относительно использования антидепрессантов как для коррекции симптомов вегетативной дисфункции, так и для улучшения качества сна. Тразодон зарекомендовал себя как препарат, достоверно уменьшающий симптомы тревоги и инсомнии, которые достаточно часто являются первыми и основными проявлениями начальных стадий цереброваскулярной патологии.
The article presents modern views on the causes, pathogenesis and treatment of sleep disorders in patients with autonomic disorders at initial stages of disturbed cerebral circulation. Autonomic dysfunction is closely associated to insomnia syndrome, and so the search for the causes and treatment of these conditions are closely related too. There is a consensus on the use of antidepressants both to correct the symptoms of autonomic dysfunction and to improve the sleep quality. Trazodone proved itself as a drug significantly reducing symptoms of anxiety and insomnia, which quite often are the first and main manifestations of the initial stages of cerebrovascular pathology.
цереброваскулярна патологія, вегетативна дисфункція, інсомнія, тразодон, Триттіко.
цереброваскулярная патология, вегетативная дисфункция, инсомния, тразодон, Триттико.
cerebrovascular pathology, autonomic dysfunction, insomnia, trazodone, Trittico.
Статья опубликована на с. 121-128
Цереброваскулярна патологія є однією з основних причин смертності та інвалідизації населення у всьому світі. Зважаючи на те, що клінічно й соціально значимі прояви зазначеної патології (інсульт і/або судинна деменція) припадають на другу половину життя (хоча останніми роками частішають випадки інсульту в молодому віці), логічно припустити, що ураження церебральних судин починається в більш молодому віці. У 60–70–х роках минулого століття, коли створювалася класифікація судинних захворювань головного та спинного мозку, було запропоновано сприймати вегетативну (вегетосудинну) дистонію, яка, як відомо, зустрічається переважно в молодому віці, як вірогідний предиктор розвитку цереброваскулярної патології в майбутньому. Слід зазначити, що ряд симптомів, які в молодому віці свідчать про дисфункцію автономної нервової системи (АНС), як прояв вегетосудинної дистонії, у середньому і похилому віці входять до симптомокомплексу порушення функції АНС унаслідок вогнищевого ураження ЦНС на тлі судинної патології. Зважаючи на таку «стійкість» симптомів дисфункції АНС, можна говорити про стадійність процесу — функціональну та органічну стадії [7, 8].
Вегетативна (вегетосудинна) дисфункція або дистонія (ВСД) — діагностична категорія, а не нозологічна одиниця, зазвичай вторинна щодо психічних або соматичних захворювань. Виявлення ознак ВСД, що проявляється полісистемними вегетативними порушеннями, перш за все повинно сприяти пошуку причини зазначеного стану: психогенні захворювання (психофізіологічні реакції на стрес, порушення адаптації, психосоматичні захворювання, посттравматичне стресорне порушення, тривожно–депресивні розлади); органічне ураження ЦНС, соматичні захворювання, періоди фізіологічної перебудови гормонального статусу в організмі тощо [2].
Клінічна картина ВСД складається з соматичних скарг, які спонукають до ретельного обстеження органа чи системи, з боку яких ці скарги найбільш виражені, з метою виключення органічної або невідкладної соматичної патології та симптомів психічного дискомфорту (відчуття неспокою, стурбованості, пригніченості, роздратованості, плаксивості), які можуть розцінюватися пацієнтами як реакція на соматичний стан. Тому для встановлення діагнозу перш за все слід виключити органну патологію [2].
Клінічні прояви вегетативної дисфункції мають зазвичай полісистемний характер, але часто є так звані провідні скарги, які визначають вразливі, найменш здатні до адаптації органи чи системи. Частіше за все спостерігаються ознаки активації симпатичного відділу АНС, що імітують ураження серцево–судинної системи: тахікардію, екстрасистолію, неприємні відчуття у грудях, кардіалгії, артеріальну гіпер– або гіпотензію, дистальний акроціаноз, напади жару або холоду. Прояви вегетативної дисфункції з боку дихальної системи часто є вирішальними у зверненні до лікаря: утруднене дихання, ком у горлі, гіпервентиляційний синдром (відчуття нестачі повітря, задишка, відчуття втрати автоматизму дихання, задухи, сухість у роті, аерофагія та інші) та гіпервентиляційні еквіваленти (кашель, позіхання, зітхання). Дихальні розлади беруть активну участь у формуванні інших патологічних симптомів, таких як м’язово–тонічні чи моторні розлади (болісне напруження м’язів, м’язові спазми, судомні м’язово–тонічні феномени); парестезії у кінцівках (відчуття оніміння, поколювання, «повзання мурах», свербіння, печіння) і/або носогубному трикутнику; феномени порушення свідомості (запаморочення, відчуття «порожньої» голови, головокружіння, нечіткість зору, туман перед очима, дзвін у вухах). Потребують особливої уваги та ретельної диференціальної діагностики вегетативні розлади з боку шлунково–кишкового тракту (нудота, блювота, відрижка, метеоризм, урчання, запори, проноси, біль у животі) [2, 3].
Досить патогномонічним є загострення симптоматики на тлі конфліктних або стресорних ситуацій. Іншими словами, часова залежність соматичних скарг від психологічного стану є важливим діагностичним маркером вегетативної дисфункції. Іншою досить характерною диференціальною ознакою ВСД є рухливість симптомів, тобто поява нових скарг, що, у свою чергу, є психологічним стресом, який погіршує загальний стан [3].
Вегетативні розлади часто превалюють над психічними симптомами, тип та ступінь вираженості яких варіюють, але виявлення цих психопатологічних симптомів (тривога, депресія, змішані тривожно–депресивні розлади, фобії, істерія, іпохондрія) має велике значення для адекватної терапії. Найбільш поширеним психопатологічним симптомом, який асоціюється з вегетативною дисфункцією, є тривога.
Тривожні патологічні стани характеризуються загальними тривожними симптомами та специфічними проявами. Вегетативні симптоми (головокружіння, тахікардія, епігастральний дискомфорт, сухість у роті, пітливість тощо) є неспецифічними та спостерігаються при будь–якій тривозі. Крім того, до неспецифічних симптомів тривоги належать: погані передчуття (стурбованість за майбутнє, передчуття неприємностей, труднощі при концентрації уваги); моторне напруження (рухове збудження, метушливість, неможливість розслабитися, головні болі напруження, тремтіння). Зміст тривожних думок зазвичай стосується власного здоров’я або здоров’я близьких. Підвищення уваги до свого здоров’я поступово формує іпохондричний стиль життя [9].
Специфічні ознаки тривоги, що стосуються типу її формування та перебігу, визначають характер тривожного розладу. Тривожні розлади відрізняються за факторами, що їх викликають, та швидкістю і послідовністю виникнення симптомів. Серед найбільш поширених форм тривоги виділяють генералізовані тривожні розлади (ГТР), панічні атаки (ПА) та розлади адаптації.
ГТР належать до хронічних тривожних розладів із високою вірогідністю повторення симптомів у майбутньому. Виникають вони, як правило, до 40 років, флуктуюють. Основними проявами захворювання є надмірна тривога чи схвильованість, що спостерігаються майже щоденно, тяжко підлягають довільному конт–ролю, не обмежені конкретними стресовими ситуаціями та поєднуються з такими симптомами: 1) нервозність, тривожність, відчуття стурбованості, стан на межі зриву; 2) втомлюваність; 3) порушення концентрації уваги, «виключення» із життя; 4) роздратованість; 5) м’язове напруження; 6) порушення сну, частіше — труднощі при засинанні і підтримці сну [2, 9].
Панічні розлади — поширені, схильні до хронізації розлади, що зазвичай маніфестують у молодому, соціально активному віці. Основними клінічними симптомами панічних розладів є пароксизми тривоги (панічні атаки), що повторюються. ПА являють собою безпричинні, виснажливі для хворого напади страху та тривоги у поєднанні з різноманітними вегетативними (соматичними) симптомами: пульсація у грудях, сильне серцебиття; пітливість; тремор, озноб, відчуття внутрішнього тремтіння; відчуття нестачі повітря, задишка; утруднене дихання, задуха; біль та дискомфорт у лівій половині грудної клітки; нудота, абдомінальний дискомфорт; відчуття головокружіння, нестійкість, «порожнеча» в голові або запаморочення; тимчасове відчуття дереалізації і/або деперсоналізації; страх померти; страх зробити неконтрольовану дію або лишитися розуму; відчуття оніміння або поколювання (парестезії) у кінцівках; відчуття проходження по тілу жару або холоду [9].
Панічні розлади мають особливий стереотип становлення і розвитку симптоматики. Перші атаки найбільше впливають на психічний стан хворого та сприяють формуванню синдрому очікування нападу, який, у свою чергу, провокує появу наступних епізодів. Зі збільшенням строку захворювання в кожного пацієнта збільшується кількість (частота) таких психопатологічних симптомів, як акрофобія, депресія тощо.
Виникнення хворобливого стану під впливом стресорного фактора, який виходить за межі звичайного повсякденного психічного навантаження, що призводить до порушення звичного функціонування пацієнта (професійної діяльності, соціального життя), називається розладом адаптації — реакція, що може проявлятися протягом трьох місяців після початку дії стресорного фактора. Розлад слід відрізняти від реакцій на надзвичайний стрес або загострення існуючого психічного захворювання. Реакція дезадаптації триває не більше 6 місяців, в іншому разі діагноз треба уточнювати.
Клінічні прояви адаптаційних розладів дуже різноманітні, але мають психопатологічну та вегетативну складові. Частіше за все порушення адаптації до стресорного фактора проявляється тривожним настроєм (дифузне, неприємне, невизначене відчуття страху, відчуття загрози, напруження, підвищена дратівливість, плаксивість). Пацієнти можуть відчувати страх окремої події та стурбованість власним здоров’ям (ризик виникнення серйозного захворювання), що спонукає звернутися до лікаря. Характерним є вплив стану на професійну діяльність [9].
Вегетативні розлади взагалі часто супроводжуються порушеннями сну, а саме: труднощами при засинанні, неглибоким сном, частими нічними пробудженнями, астенічним симптомокомплексом, роздратованістю щодо звичайних життєвих ситуацій, нейроендокринними порушеннями, пов’язаними з недосипанням [2, 3]. Крім того, порушення сну є одним із перших симптомів цереброваскулярної патології — початкових проявів недостатності мозкового кровообігу [4, 6, 8].
Сон відіграє важливу роль у підтримці оптимального функціонального стану головного мозку. Основною функцією сну, а саме повільної фази, є відновлення сил організму, у тому числі це стосується відновлення гомеостазу мозкової тканини. Доказом даної теорії є те, що саме на цей період припадає пік секреції соматотропного гормона, відновлення кількості клітинних білків, рибонуклеїнових кислот та фосфорорганічних зв’язків. Останні дані свідчать про те, що у фазу повільного сну продовжується переробка інформації мозком, але тієї її частини, що заснована на інтероцептивній імпульсації, іншими словами, відбувається оптимізація управління внутрішніми органами [5]. Вважається, що у фазу швидкого сну відбувається переробка інформації й утворення програми дії та поведінки на майбутнє. У цю фазу клітини мозку надзвичайно активні, але результуюча цієї активності до м’язів не доходить. Ймовірно, проводиться обробка інформації, отриманої під час неспання, та зберігається у пам’яті. Існує теорія M. Jouvet, що у фазу швидкого сну відбувається збереження генетичної інформації в оперативній пам’яті, яка стосується моделі поведінки в цілому з метою реалізації її на нейрональному рівні [3]. Іншими словами, функції сну реалізуються на адекватному рівні не тільки за рахунок його загальної тривалості, але і за умови збалансованості різних його циклів (фаз).
Cон є активним процесом, під час якого підтримується висока активність нейронів, хоча вони мають інший просторовий характер порівняно з фазою неспання. Говорячи про функцію АНС під час сну, можна виділити декілька аспектів: 1) вегетативне забезпечення діяльності мозку під час сну; 2) активність вегетативних рефлексогенних зон під час сну; 3) динаміка вегетативних показників по стадіях та фазах сну. Так, під час більшої частини сну (ІІ ст. фази повільного сну, дельта–сон, тонічний швидкий сон) активність симпатичного відділу АНС знижена, а тонус парасимпатичного відділу АНС підвищений. У фазу швидкого сну тонус симпатичного відділу АНС підвищується, а парасимпатичного відділу — варіабельний [3].
Порушення сну (інсомнія) – стан, що визначається (DSM–IV) як дефіцит якості і кількості сну, що необхідні для нормальної життєдіяльності. У МКХ–10 інсомнія — це первинний психогенний стан з емоційно обумовленим порушенням кількості, тривалості і ритму сну. Розрізняють декілька видів порушення сну [6]. Пресомнічні порушення — труднощі на початку сну, тобто процес засинання триває не 3–10 хвилин, як у здорової людини, а при патології цей період може тривати до 2 годин; інтрасомнічні розлади проявляються переважно поверхневим сном, частими нічними пробудженнями та поганим засинанням після них. Післясомнічні порушення — тяжке пробудження, що не приносить відчуття бадьорості, виникає відчуття розбитості, сонливості. Діагноз інсомнії встановлюється за наявності постійних (більше місяця) або періодичних (протягом 3 і більше місяців) таких (3 і більше) ознак [1]: 1) засинання триває понад 30 хв; 2) сон бентежить хворого (всю ніч у голову «лізуть думки»); 3) страх перед неможливістю заснути; 4) часті пробудження протягом ночі; 5) ранні пробудження з неможливістю потім заснути; 6) знижений настрій; 7) немотивовані страх, тривога.
У фізіологічних випадках інсомнія може виникати внаслідок зміни часового поясу, зміни режиму роботи (нічні зміни з уживанням тонізуючих напоїв, таких як чай, кава тощо), пізнього відходження до сну (насамперед це стосується молодих людей, які віддають перевагу нічним дискотекам, комп’ютерним іграм, телевізору тощо) і, навпаки, раннього сну із занадто раннім пробудженням; сильних психоемоційних відчуттів. Слід зазначити, що передчасне засинання може бути проявом цереброваскулярної патології з супутнім астенодепресивним синдромом.
Існує дуже тісний зв’язок між АНС та функцією сну, анатомічно, фізіологічно та нейробіохімічно обумовлений. Багато робіт виявили зміни в активності АНС, які асоціювалися з порушеннями сну, що переважно відображалося на функціонуванні серцево–судинної системи. Було встановлено, що коливання артеріального тиску під час сну є важливим предиктором цереброваскулярних та серцево–судинних захворювань. Крім того, важливо визначати параметри функціонування АНС протягом сну при таких станах, як апное уві сні (драматичні зміни в системному та легеневому кров’яному тиску) та хвороба Піквіка (порушення дихання) [3, 14].
Порушення функціонування АНС при розладах сну може виражатися широким різноманіттям симптомів та синдромів, що створює серйозні діагностичні труднощі внаслідок їх схожості при різних захворюваннях. У табл. 1 наведені найбільш поширені порушення функціонування АНС в осіб із розладами сну, що проявляються з боку різних органів та систем [14].
/124/124.jpg)
Багато неврологічних та інших захворювань асоціюється як із дисфункцією АНС, так і з порушеннями сну (табл. 2). Та навпаки, деякі первинні порушення сну можуть свідчити або асоціюватися з дисфункцією вегетативної нервової системи [2, 14].
/124/124_2.jpg)
Автономна нейропатія є поширеним та тяжким ускладненням у хворих із цукровим діабетом та може уражати і залучати декілька систем (серцево–судинну, гастроінтестинальну, сечостатеву, потовидільну систему та окорухову функцію). Серцево–судинна автономна ней–ропатія клінічно є найбільш значимою серед діабетичних автономних нефропатій та асоціюється з підвищеним ризиком смерті в цій популяції. Серед різноманіття клінічних проявів слід виділити тахікардію у спокої, непереносимість фізичних навантажень, ортостатичну гіпотензію, приховану ішемію міокарда [14, 23].
Цукровий діабет часто супроводжується порушеннями сну, такими як безсоння, поганий сон, надмірна денна сонливість та порушення дихання уві сні [19]. З іншого боку, зменшення тривалості сну та погіршення його якості зі зменшенням частки повільної фази сну можуть впливати на гомеостаз глюкози крові, включаючи підвищення ризику виникнення цукрового діабету та зниження чутливості до інсуліну без адекватної компенсаторної реакції з боку bклітин підшлункової залози [22]. Більше того, є дані про потенційний зв’язок безсоння з поліурією, периферичною й автономною полінейропатією та підвищенням тонусу симпатичного відділу АНС [14].
Порушення дихання уві сні (синдром обструктивного апное уві сні, центральне апное уві сні, періодичне дихання тощо) дуже поширені серед пацієнтів із цукровим діабетом 2–го типу й асоціюються не тільки з поганою якістю сну та денною сонливістю, але і з важливими клінічними станами, такими як артеріальна гіпертензія та підвищення серцево–судинного ризику. Інтермітуюча гіпоксія та переривчастий сон, пов’язані із синдромом обструктивного апное уві сні, можуть патогенетично обумовлювати інсулінову резистентність через декілька шляхів, серед яких гіперактивність симпатичного відділу [11, 13, 14].
У багатьох дослідженнях був виявлений зв’язок між підвищеною активністю симпатичного відділу АНС та епізодами апное уві сні. Крім того, епізоди апное під час сну підвищують варіабельність частоти серцевих скорочень (ЧСС), яка є встановленим серцево–судинним фактором ризику. Ряд аритмій, що виникають унаслідок порушення функції АНС, асоціюються з обструктивним апное уві сні. Більш поширеними є брадіаритмії (відносна брадикардія під час обструкції та відносна тахікардія при відновленні дихання). Інші дизритмії включають синусову брадикардію, відсутність пульсу протягом 2–13 секунд, серцевий блок другого порядку, епізоди шлуночкових екстрасистол та шлуночкову тахікардію. Взагалі шлуночкові або суправентрикулярні аритмії тісно пов’язані зі ступенем порушення сатурації киснем [14, 15].
Під час сну у здорових осіб АТ знижується на 10–20 % порівняно з періодом неспання. У жінок під час сну АТ знижується більш виражено, ніж у чоловіків. Окрім глибокого нічного зниження АТ, протягом доби спостерігається менш значиме фізіологічне зниження АТ приблизно о 9–й та 19–й годинах і зовсім незначне — о 15–й годині. Слід зауважити, що під час сну спостерігається зниження частоти серцевих скорочень, але підвищується варіабельність (особливо у фазу швидкого сну) [3].
Моніторинг артеріального тиску під час сну має значення для прогнозування серцево–судинних захворювань. Так, у дослідженні PIUMA було показано, що зменшення ступеня нічного зниження систолічного АТ є незалежним предиктором підвищення серцево–судинної захворюваності при будь–якому рівні супутніх факторів ризику. Особливо це стосується жінок нон–диперів з артеріальною гіпертензією. Отримані докази зв’язку між зменшенням ступеня нічного зниження АТ та цереброваскулярною захворюваністю. Частота мозкових і серцевих ускладнень та ступінь ураження органів–мішеній вищі серед нон–диперів та осіб із значним зниженням АТ під час сну — овер–диперів. Вважається, що це обумовлене розвитком гіпоперфузії органів і тканин, а саме ішемії головного мозку, серця, нирок, та розвитком їх функціональної недостатності [3, 10].
Вивчення хронобіологічних аспектів мозкових інсультів показало, що від 18 до 61 % випадків інсультів розвивалися у ранкові години, після сну. Доведено, що саме в цей час підвищуються АТ, ЧСС, рівень норадреналіну і реніну у крові, агрегаційні властивості тромбоцитів. Нічні інсульти, за даними літератури, спостерігаються у 12–44 % хворих і пов’язуються зі зниженням АТ, ЧСС, змінами реологічних властивостей крові, що сприяє погіршенню кровопостачання мозку. Є дані на користь того, що ранкові та нічні інсульти виникають не тільки внаслідок тромбоутворення чи тромбоемболії з поверхні атеросклеротичних бляшок під час різкого підйому АТ, але і в результаті порушення авторегуляторних механізмів кровопостачання на тлі багатогодинного обмеження доступу аферентних імпульсів (нерухомість). Ця думка сприяє розумінню особливостей нічного сну в людей похилого віку (часті пробудження, скорочення тривалості глибокого сну, раннє пробудження) та розумінню адаптивного характеру таких змін [2, 3].
За даними О.С. Кадикова і співавторів (2006), серед хворих із ранніми формами цереброваскулярної патології найчастіше спостерігаються поверхневий сон із безліччю сновидінь, труднощі при засинанні, нічні пробудження (що також можуть бути пов’язані з частим сечовипусканням). Частіше за все порушення сну спостерігаються у хворих із цереброваскулярною патологією та депресією, тривожністю, синдромом апное уві сні та порушеннями сечовипускання [4].
Дослідники Університету Warwickу у Великій Британії проаналізували дані 3968 чоловіків та 4821 жінки, які взяли участь у дослідженні ELSA, та виявили зв’язок між якістю і тривалістю сну та функцією мозку, що змінюється з віком. Серед учасників віком від 50 до 64 років із коротким (менше 6 годин вночі) та занадто довгим сном (понад 8 годин) спостерігалися більш низькі бали за шкалами оцінки функції мозку. У досліджуваних осіб більш старшого віку (68–89 років) на функцію мозку впливала лише надмірна тривалість сну [21].
Таким чином, для оптимальної функції головного мозку сон повинен тривати від 6 до 8 годин у молодих осіб. Крім того, така тривалість сну виявилася оптимальною для загального стану здоров’я, включаючи зниження ризику розвитку ожиріння, артеріальної гіпертензії, цукрового діабету, серцевих захворювань та інсульту. Слід зазначити, що у пацієнтів віком до 65 років, які брали участь у дослідженні, якість сну не мала впливу на функцію мозку на відміну від осіб віком понад 65 років, у яких була виявлена вірогідна кореляція між зазначеними показниками. Було зроблено припущення, що підтримка оптимальної тривалості сну може зменшити ризик розвитку когнітивних порушень із віком або відтягнути чи попередити зміни, що призводять до деменції. Іншими словами, якщо поганий, короткий сон призводить до когнітивних порушень, тоді слід активно моніторувати та корегувати порушення сну з метою профілактики порушень функцій мозку [21].
Таким чином, вегетативна дисфункція тісно пов’язана з розладами сну, тобто при порушенні балансу у функціонуванні надсегментарного вегетативного апарату виникають порушення сну, і навпаки, інсомнія супроводжується симптомами вегетативної дисфункції. Відомо, що на стадії вегетосудинної дисфункції клінічні прояви обумовлені функціональними порушеннями, але симптоми вегетативної дисфункції виникають і при органічному ураженні головного мозку, що і спостерігається при цереброваскулярній патології, тобто симптоми інсомнії є проявом судинного ураження головному мозку також. Крім того, за класифікацією до порушень сну належать розлади дихання уві сні (апное), що зараховані до судинних факторів ризику, оскільки супроводжуються гіпоксією головного мозку. Іншими словами, розлади сну відіграються важливу роль у патогенезі і діагностиці початкових стадій цереброваскулярної патології, а тому потребують відповідного лікування.
При вегетативній дисфункції найбільший дискомфорт пацієнту завдають саме психоемоційні симптоми, що можуть тривати навіть після встановлення контролю над соматичними проявами. Тому в лікуванні ВСД активно застосовується психофармакологічне лікування. Спектр протитривожних засобів дуже широкий: транквілізатори (бензодіазепінові і небензодіазепінові), антигістамінні препарати, малі нейролептики, седативні рослинні збори, антидепресанти. Саме антидепресанти використовуються з 60–х років ХХ ст. для купірування епізоду та запобігання його повторенню переважно у зв’язку з їх ефективністю при тривозі незалежно від її типу. Відповідно до сучасних поглядів, до препаратів першого вибору при хронічній тривозі належать антидепресанти, а саме селективні інгібітори зворотного захвату серотоніну (СІЗЗС). Ця прихильність обумовлена хорошою переносимістю, тривалою ефективністю; побічні ефекти зникають протягом першого тижня або внаслідок корекції дози препарату. Зазвичай симптоми тривоги проходять протягом одного–двох тижнів від початку прийому препарату [3, 9].
Бензодіазепінові транквілізатори (БТ), у свою чергу, переважно використовують для купірування гострих симптомів тривоги і не повинні застосовуватися більше ніж 4 тижні через загрозу формування синдрому залежності. Достатньо швидке досягнення протитривожного ефекту. Психотропні властивості анксіолітиків реалізуються через ГАМКергічну нейротрансмітерну систему. Через морфологічну однорідність ГАМКергічних ней–ронів у різних відділах ЦНС транквілізатори діють на багато відділів нервової системи, що і обумовлює широкий спектр ефектів, у тому числі й небажаних. Основними проблемами, що виникають під впливом бензодіазепінів, є надмірна седація, міорелаксуючий ефект, підсилення ажитації (парадоксальна реакція) та психічна і фізична залежність [9].
Комбінація СІЗЗС та БТ використовується для найбільш ефективної терапії тривожних розладів при ВСД. Така комбінація дозволяє нівелювати індуковану СІЗЗС тривогу на початку лікування у деяких хворих, краще переноситься період очікування ефекту від антидепресантів, підвищується комплайєнс [4].
У той же час основні принципи лікування інсомній включають: 1) лікування причин, що викликають порушення сну (тривожність, депресія, синдром апное уві сні, порушення сечовипускання); 2) лікування самого синдрому інсомнії, що включає додержання гігієни сну, медикаментозну терапію, фітотерапію. Основні правила гігієни сну полягають у дотриманні того ж самого часу відходження до сну та пробудження, сон у тихій темній прохолодній кімнаті, якщо можливо, слід виключити денний сон, вживання чаю, кави тощо за декілька годин до сну; слід зменшити фізичне та розумове навантаження за 2–3 години до сну та виключити перегляд хвилюючих телепередач перед сном; можна перед сном приймати прохолодний душ або здійснювати прогулянку на свіжому повітрі [1, 6].
Медикаментозне лікування інсомній повинно відповідати таким вимогам: швидке настання сну, підтримка достатньо глибокого сну, відсутність постсомнотичних розладів. Можуть застосовуватися снодійні (короткої, середньої та тривалої дії), бензодіазепіни (діазепам, лоразепам, нітразепам), антидепресанти. При застосуванні препаратів, що впливають на сон (снодійних засобів), слід обмежити вживання алкоголю та водіння автотранспорту [6].
Таким чином, для корекції як вегетативних розладів, так і порушень сну рекомендується застосовувати антидепресанти. Як клас препаратів вони були створені з метою перш за все впливати на симптоми депресії, але за рахунок різних додаткових ефектів використовуються для лікування тривоги, больового синдрому, безсоння тощо. Ці ефекти в різних представників класу виражені по–різному, що і обумовлює вибір того чи іншого препарату залежно від переважання тієї чи іншої симптоматики у конкретного пацієнта. Наприклад, вплив на симптоми безсоння у різних представників класу коливається від відсутності впливу на якість сну, обтяження симптомів існуючого безсоння та здатності її викликати до вираженого снодійного впливу із здатністю нормалізувати формулу сну і, таким чином, підвищувати схильність до лікування, оскільки цей ефект настає раніше за інші (насамперед антидепресивний) [18]. Одним із таких препаратів є тразодон.
Тразодону гідрохлорид — похідне тріазолпіридину, за своїми фармакологічними показниками належить до групи антагоністів серотонінових рецепторів (5HT) і селективних інгібіторів зворотного захвату серотоніну. Тразодон є антагоністом 5–HT2A– і 5–HT2C–рецепторів, а також антагоністом 5–HT1а–рецепторів, інгібує постсинаптичні a1– і пресинапричні a2–адренергічні рецептори [17].
Ступінь впливу тразодону на рецептори визначається дозою препарату: доза, близька до 50 мг (25–100 мг), повністю насичує 5HT2A–рецептори, суттєво блокує a1–адренорецептори і зв’язує лише половину гістамінових рецепторів першого типу і ділянок зворотного захвату серотоніну. Цього достатньо саме для виникнення седативного і снодійного ефекту [24]. Є спостереження, що застосування препарату саме на ніч, перед сном, має більший гіпнотичний ефект: швидше настає сон, зменшується кількість пробуджень, покращується якість сновидінь та самопочуття при пробудженні [25]. Крім того, останні дослідження показали, що 100 мг тразодону на ніч не впливає на психічні показники [12]. Для отримання антидепресивного ефекту добова доза тразодону повинна становити щонайменше 150–300 мг, що дозволяє створити повне насичення переносників серотоніну [16].
З огляду на те, що тразодон (Триттіко) — це антидепресант, який є антагоністом рецепторів серотоніну та інгібує зворотний захват серотоніну синаптосомами головного мозку, його зараховують до поліфункціональних психофармакологічних засобів. Так, тразодон показаний перш за все при депресії. Крім того, тразодон широко застосовується як замінник бензодіазепінів або снодійних засобів, за рахунок анксіолітичного та снодійного ефекту. Дані, що отримані з офіційних джерел, підтверджують його ефективність у лікуванні генералізованого тривожного розладу, хронічного больового синдрому, а також як анксіолітика у випадах алкогольної чи бензодіазепінової залежності [16].
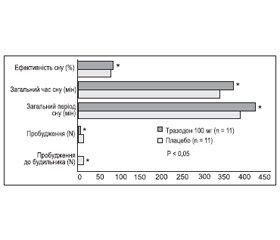
Застосування тразодону сприяє збільшенню загальної тривалості сну за рахунок зменшення кількості пробуджень уночі і скорочення тривалості швидкого сну. За рахунок цього частково пом’якшується вплив фази швидкого сну на психічний стан людини і, отже, послаблюється фактор, що є частою причиною виникнення депресії. На відміну від трициклічних антидепресантів тразодон не вкорочує спокійну четверту фазу сну (рис. 1).
/127/127.jpg)
Завдяки своїм седативним і снодійним ефектам препарат може використовуватися при лікуванні станів із підвищеною тривожністю, що часто супроводжуються безсонням. Є дані ефективного застосування тразодону при безсонні недепресивного походження, у тому числі у хворих з алкогольною, наркотичною і бензодіазепіновою залежністю. Також тразодон застосовують для лікування порушень сну у посттравматичному періоді. Слід зазначити, що тразодон ефективний для зменшення тривоги і загального збудження у хворих із деменцією (у дозі 50–150 мг). Крім того, препарат не впливає на еректильну функцію [16].
Тразодон у дозі 100 мг не впливає на частоту серцевих скорочень, систолічний та діастолічний АТ у положенні стоячи або лежачи у людей похилого віку, але тривалий прийом препарату призводить до значимого зниження частоти пульсу й АТ. У зв’язку з a1–адреноблокуючим ефектом тразодон може викликати поступальну гіпотензію, що необхідно мати на увазі при призначенні препарату пацієнтам із коливаннями АТ та враховувати при проведенні антигіпертензивної терапії [12, 20].
З високим ступенем вірогідності тразодон можна розглядати як альтернативу амітриптиліну і нейролептикам першого і другого покоління при лікуванні органічних психосиндромів, характерних для тривожних станів [16].
Можна говорити про доцільність використання поліфункціонального антидепресанту Триттіко (тразодону) у комплексному лікуванні синдрому вегетативної дисфункції з явищами інсомнії, у тому числі на тлі цереброваскулярної патології, оскільки препарат позитивно впливає на симптоми (тривога, депресивний настрій), що часто виражені на початкових стадіях недостатності мозкового кровообігу і корекція яких обумовлює прихильність до профілактичного лікування (антигіпертензивна, ліпідкорегуюча, антитромботична терапія тощо).
1. Артюхова М.Г., Шанаева И.А. Структура и особенности лечения нарушений сна у больных с сердечно–сосудистыми заболеваниями // РМЖ. — 2010. — Т. 18, № 26. — С. 1573–1577.
2. Вегетативные расстройства (клиника, диагностика, лечение) / Под ред. А.М. Вейна. — М.: Медицинское информационное агентство, 1998. — 752 с.
3. Вегетативные расстройства: клиника, лечение, диагностика: Руководство для врачей / Под ред. В.Л. Голубева. — М.: Медицинское информационное агентство, 2010. — С. 608–633.
4. Кадыков А.С., Манвелов Л.С., Шахпаронова Н.В. Хронические сосудистые заболевания головного мезга (дисциркуляторная энцефалопатия). — М.: ГЭОТАР–Медиа, 2006.
5. Пигарев И.Н. Висцеральная теория сна // Журнал высшей нервной деятельности. — 2013. — Т. 63, № 1. — С. 86–104.
6. Ранние клинические формы сосудистых заболеваний головного мезга: руководство для врачей / Под ред. Л.С. Манвелова, А.С. Кадыкова. — М.: ГЭОТАР–Медиа, 2014. — 344 с.
7. Семенова Е.П., Пантелеева Р.А., Логинова Н.Н. Актуальные вопросы диагностики начальных форм сосудистых заболеваний головного мозга // Начальные формы сосудистой патологии нервной системы / Под ред. проф. Е.П. Семеновой. — Горький, 1975. — С. 5–10.
8. Трошин В.Д. О систематизации начальных форм сосудистых заболеваний мозга / Под ред. проф. Е.П. Семеновой. — Горький, 1975. — С. 11–18.
9. Blazer D.G., Hughes D., George L.K. et al. Generalized anxiety disorder. Psychiatric Disorders in America: The Epidemiologic Catchment Area Study / Eds. Robins L.N., Regier D.A. — NY: The Free Press, 1991. — Р. 180–203.
10. Bradley T.D., Floras J.S. Sleep apnea and heart failure: part I: obstructive sleep apnea // Circulation. — 2003. — 107. — 1671–1678.
11. Bradley T.D., Floras J.S. Obstructive sleep apnoea and its cardiovascular consequences // Lancet. — 2009 Jan 3. — 373(9657). — 82–93.
12. Branconnier R., Cole J. Effect of acute administration of trazodone and amitriptyline on cognitive, cardiovascular functions and salivation in normal geriatric subjects // J. Clin. Psychopharmacol. — 1981. — 1 (6). — P. 82s–88s.
13. Clarenbach C.A. et al. Is obstructive sleep apnea a risk faktor for diabetes // Discovery Med. — 2011.
14. Cortelli P., Calandra–Buonaura G., Culebras A. Autonomic dysfunction in sleep disorders // Originally released. — 2003. — July 21, last updated October 5, 2013.
15. Douglas Bradley T., Floras J.S. Sleep Apnea and Heart Failure Part II: Central Sleep Apnea.
16. Frecska E. Trazodone — its multifunctional mechanism of action and clinical use // Neuropsychopharmacol. Hung. — 2010. — № 12 (4). — Р. 477–482.
17. Frazer A. Pharmacology of antidepressants // J. Clin. Psychopharmacol. — 1997. — 17 (2). — P. 2–18.
18. Obemdorfer S. et al. Effects of selectiveserotonin — inhibitors on objective and subjective sleep // Neuropsychobiology. — 2000. — 42. — P. 69–81.
19. Plantinga T.S., Johnson M.D., Scott W.K., van de Vosse E., Velez Edwards D.R., Smith P.B., Alexander B.D., Yang J.C., Kremer D., Laird G.M. et al. Toll–like receptor 1 polymorphisms increase susceptibi–lity to candidemia // J. Infect. Dis. — 2012. — 205. — 934–943.
20. SaJetu–Zyhlan G.M. et al. // Progress in Neuro–Psychopharmacology & Biological Psychiatry. — 2002. — 26. — 249–260.
21. Sleep Problems Linked To Decline in Brain Function With Age / By Janice Wood Associate News Editor Reviewed by John M. Grohol. — 2014 June 28.
22. Tasali E., Mokhlesi B., Van Cauter E. et al. Obstructive sleep apnea and type 2 diabetes: interacting epidemics // Chest. — 2008. — 133. — 496–506.
23. Vinik et al. Diabetic Autonomic Neuropathy // Diabetes Care. — 2003. — 26. — 1553–1579.
24. Ware J.C. et al. Inaeased deep sleep after trazadone use: a double–blind placebo–controlled study in healthy young adults // J. Clin. Psychiatry. — 51 (Suppl. 9). — P. 18–22.
25. Wheatley D. Trazodone: alternative dose regimen and sleep // Pharmatherapeutica. — 1984. — № 9 (3). — P. 607–612.