Журнал «Травма» Том 16, №1, 2015
Вернуться к номеру
Роль симптом-модифікуючих і структурно-модифікуючих препаратів у терапії остеоартриту: місце неомилюваних фітостеролів
Авторы: Головач І.Ю. - Клінічна лікарня «Феофанія» ДУС, м. Київ
Рубрики: Травматология и ортопедия
Разделы: Справочник специалиста
Версия для печати
Розглядаються загальні підходи до лікування остеоартриту та основні групи препаратів, що використовуються в терапії цього захворювання. Подані останні рекомендації 2014 року щодо підходів до лікування остеоартриту. Обговорюються особливості симптом-модифікуючих і структурно-модифікуючих лікарських засобів. До числа препаратів із хондропротективними й структурно-модифікуючими властивостями належить Піаскледин 300, до складу якого входять неомилювані фітостероли та жирні кислоти. Піаскледин представлений як антицитокіновий препарат, його дія спрямована на корекцію низки процесів, що лежать в основі порушеного метаболізму хряща при остеоартриті. Наведені результати досліджень щодо симптом-модификуючого та структурно-модифікуючого ефектів препарату.
Рассматриваются общие подходы к лечению остеоартрита и основные группы препаратов, используемые в терапии этого заболевания. Представлены последние рекомендации 2014 года относительно подходов к лечению пациентов с остеоартритом. Обсуждаются особенности симптом-модифицирующих и структурно-модифицирующих лекарственных средств. К числу препаратов с хондропротективными и структурно-модифицирующими свойствами относится Пиаскледин 300, в состав которого входят неомыляемые соединения фитостеролов и жирных кислот. Пиаскледин представлен как антицитокиновый препарат, действие которого направлено на коррекцию ряда процессов, лежащих в основе нарушенного метаболизма хряща при остеоартите. Представлены результаты исследований структурно-модифицирующих и симптом-модифицирующих эффектов препарата.
The general approaches to the treatment of osteoarthritis and the main groups of drugs being used in the treatment of this disease are considered. The latest 2014 guidelines on the approaches to the treatment of osteoarthritis are presented. Features of symptom-modifying and structural-modifying drugs are discussed. Piascledine 300, containing avocado and soybeans unsaponifiables in the ratio 1 : 2, belongs to the drugs with chondroprotective and structure-modifying properties. Piascledine is described as anticytokine agent, its action is directed at correcting a number of processes which underlie the impaired metabolism of cartilage in osteoarthritis. The results of the studies on symptom-modifying and structure-modifying effects of this drug are presented.
остеоартрит, неомилювані фітостероли та жирні кислоти, Піаскледин 300, лікування, цитокіни, структурно-модифікуючий ефект, симптом-модифікуючий ефект, рекомендації.
остеоартрит, неомыляемые соединения фитостеролов и жирных кислот, Пиаскледин 300, лечение, цитокины, структурно-модифицирующий эффект, симптом-модифицирующий эффект, рекомендации.
osteoarthritis, unsaponifiables compounds of phytosterols and of fatty acids, Piascledine 300, treatment, cytokines, structure-modifying effect, symptom-modifying effect, guidelines.
Статья опубликована на с. 15-21
Остеоартроз (ОА) — найпоширеніше захворювання суглобів, клінічні симптоми якого спостерігаються більше ніж у 20 % населення земної кулі [5]. ОА зустрічається в кожного третього пацієнта віком від 45 до 64 років і в 60–70 % хворих віком понад 65 років, причому співвідношення чоловіків і жінок становить 1 : 3, а при ОА кульшових суглобів — 1 : 7 [10]. ОА значно погіршує якість життя хворих і є однією з основних причин виникнення тимчасової та стійкої втрати працездатності.
ОА традиційно визначався як «хронічне прогресуюче незапальне захворювання суглобів невідомої етіології, яке характеризується дегенерацією суглобового хряща та структурними змінами субхондральної кістки», а також «явно чи приховано перебігаючим помірно вираженим синовітом» [6, 9]. Останніми роками відбувся поворот у поглядах на механізми розвитку й прогресування ОА. Раніше захворювання розцінювалося як стигма старіння організму в цілому і супутнього процесу дегенерації суглобових структур зокрема [5, 9]. У даний час ОА сприймається не просто як хвороба зношування (хвороба wear and tear), а як анормальне ремоделювання суглобових тканин, кероване безліччю прозапальних факторів, що продукуються насамперед субхондральною кісткою й синовією [4, 11]. Анормальне/патологічне ремоделювання згодом формує метаболічну, а пізніше й функціональну дисфункцію всіх суглобових структур [21] з розвитком типової клінічної картини й однотипних патобіохімічних змін. Місцева продукція прозапальних цитокінів здатна також впливати на ініціацію й посилення інших вікозалежних і метаболічних захворювань. Не дарма ОА відносять до захворювань з одним із найвищих індексів коморбідності [4]. Нерозуміння багатьох істотних моментів ОА виявляється, зокрема, у тому, що в даний час у країнах пострадянського простору, у тому числі й в Україні, одну й ту ж хворобу називають то «деформуючим артрозом», то «остеоартритом», то «артрозом» [4, 6].
Згідно з сучасними уявленнями ОА розглядається як гетерогенна група захворювань різної етіології, але з подібними біологічними, морфологічними й клінічними результатами, при яких у патологічний процес залучається не тільки суглобовий хрящ, але й усі структури суглоба — субхондральна кістка, зв’язки, суглобова капсула, синовіальна оболонка й періартикулярні м’язи й зв’язки [4], тобто ОА сьогодні розглядається як хвороба всього суглоба [21].
У даний час розшифровані основні молекулярні механізми ОА [8]. В ініціації патологічних змін при первинному ОА та їх прогресуванні вирішальну роль відіграє гіперпродукція матриксних металопротеїназ (ММП), включаючи колагенази (ММП–1, –8, –13), агрекінази (ADAMTS4, ADAMTS5), стромелізин–1 (ММП–3) й желатинази (ММП–2, –9). У цьому процесі задіяний інтерлейкін–1b (ІЛ–1b), що експресується в ураженому хрящі й стимулює продукцію ММП. Крім того, цей цитокін безпосередньо впливає на темпи хрящової деструкції, гальмуючи синтез компонентів матриксу (агрекану й колагену ІІ типу) та стимулюючи продукцію інших прозапальних цитокінів (ІЛ–6, ІЛ–8). У складному багатоступеневому каскаді різних патологічних змін задіяні також простагландин Е2, оксид азоту, ростові фактори тощо. Ці порушення сприяють недостатньому синтезу хондроцитами протеогліканів і фрагментації протеогліканових агрегатів, тобто головним складовим патологічних порушень при ОА [8, 11].
Окрім серйозних досліджень патогенезу ОА і зміни поглядів на механізми розвитку й прогресування даної недуги, 2014 рік ознаменувався появою двох рекомендацій із менеджменту пацієнтів з ОА — рекомендацій OARSI та ESCEO [14, 24]. У рекомендаціях OARSI–2014 основна увага приділяється нехірургічному лікуванню пацієнтів з ОА колінних суглобів із поділом пацієнтів на фенотипові групи за наявності чи відсутності коморбідних станів. Рекомендації ESCEO–2014 подають алгоритм послідовних дій у разі діагностики ОА колінних суглобів (рис. 1). Ці рекомендації наголошують на необхідності комбінування лікувальних можливостей, включаючи фармакологічні й нефармакологічні методи. Ядро лікування (core set) формують освіта пацієнта, надання йому адекватної інформації, зниження маси тіла в разі ожиріння (індекс маси тіла > 25 кг/м2), фізична програма (аеробіка, витягнення, силові вправи, вправи на рівновагу тощо). Чотири кроки передбачають послідовні етапи застосування медикаментозних засобів.
Розкриття молекулярних механізмів деградації хряща та уточнення причин, що ведуть до персистуючого запалення безпосередньо в тканинах суглоба, слугували підставою для включення повільно діючих симптом–модифікуючих препаратів (symptomatic slow acting drugs for osteoarthritis — SYSADOA) як препаратів першої лінії в рекомендації щодо менеджменту остеоартриту колінного суглоба в Європі та світі ESCEO–2014. Симптом–модифікуюча та можлива структурно–модифікуюча дія цих засобів дозволяє активно впливати на перебіг і темпи подальшого прогресування захворювання. Згідно із рекомендаціями EULAR (2003) [19] і OARSI (2010) [27], до повільно діючих симптом–модифікуючих препаратів відносять хондроїтину сульфат, глюкозаміну сульфат, гіалуронову кислоту, неомилювані сполуки авокадо й сої (Піаскледин) та діацереїн. Для всіх цих сполук у численних клінічних дослідженнях доведений симптом–модифікуючий ефект щодо ОА, а також продемонстрована структурно–модифікуюча дія, тобто здатність препаратів впливати на прогресування патологічних змін при ОА. Що стосується інших препаратів, що належать до хондропротекторів, то їм тією чи іншою мірою притаманний аналгетичний і протизапальний ефект, але дані про їх вплив на прогресування ОА залишаються суперечливими [5].
Доцільність пошуку й використання структурно–модифікуючих препаратів обумовлена тим, що навіть у хворих із ІІІ–IV стадіями ОА хондроцити зберігають здатність до синтезу міжклітинного матриксу. Ефективна повільно діюча симптоматична терапія спрямована на стимуляцію хондробластами й хондроцитами синтезу макромолекул основної речовини гіалінового хряща, зокрема протеогліканів, зниження активності ММП й прозапальних цитокінів, активацію анаболічних процесів у матриксі хряща й створення умов для підвищення його резистентності. Окрім того, така терапія збільшує стійкість хондроцитів до негативного впливу як прозапальних цитокінів, так і більшості нестероїдних протизапальних препаратів, що чинять хондронегативний вплив.
Одним із представників класу SYSADOA є новий для України препарат Піаскледин 300 (ASU — в англомовній літературі), що має доведену клінічну ефективність і потенційні хондропротективні властивості [1, 2, 7]. Піаскледин містить комплекс неомилюваних фітостеролів та жирних кислот, які отримують з екстрактів масел авокадо та сої методом молекулярної дистиляції. Фітостероли інгібують абсорбцію холестеролу та перешкоджають його ендогенному біосинтезу. Також було продемонстровано, що фітостероли й частково b–ситостерол є протизапальними агентами з антиоксидантною й аналгетичною активністю [17]. Стиролові екстракти з різних рослин в експериментах на тваринах довели їх протизапальну дію [26].
Поєднане застосування екстрактів авокадо та сої викликає більш виражену інгібіцію цитокінів порівняно з їх ізольованим застосуванням, а ступінь гальмування залежить від співвідношення цих інгредієнтів [18]. Інкубація препаратів із різним співвідношенням зазначених компонентів — 1 : 2 (A1S2), 2 : 1 (A2S1) і 2 : 2 (A2S2) з культурою людських хондроцитів упродовж 72 годин за відсутності або при наявності ІЛ–1b довела, що НСАС у пропорціях 1 : 2 і 2 : 2 викликали суттєве й вірогідне зниження активності стромелізину в культурі клітин з одночасним зниженням експресії ІЛ–6 і ІЛ–8. Вірогідне зниження колагеназної активності відзначене тільки при застосуванні цих пропорцій НСАС, тоді як зниження на 45–50 % рівня простагландину Е2, що стимулюється ІЛ–1b, однаково мало місце при застосуванні всіх сумішей. Суміш, що містить дві частини екстракту соєвих бобів і одну частину авокадо (А1S2), є найбільш дієвою сполукою, що й використовується як лікарський препарат [18].
Піаскледин інгібує ІЛ–1, запобігаючи його шкідливій дії на хондроцити й синовіоцити, стимулює синтез колагену й протеогліканів, пригнічує стимульований ІЛ–1b синтез ММП (колагенази і стромелізину) хондроцитами, експресію ІЛ–6 та ІЛ–8, а також простагландину Е2, що обумовлює як антикатаболічний вплив на матрикс хряща, так і призупинення вторинного запалення в тканинах суглоба, а саме: у синовіальній оболонці, ентезах, субхондральній кістці й безпосередньо в гіаліновому хрящі. В експерименті було відзначено, що НСАС превентивно діють на розвиток посттравматичного ОА й можуть стимулювати процес відновлення хряща [2].
Однак, окрім впливу на синтез і вивільнення прозапальних цитокінів, простагландинів та активних форм кисню, що властиво також деяким іншим структурно–модифікуючим препаратам, Піаскледин 300 має унікальні фармакологічні особливості. Зокрема, він підвищує експресію трансформуючих факторів росту b1 (TGF–b1) і b2 (TGF–b2), а також інгібітора активатора плазміногену–1 (PAI–1) [13]. Трансформуючі фактори росту є цитокінами, що синтезуються хондроцитами й остеобластами; вони активно впливають на синтез макромолекул міжклітинної речовини суглобового хряща — протео–гліканів і колагену ІІ типу. З одного боку, TGFb відзначається анаболічним ефектом і є одним із найпотужніших стимуляторів синтезу матриксу суглобового хряща, з іншого — гальмує його деградацію, блокуючи експресію тканинних і плазмових металопротеїназ і пригнічуючи експресію рецепторів, чутливих до ІЛ–1. Щодо PAI–1, то він знижує продукцію плазміногену, що бере участь у пошкодженні суглобового хряща як опосередковано через стимуляцію ММП, так і внаслідок прямого впливу на хрящ шляхом активації деградації протеогліканів. Вплив Піаскледину на ростові фактори та PAI–1 дозволяє розглядати цей препарат як засіб з унікальним антицитокіновим механізмом дії.
Симптом–модифікуючий ефект Піаскледину, що полягає у зменшенні болю в суглобах і поліпшенні їх функціональної здатності, доведений результатами численних добре контрольованих досліджень.
Так, симптом–модифікуючий ефект Піаскледину був продемонстрований у подвійному сліпому плацебо–контрольованому рандомізованому клінічному дослідженні [12], що охоплювало 164 пацієнтів з ОА колінних і кульшових суглобів. Упродовж 3 місяців пацієнти з помірними або сильними болями отримували Піаскледин по 300 мг/добу або плацебо. Основним критерієм оцінки ефективності препарату була потреба в нестероїдних протизапальних препаратах: в інтервалі між 60–м і 90–м днями терапії вона була вірогідно меншою в групі Піаскледину (43,4 проти 69,7 % у групі плацебо; р < 0,001). Крім цього, кумулятивна доза НПЗП, використовувана пацієнтами в інтервалі між 45–м і 90–м днями лікування, була вірогідно нижчою в групі Піаскледину (р < 0,01) (табл. 1).
Через рік Е. Maheu і співавт. [23] опублікували результати іншого рандомізованого клінічного дослідження, тривалість якого становила 8 місяців (6 місяців — активна терапія, 2 місяці — оцінка післядії препарату). За всіма основними показниками Піаскледин перевершував плацебо. Так, середня вираженість болю до кінця лікування в основній групі знизилася з 56,1 ± 1,6 мм до 35,3 ± 2,3 мм за візуальною аналоговою шкалою (ВАШ; р = 0,003), а в групі порівняння — з 56,1 ± 1,8 мм до 45,7 ± 2,6 мм. Відзначено також вірогідне покращання функціонального стану суглобів і зменшення індексу Лекена (–2,1 ± 0,5; р < 0,001) порівняно з групою плацебо. Особливої уваги заслуговує проведена в цьому дослідженні оцінка потреби в НПЗП через 2 місяці після припинення прийому Піаскледину й плацебо: вона становила 40,5 і 56,4 % відповідно (р < 0,05). Дане дослідження підтвердило клінічно значущу перевагу Піаскледину над плацебо упродовж усього періоду терапії. Дослідники зробили висновок, що НСАС є повільно діючим симптоматичним лікарським засобом зі стійким ефектом і високим ступенем безпеки, а збереження симптоматичного ефекту після припинення прийому Піаскледину свідчить про наявність у препарату вираженого ефекту післядії.
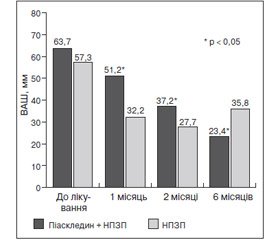
У відкритому дослідженні [2, 3], що включало 92 пацієнтів з ОА колінних і кульшових суглобів, симптом–модифікуючий ефект Піаскледину (n = 46) порівнювався з ефектом НПЗП (n = 46; добова доза еквівалентна 100 мг диклофенаку) за 6–місячний період. У групі пацієнтів, які отримували НПЗП, аналгетичний ефект проявлявся раніше: через 1 місяць зниження болю у спокої і особливо при рухах було більш істотним (p < 0,05). Однак після 3 місяців терапії позитивна динаміка больового синдрому в групі, що приймала Піаскледин, була вірогідно більш виражена, ніж у групі порівняння (p < 0,05 для обох показників) (рис. 2, 3).
При цьому через 3 міс. потреба в НПЗП в групі, що отримувала Піаскледин, зменшилася більше ніж у 2 рази, а до кінця дослідження — у 3 рази. У ці ж терміни відзначено й вірогідно більше покращання за індексом Лекена (р < 0,05 через 3 і 6 міс.). На фоні прийому Піаскледину через 3 міс. терапії індекс Лекена зменшувався більше ніж у 2 рази, а до кінця 6–го міс. — майже в 3 рази. Цілком імовірно, що аналгетичний ефект Піаскледину визначається не тільки протизапальною дією, але і його багатогранним впливом на цитокін–опосередковані патологічні ефекти при ОА [7].
Структурно–модифікуючий ефект Піаскледину був оцінений у багатоцентрових плацебо–конт–рольованих дослідженях [20, 22]. Дослідження, проведене M. Lequesne et al. у 2002 р., включило 163 пацієнтів з одно– або двобічним коксартрозом. Стадія за Kellgren–Lawrence до початку дослідження була I–II. Обов’язковим критерієм включення до дослідження було: рентгенологічно зареєстроване звуження щілини кульшового суглоба та постійний біль в уражених суглобах тривалістю не менше 6 міс. Рандомізовані пацієнти були розподілені на 2 групи: 85 хворих весь термін дослідження отримували 300 мг/добу Піаскледину, а 78 хворих — плацебо. У цілому в обох групах відзначалася подібна динаміка зміни суглобової щілини, але серед хворих, які мали ширину суглобової щілини на початку дослідження менше 2 мм, прийом Піаскледину зменшив негативну динаміку порівняно з плацебо практично у 2 рази: при прийомі Піаскледину зменшення ширини щілини за рік становило 0,24 мм, на тлі плацебо — 0,47 мм (p < 0,05).
Друге дослідження E. Maheu et al. — ERADIAS [22] — проводилося впродовж 3 років, включало 399 хворих із коксартрозом за наявності клінічної симптоматики (постійний або рецидивуючий біль упродовж останнього року, що відчувається не менше половини часу за останні 3 міс., альгофункціональний індекс Лекена для кульшового суглоба — від 3 до 10 балів). У цьому дослідженні оцінка зміни суглобової щілини в кульшовому суглобі була первинною кінцевою точкою й проводилася незалежним оцінювачем (рентгенограми були «засліплені») відповідно до останніх рекомендацій за стандартними позиціями й методикою рентгенологічного обстеження кульшових суглобів [16]. Включалися пацієнти з передньолатеральним або передньомедіальним ураженням, величина щілини повинна була варіювати від 1 до 4 мм. Враховуючи, що вже після початку дослідження міжнародний консенсуc [25] не рекомендував використовувати зміну суглобової щілини як первинну кінцеву точку у зв’язку із труднощами трактування такої зміни (нерівномірність і несиметричність змін), то додатково в групах хворих, які отримували Піаскледин або плацебо, оцінювалося число хворих із рентгенологічним прогресуванням. Прогресування деструкції реєструвалося, якщо зменшення суглобової щілини було ≥ 0,5 мм за 3 роки. Серед хворих, які закінчили дослідження (по 170 пацієнтів у кожній групі), зменшення суглобової щілини за 3 роки становило –0,67 мм у групі плацебо і –0,64 мм у групі хворих, які отримували активний препарат (різниця 0,034 мм; 95% ДI –0,156… –0,225), відмінності невірогідні (р = 0,72). При цьому вірогідно менше було хворих із рентгенологічним прогресуванням звуження суглобової щілини при лікуванні Піаскледином (40,4 %), ніж у групі плацебо (50,3 %) (р = 0,040) (рис. 4).
/20/20.jpg)
Метааналіз 4 контрольованих клінічних досліджень з Піаскледином [12, 20, 23] включив 664 пацієнтів з ОА кульшових (41,4 %) і колінних суглобів (58,6 %), з яких 336 хворих отримували Піаскледин по 300 мг/добу і 328 — плацебо впродовж 6 місяців [15]. Піаскледин перевершував плацебо щодо впливу на біль (середнє зменшення болю за ВАШ становило 10,7 % при гонартрозі й 11,3 % при коксартрозі; р = 0,04) і на функціональний індекс Лекена (р = 0,0003). У 3 дослідженнях відзначався вірогідно більший, ніж при застосуванні плацебо, позитивний ефект Піаскледину, тільки в дослідженні M. Lequesne et al. [20] симптоматичний ефект НСАС не відрізнявся від ефекту плацебо. Нагадаємо, що основним критерієм відбору хворих у це дослідження було значуще зменшення ширини суглобової щілини кульшового суглоба. А оскільки при ОА добре відома дисоціація між клінічними і рентгенологічними проявами, можливо, група хворих не мала виражених симптомів ОА.
Піаскледин характеризувався доброю переносимістю й високою безпекою в усіх проведених дослідженнях. Невелика кількість небажаних явищ при його прийомі спостерігається на першому етапі лікування, надалі вони повністю купіруються без зміни програми лікування. Важливим аспектом безпеки є відсутність значущих лікарських взаємодій Піаскледину з відомими лікарськими засобами, особливо це важливо для літніх хворих, які приймають досить широкий набір препаратів для лікування коморбідних станів [1, 3]. Препарат зручний для прийому — 1 капсула на день, що, безсумнівно, збільшує комплайєнтність у його застосуванні.
Особливий механізм дії Піаскледину 300, його висока дієвість, зручність застосування — 1 капсула на добу — і добра переносимість дозволяють рекомендувати цей препарат для лікування ОА як ефективний засіб, що має симптом–модифікуючі та структурно–модифікуючі властивості. Ці дані підтверджені численними контрольованими дослідженнями. Піаскледин повністю відповідає сучасним вимогам, що висуваються до лікарських препаратів для лікування ОА.
1. Алексеева Л.И., Чичасова Н.В., Кашеварова Н.Г. и др. Применение пиаскледина при остеоартрозе суставов кистей // Фарматека. — 2010. — № 10. — С. 48–55.
2. Бадокин В.В. Пиаскледин — хондропротективный препарат с антицитокиновой активностью // Consilium Medicum. — 2007. — № 8. — С. 145–150.
3. Бадокин В.В. Результаты многоцентрового исследования по оценке эффективности и переносимости Пиаскледина // Эффективная фармакотерапия. — 2011. — № 39. — С. 6–12.
4. Головач И.Ю. Остеоартрит: фундаментальные и прикладные аспекты этиопатогенеза заболевания. Ничего не стоит на месте // Укр. ревматол. журнал. — 2014. — № 2(56). — С. 4–11.
5. Коваленко В. М. Борткевич О.П. Остеоартроз. Практична настанова. — 3–тє вид., доп., зі змінами. — К.: Моріон, 2010. — 607 с.
6. Хитров Н.А. Остеоартроз и остеоартрит — от новых взглядов на патогенез к новому названию // Медицинский совет. — 2013. — № 4. — С. 74–78.
7. Чичасова Н.В., Алексеева Л.И., Бадокин В.В., Шостак Н.А. Опыт применения неомыляемых соединений авокадо и бобов сои (пиаскледин) в лечении остеоартроза различной локализации // РМЖ. — 2014. — Т. 22, № 7. — С. 524–531.
8. Шуба Н.М., Воронова Т.Д., Тарасенко Т.М., Крилова А.С. Нові аспекти патогенезу остеоартрозу та шляхи його корекції // Укр. мед. часопис. — 2012. — № 2(88). — С. 113–119.
9. Шумада И.В. Диагностика и лечение дегенеративно–дистрофических поражений суставов. — К.: Здоров’я, 1990. — 196 с.
10. Arden N., Nevitt M.C. Osteoarthritis: epidemiology // Best Pract. Res. Clin. Rheumatol. — 2006. — Vol. 20(1). — P. 3–25.
11. Berenbaum F. Osteoarthritis as an inflammatory disease (osteoarthritis is not osteoarthrosis!) // Osteoarthr. Cartilage. — 2013. — Vol. 21. — P. 16–21.
12. Blotman F., Maheu E., Wulwic A. et al. Efficacy and safety of avocado/soybean unsaponifiables in the treatment osteoarthritis of the knee and hip // Rev. Rhum. (Engl. Ed). — 1997. — Vol. 64. — P. 825–834.
13. Воumediene K., Felisaz P., Bogdanowicz P. et al. Avocado/soybean unsopanifiable enhance the eхpression of transforming growth 1, 2 in cultured articular chondrocytes // Arthritis Rheum. — 1999. — Vol. 42. — P.148–156.
14. Bruyиre O., Cooper C., Pelletier J.–P. et al. An algorithm recommendation for the management of knee osteoarthritis in Europe and internationally: A report from a task force of the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO) // Semin. Arthritis. Rheum. — 2014. — Vol. 44(3). — P. 253–263.
15. Christenen R., Barteles E.M., Astrup A. et al. Symptomatic efficacy of avocado/soybean unsaponifiables (ASU) in Osteoarthritis (OA) patients: a meta–analysis of randomized controlled trials // Osteoarthritis Cartilage. — 2008. — Vol. 6(2). — P. 339–408.
16. Conrozier T., Lequesne M.G., Tron A.M. et. al. The effect of position on the radiographic joint space in osteoarthritis of the hip // Osteoarthritis Cartilage. — 1997. — Vol. 5. — P. 17–22.
17. De Jong A., Plat J., Mensink R.P. Metabolic effects of plant sterols and stanols (review) // J. Nutr. Biochem. — 2003. — Vol. 14. — Р. 362–369.
18. Henrotin Y.E., Labasse A.H., Jaspar J.M. et al. Effects of three avocado/soybean unsopanifiable miхtures on metalloproteinases, cytokines and prostaglandin E2 production by human articular chondrocytes // Clinical Rheum. — 1998. — Vol. 17. — P. 31–39.
19. Jordan K.M., Arden N.K., Doherty M. et al. EULAR re–commendations 2003: an evidence based approach to the management of knee osteoarthritis: report or a task force of the standing committee for international clinical studies including therapeutic trials (ESCISIT) // Ann. Rheum. Diseases. — 2003. — Vol. 62. — P. 1145–1155.
20. Lequesne M., Maheu E., Cadet C. et al. Structural effect of avocado/soybean unsopanifiables on joint space loss in osteoarthritis of hip // Arthritis Care Research. — 2002. — Vol. 47. — Р. 50–58.
21. Loeser R.F., Goldrina S.R., Scanzello C.R. et al. Osteoarthritis: A Disease of the Joint as an Organ // Arthritis Rheum. — 2012. — Vol. 64(6). — P. 1697–1707.
22. Maheu E., Cadet C., Marty M. et. al. Randomised, controlled trial of avocado–soybean unsaponifiables (Piaskledine) effect on structure modification in hip osteoarthritis: the ERADIAS study // Ann. Rheum. Dis. — 2014. — Vol. 73. — P. 376–384.
23. Maheu E., Mazieres B., Valat J.–P. et al. Symptomatic efficacy of avocado/soybean unsaponifiables in the treatment of osteoarthritis of the knee and hip // Arthritis Rheum. — 1998. — Vol. 41. — P. 81–91.
24. McAlindon T.E., Bannuru R.R., Sullivan M.C. OARSI guidelines for the non–surgical management of knee osteoarthritis // Osteoarthritis and Cartilage. — 2014. — Vol. 22(3). — P. 363–388.
25. Ornetti P., Brandt K., Hellio Le Graverand M.P. et. al. OARSI–OMERACT definition of relevant radiological progression in hip/knee osteoarthritis // Osteoarthritis Cartilage. — 2009. — 17. — 856–63.
26. Soeken K.L. CAM therapies for arthritis–related pain: the evidence from systemic reviews // Clin. J. Pain. — 2004. — Vol. 20. — Р. 13–18.
27. Zhang W., Nuki G., Moskowitz R.W. et al. OARSI re–commendations for the management of hip and knee osteoarthritis: part III // Osteoarthritis Cartilage. — 2010. — Vol. 18(4). — P. 476–499.

/17/17.jpg)
/18/18.jpg)
/19/19.jpg)