Журнал «Здоровье ребенка» 1 (60) 2015
Вернуться к номеру
Клинико-иммунологические особенности бронхиальной астмы у детей, протекающей на фоне персистирующих внутриклеточных инфекций
Авторы: Чернышева О.Е. - Донецкий национальный медицинский университет им. М. Горького
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
В статье представлены сведения о влиянии персистирующих внутриклеточных инфекций на течение заболевания и состояние иммунной системы у детей, больных бронхиальной астмой. Описаны особенности клинического течения бронхиальной астмы, степень сенсибилизации, уровень провоспалительных (IL-1, IL-2, IL-6, IL-8, IFN-α и IFN-γ, ФНО-α) и противовоспалительных (IL-4, IL-10) цитокинов в сыворотке крови.
У статті представлено відомості про вплив персистуючих внутрішньоклітинних інфекцій на перебіг захворювання та стан імунної системи в дітей, хворих на бронхіальну астму. Описано особливості клінічного перебігу бронхіальної астми, ступінь сенсибілізації, рівень прозапальних (IL-1, IL-2, IL-6, IL-8, IFN-α і IFN-γ, ФНП-α) та протизапальних (IL-4, IL-10) цитокінів у сироватці крові.
The article presents information on the impact of persistent intracellular infections on the course of the disease and the state of immune system in children with bronchial asthma. Clinical features of bronchial asthma, the degree of sensitization, level of proinflammatory (IL-1, IL-2, IL-6, IL-8, IFN-α and IFN-γ, TNF-α) and antiinflammatory (IL-4, IL-10) cytokines in the blood serum are described.
бронхиальная астма, персистирующие инфекции, иммунитет.
бронхіальна астма, персистуючі інфекції, імунітет.
bronchial asthma, persistent infections, immunity.
Статья опубликована на с. 69-76
Бронхиальная астма является наиболее распространенным хроническим аллергическим заболеванием органов дыхания, дебют которого чаще приходится на детский возраст [1, 2]. Хронизация патологического процесса при бронхиальной астме приводит к ухудшению качества жизни больных, снижению их активности, инвалидизации и смертности [3–5]. Несмотря на внедрение в практику рекомендаций Международного консенсуса по диагностике и лечению бронхиальной астмы, унифицированных подходов к ее терапии с использованием современных ингаляционных противовоспалительных и бронхолитических средств, не всегда удается добиться контроля над заболеванием. Среди причин, нередко определяющих реализацию заболевания, его последующее течение, а порой и исход, большая роль в патогенезе бронхиальной астмы придается инфекции. Инфекции могут быть как пусковым механизмом развития заболевания, особенно у детей раннего возраста, так и триггерным механизмом обострений бронхиальной астмы [6]. Наиболее часто приводят к обострению бронхиальной астмы инфекционные вирусные заболевания дыхательных путей [7], в частности герпесвирусы (вирусы Эпштейна — Барр, герпес І, герпес ІІ, цитомегаловирус, их ассоциации), хламидийная инфекция, вызванная Chlamydophila pneumonia, и микоплазменная инфекция, вызванная Mycoplasma pneumoniaе [1].
Рост распространенности бронхиальной астмы, не всегда достаточная эффективность базисной противовоспалительной терапии, высокая заболеваемость респираторным хламидиозом, микоплазмозом, герпесвирусными инфекциями требуют разработки дополнительных мероприятий для контроля над астмой, предупреждения или замедления процессов ремоделирования дыхательных путей и улучшения качества жизни детей с этим хроническим заболеванием.
Целью нашей работы явилось определение особенностей клинического течения и состояния цитокинового статуса у детей с бронхиальной астмой, ассоциированной с герпесвирусными, хламидофильной, микоплазменной инфекциями.
Материалы и методы исследований
Проведено комплексное обследование 328 детей в возрасте от 1 до 15 лет, страдающих персистирующей бронхиальной астмой, в период обострения заболевания.
Диагноз бронхиальной астмы и степень тяжести устанавливали в соответствии с утвержденными критериями — приказом МЗ Украины № 767 и международными рекомендациями GІNA, 2009.
Для выявления степени влияния внутриклеточных возбудителей на течение бронхиальной астмы у всех детей определялся уровень иммуноглобулинов классов M и G в сыворотке крови, а также ДНК вируса простого герпеса І–ІІ типов, цитомегаловируса, Эпштейна — Барр-вируса, Сhlamydophila pneumoniae и Mycoplasma pneumoniaе в соскобе слизи со слизистой оболочки ротовой полости.
Объективный статус пациентов исследовался по общепринятой схеме, определение степени бронхиальной проходимости проводили методом пикфлоуметрии, спирометрии. Исследовались показатели, отражающие степень сенсибилизации организма (уровни в сыворотке крови общего иммуноглобулина Е, гистамина, серотонина), цитокиновый статус пациентов (определение сывороточного α-интерферона, γ-интерферона, интерлейкинов (IL) 1, 2, 4, 6, 8, 10, ФНО-α).
Статистическое описание выборок давали методами оценки вариационных рядов. Достоверность различий между относительными частотами устанавливали по критерию Стьюдента, дисперсионному анализу. Для сравнения групп степеней тяжести бронхиальной астмы использовался критерий ф* Фишера.
Результаты и обсуждение
В результате полученных данных были выделены 2 группы обследуемых детей. Основную группу (I группа) составили 256 детей с бронхиальной астмой, инфицированных внутриклеточными инфекциями: герпесвирусными, в частности вирусом простого герпеса І–ІІ типов, цитомегаловирусной, Эпштейна — Барр-вирусной, хламидофильной, вызванной Сhlamydophila pneumoniae, и микоплазменной — Mycoplasma pneumonia. В группу сравнения (ІІ группа) вошли 72 ребенка с бронхиальной астмой, не инфицированные внутриклеточными инфекциями. Группу контроля составили 50 практически здоровых детей аналогичного возраста.
В основной группе и группе сравнения отмечалось преобладание количества мальчиков над количеством девочек. Так, в основной группе было 173 (67,6 %) мальчика и 83 (32,4 %) девочки, в группе сравнения — соответственно — 48 (66,7 %) и 24 (33,3 %). Среди практически здоровых детей мальчиков было 34 (68,0 %), девочек — 16 (32,0 %). Средний возраст детей в основной группе составил 10,17 ± 0,45 года, в группе сравнения — 9,23 ± 1,23 года, в группе здоровых детей — 9,74 ± 0,87 года.
По возрастной структуре дети основной группы и группы сравнения различались между собой. В І группе количество детей школьного и дошкольного возраста было примерно одинаковым, а во ІІ группе преобладали дети школьного возраста (77,7 %). В основной группе дети подросткового возраста составили 12,5 %, в то время как в группе сравнения — 40,2 % (р < 0,05).
В соответствии с утвержденными критериями — приказом МЗ Украины № 767 и международными рекомендациями GІNA, 2009, наблюдаемые дети в зависимости от степени тяжести заболевания были распределены на 3 группы: с легким, среднетяжелым и тяжелым персистирующим течением (соответственно II, III, IV ступени) бронхиальной астмы.
В основной группе преобладали дети со среднетяжелым персистирующим течением (41,8 %, ф* = 2,7, р < 0,002), в группе сравнения — дети с легким персистирующим течением (63,9 %, ф* = 3,9, р < 0,001). В обеих группах меньшее количество детей отмечалось с тяжелым течением заболевания — соответственно 20, 3 и 11,1 % (ф* = 1,91, р < 0,025). Это подтверждает предположение о том, что внутриклеточное персистирующее инфицирование дыхательных путей при бронхиальной астме поддерживает хроническое воспаление и усугубляет течение патологического процесса, вызывая более тяжелое течение бронхиальной астмы у детей.
Длительность бронхиальной астмы в основной группе составила 5,43 ± 1,01 года и в группе сравнения — 5,19 ± 1,35 года.
Приступы бронхоспазма наблюдались 2,48 ± 0,19 и 2,63 ± 0,34 раза в месяц у детей I и II групп соответственно, ночные симптомы — 1,29 ± 0,12 и 1,31 ± 0,18 раза в месяц. При легком течении бронхиальной астмы приступы бронхоспазма развивались у больных I и II групп 0,96 ± 0,08 и 1,02 ± 0,09 раза в месяц соответственно, ночные симптомы наблюдались 0,59 ± 0,06 и 0,58 ± 0,09 раза в месяц. У пациентов со среднетяжелым течением заболевания приступы бронхоспазма развивались 4,39 ± 0,47 раза в месяц в основной группе и 4,27 ± 0,39 раза в месяц в группе сравнения. Ночные симптомы регистрировались соответственно 2,31 ± 0,19 и 2,48 ± 0,39 раза в месяц. При тяжелом течении заболевания приступы бронхоспазма развивались у детей основной группы и группы сравнения 23,72 ± 2,48 и 24,44 ± 2,91 раза в месяц соответственно, ночные симптомы — 18,78 ± 2,13 и 19,12 ± 2,23 раза. Достоверных различий в частоте эпизодов бронхоспазма у больных бронхиальной астмой детей в обеих группах не выявлено (p > 0,05).
При исследовании детей, больных бронхиальной астмой, у 256 (78,05 %) было выявлено наличие IgM и/или IgG к различным внутриклеточным персистирующим возбудителям — вирусу простого герпеса І–ІІ типов, цитомегаловирусу, Эпштейна — Барр-вирусу, Сhlamydophila pneumoniae и Mycoplasma pneumonia. Антитела к вирусу простого герпеса І–ІІ типов выявлены у 80 (31,3 %), цитомегаловирусу — у 124 (48,4 %), Эпштейна — Барр-вирусу — у 66 (25,8 %), Сhlamydophila pneumoniae — у 71 (66,8 %) и Mycoplasma pneumonia — у 33 (12,9 %) детей. У 134 (52,3 %) пациентов отмечалась сочетанная инфицированность различными возбудителями.
У 72 (21,95 %) наблюдаемых детей с бронхиальной астмой не были обнаружены IgM и/или IgG к различным вирусам, в связи с чем пациенты были отнесены ко ІІ группе — группе сравнения.
В группе детей, инфицированных внутриклеточными персистирующими возбудителями, определялось наличие ДНК возбудителей методом полимеразной цепной реакции с целью определения активности инфекционного процесса. Активное течение инфекционного процесса, вызванное внутриклеточными персистирующими возбудителями, наблюдалось у 164 (64,1 %) детей, латентное — у 92 (35,9 %) детей, больных бронхиальной астмой. ДНК вируса простого герпеса І–ІІ типов выявлено у 21 (26,3 %), цитомегаловируса — у 49 (39,5 %), Эпштейна — Барр-вируса — у 31 (46,9 %), Сhlamydophila pneumoniae — у 49 (69,1 %) и Mycoplasma pneumonia — у 8 (24,2 %) детей.
Нами были проанализированы различия в длительности текущего обострения бронхиальной астмы в группах детей, которая фиксировалась с момента первых симптомов бронхиальной обструкции, включая период не всегда эффективного амбулаторного лечения. При сопоставлении этих показателей было выявлено, что в группе детей с бронхиальной астмой, инфицированных персистирующими внутриклеточными инфекциями, длительность обострения была в 1,4 раза выше, чем в группе неинфицированных пациентов. Так, в основной группе длительность текущего обострения составила 24,9 ± 2,3 дня, а в группе сравнения — 17,6 ± 1,5 дня (p < 0,05). При легком персистирующем течении бронхиальной астмы длительность обострения в I группе составила 23,7 ± 2,5 дня, во II группе — 16,3 ± 1,7 дня, при среднетяжелом персистирующем течении — соответственно 25,1 ± 2,3 и 18,2 ± 1,6 дня, при тяжелом персистирующем течении — соответственно 27,3 ± 2,4 и 19,1 ± 1,8 дня (p < 0,05). Большая длительность обострения бронхиальной астмы в группе инфицированных внутриклеточными возбудителями детей может быть связана с отсутствием типичных приступов обострения и отсутствием патогенетического лечения, что влечет за собой более продолжительный временной этап неэффективного амбулаторного лечения.
В ходе исследования у детей, больных бронхиальной астмой, определялась функция внешнего дыхания. Данное исследование, с учетом особенностей его выполнения, мы проводили у детей с шестилетнего возраста: у 143 (55,9 %) детей с бронхиальной астмой, инфицированных внутриклеточными персистирующими инфекциями, и у 56 (77,8 %) детей с бронхиальной астмой, не инфицированных внутриклеточными персистирующими инфекциями. Было выявлено, что из всех 199 обследованных пациентов у 178 (89,5 %) отмечались нарушения функции внешнего дыхания по обструктивному или смешанному типу.
В основной группе наблюдения у 109 (76,2 %) пациентов выявлены вентиляционные нарушения по смешанному типу, в то время как в группе сравнения — у 4 (7,1 %). В группе сравнения у 42 (75,0 %) детей (p < 0,001) наблюдались нарушения функции внешнего дыхания по обструктивному типу. Скрытый бронхоспазм наблюдался более чем в 2 раза чаще в группе детей с бронхиальной астмой, не инфицированных внутриклеточными инфекциями, по сравнению с пациентами, у которых заболевание протекало на фоне инфицирования персистирующими патогенами, — соответственно у 10 (17,9 %) и 11 (7,7 %) детей.
Анализ клинического течения заболевания свидетельствует, что у детей, инфицированных герпесвирусами, период обострения бронхиальной астмы более длительный, что проявляется пролонгацией приступа бронхиальной обструкции и необходимостью применения более высоких доз ингаляционных кортикостероидов. Недостаточная эффективность лечения заболевания может быть связана с течением заболевания, сочетающимся с присоединением персистирующей внутриклеточной инфекции. У детей при бронхиальной астме, протекающей на фоне активной внутриклеточной инфекции, отмечается более длительное и частое развитие обострений заболевания с сочетанием обструктивного и интоксикационного синдромов. Для этих же детей характерен смешанный тип нарушений функции внешнего дыхания по сравнению с неинфицированными больными, у которых главенствующим является нарушение дыхания по обструктивному типу.
С целью оценки степени сенсибилизации детей с бронхиальной астмой, инфицированных и не инфицированных внутриклеточными возбудителями, были определены уровни иммуноглобулина класса Е (IgЕ), гистамина, серотонина в сыворотке крови. При оценке данного показателя в основной группе и группе сравнения было выявлено, что у детей до 5 лет уровень общего IgE был практически в 1,7 раза ниже в основной группе, чем в группе сравнения, и составил соответственно 224,83 ± 51,94 и 373,62 ± 76,92 нг/мл (p < 0,05). В группе младших школьников отмечалось другое соотношение показателя. В группе пациентов, инфицированных внутриклеточными инфекциями, уровень IgE был в 1,3 раза выше, чем у пациентов без инфицирования, и составил соответственно 392,21 ± 59,13 и 294,26 ± 58,64 нг/мл (p < 0,05). У детей старше 9 лет наблюдалось максимальное повышение уровня IgE. При этом в основной группе он был в 1,8 раза выше, чем в группе сравнения — соответственно 613,09 ± 60,48 и 341,84 ± 59,22 нг/мл (p < 0,05). Высокий уровень IgE свидетельствует о развитии IgE-опосредуемых аллергических реакций вследствие нарушения соотношения Th1/Th2 из-за переключения реакций с Th1-типа на Th2-тип [8–11].
Показатели гистамина и серотонина в сыворотке крови были статистически значимо выше в группе детей с бронхиальной астмой по сравнению с практически здоровыми детьми (p < 0,05).Уровень гистамина был выше в группе детей, больных бронхиальной астмой и инфицированных внутриклеточными возбудителями, и составил 0,14 ± 0,01 мкг/мл, в то время как в группе неинфицированных пациентов — 0,110 ± 0,004 мкг/мл (p < 0,05). Такая же зависимость отмечена и с уровнем серотонина. В основной группе его показатель составил 0,095 ± 0,004 мкг/мл, а в группе сравнения — 0,085 ± 0,003 мкг/мл (p < 0,05).
Таким образом, анализ показателей, характеризующих уровень сенсибилизации организма, в частности IgE, гистамина и серотонина, выявил более высокие значения в группе детей с бронхиальной астмой, инфицированных внутриклеточными возбудителями.
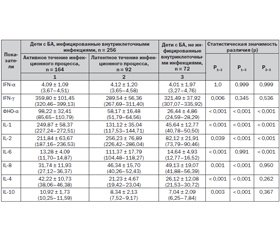
Выбор исследованных цитокинов в сыворотке крови, в частности провоспалительных — IL-1, IL-2, IL-6, IL-8, IFN-α и IFN-γ, ФНО-α и противовоспалительных — IL-4, IL-10, был основан на спектре их опосредованных возможностей. Диагностическую ценность в данном мониторинге представляли состояния, связанные с гипер- или гипопродукцией цитокинов (табл. 1, 2).
Нами получены данные о значительном снижении уровня IFN-α в сыворотке крови детей, больных бронхиальной астмой, как инфицированных, так и не инфицированных внутриклеточными возбудителями. Так, в основной группе пациентов уровень IFN-α был несколько выше, чем в группе сравнения, и соответственно составил 4,12 ± 1,05 и 4,01 ± 1,97 пг/мл. Статистической разницы между этими показателями не отмечалось (р = 0,999), однако отмечены статистически значимые различия между показателями инфицированных и не инфицированных внутриклеточными инфекциями детей с бронхиальной астмой и практически здоровыми детьми — 32,56 ± 8,17 пг/мл (p < 0,001). Статистически значимых различий между уровнем IFN-α в группе инфицированных детей с активным и латентным течением внутриклеточных инфекций выявлено не было. Уровень IFN-α при активном течении инфекции составил 4,09 ± 1,09 пг/мл, в группе сравнения — 4,12 ± 1,20 пг/мл (p = 1,0).
Таким образом, снижение уровня IFN-α свидетельствует о нарушении противовирусного иммунитета, нарушении стимуляции клеток, обладающих цитотоксической активностью. Низкие уровни IFN-α как при активном, так и при латентном течении внутриклеточных инфекций в основной группе пациентов способствуют хронизации инфекции и повышают вероятность рецидивов бронхообструкции.
Содержание уровня IFN-γ в сыворотке крови у детей, больных бронхиальной астмой, протекающей на фоне инфицирования внутриклеточными возбудителями и без него, в 3 раза превышало показатель практически здоровых детей, составляющий 110,64 ± 27,88 пг/мл (p < 0,001). В основной группе пациентов уровень IFN-γ составил 346,77 ± 93,20 пг/мл и был выше, чем в группе сравнения, — 321,49 ± 37,92 пг/мл, однако статистически значимого различия между ними выявлено не было (p = 0,741). При сравнении уровня IFNy у пациентов с бронхиальной астмой, инфицированных внутриклеточными возбудителями, было выявлено, что при активном течении инфекции уровень данного цитокина был выше и составил 359,80 ± 101,45 пг/мл по сравнению с показателем при латентном течении — 289,54 ± 56,36 пг/мл. Статистическое различие при этом составило p = 0,006.
Таким образом, гиперсекреция IFN-γ свидетельствует об активации Т-клеточного звена иммунитета в пользу Th1, особенно в группе детей с бронхиальной астмой, инфицированных внутриклеточными возбудителями, при активном течении инфекции. Пациенты, страдающие бронхиальной астмой, протекающей на фоне внутриклеточного инфицирования, подвергаются воздействию как со стороны возбудителей, так и со стороны IFN-γ. Высокий уровень продукции IFN-γ обычно ассоциируется с иммунным ответом на персистенцию внутриклеточных патогенов, а также с иммуноопосредованной и аутоиммунной патологией, связанной с реакциями гиперчувствительности замедленного типа, способствует хронизации инфекционно-воспалительного процесса и повышает риск развития системной хронической, в том числе аутоиммунной, патологии.
Поступление антигена в организм приводит к активации синтеза ряда медиаторов воспаления, в числе которых находится фактор некроза опухоли альфа (ФНО-α), который похож по действию с IL-1 и может ликвидировать не только клетки опухоли, но и клетки, пораженные вирусом [12]. Для пациентов, больных бронхиальной астмой, было характерно более высокое содержание ФНО-α в сыворотке крови по сравнению со здоровыми детьми (20,43 ± 4,97 пг/мл). Так, в группе детей с бронхиальной астмой, не инфицированных внутриклеточными возбудителями, уровень ФНО-α составил 26,44 ± 4,86 пг/мл (p < 0,001). Более выраженным данный показатель был в группе детей, инфицированных внутриклеточными инфектами (75,41 ± 19,34 пг/мл, p < 0,001), достигая наибольшего уровня при активном течении внутриклеточных инфекций (98,22 ± 32,41 пг/мл, p < 0,001). Отмечалось достоверно значимое различие показателя при активном (98,22 ± 32,41 пг/мл) и латентном течении инфекционного процесса (58,17 ± 16,48 пг/мл, p < 0,001). Учитывая тот факт, что ФНО-α является одним из важнейших провоспалительных цитокинов, запускающих воспаление, а также участвует в процессах деструкции и репарации, мы предполагаем неоднозначную природу повышения данного цитокина. Это может быть как неэффективность иммунного ответа на этапе стимуляции лейкоцитов, так и неэффективность фагоцитоза вследствие нарушения сигнала к активации фагоцитов. Подтверждается данный тезис фактом увеличения фагоцитарного числа на фоне снижения процента клеток, вступающих в фагоцитоз, что приводит к снижению уровня клеток, способных воспринимать сигналы к активации фагоцитоза. Иной причиной повышения уровня ФНОa может быть фактор аутоагрессии у детей, больных бронхиальной астмой и инфицированных внутриклеточными агентами. Данный процесс приводит к хронизации и изменению микроструктуры слизистой и подслизистой оболочек дыхательных путей.
Следствием постоянной антигенной нагрузки и хронического воспаления объясняется повышение уровня IL-1 у наблюдаемых пациентов, больных бронхиальной астмой. У пациентов основной группы и группы сравнения отмечалось повышение уровня IL-1 в сыворотке крови. Однако если у детей с бронхиальной астмой, не инфицированных внутриклеточными возбудителями, отмечалось троекратное повышение показателя, которое составило 45,64 ± 12,77 пг/мл по сравнению с 15,11 ± 4,05 пг/мл у здоровых детей (р = 0,008), то в группе пациентов, инфицированных внутриклеточными агентами, отмечалось уже многократное его увеличение — 183,46 ± 27,56 пг/мл (p < 0,001). Таким образом, отмечалось статистически значимое различие (p < 0,001) уровня IL–1 в группах детей с бронхиальной астмой, инфицированных и не инфицированных внутриклеточными инфекциями. При этом при активном течении инфекции уровень IL–1 составил 249,87 ± 58,37 пг/мл, что было статистически значимо выше, чем при латентном течении инфекции — 131,12 ± 35,04 пг/мл (p < 0,001). Следовательно, выявленные отклонения данного цитокина подтверждают зависимость его гиперпродукции от антигенной нагрузки у детей, больных бронхиальной астмой, которая усугубляется у пациентов, инфицированных внутриклеточными возбудителями, особенно при активном течении инфекционного процесса.
IL-1 обладает способностью влиять на синтез других цитокинов, что приводит к повышению активности представителей «провоспалительной» группы, в частности IL-2-8, TNF-α, INF, GM-CSF, G-CSF, M-CSF [13]. Поэтому закономерным было повышение активности IL-2 в сыворотке крови у наблюдаемых детей с бронхиальной астмой.
В группе детей, больных бронхиальной астмой и не инфицированных внутриклеточными возбудителями, наблюдалось статистически значимое повышение уровня IL-2, составившего 82,12 ± 21,91 пг/мл, по сравнению со здоровыми детьми — 13,99 ± 2,73 пг/мл, p < 0,001. Более значимое повышение данного цитокина по сравнению со здоровыми детьми отмечалось в группе детей с бронхиальной астмой, инфицированных внутриклеточными агентами (214,33 ± 61,13 пг/мл, p < 0,001). Необходимо отметить, что наличие внутриклеточной инфекции определяло статистически значимое различие уровня IL–2 в сыворотке крови детей с бронхиальной астмой по сравнению с не инфицированными данными возбудителями пациентами (p < 0,001). Наблюдались различия показателя при активном и латентном течении инфекции, которые соответственно составили 211,84 ± 63,67 и 256,23 ± 76,89 пг/мл (p = 0,039). Повышение уровня IL-2 было сопряжено с пролиферативной активацией клеточного звена иммунитета, особенно у детей с латентным течением инфекции. Такие реакции рассматриваются нами как компенсаторные механизмы, направленные на восстановление после инфекционного заболевания.
При анализе содержания IL-6 в сыворотке крови у обследованных детей было выявлено повышение уровня данного цитокина как в основной группе пациентов, так и в группе сравнения. Однако степень повышения данного цитокина была не такой высокой, как у IL-1 и IL-2. Если у практически здоровых детей уровень IL-6 составил 3,97 ± 1,89 пг/мл, то у детей с бронхиальной астмой, не инфицированных внутриклеточными возбудителями, он был повышен до 14,64 ± 4,93 пг/мл (p = 0,001). Уровень IL-6 у детей, больных бронхиальной астмой и инфицированных внутриклеточными инфекциями, был выше и уже составил 67,14 ± 12,24 пг/мл (p < 0,001). При этом разница показателей IL-6 у детей, больных бронхиальной астмой, инфицированных и не инфицированных внутриклеточными инфекциями, была статистически значимой, p < 0,001. В группе пациентов при активном течении инфекции уровень данного цитокина составил лишь 13,28 ± 4,09 пг/мл, в то время как при латентном — 111,37 ± 17,79 пг/мл (p < 0,001). Длительно высокий его уровень является индикатором развития осложнений или хронизации патологического воспалительного процесса [14].
Уровень IL-8 в сыворотке крови у обследуемых детей с бронхиальной астмой основной группы и группы сравнения был статистически значимо выше показателя практически здоровых детей (6,13 ± 1,86 пг/мл, p < 0,001). В группе инфицированных детей с бронхиальной астмой он составил 41,57 ± 8,19 пг/мл, а в группе неинфицированных пациентов среднестатистический показатель цитокина был максимально высоким — 49,13 ± 19,07 пг/мл, что не имело статистически значимой разницы (р = 0,274). В основной группе детей при активном течении внутриклеточной инфекции содержание IL-8 составило 31,74 ± 11,93 пг/мл, а при латентном — 46,34 ± 15,70 пг/мл, p = 0,001. IL-8 обладает выраженными провоспалительными свойствами посредством экспрессии молекул межклеточной адгезии и усиления прилипания нейтрофилов к эндотелиальным клеткам и субэндотелиальным матричным белкам. Это свидетельствует о его важной роли в опосредовании воспалительного ответа и подтверждает высокую напряженность иммунитета у детей, больных бронхиальной астмой, вследствие выраженной антигенной нагрузки, по всей видимости, обусловленной как основным заболеванием, так и действием персистирующих инфекций у пациентов основной группы. Кроме того, IL-8 способствует стимуляции высвобождения TGF-α, обладающего профиброзными эффектами, что приводит к ремоделированию слизистой оболочки дыхательных путей [15].
Значимыми иммунорегуляторными цитокинами, обладающими супрессорными эффектами, направленными на подавление воспалительного пролиферативного ответа, являются противовоспалительные цитокины IL-4 и IL-10. IL-4 является ключевым цитокином, определяющим формирование хронического аллергического воспаления у больных бронхиальной астмой [16]. Уровень IL-4 в сыворотке крови при бронхиальной астме у наблюдаемых детей, инфицированных и не инфицированных внутриклеточными возбудителями, статистически значимо превышал показатели здоровых детей (7,22 ± 2,93 пг/мл, p < 0,001), что характерно для аллергических заболеваний, и составил соответственно 33,65 ± 6,53 и 26,12 ± 12,08 пг/мл. В основной группе пациентов уровень IL-4 превышал показатели детей группы сравнения в 1,3 раза, разница была статистически значимой (p = 0,016). Определение более высокого уровня IL-4 у детей с бронхиальной астмой, инфицированных внутриклеточными возбудителями, по сравнению с неинфицированными пациентами позволяет предположить стимуляцию образования данного противовоспалительного цитокина внутриклеточными персистирующими возбудителями. У детей основной группы при активном течении внутриклеточного инфекционного процесса его уровень составил 42,22 ± 10,73 пг/мл, что было в 2 раза выше, чем при латентном течении инфекции (21,23 ± 4,67 пг/мл, p < 0,001).
Бронхиальная астма, протекающая как на фоне инфицирования пациентов внутриклеточными возбудителями, так и без инфицирования, отличается дефектом противовоспалительного ответа, что проявляется снижением концентрации IL-10 в сыворотке крови. Анализ уровня IL-10 в сыворотке крови больных бронхиальной астмой детей свидетельствует о статистически значимом снижении показателя по сравнению с показателем здоровых детей (14,87 ± 3,49 пг/мл, p < 0,001). Так, в основной группе этот показатель составил 9,64 ± 1,10 пг/мл, а в группе сравнения — 7,04 ± 2,09 пг/мл (р = 0,002). У детей основной группы при активном течении внутриклеточного инфекционного процесса уровень IL-10 составил 10,92 ± 1,73 пг/мл, при латентном течении инфекции — 8,34 ± 2,13 пг/мл, p = 0,003. Более высокий уровень IL-10 у детей, больных бронхиальной астмой, инфицированных внутриклеточными возбудителями, по сравнению с неинфицированными пациентами может косвенно свидетельствовать в пользу более глубокого угнетения иммунитета у пациентов основной группы, особенно в сочетании с гиперпродукцией IL-4, также оказывающего угнетающее влияние на клеточное и гуморальное звенья иммунитета. С другой стороны, известно, что IL-10 через свое регулирующее влияние на активность Т-клеток, моноцитов, макрофагов, естественных киллеров способен приводить к завершению воспалительного процесса. Противовоспалительный эффект IL-10 при атопии реализуется через увеличение продукции Т-лимфоцитами IFN-α [9].
По нашему мнению, сочетание сниженной продукции противовоспалительных цитокинов с повышением уровней провоспалительных цитокинов на фоне иммунного дисбаланса способствует поддержанию воспалительного процесса, провоцируя его хронизацию, формирование глубокого иммунного дисбаланса и возникновение необратимых изменений в дыхательных путях, приводящих к их ремоделированию. В результате таких изменений усиливается аллергическое воспаление слизистой оболочки дыхательных путей, что в конечном счете приводит к формированию более высокой гиперреактивности бронхов у детей с бронхиальной астмой, инфицированных внутриклеточными возбудителями, процессам ремоделирования дыхательных путей и затруднению контроля над течением заболевания.
Таким образом, персистирующую внутриклеточную инфекцию можно рассматривать как триггерный фактор, приводящий к повышению гиперреактивности бронхов, ухудшению течения бронхиальной астмы у детей, нарушению иммунного статуса, что диктует необходимость введения в комплекс обследования детей определение уровня иммуноглобулинов классов M и G в сыворотке крови, а также ДНК вируса простого герпеса І–ІІ типов, цитомегаловируса, Эпштейна — Барр-вируса, Сhlamydophila pneumoniae и Mycoplasma pneumoniaе в соскобе слизи со слизистой оболочки ротовой полости и, в случае обнаружения активного течения инфекционного процесса, проведение специфической этиотропной терапии.
1. Геппе Н.А. Бронхиальная астма и инфекции у детей: есть ли связь? // Аллергология и иммунология. — 2013. — № 1. — С. 9–10.
2. Уманець Т.Р. Клініко-анамнестичні особливості фенотипів бронхіальної астми у дітей // Перинаталогия и педиатрия. — 2011. — № 2(46). — С. 69–71.
3. Антипкин Ю.Г. Рецидивирующий бронхит у детей: дискуссионные вопросы / Ю.Г. Антипкин, В.Ф. Лапшин, Т.Р. Уманец // Здоров’я України: медична газета. — 2008. — № 18/1. — С. 19–21.
4. Антипкін Ю.Г., Надточій Т.Г. Сучасні погляди на етіопатогенез, клінінко-діагностичні та лікувально-профілактичні особливості перебігу запального процесу при неспецифічних захворюваннях органів дихання у дітей (огляд літератури) // Перинатология и педиатрия. — 2011. — № 1(45). — С. 19–23.
5. Крючко Т.А., Вовк Ю.А., Ткаченко О.Я. Роль генетических факторов в развитии тяжелой атопической бронхиальной астмы у детей // Здоровье ребенка. — 2012. — № 5(40). — С. 58–62.
6. Геппе Н.А. Новые международные рекомендации по бронхиальной астме у детей PRACTALL / Н.А. Геппе, В.А. Ревякина // Атмосфера. Пульмонология и аллергология. — 2008. — № 1. — С. 60–67.
7. Чучалин А.Г. Тяжелая бронхиальная астма // Русский медицинский журнал. — 2000. — № 8(12). — С. 82–87.
8. Балаболкин И.И., Смирнов И.Е., Булгакова В.А., Горюнов А.В., Ларькова И.А. Современная концепция патогенеза бронхиальной астмы у детей // Иммунопатология, аллергология, инфектология. — 2006. — № 1. — С. 26–35.
9. Маркелова Т.Н. Особенности цитокинового профиля, фармакотерапии и показателей качества жизни у детей дошкольного возраста с бронхиальной астмой: Автореф. дис… канд. мед. наук. — Самара, 2011. — 25 с.
10. Гречанина Е.Я., Безродная А.И., Ходош Э.М. Иммуногенетические характеристики бронхиальной астмы // Астма та алергія. — 2011. — № 3. — С. 23–26.
11. Силков А.Н.., Ковалевская-Кучерявенко, Сенников С.В. Цитокины в иммуногенезе атопического дерматита // Цитокины и воспаление. — 2012. — № 1. — С. 5–10.
12. Зайцева О.В., Лаврентьев А.В., Зайцева С.В., Самсыгина Г.А. Интерлейкин-1 альфа, фактор некроза опухолей-альфа и интерферон-гамма в сыворотке крови детей, больных бронхиальной астмой // Аллергология. — 2000. — № 3. — С. 7–12.
13. Ильина А.Е., Станислав М.Л., Денисов Л.Н., Насонов Е.Л. Интерлейкин 1 как медиатор воспаления и терапевтическая мишень // Научно-практическая ревматология. — 2011. — № 3. — С. 62–71.
14. Ячник А.И., Победенная Г.П. Механизмы реализации хронического воспаления при бронхиальной астме и возможные подходы к его лечению // Український пульмонологічний журнал. — 2005. — № 1. — С. 60–63.
15. Дугарова И.Д., Анаев Э.Х., Чучалин А.Г. О роли цитокинов при бронхиальной астме // Пульмонология. — 2009. — № 4. — С. 96–101.
16. Суханова Н.А., Цветков Э.А., Новик Г.А. Клиническое значение влияния латентной инфекции верхних дыхательных путей на течение бронхиальной астмы у детей // Педиатрическая фармакология. — 2012. — № 6. — Т. 9. — С. 54–60.

/72/72.jpg)
/73/73.jpg)