Журнал «Здоровье ребенка» 1 (60) 2015
Вернуться к номеру
Обґрунтування раціональної антибактеріальної терапії бактеріальних захворювань респіраторного тракту у дітей
Авторы: Леженко Г.О., Пашкова О.Є. - Запорізький державний медичний університет
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
У статті розглядається сучасний стан проблеми антибактеріальної терапії бактеріальних інфекцій дихальних шляхів у дітей. Науково обґрунтовано застосування при патології органів дихання препарату з групи цефалоспоринів ІІІ покоління — цефподоксиму проксетилу (Цефодокс). Наведено досвід зарубіжних та вітчизняних фахівців, а також власний досвід застосування цефподоксиму проксетилу в терапії респіраторних бактеріальних інфекцій у дітей.
В статье рассматривается современное состояние проблемы антибактериальной терапии бактериальных инфекций дыхательных путей у детей. Научно обосновано применение при патологии органов дыхания препарата из группы цефалоспоринов III поколения — цефподоксима проксетила (Цефодокс). Приведен опыт зарубежных и отечественных специалистов, а также собственный опыт применения цефподоксима проксетила в терапии респираторных бактериальных инфекций у детей.
This article discusses the current state of the problem of antibiotic therapy for bacterial respiratory infections in children. The use of third generation cephalosporin — cefpodoxime proxetil (Cefodox) in respiratory diseases is scientifically substantiated. The experience of foreign and domestic experts, as well as our own experience of using cefpodoxime proxetil in the treatment of respiratory bacterial infections in children, is provided.
респіраторні бактеріальні інфекції, діти, антибіотикотерапія, цефподоксиму проксетил.
респираторные бактериальные инфекции, дети, антибиотикотерапия, цефподоксима проксетил.
respiratory bacterial infections, children, antibacterial therapy, cefpodoxime proxetil.
Статья опубликована на с. 41-46
Гострі респіраторні захворювання продовжують займати провідне місце у структурі гострої інфекційної патології. За даними офіційної статистики, у структурі захворюваності дітей віком від 0 до 14 років хвороби органів дихання займають перше місце і становлять близько 62–65 % [3]. На інфекції дихальних шляхів та складні форми легеневих хвороб хворіють 90 тисяч зі 100 тисяч дітей [1].
Респіраторні інфекції, особливо при рецидивуючому їх перебігу, у клінічній практиці дуже часто є поєднанням інфекції верхніх дихальних шляхів та лор-патології. При цьому одне з перших місць серед захворювань лор-органів посідає гострий риносинусит. У світі щорічно реєструють близько 1 млрд випадків вірусних інфекцій дихальних шляхів, близько 5–13 % із яких ускладнюються бактеріальною інфекцією навколоносових синусів [8, 35].
Успішне лікування хворих із запальними захворюваннями органів дихання та лор-органів, в основі яких лежить бактеріальний процес, залежить насамперед від раціональної антибактеріальної терапії, що є невід’ємним компонентом лікування будь-якого мікробно-запального процесу [13, 14, 29]. Незважаючи на значний прогрес у розробці нових і ефективних протимікробних лікарських засобів, питання успішної терапії інфекційних захворювань продовжують зберігати свою актуальність. При цьому особливої гостроти ця проблема набуває в педіатричній практиці. Це пов’язано як зі значним поширенням означених захворювань у дітей, так і з високою частотою розвитку в них серйозних бактеріальних ускладнень. Не можна не відзначити і зростання при цьому резистентності бактеріальних збудників до антибіотиків за рахунок невиправдано широкого і безконтрольного застосування антибактеріальних препаратів у дітей.
У сучасних умовах провідне місце займають і питання фармекономіки. З огляду на зростання вартості лікарських засобів зміна антибактеріальної терапії на тлі неефективності стартових засобів, крім питань щодо якості надання медичної допомоги, несе проблему значного зростання курсової вартості терапії. Все це обумовлює необхідність суворого дотримання принципів раціональної антимікробної терапії з урахуванням вірогідного збудника інфекційного процесу.
Стартова антибактеріальна терапія призначається емпірично з урахуванням можливого збудника, а при нозокоміальній етіології захворювання — з урахуванням мікрофлори медичного закладу. Необхідно чітко дотримуватися дози і кратності введення препарату, брати до уваги супутню патологію, здатну вплинути на фармакокінетику антибіотика.
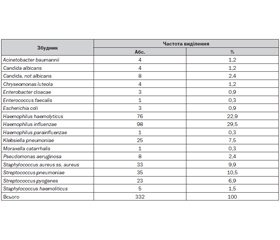
Проведений нами аналіз результатів бактеріологічного моніторингу збудників респіраторних захворювань у дітей — мешканців Запорізької області, результати якого надані в табл. 1, показав, що бактерії роду Haemophilus відіграють провідну роль в етіології інфекції дихальних шляхів, при яких на частку вказаних мікроорганізмів приходиться 52,7 % випадків. Частота виділення Haemophilus influenzae при рецидивуючому бронхіті становила 40,3 %, при пневмонії — 12,8 %, гострому бронхіті — 43 %, тонзилофарингіті та риносинуситі — 35–38 %.
Haemophilus influenzae — грамнегативна бактерія, що є факультативним анаеробом. Вона має природну стійкість до макролідів і аміноглікозидів, низьку природну чутливість до цефалоспоринів I покоління. Однак на сучасному етапі не отримано клінічних штамів Haemophilus influenzae, стійких до цефалоспоринів III–IV поколінь і карбапенемів [9].
Проведене нами дослідження чутливості Haemophilus influenzae, виділеної з верхніх дихальних шляхів 210 дітей, хворих на запальні захворювання бронхолегеневої системи, до антибактеріальних препаратів показало, що основна частина бактерій роду Haemophilus (92 %) була здатна до синтезу цефінази, що обумовлювало резистентність мікроорганізмів до амінопеніцилінів, карбоксипеніцилінів та уреїдопеніцилінів. У 24 % випадків виділені штами гемофільної палички проявляли стійкість до амоксициліну клавуланату та в 74 % штамів відмічена резистентність до ампіциліну. При цьому у всіх випадках мікроорганізми, що були виділені, мали високу чутливість до цефалоспоринів ІІ–ІІІ покоління.
Streptococcus pneumoniae — грампозитивна бактерія, що є другим за частотою збудником респіраторних захворювань у дітей. Згідно з проведеними нами дослідженнями, найбільш часто Streptococcus pneumoniae виступав етіологічним фактором при пневмоніях (15 дітей — 25 %) та рецидивуючому бронхіті (2 дітей — 25 %). У 38 хворих (20,9 %) Streptococcus pneumoniae ускладнював перебіг обструктивного бронхіту, при трахеїті та синуситі даний мікроорганізм виділявся в 19 (16,2 %) та 2 пацієнтів (16,7 %) відповідно. Проведений аналіз чутливості Streptococcus pneumoniae до антибіотиків показав, що найбільшу чутливість він проявляв стосовно цефалоспоринів ІІІ покоління, ванкоміцину та ципрофлоксацину. Звертала на себе увагу висока антибіотикорезистентність Streptococcus pneumoniae до кліндаміцину (50,0 %) та пеніцилінів (96,8 %) [17]. Останнім часом спостерігається значне зростання резистентності Streptococcus pneumoniae і до макролідів [16].
Відомо, що неадекватний вибір антибіотика, використання нераціональних режимів дозування певною мірою сприяють хронізації запального процесу, призводять до збільшення тривалості лікування та зростання витрат на надання медичної допомоги.
Використання в педіатрії антибіотиків регламентується низкою особливостей дитячого віку, і в першу чергу постійною зміною фізіологічних процесів, що визначають характер фармакодинаміки і фармакокінетики антибактеріальних препаратів.
З усього різноманіття постійно мінливих фізіологічних процесів в організмі дитини найбільший вплив на фармакокінетику і фармакодинаміку антибактеріальних препаратів мають:
— характер та інтенсивність абсорбції препарату, що тісно пов’язано з характеристиками шлунково-кишкового тракту (при прийомі всередину) і з характеристиками гемодинаміки і метаболізму (при парентеральному введенні);
— рівень активності ферментних систем, що тісно пов’язаний із віком дитини;
— об’єм екстрацелюлярної рідини і концентрація білка в плазмі крові, які також залежать від віку дитини;
— функціональна зрілість органів виведення — нирок і печінки.
До критеріїв вибору антибіотика в педіатричній практиці, крім урахування його антимікробної активності, пред’являють ще ряд особливих вимог [25]:
— високий ступінь безпеки;
— системність дії;
— мінімальний вплив на мікробіоценоз, у першу чергу кишечника.
При виборі способу введення антибіотика (парентеральний і пероральний), якщо можливо, в дітей слід віддати перевагу саме пероральному шляху як природному і найбільш щадному, що дозволяє мінімізувати психотравмуючий ефект.
Крім того, антибіотики повинні мати стабільну біологічну активність, не інактивуватися в макроорганізмі і не справляти на нього токсичну дію. Термін «ідеальний протимікробний засіб» має на увазі селективну токсичність щодо мікроорганізму і відсутність такої щодо макроорганізму [12, 27].
Найбільш часто при респіраторних інфекціях у дітей призначаються такі групи антибіотиків:
— бета-лактами;
— амінопеніциліни;
— комбінації амінопеніцилінів із інгібіторами лактамаз;
— цефалоспорини;
— макроліди.
Пеніциліни і цефалоспорини, як правило, добре переносяться. Проте напівсинтетичні пеніциліни при застосуванні per os можуть викликати неспецифічне подразнення слизової оболонки шлунка й кишечника з розвитком діареї. Найбільш небезпечна група ускладнень — дисбактеріоз і суперінфекція. З усіх випадків псевдомембранозного коліту, що реєструються сьогодні, 35 % пов’язані із застосуванням напівсинтетичних пеніцилінів, 25 % — цефалоспоринів, 15 % — фторхінолонів, 12 % — аміноглікозидів, 7 % — лінкозамінів і макролідів [16, 24].
Реакції гіперчутливості до напівсинтетичних пеніцилінів проявляються у вигляді шкірного висипу, набряку Квінке, бронхоспазму, еозинофілії, анафілактичного шоку. Серед проявів побічної дії, характерних для цієї групи препаратів: гранулоцитопенія, погіршення функції печінки і нирок, порушення гемостазу; при призначенні їх у високих дозах — енцефалопатія. Найбільш часто побічні реакції реєструються на амоксицилін, особливо в комбінації з клавулановою кислотою, що пояснюється тим фактом, що клавуланова кислота також є бета-лактамом [26]. Серед частих побічних ефектів при прийомі амоксициліну/клавуланової кислоти відзначаються розлади з боку травного тракту, у першу чергу діарея, що пов’язано з ефектами клавуланової кислоти [15]. За даними American Academy of Pediatrics, амоксицилін слід використовувати як препарат першої лінії тільки у дітей, які були раніше здоровими, та вакцинованих дітей [28].
Біосинтетичні пеніциліни малотоксичні і добре переносяться хворими. Ускладнення при їх застосуванні найчастіше проявляються у вигляді алергічних реакцій (10 %): шкірного висипання різного типу, у тому числі кропив’янки, що з’являється зазвичай після 7–10 днів лікування і може супроводжуватися підвищенням температури, лімфаденопатією, рідко — набряком [24]. Реакції гіперчутливості можуть розвиватися і після першого введення цих лікарських засобів, що може бути результатом сенсибілізації (при лікуванні пеніцилінами в минулому; вживанні продуктів, що містять слідові кількості антибіотиків; при переливанні крові зі слідами біосинтетичних пеніцилінів тощо). Алергізуючі властивості мають не тільки молекули цих лікарських засобів, але й продукти їх деградації [4].
Для цефалоспоринів також характерний ряд загальних системних проявів побічних дій. У першу чергу це стосується їх нефротоксичності, що характерна для препаратів I покоління, які елімінуються шляхом екскреції нирковими канальцями. Реакції підвищеної чутливості, що зустрічаються у 2–18 % випадків, проявляються переважно у вигляді різних проявів лікарської алергії. Особливе значення має перехресна алергія, тому хворі, які мали раніше алергічні реакції на пеніциліни, не повинні отримувати цефалоспорини. Препарати цефалоспоринів щодо ступеня ризику виникнення алергічних реакцій можна розташувати в такому порядку: цефтріаксон > цефоперазон > цефокситин > цефтазидим > цефотаксим > цефуроксим. Ризик розвитку перехресних реакцій на цефалоспорини у хворих з алергією на пеніцилін найбільш високий (10–15 %) для цефалоспоринів I покоління і мінімальний (1–2 %) для препаратів III–IV поколіня [5]. Порушення з боку нервової системи у вигляді психомоторного збудження, галюцинацій, екстрапірамідного синдрому, енцефалопатії, як правило, виникають при внутрішньовенному введенні препаратів даної групи. Зміни системи кровотворення зустрічаються нечасто. На сьогодні описані такі стани: агранулоцитоз, нейтропенія. Пероральне застосування цефалоспоринів може призводити до розвитку диспептичних явищ, нудоти, блювоти, діареї [24].
Макроліди на сьогодні становлять групу антибіотиків, на які найбільш часто виникають побічні реакції. На жаль, і до сьогодні часу реєструються так звані серйозні побічні реакції на азитроміцин. Серйозна побічна реакція — це будь-який несприятливий медичний прояв при застосуванні лікарського засобу (незалежно від дозування), який призводить до смерті, становить загрозу життю, вимагає госпіталізації або подовження терміну госпіталізації, призводить до довготривалої або значної непрацездатності чи інвалідності або до вродженої аномалії чи вади розвитку. FDA попередило про загрозу застосування азитроміцину пацієнтами, які страждають від серцево-судинних захворювань. Азитроміцин викликає порушення електричної активності серця і підвищує вірогідність розвитку аритмії. У групі ризику знаходяться хворі з подовженим інтервалом QT, брадикардією, гіпокаліємією та гіпомагніємією. Прийом азитроміцину може поглибити серцеві-судинні порушення і призвести до такого потенційно загрозливого ускладнення, як піруетна шлуночкова тахікардія (torsades de pointes). Існують повідомлення, що застосування азитроміцину асоціюється з підвищеним ризиком раптової серцевої смерті [28, 33].
Одним зі шляхів мінімізації побічних реакцій антибактеріальних лікарських засобів є застосування цефалоспоринів, що виробляються за унікальною технологією Prodrug (проліки). Означена технологія дозволяє підвищити біодоступність препарату, знижує його токсичність та мінімізує низку побічних дій, що притаманні антибактеріальним препаратам, зокрема порушення мікробіоценозу шлунково-кишкового тракту. Крім того, технологія Prodrug дозволяє підвищити пероральну абсорбцію препарату, захистити активну речовину від руйнування, вирішити питання захисту від дії соляної кислоти шлунка, забезпечити високу швидкість всмоктування.
На сьогодні за технологією Prodrug виробляється пероральний цефалоспорин III покоління цефподоксиму проксетил (Цефодокс), тобто це проліки, що стають активними лише в стінці тонкої кишки, де вони перетворюються на активну форму (цефподоксим).
Цефподоксиму проксетил активний щодо грампозитивної та грамнегативної флори. Особливості фармакокінетики препарату забезпечують збереження необхідної концентрації діючої речовини в плазмі крові протягом 12 годин, що обумовлює можливість ерадикації збудників [10, 23].
Цефподоксим швидко проникає в тканини, у тому числі мигдалини, легені й рідини організму. Концентрація цефподоксиму швидко досягає максимальних рівнів. Крім того, терапевтична концентрація цефподоксиму в слизовій оболонці носа виявляється вже після введення одноразової дози. Цефподоксим добре проникає в міжклітинну рідину і запальний ексудат, пов’язаний із пошкодженням шкіри. Клінічно значущі концентрації цефподоксиму виявляються в міометрії і простаті. Невелика кількість цефподоксиму виділяється в грудне молоко [30].
У слизовій оболонці гайморових пазух концентрація цефподоксиму становить 0,34 мг/л, у тканині піднебінних мигдалин — 0,24 мг/л, у паренхімі легенів — 0,63 мг/л, у слизовій оболонці бронхів — 0,91 мг/л, у плевральній рідині — 1,84 мг/л, а в запальній рідині — 2,84 мг/л [2]. Концентрація цефподоксиму в легеневій тканині через 6–8 годин понад МПК90 для таких респіраторних збудників, як Moraxella catarrhalis, у 2 рази, Haemophilus influenzae і Streptococcus pneumoniae — у 20 разів, Streptococcus pyogenes — приблизно в 70 разів [7].
Цефодоксу притаманний тривалий період напіввиведення. Фармакокінетичні властивості цефподоксиму не залежать від віку пацієнтів.
У педіатричній практиці Цефодокс призначається перорально у вигляді таблеток або суспензії з розрахунку 10 мг на 1 кг маси тіла на добу. Розрахункова доза приймається у 2 прийоми після їжі.
На сучасному етапі накопичена значна доказова база ефективності застосування цефподоксиму проксетилу в терапії бактеріальних респіраторних захворювань у дітей. Перш за все це вітчизняне проспективне дослідження «Цеф-ПРОСТО», де було показано високу ефективність препарату (88 % — висока та 10,2 % — помірна ефективність) у лікуванні бактеріальних захворювань органів дихання у дітей, а також доведено високий рівень безпеки препарату [6].
У проспективному дослідженні «ЦЕНТР» було показано, що ефективність застосування препарату Цефодокс становила 93,1 % у хворих на позагоспітальну пневмонію [11].
Результати проведеного багатоцентрового подвійного сліпого рандомізованого дослідження показали високу клінічну ефективність застосування цефподоксиму в лікуванні гострих бактеріальних інфекцій дихальних шляхів, яка становила 94,57 %. Частота побічних ефектів не перевищувала 5 % (4,48 %) [31].
Крім того, аналіз in vitro спектра антимікробної дії пероральних цефалоспоринів, що найбільш часто призначають в амбулаторній практиці при лікуванні інфекцій дихальних шляхів (цефаклор, цефдинір, цефподоксим, цефуроксиму аксетил, цефалексин), та амоксициліну клавуланату показав, що пероральні цефалоспорини III покоління мають більш широкий спектр активності проти основних бактеріальних патогенів порівняно з іншими пероральними цефалоспоринами попередніх поколінь або амоксициліну. Було показано, що на відміну від цефалексину і цефаклору цефподоксим проявляв високу активність щодо Streptococcus pneumoniae, як пеніцилінчутливих штамів, так і штамів із проміжною резистентністю до пеніциліну та пеніцилінрезистентних [30, 34]. Також цефподоксим проявляв активність щодо Haemophilus influenzae, Moraxella catarrhalis, у тому числі β-лактамазопродукуючих штамів [34].
За своєю клінічною ефективністю цефподоксиму проксетил не поступався цефтріаксону при лікуванні позалікарняної пневмонії в госпіталізованих пацієнтів, які мали додаткові фактори ризику (похилий вік, дихальна недостатність, серцево-судинні захворювання або куріння) [30].
Цефподоксим проявляє високу інгібуючу активність щодо анаеробних патогенних мікроорганізмів дихальних шляхів, включаючи Prevotella, Peptostreptococcus і Fusobacterium spp. [30].
Достатньо відомі праці науковців присвячені ефективному застосуванню Цефодоксу при захворюваннях лор-органів у дітей та дорослих [2, 22]. Результати, отримані професором В.В. Бережним зі співавт. (2007) у порівнянному дослідженні терапії гнійних синуситів із використанням Цефодоксу або комбінації амоксицилін + клавуланова кислота, свідчили про відсутність побічних реакцій у групі хворих, які отримували Цефодокс. У той же час у групі пацієнтів, де як стартовий антибіотик застосовувався амоксицилін/клавуланат, у 15 % дітей була відмічена діарея, у 5 % — алергічне висипання [2].
У дослідженнях H. Portier і співавт. (1994) було проведено порівняльну оцінку ефективності застосування цефподоксиму проксетилу 100 мг два рази на добу протягом 5 днів або феноксиметилпеніциліну 600 мг три рази на день протягом 10 днів у терапії бактеріального фарингіту/тонзиліту у 220 дорослих та дітей шкільного віку. Наприкінці лікування задовільна клінічна відповідь була отримана в 96,6 % пацієнтів, які отримували цефподоксиму проксетил, і 96,1 % хворих, які отримували феноксиметилпеніцилін. Було встановлено, що ерадикація β-гемолітичного стрептококу була досягнута у 96,3 % пацієнтів, яким було застосовано цефподоксиму проксетил, і в 94,1 % випадків при застосуванні феноксиметилпеніциліну. Повторне бактеріологічне дослідження через 20–30 днів після закінчення лікування показало відсутність β-гемолітичного стрептококу в 93,1 % пацієнтів, які отримували цефподоксиму проксетил, і 91,8 % пацієнтів, які отримували феноксиметилпеніцилін. При цьому погану переносимість препарату відмічали тільки 2 % пацієнтів, які отримували цефподоксиму проксетил, проти 16 % хворих, яким було застосовано феноксиметилпеніцилін. У результаті проведеного дослідження авторами було зроблено висновок, що за рахунок коротшої тривалості терапії в поєднанні з більш високою клінічною та бактеріологічною ефективністю цефподоксиму проксетил є препаратом вибору для лікування фарингітів/тонзилітів, викликаних β-гемолітичним стрептококом [32].
У наших попередніх дослідженнях було показано високу ефективність застосування цефподоксиму проксетилу в терапії бактеріальних інфекцій дихальних шляхів у дітей, у тому числі рецидивуючих бронхітів та пневмонії, зумовлених як Haemophilus influenzae, так і іншими збудниками [18–21].
Таким чином, наведені вище дані є свідченням того, що на сучасному етапі препаратом вибору в терапії бактеріальних захворювань респіраторного тракту у дітей у практиці лікаря першого контакту виступають пероральні цефалоспорини ІІІ покоління.
1. Альбицкий В.Ю. Прогноз развития научных исследований в педиатрии на 2006–2010 гг. / В.Ю. Альбицкий, И.И. Балаболкин, А.А. Баранов [и др.] // Вопросы современной педиатрии. — 2006. — № 5. — С. 111–113.
2. Бережной В.В. Опыт использования препарата «Цефодокс» в комплексной терапии гнойных синуситов у детей / В.В. Бережной, В.Г. Козачук, И.Б. Орлюк [и др.] // Современная педиатрия. — 2007. — № 3. — С. 88–92.
3. Василишин Х.І. Динаміка вмісту цинку та міді в дітей переддошкільного віку, хворих на негоспітальну пневмонію, асоційовану із залізодефіцитною анемією / Х.І. Василишин // Актуальні питання теоретичної та практичної медицини: Збірник тез доповідей ІІ Міжнародної науково-практичної конференції студентів та молодих вчених, м. Суми, 16–18 квітня 2014 р. / М.В. Погорєлов. — Суми: СумДУ, 2014. — С. 179.
4. Викторов А.П. Проблемы безопасности применения пенициллинов / А.П. Викторов, И.А. Логвина, Е.В. Матвеева, К.А. Посохова // Клиническая иммунология. Аллергология. Инфектология. — 2007. — № 1. — С. 36–38.
5. Викторов А.П. Анализ побочных действий антибиотиков группы цефалоспоринов в Украине по итогам 2005 года / А.П. Викторов, К.А. Посохова, Е.В. Матвеева [и др.] // Сімейна медицина: Наук.-практ. журн. — 2006. — № 3. — С. 42–43.
6. Волосовец А.П. Результаты многоцентрового исследования «Цеф-ПРОСТО» (цефподоксима проксетил в стартовой терапии внебольничной пневмонии у детей) в Украине / А.П. Волосовец, А.Е. Абатуров, Л.В. Беш [и др.] // Современная педиатрия. — 2011. — № 2(36). — С. 107–112.
7. Волосовец А.П. Цефодокс (цефподоксима проксетил): трехлетний анализ клинического использования в педиатрии / А.П. Волосовец, С.П. Кривопустов, О.Л. Дзюба [и др.] // Современная педиатрия. — 2009. — № 4. — С. 34–38.
8. Волянська Л.А. Гострий риносинусит у дітей у практиці лікаря загальної практики та раціональна антибіотикотерапія при його бактеріальній природі // Здоровье ребенка. — 2013. — № 6. — С. 9–13.
9. Выделение, идентификация и определение чувствительности к антибиотикам Haemophilus influenzae (Метод. рекомендации для микробиологов) // Клин. микробиол. и антимикроб. химиотерапия. — 2000. — Т. 2, № 2. — С. 93–109.
10. Диференційоване застосування антибактеріальних препаратів в педіатрії (по матеріалах IX Всеукраїнської науково–практичної конференції «Актуальні питання педіатрії») // Новости медицины и фармации. — 2007. — № 21–22. — С. 230–231.
11. Дядык А.И. Опыт применения цефподоксима у больных с внегоспитальными пневмониями (Результаты проспективного открытого исследования «ЦЕНТР») / А.И. Дядык, А.Э. Багрий, Н.Л. Суровцева [и др.] // Ліки України. — 2009. — № 8. — С. 73–75.
12. Жель Ф. Від антибіотикограми до рецепту / Ф. Жель, М. Шомара, М. Уебер [та ін.]. — К.: Логос, 2007. — С. 87–89.
13. Зоркин С.Н. Взгляд на антибактериальную терапию у детей с урологической патологией / С.Н. Зоркин, Л.К. Катосова, З.Н. Музыченко // Лечащий врач. — 2010. — № 8. — С. 6–10.
14. Коровина Н.А. Клинические аспекты применения цефалоспориновых антибиотиков в педиатрической практике / Н.А. Коровина, И.Н. Захарова, А.Л. Заплатников — М., 2000.
15. Крюков А.И. Возможности современных макролидов в стартовой терапии острого бактериального синусита / А.И. Крюков, А.В. Гуров, Г.Н. Изотова // Русский медицинский журнал. — 2012. — № 20 (27). — С. 1374–1377.
16. Кунельская Н.Л., Изотова Г.Н. Рациональная антибактериальная терапия острого отечно-инфильтративного ларингита / Н.Л. Кунельская, Г.Н. Изотова, С.Г. Романенко // Медицинский совет. — 2013. — № 7. — С. 18–20.
17. Леженко Г.О., Пашкова О.Є., Пантюшенко Л.І. Вибір раціональної антибактеріальної терапії у дітей з бактеріальними захворюваннями органів дихання в умовах зростання рівня антибіотикорезистентності // Современная педиатрия. — 2014. — № 5. — С. 77–82.
18. Леженко Г.О. Роль Haemophilus influenzae у формуванні інфекційної патології в дітей / Г.О. Леженко, О.Є. Пашкова, Л.І. Пантюшенко // Здоровье ребёнка. — 2013. — № 1. — С. 67–72.
19. Леженко Г.О. Досвід застосування цефодоксу в лікуванні позалікарняних пневмоній та рецидивуючих бронхітів у дітей / Г.О. Леженко, О.Є. Пашкова // Здоровье ребенка. — 2010. — № 4. — С. 29–31.
20. Леженко Г.О. Обґрунтування вибору тактики фармакотерапії гострих синуситів у дітей / Г.О. Леженко, О.Є. Пашкова, Л.І. Пантюшенко // Совр. педиатрия: науч.-практ. педиатрич. журн. — 2012. — № 3. — С. 95–98.
21. Леженко Г.О. Раціональна антибактеріальна терапія захворювань органів дихання у дітей / Г.О. Леженко, О.Є. Пашкова, Л.І. Пантюшенко // Совр. педиатрия. — 2013. — № 7. — С. 88–92.
22. Митин Ю.В. Целесообразность применения в лор-практике цефалоспоринов III поколения для приема внутрь / Ю.В. Митин, Я.Ю. Гомза // Журнал вушних, носових та горлових хвороб. — 2007. — № 2. — C. 59–63.
23. Нові перспективи використання пероральних цефалоспоринів в педіатрії. По матеріалах V Конгресу педіатрів України, 15–17 жовтня, м. Київ // Здоров’я України. — 2008. — № 24/1. — С. 36–37.
24. Посохова К.А. Антибіотики (властивості, застосування, взаємодія): Навч. посібник / К.А. Посохова, О.П. Вікторов. — Тернопіль: ТДМУ, 2005. — 296 с.
25. Самсыгина Г.А. Цефалоспорины в педиатрии // В мире лекарств. — 2000. — № 1. — С. 18–21.
26. Скороходкина О.В. Лекарственная аллергия при проведении антибиотикотерапии / О.В. Скороходкина, А.В. Лунцов // Вестник современной клинической медицины. — 2013. — Т. 6, вып. 3. — С. 60–67.
27. Хапалюк А.В. Клинико-фармакологическая характеристика и сравнительный анализ основных групп антибактериальных лекарственных средств / А.В. Хапалюк // Лечебное дело. — 2010. — № 5. — С. 64–82.
28. XV щорічна Всеукраїнська науково–практична конференція «Актуальні питання педіатрії» — Сідельниковські читання» // Здоров’я України. — 2013. — Тематичний випуск «Педіатрія». — С. 22–23.
29. Bartkowski D.P. Recognizing UTIs in infants and children. Early treatment prevents permanent damage / D.P. Bartkowski // Postgraduate medicine. — 2001. — Vol. 109, 1. — P. 177–181.
30. Frampton J.E. Cefpodoxime proxetil / J.E. Frampton, R.N. Brogden, H.D. Langtry, M.M. Buckley // Drugs. — 1992. — Vol. 44(5). — P. 889–917.
31. Huiling W.A.N.G. Multicenter, double-blind, randomized controlled clinical trial of cefcapene pivoxil hydrochloride tablets in the treatment of acute bacterial infections / W.A.N.G. Huiling, H.U.O. Li, W.A.N.G. Zhenshan [et al.] // The Chinese Journal of Clinical Pharmacology. — 2012. — Vol. 1. — P. 002.
32. Portier H. Five versus ten days treatment of streptococcal pharyngotonsillitis: a randomized controlled trial comparing cefpodoxime proxetil and phenoxymethyl penicillin / H. Portier, P. Chavanet, A. Waldner-Combernoux [et al.] // Scandinavian journal of infectious diseases. — 1994. — Vol. 26(1). — P. 59–66.
33. Ray W.A. Azithromycin and the Risk of Cardiovascular Death / W.A. Ray, K.T. Murray, K. Hall [et al.] // N. Engl. J. Med. — 2012. — Vol. 366. — P. 1881–1890.
34. Sadera H.S. Review of the spectrum and potency of orally administered cephalosporins and amoxicillin/clavulanate / H.S. Sadera, M.R. Jacobsb, T.R. Fritsche // Diagnostic Microbiology and Infectious Disease. — 2007. — Vol. 57 (3). — P. S5–S12.
35. Wald E.R. Sinusitis. Pediatric Infectious Diseases Principles and Practice / Ed. by Jenson H.B., Baltimore R.S. — 1st ed. — 2002. — Vol. 1. — P. 760–770.

/42/42.jpg)