Журнал «Здоровье ребенка» 1 (60) 2015
Вернуться к номеру
Функціональне значення однонуклеотидного поліморфізму (RS11204981) в гені філагрину (FLG) для лікування бронхіальної астми у дітей з атопічним дерматитом
Авторы: Волосовець О.П., Досенко В.Є., Кривопустов С.П., Павлик О.В., Ємець О.В., Строй Д.О. - Національний медичний університет імені О.О. Богомольця, м. Київ
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
Мета. Метою даного дослідження було визначити зв’язок однонуклеотидного поліморфізму в гені філагрину й експресії мРНК філагрину в букальному епітелії з фенотипом бронхіальної астми з атопічним дерматитом в анамнезі у дітей. Методи. Генотипування філагрину (rs11204981) проводили в групі хворих із бронхіальною астмою і контрольній групі за допомогою ПЛР у реальному часі. Рівень експресії мРНК оцінювався з використанням зворотної транскрипції та наступної ПЛР у реальному часі. Результати. Ми виявили, що 5 % пацієнтів основної групи і 2 % контрольної групи мали мінорну алель (АА), 27 і 36 % відповідно мали гетерозиготну алель, 67 і 61 % відповідно — мажорну алель. Варіанти з генотипом АА з rs11204981 FLG виявилися в 2,4 раза частіше у пацієнтів основної, ніж контрольної групи. Гетерозиготний варіант мав значно вищу експресію філагрину в букальному епітелії. Висновки. Ми вважаємо, що поліморфізм в гені філагрину (rs11204981) може служити як важливий прогностичний маркер для фенотипу бронхіальної астми та атопічного дерматиту і що високий рівень експресії в гетерозиготному стані може свідчити про протекторну роль даного генотипу у розвитку алергії.
Цель. Целью данного исследования было определить связь однонуклеотидного полиморфизма в гене филаггрина и экспрессии мРНК филаггрина в буккальном эпителии с фенотипом бронхиальной астмы и атопическим дерматитом в анамнезе у детей. Методы. Генотипирование филаггрина (rs11204981) проводили в группе больных с бронхиальной астмой и контрольной группе с помощью ПЦР в реальном времени. Уровень экспрессии мРНК оценивался с использованием обратной транскрипции и последующей ПЦР в реальном времени. Результаты. Мы обнаружили, что 5 % пациентов основной группы и 2 % контрольной группы имели минорную аллель (AA), 27 и 36 % соответственно имели гетерозиготную аллель, 67 и 61 % соответственно имели мажорную аллель. Варианты с генотипом АА с rs11204981 встречались в 2,4 раза чаще у пациентов основной, чем контрольной группы. Гетерозиготный вариант имел значительно более высокую экспрессию филаггрина в буккальном эпителии. Выводы. Мы считаем, что полиморфизм в гене филаггрина (rs11204981) может служить в качестве важного прогностического маркера для фенотипа бронхиальной астмы и атопического дерматита, и высокий уровень экспрессии в гетерозиготном состоянии может свидетельствовать о протекторной роли данного генотипа в развитии аллергии.
Objective. The objective of this study was to determine the correlation between single-nucleotide polymorphism in filaggrin gene and expression of filaggrin mRNA in buccal epithelium and the phenotype of bronchial asthma with atopic dermatitis in medical history of children. Methods. Filaggrin genotyping (rs11204981) was carried out in group of patients with bronchial asthma and control group using real-time polymerase chain reaction (PCR). The level of mRNA expression was assessed by reverse transcription and subsequent real-time PCR. Results. We have found that 5 % of patients in the study group and 2 % in the control group had a minor allele (AA), 27 and 36 %, respectively, — heterozygous allele (GA), 67 and 61 % — major allele (GG). Variants with the AA genotype of the FLG rs11204981 were found 2.4 times more often in patients from the study group than in controls. Heterozygous variant had significantly higher expression in filaggrin in buccal epithelium. Conclusions. We believe that polymorphism in filaggrin gene (rs11204981) can serve as an important prognostic marker for the phenotype of bronchial asthma and atopic dermatitis, and that high levels of expression in the heterozygous state may indicate the protective role of this genotype in the development of allergy.
однонуклеотидний поліморфізм, філагрин, астма, педіатрія.
однонуклеотидный полиморфизм, филаггрин, астма, педиатрия.
single-nucleotide polymorphism, filaggrin, asthma, pediatrics.
Статья опубликована на с. 14-18
Вступ
Атопічний дерматит (АД) є хронічним запальним захворюванням шкіри, що зазвичай пов’язане з іншими атопічними захворюваннями, такими як астма. Генетичні дефекти епідермальних білків, таких як філагрин (FLG), відіграють важливу роль у розвитку атопічного дерматиту. На сьогодні вивчається також їх зв’язок із комбінацією АД та астми [4].
Філагрин відіграє важливу роль у білково-ліпідній структурі рогового шару, який замінює плазматичну мембрану диференційованих кератиноцитів, утворюючи бар’єр, що перешкоджає втраті води і зменшує потрапляння алергенів і мікроорганізмів [7]. Ген філагрину розташований у комплексі епідермальної диференціації, на хромосомі 1q21. Мутації в гені філагрину є найбільш значним відомим генетичним фактором для розвитку АД [1]. Дослідження дефектів у гені FLG вказало на важливий зв’язок порушеного шкірного бар’єра з розвитком астми та алергії. У первинному дослідженні, яке продемонструвало зв’язок між АД і мутаціями у FLG, Palmer і співавт. (C.N. Palmer, 2006) також показали, що мутації в гені були тісно пов’язані з астмою, але тільки в тих осіб, у яких в анамнезі був АД.
Дефекти у FLG є важливими факторами ризику для кожного кроку атопічного маршу: атопічного дерматиту, алергічної сенсибілізації, астми з попереднім атопічним дерматитом, алергічного риніту. Генетичні варіанти (однонуклеотидний поліморфізм, SNPs) у FLG також є факторами ризику для алергічних захворювань, таких як астма [2, 5, 6, 8, 9]. Наявність поліморфізму може призводити до зміни рівня експресії даного гена і/або зміни структури його білкового продукту — філагрину. Це зниження бар’єрної функції може призводити до розвитку запалення у зв’язку зі збільшенням проникнення алергену через шкіру, призводячи до сенсибілізації до імуноглобуліну E (IgE). Дослідження функціонального значення генетичних варіантів у FLG показало, що цей ген, імовірно, робить свій внесок у механізми, за допомогою яких кількісне скорочення рівня внутрішньоклітинного філагрину (експресія матричної рибонуклеїнової кислоти (мРНК)) призводить до парацелюлярного бар’єрного дефекту [3].
Ми припустили, що поліморфізм rs11204981 у промоторній ділянці FLG може бути пов’язаний з АД у дитячому віці та фенотипом АД плюс астма. Щоб перевірити цю гіпотезу, ми досліджували відмінності в частоті цього SNP між дітьми без алергічної патології (контрольна група) та дітьми з бронхіальною астмою та АД в анамнезі. Було виявлено, що варіанти з генотипом АА на rs11204981 FLG у 2,4 раза частіше зустрічаються в пацієнтів основної, ніж контрольної групи. Функціональний аналіз цього SNP показав, що мРНК FLG експресується в гетерозигот у 4 рази частіше, ніж у пацієнтів із генотипом GG (р = 0,03), і в 4,3 раза частіше, ніж у генотипі АА (р = 0,9).
Матеріали та методи
Всі діти мали симптоми астми, АД на момент огляду або в анамнезі, алергічний риніт або принаймні один позитивний результат шкірного прик-тесту з панелі з 15 алергенами. Шкірні прик-тести були проведені та інтерпретовані згідно з протоколом Global Allergy and Asthma European Network, з використанням загальної панелі інгаляційних алергенів на основі опублікованих методичних рекомендацій (документ Європейської академії алергології та клінічної імунології (EAACI) та протокол Північних стандартів і міжнародного дослідження астми та алергії серед дітей (ISAAC), ІІ фаза). Батьки підписали інформовану згоду на включення в дослідження. Дослідження включало дітей віком від 5 до 18 років із бронхіальною астмою та АД, які перебували на стаціонарному лікуванні в алергологічному відділенні Київської міської дитячої клінічної лікарні № 2.
Встановлення діагнозу АД відбувалося на основі даних, внесених батьками в адаптовану затверджену анкету (ISAAC), і включало в себе скарги на висип, сухість шкіри, лущення, свербіж упродовж дитинства. Результатами клінічного обстеження відповідно до АД були висип, сухість шкіри, лущення, свербіж, ліхенізація. Наявність бронхіальної астми встановлювалась на основі даних, зі слів батьків, щодо персистуючого свистячого дихання (b 2 епізодів нападів, не пов’язаних з інфекцією верхніх дихальних шляхів), даних спірометрії (знижений об’єм у кінці першої секунди форсованого видиху (FEV1) і співвідношення FEV1/FVC (форсована життєва ємкість легень), позитивний тест з b2-агоністами), підвищення рівня IgE, позитивних шкірних прик-тестів з аероалергенами (табл. 1).
Вибір SNP
SNP rs11204981 у гені філагрину, розташований у промоторній ділянці, був обраний для генотипування, тому що гіпотетично він може впливати на експресію мРНК філагрину і, як повідомляється, зустрічається в європейських популяціях.
Виділення ДНК і РНК
Забір букального епітелію проводився з використанням букальних щіток з наступним заморожуванням зразків та їх зберіганням при температурі –20 °С. Дезоксирибонуклеїнову кислоту (ДНК) для генотипування екстрагували зі зразків із використанням наборів DiatomTM Prep 200 («Лаборатория Изоген», РФ) відповідно до протоколу виробника. РНК екстрагували зі зразків букального епітелію з використанням екстракції фенолом-хлороформом. Концентрацію загальної ДНК і РНК визначали за допомогою NanoDrop спектрофотометра ND1000 (NanoDrop Technologies Inc., США).
Генотипування методом полімеразної ланцюгової реакції (ПЛР)
Реакції ампліфікації проводили з використанням Fast Real-time PCR System (Applied Biosystems, США), у кінцевій реакції об’ємом 20 мкл, що містив 2X TaqMan Універсальний Master Mix (Applied Biosystems, США), assay C_1792560_10 і матричну ДНК. Ампліфікація фрагментів генів складалася зі стадії денатурації при 95 °С протягом 20 с, а потім 40 циклів ампліфікації при 95 °С протягом 3 с і 60 °С протягом 30 с. Аналіз даних проводився з 7500 Fast Real-Time PCR Software.
Оцінка експресії за допомогою зворотної транскрипції і ПЛР у реальному часі
Зворотну транскрипцію проводили з використанням RevertAid First Strand cDNA Synthesis Kit (Thermo Scientific, США). Отриману одноланцюгову ДНК використовували для ПЛР із застосуванням праймерів. Експресія гена FLG визначалась за допомогою TaqMan assay експресії генів (HS 00856927_g1, Applied Biosystems, США). Пари прямого і зворотного праймерів для генів, зазначених вище, і TaqMan зондів для цільових мРНК були розроблені Applied Biosystems на основі послідовності мРНК людини. Для контролю за якістю виділення РНК та порівняння інтенсивності експресії гена FLG паралельно ампліфікували фрагмент гена b-актину — одного з house-keeping генів із використанням TaqMan b-актину контроль реагенту (FAM Probe). Ампліфікація гена FLG складалася з таких циклів: денатурація — 95 °С протягом 20 с, приєднання праймерів — 95 °С протягом 3 с, елонгація — 60 °С протягом 30 с (45 циклів) із використанням 7500 Fast Real-Time PCR (Applied Biosystems). Аналіз даних проводився з 7500 Fast Real-Time PCR Software.
Статистичний аналіз
Отримані дані обробляли статистично з використанням програми Excel 2000 та Оrigin 7.0. Відмінність у частоті генотипу й алелей між групою пацієнтів із бронхіальною астмою і контрольною групою визначалась за допомогою x2-тесту. Значення р < 0,05 вважалося статистично значущим. Розподіл частот генотипів був проаналізований із використанням тесту x2 Пірсона з програмним забезпеченням Excel 2000. Для перевірки рівноваги Харді — Вайнберга використовували SNPAnalyzer (веб-програмне забезпечення).
Результати
Атопічний дерматит в анамнезі був присутній у 100 % дітей, 35 % із них мали прояви атопічного дерматиту на момент огляду у вигляді висипу, сухості шкіри, лущення, свербежу, ліхенізації. 80 % пацієнтів основної групи мали АД легкого ступеня тяжкості за шкалою SCORAD, 20 % — середнього ступеня тяжкості. Інша супутня алергічна патологія виявлена в 46 % дітей (алергічний риніт, харчова алергія). 72 % дітей мали загострення астми, що проявлялось наявністю свистячих хрипів і кашлем (з яких 60 % мали загострення легкого ступеня, 39 % — середньої тяжкості, 1 % — тяжке загострення), 28 % дітей мали ремісію. У 60 % пацієнтів основної групи виявлено зниження показника FEV1 (< 80 %), 34 % мали позитивний тест із b2-агоністом (табл. 1).
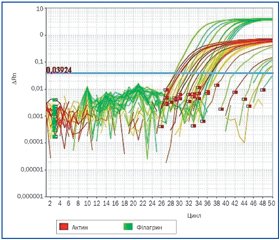
Розподіл генотипів SNP відповідає закону Харді — Вайнберга. Було виявлено, що у 5 % пацієнтів основної групи і у 2 % здорових дітей була наявна мінорна алель (AA) (р > 0,05 за x2-тестом, відношення шансів (ОR) — 2,28, 95% довірчий інтервал (ДІ) 0,42–12,2), 27 % пацієнтів основної групи і 36 % здорових дітей мали гетерозиготну алель (GA) (р > 0,05 за x2-тестом, ОR — 1,69, 95% ДІ 0,92–3,1), 67 і 61 % відповідно мали мажорну алель (GG) (р > 0,05 за x2-тестом) (табл. 2–4, рис. 1). Варіанти з генотипом АА з rs11204981 FLG виявилися у 2,4 раза частіше в основній, ніж у контрольній групі.
/17/17.jpg)
Експресія філагрину
Також виявлено, що рівень експресії мРНК філагрину у пацієнтів основної групи із генотипом GG становить 22,80 ± 11,67 (р > 0,05 порівняно з генотипом АА), 92,95 ± 35,30 — у генотипі GA (р < 0,05 порівняно з генотипом GG) і 21,8 ± 13,4 — у генотипі АА (р > 0,05 порівняно з генотипом GA). Таким чином, гетерозиготний варіант має значно вищу експресію філагрину в епітелії слизової оболонки рота (рис. 2).
Обговорення та висновки
Літературні дані висвітлюють важливу роль порушення функції епідермального бар’єра в розвитку АД і, можливо, фенотипу АД плюс астма. Поєднання АД та астми може становити особливий ендофенотип з унікальними патогенетичним і прогностичним значеннями. Ідентифікація факторів ризику, що можуть вплинути на ризик розвитку бронхіальної астми у дітей з АД, дуже важлива. Крім того, більш глибоке розуміння взаємозв’язку між АД та астмою може забезпечити розуміння патогенезу астми. Ми досліджували взаємозв’язок дитячого АД та астми з епідермальним білком, закодованим на 1q21, а також із даними експресії РНК і дослідженням відмінностей частот алелей у дітей з астмою. Було виявлено можливий зв’язок між SNP у гені FLG та фенотипом АД плюс астма в дітей. АА-генотип SNP rs11204981 є фактором ризику фенотипу АД плюс астма. Отримані результати експресії РНК філагрину в букальному епітелії, можливо, мають зв’язок із FLG-поліморфізмом. Таким чином, поліморфізм у гені FLG може вплинути на експресію філагрину у шкірі.
У даній роботі ми визначили частоту rs11204981 SNP і показали, що мінорна алель зустрічається в 2,4 раза частіше у пацієнтів основної групи, хоча не було отримано статистичної значущості. Асоціації генотипу з клінічними параметрами також не було встановлено раніше. Дослідниками був показаний зв’язок підвищеного ризику розвитку атопічного дерматиту з іншими поліморфізмами FLG, а саме S. Weidinger, A.G. Saffron (2013), M.H. Lambert та ін. (2010). Зокрема, були визначені позитивні асоціації rs2184951 і rs12730241 [6] із бронхіальною астмою та алергічними захворюваннями. Поліморфізм rs11204981 був широко вивчений у європейській популяції і, отже, був обраний нами для дослідження.
Тим не менше при вивченні рівня мРНК філагрину ми змогли показати, що цей поліморфізм функціональний і впливає на експресію філагрину. Експресія мРНК FLG в гетерозигот у 4 рази вища, ніж у гомозиготному генотипі GG (р < 0,05), і в 4,3 раза вища, ніж у гомозиготному генотипі ризику (р > 0,05).
Отримані дані щодо функціонального значення АA-генотипу FLG поліморфізму, таким чином, дають можливість припустити, що цей поліморфізм впливає на експресію цього гена та може мати прогностичне значення в розвитку астми та АД.
Таким чином, поліморфізм гена філагрину може самостійно служити корисним маркером для прогнозування розвитку бронхіальної астми у дітей з АД.
1. Brown S.J., Irwin McLean W.H. One remarkable molecule: Filaggrin // J. Invest. Dermatol. — 2012. — 132(3 Pt. 2). — 751-762. doi:10.1038/jid.2011.393.
2. Chang Y.C., Wu W.M., Chen C.H., Hu C.F., Hsu L.A. Association between P478S polymorphism of the filaggrin gene and risk of psoriasis in a Chinese population in Taiwan // Arch. Dermatol. Res. — 2008. — 300. — 133-7. doi:10.1007/s00403-007-0821-2.
3. Cole C., Karin Kroboth K., Schurch N.J. Filaggrin-stratified transcriptomic analysis of pediatric skin identifies mechanistic pathways in patients with atopic dermatitis // J. Allergy Clin. Immunol. — 2014. — 134(1). — 82-91. doi: 10.1016/j.jaci.2014.04.021
4. De Benedetto A., Kubo A., Beck L.A. Skin barrier disruption: a requirement for allergen sensitization? // J. Invest. Dermatol. — 2012. — 132. — 949-63.
5. Eun Joo Kim, Mi Sook Jeong et al. Genetic Polymorphism of FLG in Korean Ichthyosis Vulgaris Patients // Ann. Dermatol. — 2011. — 23(2). — 170-176. doi: 10.5021/ad.2011.23.2.170
6. Lambert M.H., Tremblay K. et al. Association between filaggrin family member genes, asthma, atopy and atopic asthma with atopic dermatitis history in the subjects from the Saguenay-Lac-Saint-Jean founder population // Allergy Asthma Clin. Immunol. — 2010. — 6(Suppl. 3). — P. 4. doi: 10.1186/1710-1492-6-S3-P4.
7. Palmer C.N.A., Irvine A.D., Terron-Kwiatkowski A. et al. Common loss-of-function variants of the epidermal barrier protein filaggrin are a major predisposing factor for atopic dermatitis // Nat. Genet. — 2006. — 38. — 441-6.
8. Seon-Young Kim, Sung Wan Yang et al. Association between P478S polymorphism of the filaggrin gene & atopic dermatitis // Indian. J. Med. Res. — 2013. — 138(6). — 922-927.
9. Wang I.J., Lin T.J., Kuo C.F., Lin S.L., Lee Y.L., Chen P.C. Filaggrin polymorphism P478S, IgE level, and atopic phenotypes // Br. J. Dermatol. — 2011. — 164. — 791-6.

/16/16.jpg)
/17/17_2.jpg)