Международный неврологический журнал 7 (69) 2014
Вернуться к номеру
S100β як маркер ушкодження головного мозку в неонатальній кардіохірургії при автогемотрансфузіях
Авторы: Ткаченко Я.В., Жовнір В.А., Воробйова Г.М. — ДУ «Науково-практичний медичний центр дитячої кардіології та кардіохірургії МОЗ України», м. Київ
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
Новонароджені з критичною вродженою вадою серця (ВВС), прооперовані в умовах штучного кровообігу, під час якого використовували аутологічну пуповинну кров, після операції мали статистично вірогідне зниження вмісту білка S100β у сироватці крові порівняно з доопераційним рівнем. Новонароджені з ВВС, яким під час операції застосовували компоненти донорської крові, на першу добу після операції мали статистично вірогідне підвищення рівня досліджуваного білка порівняно з доопераційним, що може свідчити про більш виражені порушення мозкового кровообігу під час операції в пацієнтів, яким переливали донорську кров.
Новорожденные с критическим врожденным пороком сердца (ВПС), прооперированные в условиях искусственного кровообращения, во время которого использовали аутологичную пуповинную кровь, после операции имели статистически достоверное снижение содержания белка S100β в сыворотке крови по сравнению с дооперационным уровнем. Новорожденные с ВПС, которым во время операции переливали компоненты донорской крови, в первые сутки после операции имели статистически достоверное повышение уровня исследуемого белка по сравнению с дооперационным, что может указывать на более выраженные нарушения мозгового кровообращения во время операции у пациентов, которым переливали донорскую кровь.
Neonates with critical congenital heart disease (CHD), who underwent surgery with cardiopulmonary bypass, during which autologous cord blood was used, after surgery had a statistically significant reduction of S100β protein content in the blood serum compared with the preoperative level. Neonates with CHD, in whom during surgery donated blood components were used, in the first day after surgery had a statistically significant increase in the level of the test protein compared with the preoperative level, which may indicate a more severe disorders of cerebral circulation during surgery in patients with donor-specific transfusion.
аутологічна пуповинна кров, вроджені вади серця, білок S100β.
аутологичная пуповинная кровь, врожденные пороки сердца, белок S100β.
autologous cord blood, congenital heart diseases, protein S100β.
Статья опубликована на с. 42-45
Вступ
Хірургічна корекція критичних вроджених вад серця (ВВС) з використанням апарата штучного кровообігу (АШК) вимагає застосування донорської крові. Трансфузія алогенної еритроцитарної маси призводить до порушень гомеостазу, більш виражених у новонароджених, ніж у дорослих. Пошук ефективних засобів трансфузійної безпеки у ДУ «НПМЦДКК МОЗ України» сприяв розробці альтернативного методу — автогемотрансфузії пуповинної крові в кардіохірургії новонароджених. Під час штучного кровообігу (ШК) розвиваються ішемічні ураження, що лежать в основі неврологічних порушень у післяопераційному періоді. У новонароджених важко оцінити ступінь порушень з боку центральної нервової системи. На сьогодні є роботи з оцінки ступеня ураження головного мозку за рівнем гліального білка S100β [1]. Саме тому концентрація цього білка підвищується у крові та спинномозковій рідині при ураженнях головного мозку. Гліальний білок S100β — це сироватковий маркер церебральної ішемії [2]. У пацієнтів, які перенесли інсульт, субарахноїдальний крововилив або травму головного мозку, а також у новонароджених при перинатальній асфіксії в цереброспинальній рідині і в крові відзначалося вірогідне підвищення рівня S100β [3–5]. Також білок S100 може бути використаний при спостереженні за пацієнтами з різними порушеннями мозкового кровообігу і у випадках екстракорпорального кровообігу [6]. Таким чином, оцінка стану центральної нервової системи в новонароджених, прооперованих в умовах штучного кровообігу, є важливим аспектом оцінки адекватності перфузії. Про вміст білка S100β у сироватці крові новонароджених із ВВС, яким під час операції із ШК переливалась аутологічна пуповинна кров, опублікованих результатів досліджень не знайдено.
Мета дослідження: вивчити сироватковий рівень білка S100β у новонароджених із вродженою вадою серця, яким під час операції з ШК використовували аутологічну пуповинну кров.
Матеріали і методи дослідження
Новонароджені з критичною ВВС, прооперовані в перші години життя з використанням аутологічної пуповинної крові під час ШК, — 1-ша група (n = 10), новонароджені, оперовані на 3-тю — 7-му добу життя з використанням компонентів донорської крові (стандартна методика) — 2-га група (n = 18), для контролю використовувалася пуповинна кров здорових новонароджених дітей (n = 20). Дослідження проводили в динаміці до операції, на 1-шу, 3-тю і 7-му добу після неї. Білок S100β у сироватці крові новонароджених визначали імуноферментним методом на апараті Multiskan Ascent V1.24, наборами CanAg S100 EIA фірми Fujirebio Diagnostics (Швеція). Визначення інтерлейкінів ІЛ-6, ІЛ-8 у сироватці периферичної крові проводили методом ELISA фірми eBioscience (Австрія) та індукованого гіпоксією фактора (HIF-1α) — наборами Surveyor (Канада), показники знімали на імуноферментному аналізаторі Multiskan Ascent (Фінляндія). Для контролю ураження головного мозку проводили МРТ-обстеження.
Статистичну обробку результатів досліджень здійснювали за допомогою пакета програм Statistica 8.0 (Stat-Soft, 2007, США). Результати наведено у вигляді непараметричного показника Median, 25–75 percentile.
Результати дослідження
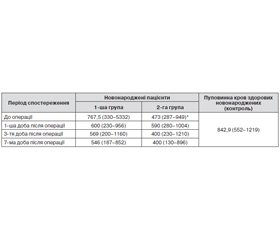
Раніше нами було досліджено індукований гіпоксією фактор у новонароджених, яким під час операції переливали аутологічну пуповинну кров або компоненти донорської крові [7]. HIF-1α є високочутливим специфічним маркером та основним медіатором адаптаційних процесів організму до гіпоксії. Тому в нашому дослідженні визначали рівень гліального білка S100β як маркера ураження головного мозку в новонароджених, прооперованих в умовах ШК із використанням аутологічної пуповинної крові. Результати виявлення білка S100β у сироватці крові новонароджених із ВВС наведено в табл. 1.
У результаті проведеного дослідження на доопераційному етапі новонароджені 1-ї групи не мали вірогідної відмінності за рівнем S100β у сироватці крові від показників контролю. На нашу думку, це пов’язано з віком пацієнта на момент дослідження. В умовах внутрішньоутробного перебування плода у фізіологічній гіпоксії на момент пологів, за даними літератури [8], пуповинна кров здорових новонароджених містить до 1,37 мкг/л білка S100β, тобто 1370 нг/л. Далі, після народження, рівень білка в сироватці крові знижується, якщо пологи не супроводжуються асфіксією. Новонароджені з транспозицією магістральних судин (ТМС) мають помірну гіпоксію в перші години життя, до проведення терапії щодо усунення вади, тому в першу добу життя пацієнти 1-ї групи не мали вірогідної відмінності за рівнем S100β у сироватці крові від контролю.
При проведенні кореляційного аналізу на доопераційному етапі в новонароджених 1-ї групи між раніше досліджуваним нами HIF-1α та рівнем білка S100β у сироватці крові виявилася сильна кореляція — r = 0,96; р < 0,05 та кореляція середньої сили — r = 0,55; р < 0,05 — між рівнем білка S100β та HIF-1α у новонароджених 2-ї групи на 1-шу добу після операції. Тобто ті діти, у яких була більш виражена гіпоксія, мали вищий показник HIF-1α в крові, відповідно, гіпоксичне ураження тканин головного мозку й підвищення S100β у сироватці крові.
У 2 новонароджених пацієнтів 1-ї групи рівень білка S100β у сироватці крові в день їх народження був занадто високим — 4171 та 6494 нг/л та показник HIF-1α — відповідно 3225 і 4866 пг/мл, в анамнезі вагітності матерів цих пацієнтів встановлено багатоводдя на 27–28-му тижні вагітності, в момент пологів води були зеленого кольору, новонароджені мали 5–6 балів за шкалою Апгар на момент народження, що зумовлювало більш тяжкий стан дітей. Це пояснює високі рівні досліджуваного білка S100β та індукованого гіпоксією фактора в сироватці крові цих пацієнтів порівняно з іншими новонародженими цієї групи.
Новонароджені 2-ї групи на момент дослідження мали 3–7 діб від народження й отримали курс терапії для усунення гіпоксичного стану, що притаманний даній ваді розвитку, тому на момент радикальної корекції вади в них рівень білка S100β у сироватці крові був вірогідно нижчим за контроль, що збігається з даними літератури [8]. Відомо, що перинатальна гіпоксія ініціює процеси, які призводять до підвищення проникності клітинних мембран, загибелі нейронів і гліальних клітин унаслідок некрозу або апоптозу, порушення цілісності структури гематоенцефалічного бар’єру, потрапляння в системний кровотік мозкових антигенів [9, 10].
На 1-шу добу після операції 80 % пацієнтів 1-ї групи мали вірогідне зниження досліджуваного показника, що відбувалося і в наступні 3-тю та 7-му доби після операції. Зниження рівня гліального білка у крові на 1-шу добу після операції в 1-й групі новонароджених може свідчити про повноцінне забезпечення мозку киснем під час ШК, що фізіологічно забезпечує аутологічна пуповинна кров. У пацієнтів 2-ї групи спостерігалось підвищення вмісту S100β у сироватці крові на 1-шу добу після операції порівняно з доопераційним рівнем. 50 % пацієнтів 2-ї групи, яким під час ШК застосовували донорську кров, мали на 1-шу добу після операції статистично значиме підвищення рівня S100β у сироватці крові, в 11 % пацієнтів цієї групи рівень досліджуваного показника у крові залишався незмінним, у 39 % новонароджених 2-ї групи відбувалось незначне зниження рівня S100β. На нашу думку, еритроцити дорослої людини не виконують повноцінно газообмінну функцію в організмі новонароджених дітей, що призводить до порушення мозкового кровообігу та ураження нейроглії. Наші дослідження лабораторних показників ураження головного мозку підтверджуються даними МРТ: паренхіматозних ушкоджень головного мозку у групі 1 не було виявлено, а у групі 2 вони діагностовані у 57 % випадків, а саме пошкодження білої речовини головного мозку. Це можна пояснити часом проведення операції: у новонароджених 1-ї групи вона проводилася в перші години життя, 2-ї групи — на 3-тю — 7-му добу після народження, і вплив гіпоксемії, що властива даному пороку розвитку, знайшов відображення в МРТ-дослідженні [11].
Для визначення імунобіологічної ролі досліджуваного білка було проведено кореляційний аналіз між рівнями S100β та раніше досліджуваних нами прозапальних цитокінів [12]. Простежувалися кореляції S100β та ІЛ-6 на 1-шу, 3-тю доби після операції (r = 0,76; р < 0,05), ІЛ-8 — на 7-му добу після операції (r = 0,77; р < 0,05) у новонароджених 2-ї групи; у пацієнтів 1-ї групи — ІЛ-6 і S100β у сироватці крові на 7-му добу після операції (r = 0,84; р < 0,05). Це може свідчити про здатність досліджуваного білка підсилювати продукцію ІЛ-6 та ІЛ-8, що було описано іншими авторами [13]. IL-6, у свою чергу, може індукувати каскад нейродегенеративних змін.
Таким чином, збільшення вмісту гліального білка S100β у сироватці крові простежується в перші години після ушкодження головного мозку. За проведеними нами дослідженнями можна дійти до висновку, що пацієнти 1-ї групи, яким переливалася аутологічна пуповинна кров під час операції, мали кращий газообмін у тканинах мозку під час ШК, завдяки функціональним особливостям фетальних еритроцитів, ніж пацієнти 2-ї групи. Це підтверджується лабораторними показниками (індукованим гіпоксією фактором та маркером ураження головного мозку — білком S100β) та свідчить про здатність власної пуповинної крові запобігати ураженню нервової тканини під час екстракорпорального кровообігу. Донорські еритроцити містять дорослий гемоглобін А, що не є фізіологічним для плода й новонародженої дитини, і повною мірою не виконують газообмінні функції у ще не сформованому організмі.
Завдяки визначенню нейроспецифічного білка S100β у сироватці крові новонароджених із ВВС можна зробити висновок, що аутологічна пуповинна кров є кращим трансфузійним середовищем під час операції на серці, ніж компоненти донорської крові.
Висновки
1. Новонароджені з ВВС 1-ї групи на першу добу після операції на серці з використанням аутологічної пуповинної крові мали зниження рівня нейроспецифічного білка S100β у сироватці крові відносно його показника до операції.
2. Новонароджені 2-ї групи на першу добу після операції з використанням донорської крові мали підвищення рівня досліджуваного білка в сироватці крові відносно доопераційного рівня, що вказує на ушкодження головного мозку новонародженого пацієнта під час штучного кровообігу.
1. Developmental and neurological status of children at 4 years of age after heart surgery with hypothermic circulatory arrest or low-flow cardiopulmonary bypass / D.C. Bellinger, D. Wypij, K.C. Kuban et al. // Circulation. — 1999. — V. 100. — P. 526–32.
2. Serum S-100B protein in severe head injury / A. Raabe, C. Grolms, O. Sorge et al. // Neurosurgery. — 1999. — V. 45. — P. 477–83.
3. Early neurobehavioral outcome after stroke is related to release of neurobiochemical markers of brain damage / M.T. Wunderlich, A.D. Ebert, T. Kratz et al. // Stroke. — 1999. — V. 30. — P. 1190–5.
4. Brain-specific proteins in the cerebrospinal fluid of severely asphyxiated newborn infants / M. Blennow, K. Savman, P. Ilves et al. // Acta Paediatr. — 2001. — V. 90. — P. 1171–1175.
5. Predictive value of S100B and neuron-specific enolase serum levels for adverse neurologic outcome after cardiac surgery / D. Georgiadis, A. Berger, E. Kowatschev et al. // J. Thorac. Cardiovasc Surg. — 2000. — V. 19. — Р. 138–47.
6. Pleines U.E., Morganti-Kossmann M.C., Rancan M. et al. S-100β reflects the extent of injury and outcome, whereas neuronal specific enolase is a better indicator of neuroinflammation in patients with severe traumatic brain injury // J. Neurotrauma. — 2001. — V. 18. — P. 491–498.
7. Ємець І.М., Воробйова Г.М., Федевич О.М., Часовський К.С., Жовнір В.А. Чернишук С.С., Максименко А.В. Спосіб лікування транспозиції магістральних судин серця у новонароджених в перші години життя. — Патент № 96700 від 25.11.2011.
8. S100 Protein in Serum as a Prognostic Marker for Cerebral Injury in Term Newborn Infants with Hypoxic Ischemic Encephalopathy / K. Thorngren-Jerneck, C. Alling, A. Herbst, I. Amer-Wåhlin, and K. Marsal // Pediatric research. — 2004. — Vol. 55, № 3.
9. Володин H.H., Дегтярев Д.Н., Хачатрян A.B., Хохлов А.П., Навасардянц Д.Г. Изменение содержания нейроспецифических белков НСЕ, ЛАП и цитокина ФНО-α у детей с перинатальным поражением ЦНС // Педиатрия. —1998. — № 5. — C. 15–20.
10. Гусев Е.И., Скворцова В.И. Ишемия головного мозга. — М., 2001. — 327 c.
11. Ершова Е.Б., Ялынская Т.А., Дыкан И.Н., Жовнир В.А., Емец И.Н. Диагностика повреждений головного мозга у новорожденных с транспозицией магистральных артерий после операции артериального переключения в первые постнатальные часы // Хірургія дитячого віку. — 2013. — № 1. — С. 48–53.
12. Ткаченко Я.В., Воробйова Г.М., Жовнір В.А., Ємець І.М. Вплив аутологічної пуповинної та донорської крові на цитокіновий профіль у новонароджених з транспозицією магістральних судин // Фізіологічний журнал. — 2012. — Т. 58, № 2. — С. 44–50.
13. Li Y., Barger S.W., Liu L. et al. S100β induction of the pro-inflammatory cytokine interleukin-6 in neurons // J. Neurochem. — 2000. — 74. — P. 143–150.

/43/43.jpg)