Журнал «Здоровье ребенка» 7 (58) 2014
Вернуться к номеру
Метод профилактики острых респираторных инфекций у детей с врожденными пороками сердца
Авторы: Бордюгова Е.В. - Донецкий национальный медицинский университет им. М. Горького
Рубрики: Кардиология, Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
Цель: изучить эффективность и безопасность рекомбинантного липосомального интерферона альфа-2β в профилактике острых респираторных инфекций (ОРИ) у детей с врожденными пороками сердца.
Материалы и методы. В предэпидемический период ОРИ 31 ребенку 3–12 лет с врожденными пороками сердца (основная группа) проводили оценку эффективности профилактической программы рекомбинантным липосомальным интерфероном альфа-2β: 250 000 ЕД 1 раз в сутки 2 раза в неделю в течение 1 месяца (методика I). В связи с недостаточной эффективностью в дальнейшем продолжили профилактику по методике II: 250 000 ЕД 2 раза в сутки в течение 3 дней, затем по 250 000 ЕД 1 раз в сутки 2 раза в неделю в течение 1 месяца. Клинико-лабораторное обследование (в том числе оценку уровня лизоцима, лактоферрина и секреторного иммуноглобулина А) проводили до начала профилактического воздействия, на 30, 120, 180-й день. Оценивали удовлетворенность результатами профилактики, побочные явления. Контрольную группу составили 20 здоровых сверстников.
Результаты. Исходно у детей с врожденными пороками сердца выявлено снижение в ротоглоточном секрете уровня лизоцима, лактоферрина и секреторного иммуноглобулина А. После профилактической программы по методике I констатировано уменьшение частоты и продолжительности ОРИ и осложнений. Профилактическая программа по методике II продемонстрировала большую эффективность по названным выше показателям. Все дети хорошо переносили профилактическое лечение, побочных эффектов не было.
Выводы. Выявлено снижение показателей местного иммунитета у детей с врожденными пороками сердца, что повышает риск заболеваемости ОРИ. Высокая эффективность и безопасность рекомбинантного липосомального интерферона альфа-2β являются основанием для его использования у детей с целью профилактики ОРИ.
Мета: вивчити ефективність і безпечність рекомбінантного ліпосомального інтерферону альфа-2β у профілактиці гострих респіраторних інфекцій (ГРІ) у дітей із вродженими вадами серця.
Матеріали і методи. У передепідемічний період ГРІ 31 дитині 3–12 років із вродженими вадами серця (основна група) проводили оцінку ефективності профілактичної програми рекомбінантним ліпосомальним інтерфероном альфа-2β: 250 000 ОД 1 раз на добу 2 рази на тиждень протягом 1 місяця (методика I). У зв’язку з недостатньою ефективністю надалі продовжили профілактику за методикою II: 250 000 ОД 2 рази на добу протягом 3 днів, потім по 250 000 ОД 1 раз на добу 2 рази на тиждень протягом 1 місяця. Клініко-лабораторне обстеження (у тому числі оцінку рівня лізоциму, лактоферину і секреторного імуноглобуліну А) проводили до початку профілактичного впливу, на 30, 120, 180-й день. Оцінювали задоволеність результатами профілактики, небажані явища. Контрольну групу становили 20 здорових однолітків.
Результати. Початково у дітей із вродженими вадами серця виявлено зниження в ротоглоточному секреті рівня лізоциму, лактоферину і секреторного імуноглобуліну А. Після профілактичної програми за методикою I констатовано зменшення частоти і тривалості ГРІ й ускладнень. Профілактична програма за методикою II продемонструвала більшу ефективність за вказаними вище показниками. Усі діти добре переносили профілактичне лікування, небажаних ефектів не було.
Висновки. Виявлено зниження показників місцевого імунітету у дітей із вродженими вадами серця, що підвищує ризик захворюваності ГРІ. Висока ефективність і безпека рекомбінантного ліпосомального інтерферону альфа-2β є підставою для його використання у дітей з метою профілактики ГРІ.
Aim: to study the efficacy and safety of liposomal recombinant interferon alpha-2β in the prevention of acute respiratory infections (ARI) in children with congenital heart disease (CHD).
Materials and Methods. In the pre-epidemic period of ARI 31 children 3–12 years old with congenital heart disease (study group) were evaluated the efficacy of a prevention program with liposomal recombinant interferon alpha-2β: 250,000 IU 1 time per day 2 times a week for 1 month (method I). Due to lack of efficacy, later prevention was continued by method II: 250,000 IU 2 times a day for 3 days, then 250,000 IU once a day, 2 times a week for one month. Clinical and laboratory examination (including assessment of the level of lysozyme, lactoferrin and secretory immunoglobulin A) was performed before the preventive effects, on the 30th, 120th, 180th day. Satisfaction with the results of prevention, side effects were assessed. The control group included 20 healthy peers.
Results. Initially children with congenital heart disease showed a reduction in oropharyngeal secretions of lysozyme, lactoferrin and secretory immunoglobulin A levels. After a prevention program by method I, we have stated a decrease in the incidence, duration and complications of ARI. Prevention program by method II showed greater efficiency on the above parameters. All children tolerated preventive treatment well, side effects were not deceted.
Conclusions. There was a reduction of local immunity parameters in children with congenital heart disease, which increases the risk of ARI morbidity. High efficiency and safety of liposomal recombinant interferon alpha-2β are the basis for its use in children to prevent ARI.
дети, врожденные пороки сердца, местный иммунитет.
діти, вроджені вади серця, місцевий імунітет.
children, congenital heart diseases, local immunity.
Статья опубликована на с. 21-26
В структуре общей заболеваемости детей и взрослых в Украине ведущее место занимают болезни органов дыхания [9], при этом удельный вес острых респираторных вирусных инфекций (ОРВИ), включая грипп, достигает 95 % [5, 9, 11, 19]. Заболеваемость детей ОРВИ в 1,5–3 раза выше, чем у взрослых [1, 5]. Особым контингентом при этом являются дети с врожденными пороками сердца (ВПС), у которых острые респираторные инфекции (ОРИ) наблюдаются чаще и протекают тяжелее, а инфекционный процесс нередко характеризуется затяжным течением, сопровождается бактериальными осложнениями, может стать причиной летального исхода. Указанное является следствием нарушений гемодинамики с увеличением кровотока в малом круге кровообращения и/или особенностями иммунной системы [12]. Согласно данным литературы [10] и нашим многолетним наблюдениям, даже успешно проведенная хирургическая коррекция ВПС не всегда избавляет пациента от частых ОРИ. По мнению Н.Н. Рябкиной [10], такие дети болеют ОРИ в 3,75 раза чаще здоровых сверстников, чему способствуют снижение уровня резервных возможностей кардиореспираторной системы, асинхронное физическое развитие за счет снижения показателей массы тела, роста и окружности грудной клетки, низкая устойчивость к гипоксии. Несмотря на значительное количество имеющихся медикаментозных препаратов, поиск путей эффективной профилактики ОРИ у детей с ВПС остается актуальной проблемой.
В связи с указанным наше внимание было обращено на рекомбинантный липосомальный альфа-2β интерферон (РЛα2βИ) для перорального приема, обладающий противовирусным и иммунокорригирующим свойствами с доказанным оптимальным режимом внутриклеточной доставки [1, 4, 6, 14].
Использование липосом для доставки лекарственных препаратов — одно из прогрессивных направлений в фармакологии и медицине [1, 4], разработанных на основе изучения базовых процессов клеточной физиологии. В середине 60-х годов ХХ столетия английским ученым А. Бэнгхемом установлено, что фосфолипиды, входящие в состав клеточных мембран, способны самопроизвольно образовывать в воде замкнутые оболочки, захватывающие в себя часть окружающего водного раствора. Они получили название везикул или липосом [1, 3, 14]. За раскрытие механизма везикулярного транспорта — главной транспортной системы в клетках организма — Рэнди Шекману, Джеймсу Ротману и Томасу Зюдхофу (США) в 2013 году была присуждена Нобелевская премия по физиологии и медицине. За разработку целевой доставки лекарства внутрь живой клетки Александр Соболев, Андрей Розенкранц и Владимир Лунин (Россия) в 2013 г. были удостоены международной Галеновской премии [8].
Помещение рекомбинантного альфа-2β интерферона в липосомальную капсулу предупреждает его разрушение протеазами желудочно-кишечного тракта, улучшает всасывание и увеличивает время циркуляции в крови, стимулирует продукцию собственного интерферона [1]. Сама оболочка липосом состоит из природных липидов (фосфатидилхолин или лецитин), легко подвергающихся биодеградации, обладает иммуностимулирующей, антиоксидантной и радиопротекторной активностью [1–3].
Пероральная форма рекомбинантного интерферона альфа-2β в сравнении с другими лекарственными формами препарата легко дозируется и не вызывает нежелательных реакций, характерных для парентерального введения (лихорадка, головная боль, миалгии, слабость, лейкопения, анемия) [14, 15], не вызывает неудобств, связанных с ректальным (психологический дискомфорт, ограничение применения при неустойчивом стуле, индивидуальные колебания в скорости и полноте всасывания) и интраназальным (сложность подбора индивидуальной дозы, ограничение использования при обильном отделяемом и др.) введениями, что важно в педиатрической практике [6, 7].
Целью нашего исследования явилось изучение эффективности и безопасности препарата РЛα2βИ в профилактике ОРИ у детей, перенесших хирургическую коррекцию ВПС, выбор оптимальной схемы профилактики.
Материалы и методы
Под нашим наблюдением в течение 2012–2014 гг. находился 51 ребенок в возрасте от 3 до 12 лет. В основную группу вошел 31 пациент с ВПС (16 мальчиков и 15 девочек), кардиохирургическая коррекция которым была проведена от 2 до 10 лет назад. У всех детей частота ОРИ составляла от 6 до 12 раз за последний год. Группу сравнения составили 20 здоровых сверстников (10 мальчиков и 10 девочек).
Комплекс обследования включал сбор и анализ жалоб, анамнестических данных с учетом количества ОРИ; тяжести течения; наличия осложнений. Оценку объективного статуса осуществляли на 4 визитах: до начала (1-й визит), на 30-й (2-й визит), 120-й (3-й визит), 180-й (4-й визит) день от начала профилактического воздействия. На 2-м и 4-–м визитах проводили контроль нежелательных явлений. На 4-м визите оценивали удовлетворенность результатами лечения с помощью интегральной шкалы удовлетворенности пациента результатами профилактического лечения (IMPSS): «всецело удовлетворен», «удовлетворен», «отношусь нейтрально», «не удовлетворен», «крайне не удовлетворен».
Работа выполнена в два этапа. На первом этапе в предэпидемический период РЛα2βИ назначали согласно инструкции к препарату в дозе 250 000 ЕД 1 раз в сутки 2 раза в неделю в течение 1 месяца (методика I). На втором этапе РЛα2βИ назначали с целью экстренной профилактики ОРИ (контакт с больным ОРИ, повышенная заболеваемость ОРИ в детском коллективе) по 250 000 ЕД 2 раза в сутки в течение 3 дней (инструкция к препарату по лечению ОРИ), затем по 250 000 ЕД 1 раз в сутки 2 раза в неделю в течение 1 месяца (согласно инструкции по профилактике) — методика II. Непосредственно перед употреблением, за 30 минут до еды, во флакон с лиофилизированным порошком добавляли 1–2 мл охлажденной кипяченой воды, встряхивали в течение 1–5 минут до образования однородной суспензии.
Критериями эффективности профилактического воздействия служили: динамика частоты и продолжительности ОРИ, наличие бактериальных осложнений в течение последующих 6 месяцев. У детей, получавших профилактическое лечение по методике II, дополнительно исследовали изменения в содержании факторов местной защиты организма — лизоцима, лактоферрина и секреторного иммуноглобулина А (sIgA) в ротоглоточном секрете до начала и на 30-й день профилактического воздействия, в группе сравнения (здоровые дети) — при первичном осмотре.
Концентрацию лизоцима в слюне измеряли нефелометрическим методом с суспензией Micrococcus lysodekticus по R. Parry в модификации Х.Я. Грант с соавт. [20].
Лизоцим (мурамидаза) — фактор неспецифической защиты организма, принимающий активное участие в процессах регуляции местного иммунитета. Продуцируют лизоцим макрофаги и клетки эпителия слизистых оболочек. Лизоцим обладает бактерицидной активностью, направленной главным образом против грамположительных стрептококков и стафилококков. При этом в организм больного выделяется мурамилдипептид — мощный природный стимулятор иммунитета. В результате происходит не только уничтожение самих возбудителей заболеваний, но и активация иммунной системы человека, что препятствует размножению вирусов. При контакте с антителами и комплементом лизоцим может инициировать лизис бактерий, уже обладающих устойчивостью к другим воздействиям [13, 16, 17].
Содержание в слюне лактоферрина определяли методом твердофазного иммуноферментного анализа (ИФА) с применением поликлональных антител к лактоферрину с помощью набора реагентов «Лактоферрин-ИФА-Бест» (ЗАО «Вектор-Бест», Россия).
Лактоферрин — железосвязывающий гликопротеид (молекулярная масса 80 000 Да), фактор неспецифической защиты организма, маркер острофазовых реакций воспалительного процесса. Лактоферрин входит в состав секрета слюнных, слезных, молочных желез, секретов пищеварительного, дыхательного и мочеполового трактов. Он обладает бактерицидной и бактериостатической активностью благодаря способности связывать ионы железа, необходимые для жизнедеятельности микробной клетки, способности присоединяться к клеточной мембране, блокируя ее транспортные функции, возможности изменять функциональные свойства нейтрофилов [18].
Определение концентрации секреторного иммуноглобулина А в слюне осуществляли методом твердофазного ИФА с помощью набора реагентов «sIgA секреторный-ИФА-Бест» (ЗАО «Вектор-Бест», Россия) с использованием моноклональных антител, обладающих высокой специфичностью к sIgA.
Секреторный иммуноглобулин А играет значимую роль в местном иммунитете, препятствуя инвазии бактерий и вирусов в организм ребенка. Его синтез происходит на базальной мембране лимфоидных и эпителиальных клеток из предшественника секреторного компонента и димера sIgA в слезной железе, в стенках органов дыхательной, пищеварительной и мочеполовой систем. Известно, что sIgA способен нейтрализовать биологически активные агенты, включая вирусы, энзимы и токсины, предотвращать адгезию патогенных микроорганизмов к эпителию слизистых оболочек, повышать антибактериальную активность других иммунных эффекторных систем [13].
При статистической обработке полученных результатов использовали программу Medstat.
Результаты исследования и их обсуждение
Анализ частоты и продолжительности ОРИ, наличие бактериальных осложнений у детей с ВПС, имевших в анамнезе оперативную коррекцию, представлен табл. 1, 2.
Как следует из табл. 1, 2, за 6 месяцев до проведения исследования каждый ребенок с ВПС имел в среднем 4,29 заболевания ОРИ в виде ринофарингита (Ме = 4,0; 25% = 4,0; 75% = 5,0), при этом у 8,27 % чел. заболевание осложнилось отитом, у 18,04 % — бронхитом, у 6,02 % чел. — пневмонией. Средняя продолжительность ОРИ до проведения профилактического воздействия (табл. 3) составляла 14 суток.
После окончания программы профилактики по методике I (табл. 1, 2) количество ОРИ в последующие 6 мес. уменьшилось в 1,3 раза (Р1 : 2 < 0,001), при этом их средняя продолжительность (табл. 3) сократилась до 11 суток (Р1 : 2 < 0,001). Осложнения ОРИ были документированы реже: бронхит — в 1,3 раза (частота на одного ребенка — 0,580); пневмония — в 2,6 раза (частота на одного ребенка — 0,096); отит — в 1,8 раза (частота на одного ребенка — 0,193).
Находившиеся под нашим наблюдением дети переносили профилактическую программу хорошо, побочных эффектов не регистрировалось.
По данным IMPSS, 25,81 % родителей пациентов были удовлетворены результатами профилактики, 32,26 % выразили нейтральное отношение, 41,94 % — недостаточную удовлетворенность. Указанное явилось поводом для проведения профилактической программы их детям (n = 31) по методике II.
Результаты профилактического воздействия по методике II представлены в табл. 1, 2, из которых видно, что медиана частоты ОРИ уменьшилась в 4 раза в сравнении с исходными данными (Р1 : 3 < 0,001), средняя продолжительность ОРИ (табл. 3) сократилась до 8 суток (Р1 : 3 < 0,001). Осложнения ОРИ возникали реже: отит — в 5,5 раза (частота на одного ребенка — 0,064), бронхит — в 4 раза (частота на одного ребенка — 0,193); пневмония не зарегистрирована.
Предложенная методика II профилактического воздействия была более эффективной в сравнении с методикой I: медиана частоты ОРИ у детей, получивших препарат РЛα2βИ по методике II, была в 3 раза меньше, чем у детей, получавших профилактическую программу по методике I (Р2 : 3 < 0,001, табл. 2). Медиана продолжительности ОРИ у детей, получавших препарат РЛα2βИ по методике II, была на 3 суток меньше, чем у детей, получавших препарат РЛα2βИ по методике I (Р2 : 3 < 0,001, табл. 3). У детей, получавших профилактическое лечение по методике II, в 3 раза реже констатировали отит и бронхит (табл. 1).
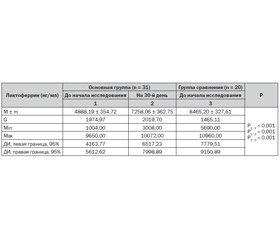
Динамика уровня лизоцима, лактоферрина, секреторного иммуноглобулина А в ротоглоточной жидкости под влиянием методики II отражена в табл. 4–6. При оценке состояния местного иммунитета установлено, что исходно у детей, имевших в анамнезе хирургическую коррекцию ВПС и рекуррентные ОРИ, в сравнении со здоровыми сверстниками имеет место снижение в ротоглоточном секрете уровня лизоцима (в 3,5 раза, Р1 : 3 < 0,001); лактоферрина (в 1,7 раза, Р1 : 3 < 0,001); секреторного иммуноглобулина А (в 1,6 раза, Р1 : 3 < 0,001).
Как видно из табл. 4–6, в результате проведенного профилактического воздействия по методике II показатели местного иммунитета имели положительную динамику: уровень лизоцима в ротоглоточном секрете повысился в 2,6 раза (Р1 : 2 < 0,001); лактоферрина — в 1,5 раза (Р1 : 2 < 0,001); секреторного IgA — в 1,3 раза (Р1 : 2 < 0,001). Однако следует отметить, что ни один из исследуемых показателей не достиг уровня здоровых детей (Р2 : 3 < 0,001).
Во время проведения исследования по методике II переносимость препарата РЛα2βИ была хорошей, побочных эффектов не зарегистрировано. Родители 96,78 % пациентов позитивно оценили результаты профилактического лечения по методике II (данные IMPSS): «всецело удовлетворен» — 6 (19,35 %); «удовлетворен» — 19 (61,29 %); «отношусь нейтрально» — 5 (16,13 %); «не удовлетворен» — 1 (3,22 %).
Выводы
У детей с ВПС выявлено снижение в ротоглоточном секрете уровня лизоцима, лактоферрина и секреторного иммуноглобулина А, что свидетельствует о недостаточности местного иммунитета и повышении риска заболеваемости ОРИ.
Применение препарата РЛα2βИ с целью профилактики ОРИ у детей от 3 до 12 лет с ВПС по 250 000 ЕД 2 раза в сутки в течение 3 дней, затем по 250 000 ЕД 1 раз в сутки 2 раза в неделю в течение 1 месяца выявило высокую эффективность и безопасность.
Профилактическая программа по указанной методике может быть проведена в предэпидемический и эпидемический период, а также перед началом посещения ребенком детского коллектива.
1. Абатуров А.Е. Индукция молекулярных механизмов неспецифической защиты респираторного тракта / А.Е. Абатуров, А.П. Волосовец, Е.И. Юлиш. — К.: Приватна друкарня Фо-П Сторожук О.В., 2012. — 240 с.
2. Бажутин Н.Б. Перспективы применения липосомальных препаратов в медицинской практике / Бажутин Н.Б., Золин В.В., Колокольцов А.А., Таргонский С.Н. // Здоровье Украины. — 2007. — № 3. — С. 71.
3. Бойко Н.Н. Перспективы совершенствования технологии получения липосом / Н.Н. Бойко, А.И. Зайцев // Нанотехнології у фармації та медицині: Матеріали міжнародної науково-практичної конференції 13–14 жовтня 2011 р., м. Харків. — 2011. — С. 38.
4. Борщевский Г.И. Стандартизация технологии изготовления липосомальной формы рекомбинантного интерферона альфа-2 / Г.И. Борщевский, С.И. Дихтярев // Фармаком. — 2009. — № 3. — С. 53–58.
5. Гриневич А.И. Этиопатогенетические профилактика и лечение гриппа и ОРВИ: новые возможности / А.И. Гриневич, В.И. Матяш // Укр. мед. часопис. — 2011. — № 4(84) VII–VIII. — С. 20–26.
6. Золин В.В. Липосомальный противовирусный препарат рекомбинантного альфа-2 интерферона человека: получение и свойства / Золин Владимир Викторович: Автореф. дис... канд. мед. наук, 03.02.02 — вирусология. — Кольцово, 2010. — 33 с.
7. Колокольцов А.А. Терапевтическая эффективность Липоферона липосомального в профилактике и лечении вирусных инфекций / А.А. Колокольцов, В.В. Золин, С.Н. Таргонский, Н.Б. Бажутин // Здоровье Украины. — 2007. — № 7. — С. 74–75.
8. Новости медицины и фармации. — 2013. — № 18(472). — С. 8–9, 17.
9. Порівняльні дані про розповсюдженість хвороб органів дихання і медичну допомогу хворим на хвороби пульмонологічного та алергологічного профілю в Україні за 2006–2012 рр. (таблиці): http: //www.ifp.kiev.ua/doc/staff/pulmukr2012.xls
10. Рябкина Н.Н. Особенности социального анамнеза у детей, имевших оперативное вмешательство по поводу врожденного порока сердца / Н.Н. Рябкина, В.Н. Шестакова, О.В. Ларионова // Вестник Смоленской медицинской академии. — 2010. — № 4. — С. 53–57.
11. Самсыгина Г.А. Современные подходы к лечению острой инфекции респираторного тракта у часто болеющих детей / Г.А. Самсыгина // Педиатрия. — 2008. — № 2. — С. 99–101.
12. Шарыкин А.С. Врожденные пороки сердца. Руководство для педиатров, кардиологов, неонатологов. — 2-е изд. / А.С. Шарыкин. — М.: Бином, 2009. — 384 с.
13. Щеплягина Л.А. Местный иммунитет: педиатру на заметку / Л.А. Щеплягина, И.В. Круглова // Поликлиника. — 2011. — № 6. — С. 100–101.
14. Юлиш Е.И. Липосомальная терапия: настоящее и будущее / Юлиш Е.И., Абатуров А.Е. // Здоровье ребенка. — 2008. — № 1(10). — С. 87–90.
15. Юлиш Е.И. Метод дифференцированного подхода к лечению и реабилитации часто и длительно болеющих респираторными заболеваниями детей при различном течении персистирующих инфекций / Е.И. Юлиш, И.В. Балычевцева, Б.И. Кривущев и др. // Здоровье ребенка. — 2009. — № 5(20). — С. 20–26.
16. Юлиш Е.И. Факторы местного иммунитета при респираторных инфекциях и методы их активации / Е.И. Юлиш // Здоровье ребенка. — 2010. — № 5(26). — С. 63–67.
17. Dajani R. Lysozyme secretion by submucosal glands protects the airway from bacterial / R. Dajani, S. Zove, P. Taft // Ann. J. Res. Cell Mol. Biol. — 2005. — № 32(6). — Р. 548–52.
18. Farnaud S. Lactoferrin — a multifunctional protein with antimicrobial properties / S. Farnaud, R.W. Evans // Mol. Immunol. — 2003. — № 40(7). — Р. 395–405.
19. World Health Organization (2010) EuroFlu Weekly Electronic Bulletin: www.euroflu.org/cgi-files/bulletin_v2.cgi.
20. Parry R., Chandon R., Shamani K. // Proc. Soc. exp. Biol. (N.Y.). — 1965. — Vol. 119, № 3. — P. 384.

/23/23.jpg)
/24/24.jpg)
/25/25.jpg)