Журнал «Здоровье ребенка» 7 (58) 2014
Вернуться к номеру
Місце синбіотиків у терапії та профілактиці антибіотик-асоційованої діареї в дітей
Авторы: Леженко Г.О., Пашкова О.Є. - Запорізький державний медичний університет
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
У статті наведено сучасні дані про патофізіологічні механізми розвитку антибіотик-асоційованої діареї, методи її профілактики та лікування, науково обґрунтовано доцільність застосування синбіотичного препарату в комплексній терапії антибіотик-асоційованої діареї в дітей.
В статье приведены современные данные о патофизиологических механизмах развития антибиотик-ассоциированной диареи, методах ее профилактики и лечения, научно обоснована необходимость применения синбиотического препарата в комплексной терапии антибиотик-ассоциированной диареи у детей.
The study represents contemporary data about pathophysiological mechanisms of antibiotic-associated diarrhea, methods of its prevention and treatment, the necessity of using synbiotic in complex therapy of antibiotic-associated diarrhea in children was scientifically substantiated.
синбіотик, антибіотик-асоційована діарея, діти.
синбиотик, антибиотик-ассоциированная диарея, дети.
synbiotic, antibiotic-associated diarrhea, children.
Статья опубликована на с. 11-15
Відкриття антибіотиків є одним із найбільш вагомих досягнень біологічної та медичної науки. Впровадження антибіотиків дозволило кардинально вирішити проблему терапії та смертності від інфекційної патології. Проте широке застосування антибіотиків є однією з причин короткострокових або довгострокових порушень складу мікробіоти шлунково-кишкового тракту. Загальною проблемою виступає антибіотик-асоційована діарея (ААД), від якої страждає 5–25 % пацієнтів, які приймають антибіотики [1]. Після широкого застосування антибіотиків із середини ХХ сторіччя антибіотик-асоційована діарея стала загальномедичною проблемою. На сьогодні під антибіотик-асоційованою діареєю мають на увазі наявність трьох і більше епізодів неоформлених (рідких) випорожнень протягом 2 і більше днів поспіль, що розвинулися на фоні застосування антибактеріальних лікарських препаратів або протягом двох місяців після їх відміни [2].
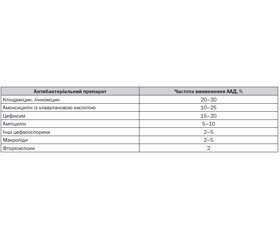
У проведеному у Швеції мультицентровому проспективному дослідженні було показано, що ААД розвинулася в 4,9 % випадків застосування антибіотиків. Частота ААД збільшувалася при застосуванні кліндаміцину або комбінації пеніциліну з інгібіторами лактамаз [3]. Парентеральне введення антибіотиків за умови їх ентеропатичної циркуляції не знижує ризику розвитку ААД, винятком є аміноглікозиди, уведення яких не супроводжувалося розвитком діареї [3]. Частота виникнення ААД при застосуванні антибіотикотерапії наведена в табл. 1 [4].
Вірогідність розвитку антибіотик-асоційованої діареї зростає:
— при одночасному прийомі кількох антибактеріальних препаратів;
— застосуванні хіміотерапії, антинеопластичних препаратів (для лікування пухлин), імуносупресивної терапії (що пригнічує діяльність та активність імунної системи);
— прийомі препаратів золота, нестероїдних протизапальних засобів (негормональних протизапальних препаратів);
— прийомі антидіарейних препаратів (для лікування діареї);
— прийомі нейролептиків (психотропних препаратів — для лікування психічних розладів).
Інфекційними агентами, що найбільш часто асоціюються з розвитком ААД, є Clostridium difficile, Clostridium perfringens, Bacteroides fragilis, Staphilococcus aureus, бактерії роду Klebsiella, Salmonella, гриби роду Candida [5]. Проте найбільш тяжким є варіант ААД, що асоціюється з Clostridium difficile.
Патоморфологічні зміни при ААД, що асоціюється з Clostridium difficile, псевдомембранозному коліті виявляються переважно в товстій кишці й характеризуються дифузійною гіперемією, а також набряком слизової кишечника з потовщенням стінки кишки й утворенням характерних фібринозних нальотів у вигляді бляшок жовтувато-білого кольору (псевдомембран). В окремих випадках слизова може бути вкрита товстим шаром фібринозно-плівчастих накладень на значному протязі кишечника. Плівки при розплавлюванні можуть відторгатися, оголюючи поверхню кишкової стінки.
Антибіотик-асоційована діарея в дітей часто проявляється клінічними симптомами нетяжкого коліту або ентероколіту. Зазвичай перебігає без лихоманки та інтоксикації. При цьому можлива поява болю в животі, але частіше болючість виявляється лише при пальпації кишечника. Відзначається помірне почастішання випорожнень, що, як правило, не призводить до виражених водно-електролітних порушень.
Симптоми псевдомембранозного коліту в дітей зазвичай розвиваються гостро й характеризуються відсутністю апетиту, лихоманкою, інтоксикацією, діареєю, відрижкою, здуттям і спастичними болями в животі (абдомінальні коліки). Живіт при пальпації болісний по ходу товстого кишечника. Випорожнення часті, в калових масах — домішки слизу і крові (рідше). Іноді більша частина випорожнень представлена густим білуватим слизом та уривками фібринозних накладень. При багаторазовій діареї розвивається ексикоз із порушеннями кровообігу, значно рідше відзначається колапс без попередньої діареї.
Для терапії легких випадків ААД, як викликаних Clostridium difficile, так і іншої етіології, достатньо відмінити антибіотики, призначити пробіотики і зменшити вміст вуглеводів у дієті. Тяжкий перебіг ААД вимагає призначення специфічної антибіотикотерапії [6, 7].
На сучасному етапі визначено декілька напрямків профілактики виникнення ААД. Якщо перший (раціональна антибактеріальна терапія) має неспецифічний характер, то наступні два мають значну доказову базу щодо профілактики виникнення ААД:
— по-перше, це технологія рrodrug: антибактеріальний засіб виготовляється у вигляді проліків, що стають активними лише в стінці тонкої кишки. Однак ця методика має певні обмеження, тобто поширюється лише на пероральні форми деяких цефалоспоринів (Цефодокс, Цефутил);
— по-друге, це застосування пробіотичної терапії. Ефективність застосування пробіотиків як засобу для запобігання ААД за критеріями доказової медицини має максимальний рівень доказовості А. Терапію пробіотиками слід призначати пацієнтам як із легкими, так і з тяжкими формами ААД. При цьому пролонгація пробіотикотерапії необхідна до 3–4 тижнів, навіть після припинення діареї, з метою нормалізації порушеного кишкового мікробіоценозу та профілактики рецидиву ААД.
Ефективність профілактичного застосування пробіотиків на фоні антибактеріальної терапії підтверджують дані рандомізованих контрольованих досліджень та метааналізів. Два метааналізи, проведені у 2006 році, наочно продемонстрували ефективність пробіотиків у профілактиці розвитку ААД, у тому числі її найбільш тяжких форм, викликаних Clostridium difficile [8, 9]. Як найбільш ефективні пробіотичні агенти використовувалися пробіотики, що містять Lactobacillus, Bifidobacterium, Saccharomyces, Streptococcus, Enterococcus і Bacillus або їх комбінації. Результати іншого метааналізу свідчили про зниження ризику розвитку ААД на ≥ 60 % (узагальнений відносний ризик — 0,396) при призначенні пробіотиків [10].
Механізм дії пробіотиків полягає в наступному [11]:
— запобігання адгезії чужорідних мікробів — колонізаційна резистентність (прямий та конкурентний елімінаційний вплив на патогенну флору — боротьба за харчування, фактори адгезії, рецептори зв’язування тощо);
— продукція антимікробних субстанцій (лізоциму, проглутамату, пероксиду);
— конкуренція за харчові субстрати з патогенними бактеріями;
— продукція цитопротективних речовин (аргініну, глутаміну, поліамінів, коротколанцюжкових жирних кислот);
— ацидифікація вмісту товстого кишечника;
— стимуляція імунної відповіді на патогени (синтез секреторного IgA, IgG, підвищення синтезу цитокінів макрофагами і T-клітинами, посилення фагоцитозу — хомінг-ефект);
— зміцнення цитоскелета (експресія тропоміозину-5, синтез актину й оклюзину);
— зниження проникності судинних тканинних бар’єрів для токсичних продуктів патогенних мікроорганізмів (найбільш характерно для біфідобактерій);
— зниження проникності кишкового епітелію (фосфорилювання білка міжклітинних з’єднань);
— підвищення синтезу муцину (стимуляція гена MUC-3);
— стимуляція синтезу й активації рецептора епітеліального фактора росту;
— збільшення синтезу поліамінів.
Розробка сучасних пробіотиків базується на вимогах, що висуваються до таких препаратів [12]:
— вони повинні містити мікроорганізми, пробіотичний ефект яких доведено в рандомізованих контрольованих дослідженнях;
— відсутність побічних ефектів при тривалому використанні;
— колонізаційний потенціал, тобто збереження в травному тракті до досягнення максимально позитивної дії (повинні бути стійкими до низьких значень рН, жовчних кислот, антимікробних субстанцій, що продукуються індигенною мікрофлорою; добре адгезуватися до епітелію слизових оболонок);
— стабільні характеристики як у клінічному, так і в технологічному плані;
— висока швидкість росту й розмноження в умовах, близьких до таких у кишковому тракті;
— при введенні у великих кількостях мінімальна здатність до транслокації з просвіту травного тракту у внутрішнє середовище макроорганізму;
— чітке біологічне, біохімічне й генетичне маркування як для виключення фальсифікації, так і для періодичного контролю ідентичності вихідних пробіотичних штамів і виробничих культур в процесі їх експлуатації.
Основною групою мікроорганізмів, що входять до складу сучасних пробіотичних препаратів і продуктів, є молочнокислі бактерії роду Bifidobacterium і Lactobacillus. Це обумовлено постійною присутністю цих бактерій у складі нормобіоценозу людини й накопиченням величезної кількості даних, що свідчать про ключову фізіологічну роль біфідобактерій і лактобацил у функціонуванні мікроекологічної системи здорових людей. Найбільш важливими фізіологічними функціями біфідобактерій і лактобацил в організмі господаря є участь в обмінних процесах і реалізації колонізаційної резистентності [13]. Слід також зазначити, що ефект пробіотиків має штамоспецифічний характер. Важливим чинником ефективності при застосуванні пробіотиків є достатня кількість мікроорганізмів, що входять до його складу. Крім того, враховуючи зміни, що відбуваються в кишечнику дитини, при застосуванні пробіотиків доречним є паралельне додаткове введення в раціон харчування пребіотичних продуктів.
Враховуючи сказане, можна виділити 4 основні вимоги до сучасних пробіотиків:
— повинні містити непатогенні для макроорганізму мікроорганізми;
— мікроорганізми повинні бути чітко гено- та фенотипічно визначеними;
— мікроорганізми повинні бути в достатній кількості;
— до складу пробіотика бажано включати пребіотчний компонент.
Таким чином, наведені дані є патогенетичним підґрунтям для вибору оптимального синбіотика для профілактики ААД. На наш погляд, наведеним вимогам повною мірою відповідає сучасний пробіотик із пребіотичним компонентом Коліфагіна ПРО (Probiotical S.p.A., Італія), в одному флаконі якого міститься 1 млрд Lactobacillus rhamnosus LR06 та 1 млрд Bifidobacterium breve BR03.
На сьогодні накопичено значний науковий матеріал, який базується на сучасних принципах доказової медицини, щодо ефективності та безпеки Lactobacillus rhamnosus, що проявляє антагоністичну активність, у профілактиці та лікуванні ААД у дітей [15–17].
Lactobacillus rhamnosus є одним із видів пробіотичних бактерій. Lactobacillus rhamnosus було вперше виділено в 1983 році в кишечнику здорової людини вченими B. Goldin та Sh. Gorbach. Згідно з дослідженнями вчених, Lactobacillus rhamnosus проявляє стійкість до соляної кислоти шлунка та жовчі, має високу здатність до адгезії до епітелію слизової оболонки кишечника і продукує молочну кислоту, у результаті чого Lactobacillus rhamnosus зупиняє розмноження патогенних бактерій в кишечнику, а також допомагає відновити баланс нормальної мікрофлори [18]. Крім того, Lactobacillus rhamnosus справляє імуномодулюючий ефект, може зменшувати вираженість запалення в кишковій стінці [19]. У результаті прийому Lactobacillus rhamnosus було відзначено збільшення продукції секреторних IgA-антитіл, що посилюють опір ротавірусам [20].
У дослідженнях, проведених у 2000 році в ряді європейських країн, було доведено ефективність призначення Lactobacillus rhamnosus у дітей, хворих на ротавірусну інфекцію: тривалість діареї скоротилася на 1 день [21]. В іншому дослідженні показано, що прийом Lactobacillus rhamnosus скорочував тривалість діареї та частоту випорожнень при ААД, яка виникла як ускладнення застосування антибіотиків при терапії H.pylori-–інфекції [22]. Доведено безпечність використання Lactobacillus rhamnosus у хворих на СНІД та в пацієнтів із синдромом короткої кишки [23].
Вifidobacterium breve відіграє важливу роль у функціонуванні шлунково-кишкового тракту людини. Ці бактерії проявляють такі властивості:
— перешкоджають розмноженню патогенних мікроорганізмів у кишечнику, що сприяє відновленню балансу нормальної мікрофлори кишечника й усуненню дисбіозу;
— підвищують локальний захист шляхом зниження проникнення патогенних мікроорганізмів через стінку кишечника:
— гальмують адгезивні властивості E.coli, пригнічують розвиток в кишечнику багатьох патогенних мікроорганізмів, зокрема бактерій типу Clostridium, Enterobacteriaceae, Pseudomonas, Staphilococcus;
— мають протизапальні властивості за рахунок індукції кишкових інтерлейкінів-10 та продукції Т-хелперів [24].
До складу Коліфагіни ПРО входять також фруктоолігосахариди пребіотичних волокон, які вибірково стимулюють ріст біфідо- та лактобактерій, пригнічують розвиток патогенних бактерій, запобігають виникненню та розвитку гнильних процесів і надлишкового газоутворення в кишечнику, покращують перетравлення та беруть участь у підтримці цілісності імунної системи.
Коліфагіну ПРО виготовлено за складною запатентованою технологією (мікрокапсуляція), що дозволяє бактеріям проходити через шлунковий бар’єр, досягаючи кишечника живими та життєздатними. Кришка флакона містить суху фазу: сахарозу, бактерії штамів Lactobacillus rhamnosus LR06 (> 1,0 млрд КУО) і Bifidobacterium breve BR03 (> 1,0 млрд КУО), допоміжні речовини. Перед застосування необхідно затягти кришку-резервуар до повного обороту, щоб порошок висипався у флакон, що містить рідку фазу: воду, фруктоолігосахариди (2500,0 мг) і допоміжні речовини. Збовтавши вміст до досягнення однорідної консистенції, випити безпосередньо з флакона. Застосовується Коліфагіна ПРО в дітей віком понад 3 роки в дозі 1 флакон на день натщесерце протягом 10 днів. Важливою є можливість прийому препарату під час антибактеріальної терапії. Однак слід взяти до уваги той факт, що при лікуванні антибіотиками перед вживанням Коліфагіни ПРО необхідно зачекати мінімум 3 години.
Метою дослідження було вивчення ефективності застосування синбіотика Коліфагіна ПРО в профілактиці антибіотик-асоційованої діареї у дітей з бактеріальною респіраторною патологією.
Матеріали та методи дослідження
Було обстежено 30 дітей із бактеріальною респіраторною патологією віком від 3 до 7 років. Усі діти отримували як антибактеріальну терапію цефалоспорини ІІІ покоління, які вводилися внутрішньовенно.
Залежно від варіанта одержуваної терапії були виділені 2 групи. У першу групу ввійшли 15 дітей, яким із першого дня антибіотикотерапії призначався пробіотик, інші 15 пацієнтів, які отримували тільки антибіотикотерапію, становили другу групу. Для кожного варіанта терапії визначалася частота розвитку дисфункції шлунково-кишкового тракту. До початку терапії у всіх дітей, які знаходилися під спостереженням, діарейний синдром був відсутній. За показаннями хворим проводилося бактеріологічне дослідження кишкової мікрофлори. Збір і доставка матеріалу здійснювалися в стерильному контейнері протягом 2 годин із моменту отримання матеріалу. Виділяли кількість колонієутворюючих одиниць в 1 г калу для біфідобактерій, лактобацил, патогенних мікробів сімейства Enterobacteriaceaе, загальної кількості кишкової палички, кишкової палички зі слабко вираженими ферментативними властивостями, гемолізуючої кишкової палички, представників умовно-патогенної флори (Klebsiella, Enterobacter, Proteus, Citrobacter тощо), Staphilococcus aureus, Staphilococcus hemolyticus та грибів роду Candida.
Результати дослідження та їх обговорення
Вивчення впливу варіантів терапії на функціональний стан шлунково-кишкового тракту показало, що в групі дітей, які з першого дня антибіотикотерапії отримували Коліфагіну ПРО, у жодному випадку не відмічено розвитку діареї. У той же час у другій групі спостереження з 3-го дня антибіотикотерапії в 5 (33,3 %) хворих відмічалося послаблення випорожнень, у 2 (13,3 %) розвинувся антибіотик-асоційований коліт, що характеризувався наявністю діареї з частотою випорожнень до 6–7 разів на добу, переймистими болями в животі, посиленням інтоксикаційного синдрому, що призвело в подальшому до зміни антибактеріальної терапії та призначення пробіотичного препарату.
Дослідження мікробного пейзажу кишечника показали, що в усіх дітей, у яких розвинулися ознаки антибіотик-асоційованої діареї, мали місце ті чи інші порушення кишкового біоценозу. У всіх дітей відзначався помірний дефіцит лакто- та біфідобактерій, що супроводжувалося зсувом рН кишечника в лужний бік. Як відомо, зменшення кількості облігатної мікрофлори в кишечнику зумовлює гальмування процесів утилізації організмом дитини біологічно активних речовин за рахунок зниження ферментативної активності лакто- і біфідобактерій, що призводить до посилення бродильних і гнильних процесів. Порушення колонізаційної резистентності підвищує адгезію і колонізацію на слизовій оболонці кишечника патогенних та умовно-патогенних бактерій та зумовлює надходження токсинів у кров [25].
Аналізи кишкової мікрофлори на наявність патогенних та умовно-патогенних штамів у хворих із діарейним синдромом, що розвинувся на фоні антибактеріальної терапії, засвідчили зміни якісних властивостей кишкової палички, тобто встановлено наявність форм зі зниженою ферментативною активністю й атипових форм — лактозонегативних та гемолізуючих штамів E.сoli, у 3 дітей було виділено Staphilococcus aureus, у 2 пацієнтів — Klebsiella та в однієї дитини — Proteus. Гриби роду Candida виявлено у 4 хворих.
За результатами застосування в комплексі терапевтичних заходів у дітей другої групи, у яких розвинувся діарейний синдром, синбіотика Коліфагіна ПРО встановлено, що оборотний розвиток шлунково-кишкових розладів спостерігався на 4–5-й день, а повне зникнення диспептичних проявів — на 7-й день.
Висновки
Таким чином, застосування Коліфагіни ПРО з першого дня антибіотикотерапії сприяє ефективній профілактиці виникнення ААД. Призначення цього синбіотика на тлі появи симптомів антибіотик-асоційованої діареї призводить до зменшення тяжкості і тривалості діареї. Наявність пребіотичних волокон у складі Коліфагіни ПРО виступає значним підґрунтям подальшої адекватної колонізації кишечника та ефективній імуномодуляції.
1. Theriot C. Antibiotic-Associated Diarrhea / C. Theriot, V.B. Young // Encyclopedia of Metagenomics. — 2014. — Р. 1–7.
2. Шевяков М.А. Антибиотик-ассоциированная диарея и кандидоз кишечника: возможности лечения и профилактики / М.А. Шевяков // Антибиотики и химиотерапия. — 2004. — № 49(10). — С. 26–29.
3. Wisham J. Frequency of antibiotic–associated diarrhea in 2462 antibiotic-treated hospitalized patients: a prospective study / J. Wisham, S.R. Norrby, C.B. Myhre [et al.] // Antimicrob. Chemother. — 2001. — Vol. 47. — P. 43–50.
4. Успенский Ю.П. Антибиотик-ассоциированная диарея — новая проблема цивилизации / Ю.П. Успенский, Ю.А. Фоминых // Архивъ внутренней медицины. — 2013. — № 2. — С. 46–52.
5. Gorkiewicz G. Nosocomial and antibiotic-associated diarrhoea caused by organisms other than Clostridium difficile / G. Gorkiewicz // Int. J. Antimicrob. Agents. — 2009. — Vol. 33, Suppl. 1. — P. S37–44.
6. Gupte N. Antibiotic-associated Diarrhea / N. Gupte, S. Gupte, R.A. Anderson // Recent Advances in Pediatrics: Pediatric Gastroenterology, Hepatology and Nutrition. — 2013. — Vol. 23. — P. 82–94.
7. Сурков А.Н. Современные технологии в лечении и профилактике антибиотик-ассоциированной диареи у детей / А.Н. Сурков // Вопросы современной педиатрии. — 2011. — Т. 10, № 5. — С. 146–151.
8. McFarland L.V. Meta-analysis of probiotics for the prevention of antibiotic associated diarrhea and the treatment of Clostridium difficile disease / L.V. McFarland // Am. J. Gastroenterol. — 2006. — Vol. 101(4). — Р. 812–822.
9. Sazawal S. Efficacy of probiotics in prevention of acute diarrhoea: a meta–analysis of masked, randomized, placebo-controlled trials / S. Sazawal, G. Hiremath, U. Dhingra [et al.] // Lancet Infect. Dis. — 2006. — Vol. 6. — P. 374–382.
10. Cremonini F. Meta-analysis: the effect of probiotic administration on antibiotic-associated diarrhoea / F. Cremonini, S. Di Caro, E.C. Nista [et al.] // Aliment. Pharmacol. Ther. — 2002. — Vol. 16(8). — P. 1461–1467.
11. Осипенко М. Ф. Пробиотики в лечении диарейного синдрома / М.Ф. Осипенко, Е. А. Бикбулатова, С. И. Холин // Фарматека. — 2008. — № 13. — С. 36–41.
12. Захарова И.Н. Перспективы использования продуктов функционального питания у детей раннего возраста / И.Н. Захарова, Ю.А. Дмитриева // Вопросы современной педиатрии. — 2011. — Т. 10, № 2. — С. 150–154.
13. Янковский Д.С. Бифидобактерии и лактобациллы как оптимальная основа современных пробиотиков / Д.С. Янковский, Г.С. Дымент // Современная педиатрия. — 2006. — № 3. — С. 184–194.
14. Huang J. S. Efficacy of probiotic use in acute diarrhea in children: a metaanalysis / J.S. Huang, A. Bousvaros, J. W. Lee [et al.] // Dig. Dis. Sci. — 2002. — Vol. 11. — P. 2625–2634.
15. Johnston B.C. Probiotics for pediatric antibiotic-associated diarrhea: a meta-analysis of randomized placebo-controlled trials / B.C. Johnston, A.L. Supina, S. Vohra // CMAJ. — 2006. — Vol. 175(4). — P. 377–383.
16. Szajewska H. Probiotics in the prevention of antibiotic-associated diarrhea in children: a metaanalysis of randomized controlled trials / H. Szajewska, M. Ruszczynski, A. Radzikowski // J. Pediatr. — 2006. — Vol. 149(3). — P. 367–372.
17. Johnston B.C. Probiotics for the prevention of pediatric antibiotic-associated diarrhea / B.C. Johnston, A.L. Supina, M. Ospina [et al.] // Cochrane Database Syst. Rev. — 2007. — Vol. 2. — CD004827.
18. Conway P.L. Survival of lactic acid bacteria in the human stomach and adhesion to intestinal cells / P.L. Conway, S.L. Gorbach, B.R. Goldin // Journal of. Dairy Science. — 1987. — Vol. 70(1). — P. 1–12.
19. Reid G. Potential uses of probiotics in clinical practice / G. Reid, J. Jass, M.T. Sebulski [et al.] // Clin. Microbiol. Rev. — 2003. — Vol. 16(4). — P. 658–672.
20. D’Souza A. L. Probiotics in prevention of antibiotic associated diarrhoea: meta–analysis / A.L. D’Souza, C. Rajkumar, J. Cooke [et al.] // BMJ. — 2002. — Vol. 324(7350). — P. 1361.
21. Guandalini S. Lactobacillus GG Administered in oral rehydration solution to children with acute diarrhea: A multi-center European trial / S. Guandalini, L. Pensabene, M. Abu Zikri [et al.] // Journal of Pediatric Gastroenterology & Nutrition. — 2000. — Vol. 30. — P. 54–60.
22. Armuzzi A. Effect of Lactobacillus GG supplementation on antibiotic-associated gastrointestinal side effects during / A. Armuzzi, F. Cremonini, V. Ojetti [et al.] // Digestion. — 2001. — Vol. 63(1). — P. 1–7.
23. Gupta V. Probiotics / V. Gupta, R. Garg // Indian Journal of Medical Microbioloy. — 2009. — Vol. 27(3). — P. 202–209.
24. Jeon S.G. Probiotic Bifidobacterium breve induces IL-10-producing Tr1 cells in the colon / S.G. Jeon, H. Kayama, Y. Ueda [et al.] // PLoS pathogens. — 2012. — Vol. 8(5). — P. e1002714.
25. Белоусова О.Ю. Дисбактериоз кишечника как фактор риска развития хронических заболеваний кишечника у детей // Здоровье ребенка. — 2011. — № 1. — С. 73–75.

/12/12.jpg)