Украинский журнал хирургии 3-4 (26-27) 2014
Вернуться к номеру
Программированные санации брюшной полости в комплексном лечении острого распространенного гнойного перитонита
Авторы: Кондратенко П.Г., Койчев Е.А. - Донецкий национальный медицинский университет им. М. Горького
Рубрики: Хирургия
Разделы: Клинические исследования
Версия для печати
Цель исследования: оптимизировать тактику лечения больных с острым разлитым гнойным перитонитом.
Материал и методы исследования. Под нашим наблюдением находился 181 пациент, оперированный по поводу острого распространенного гнойного перитонита в период с 1995 по 2013 годы. Мужчин было 102 (56,4%), женщин — 79 (43,6%) в возрасте от 28 до 86 лет. Причем в возрасте до 60 лет было 90 (49,7%) пациентов. Сопутствующая патология выявлена у 101 (55,8%) больного. Наиболее часто встречалась патология сердечно-сосудистой и дыхательной систем. Давность заболевания менее 3 суток отмечена у 91 (50,3%) пациента, 4-6 суток — у 43 (23,8%), а более 6 суток — у 47 (25,9%). Первая степень Мангеймского индекса перитонита выявлена у 27 (14,9%) пациентов, вторая — у 112 (61,9%), третья — у 42 (23,2%). Абдоминальный сепсис выявлен у 154 (85,1%) пациентов, а полиорганная недостаточность — у 42 (23,2%).
Результаты и обсуждение. В зависимости от выбранной тактики лечения все пациенты разделены на 2 группы. В 1-ю группу вошло 105 пациентов, у которых хирургическое вмешательство выполнялось по общепринятой методике и брюшная полость зашивалась наглухо. При развитии осложнений выполняли релапаротомию «по требованию». Во 2-ю группу вошло 76 пациентов, у которых хирургическое вмешательство завершали наложением лапаростомы с последующим выполнением программированных санаций брюшной полости по выше описанной методике. Кроме того в данной группе в качестве стартовой эмпирической антибактериальной терапии применялись карбапенемы, использовалась методика «экспозиционной санации», а также тактика ведения послеоперационного периода, в т.ч. и сроки зашивания брюшной полости, зависели от показателей внутрибрюшного давления.
Анализ полученных данных свидетельствует о том, что применение тактики лечения, использованной у пациентов 2-й группы по сравнению с 1-й группой позволило снизить летальность с 50,5 до 23,7%, а число послеоперационных осложнений с 21 до 6,6%. При этом во 2-й группе пациентов частота развития несостоятельности швов снизилась с 7,6 до 1,3%, эвентрации с 2,9 до 1,3%, а также практически отсутствовали такие осложнения как абсцессы брюшной полости и флегмона забрюшинной клетчатки. Лишь нагноение послеоперационной раны во 2-й группе наблюдалось несколько чаще, чем в 1-й — соответственно — у 2,6 и 1,9% пациентов.
Заключение. У пациентов с острым распространенным гнойным перитонитом хирургическое вмешательство следует завершать наложением лапаростомы с последующим выполнением программированных санаций брюшной полости. Оптимальный интервал между программированными санациями брюшной полости составляет 48 часов. Санацию брюшной полости целесообразно выполнять раствором «октенисепт», используя методику «экспозиционной санации». Контроль внутрибрюшного давления должен осуществляться всем без исключения пациентам с распространенным гнойным перитонитом. Его необходимо начинать на завершающем этапе первой операции, а завершать после восстановления перистальтики кишечника в послеоперационном периоде после операции, предусматривающей зашивание брюшной полости. При этом показатели интраабдоминального давления не должны превышать 10-15 мм рт. ст. Декомпрессию кишечника необходимо выполнять у всех пациентов с распространенным гнойным перитонитом независимо от степени дилатации петель кишок во время первой операции. Для этого могут быть использованы как закрытый интестинальный путь введения зонда (через нос), так и открытый (через гастростому и еюностому).
Мета дослідження: оптимізувати тактику лікування хворих з гострим розповсюдженим гнійним перитонітом.
Матеріал і методи дослідження. Під нашим спостереженням знаходився 181 пацієнт, оперований з приводу гострого розповсюдженого гнійного перитоніту у період з 1995 по 2013 роки. Чоловіків було 102 (56,4%), жінок — 79 (43,6%) у віці від 28 до 86 років. Причому у віці до 60 років було 90 (49,7%) пацієнтів. Супутня патологія виявлена у 101 (55,8%) хворого. Найбільш часто зустрічалася патологія серцево-судинної і дихальної систем. Давність захворювання менш 3 доби відзначена у 91 (50,3%) пацієнта, 4-6 діб — у 43 (23,8%), а більше 6 діб — у 47 (25,9%). Перша ступінь Мангеймского індексу перитоніту виявлена у 27 (14,9%) пацієнтів, друга — у 112 (61,9%), третя — у 42 (23,2%). Абдомінальний сепсис виявлений у 154 (85,1%) пацієнтів, а поліорганна недостатність — у 42 (23,2%).
Результати та обговорення. Залежно від обраної тактики лікування всі пацієнти розділені на 2 групи. У 1 групу увійшло 105 пацієнтів, у яких хірургічне втручання виконувалося за загальноприйнятою методикою і черевна порожнина зашивалась наглухо. При розвитку ускладнень виконували релапаротомию «на вимогу». У 2-у групу увійшло 76 пацієнтів, у яких хірургічне втручання завершували накладенням лапаростомії з подальшим виконанням програмованих санацій черевної порожнини за вище описаною методикою. Крім того, у цій групі в якості стартової емпіричної антибактеріальної терапії застосовувалися карбапенеми, використовувалася методика «експозиційної санації», а також тактика ведення післяопераційного періоду, в т.ч. і терміни зашивання черевної порожнини, залежали від показників внутрішньочеревного тиску. Аналіз отриманих даних свідчить про те, що застосування тактики лікування, використаної у пацієнтів 2-ї групи порівняно з 1-ю групою дозволило знизити летальність з 50,5 до 23,7%, а кількість післяопераційних ускладнень з 21 до 6,6%. При цьому в 2-й групі пацієнтів частота розвитку неспроможності швів знизилась з 7,6 до 1,3%, эвентрации з 2,9 до 1,3%, а також практично відсутні такі ускладнення як абсцеси черевної порожнини і флегмона заочеревинної клітковини. Лише нагноєння післяопераційної рани у 2-й групі спостерігалося дещо частіше, ніж у 1-й — відповідно — у 2,6 і 1,9% пацієнтів.
Висновок. У пацієнтів з гострим поширеним гнійним перитонітом хірургічне втручання слід завершувати накладенням лапаростомії з подальшим виконанням програмованих санацій черевної порожнини. Оптимальний інтервал між програмованими санаціями черевнії порожнини становить 48 годин. Санацію черевної порожнини доцільно виконувати розчином «октенисепт», використовуючи методику «експозиційної санації». Контроль внутрішньочеревного тиску повинен здійснюватися всім без винятку пацієнтам з поширеним гнійним перитонітом. Його необхідно починати на завершальному етапі першої операції, а завершувати після відновлення перистальтики кишечника в післяопераційному періоді після операції, що передбачає зашивання черевної порожнини. При цьому показники інтраабдомінального тиску не повинні перевищувати 10-15 мм рт. ст. Декомпресію кишечника необхідно виконувати у всіх пацієнтів з поширеним гнійним перитонітом незалежно від ступеня дилатації петель кишок під час першої операції. Для цього можуть бути використані як закритий интестинальный шлях введення зонда (через ніс), так і відкритий (через гастростому і еюностому).
Purpose of the research: to optimize the tactics in treatment of acute diffuse purulent peritonitis.
Patients and methods. 181 patients were under observation in the period from 1995 to 2013. All of them were operated on account of acute diffuse purulent peritonitis. The age of the patients varied from 28 to 86 years old. The men were 102 (56, 4%), the women — 79 (43, 6%). 90 (49, 7%) patients were younger than 60 years old. The concomitant disease was detected in 101 (55, 8) patients. The most common was cardiovascular and pulmonary dysfunction. The disease duration less than 3 days had 91 (50, 3%) patients, 4-6 days — 43 (23, 8%), and more than 6 days – 47 (25, 9%). The first degree of Mannheim Peritonitis Index (MPI) was detected in 27 (14, 9%) patients, second — in 112 (61, 9%), third — in 42 (23, 2%). Abdominal sepsis was observed in 154 (85, 1%) patients and multiple organ dysfunction – in 42 (23, 2%).
The results and consideration. Depending on a therapeutic approach the patients were divided in two groups. The first group consisted of 105 patients who had a standard method surgery and abdominal region was sutured tightly. If complications took place relaparotomy was performed (required relaparotomy).
The second group consisted of 76 patients who had a surgery finished with applying of laparostoma and following performance of scheduled sanations of abdominal cavity with the method described above. Besides, this group had carbapenems as starting empiric antibacterial therapy, method of “exposition sanation” and tactics for postsurgical management including abdominal closure terms which depend on intra-abdominal pressure.
The analysis of the results shows that the therapeutic approach for the patients of the 2nd group decreased the mortality rate from 50, 5% to 23, 7 %, and postsurgical complications from 21% to 6, 6%, comparing to the 1st group. At the same time suture failure in the 2nd group decreased from 7, 6% to 1, 3%, eventration from 2, 9% to 1, 3%. Also, such complications as abdominal abscesses and phlegmon of retroperitoneal tissue practically did not take place. Only postoperative wound infection was more frequent in the 2nd group than in the 1st group — 2, 6 % and 1, 9% correspondingly.
Conclusion. It is appropriate to finish the acute diffuse purulent peritonitis surgery with applying of laparostoma with following performance of scheduled sanations of abdominal cavity. The optimal interval between the scheduled abdominal sanations is 48 hours. It is advisable to perform the sanations with the solution “octenisept” with the method of “exposition sanation”. All the patients with acute diffuse purulent peritonitis must have intra-abdominal pressure monitoring. It is started at the final stage of the first surgery and finished after the restoration of intestinal peristalsis in postsurgical period after the abdominal cavity closure. Intra-abdominal pressure must not be above 10-15 mm Hg. It is necessary to perform intestinal decompression in all the patients with acute diffuse purulent peritonitis regardless of the stage of bowel loops dilatation during the first surgery. For this purpose can be used both the closed intestinal path of insertion of the probe (through nose) and open (through gastrostomy tube and jejunostomy tube).
острый распространенный гнойный перитонит, лапаростомия, программированные санации брюшной полости.
гострий розповсюджений гнійний перитоніт, лапаростомия, програмовані санації черевної порожнини.
acute diffuse purulent peritonitis, laparotomy , scheduled sanations of abdominal cavity.
Статья опубликована на с. 68-73
Проблема лечения больных с острым распространенным гнойным перитонитом (ОРГП) по-прежнему остается актуальной и не до конца решенной. Сложность данной проблемы состоит в том, что при распространенном гнойном перитоните в патологический процесс вовлекается не только брюшная полость, но, практически, все жизненно важные органы и системы. Этим и обусловлена летальность, которая по данным различных авторов, остается стабильно высокой, а при госпитальном перитоните может достигать 90% [3, 4, 6].
Не способствовало решению проблемы и разработка множества оценочных, прогностических шкал и методик лечения [2, 5]. Их большое количество лишний раз свидетельствует о том, что среди хирургов до сих пор нет единства взглядов на тактику лечения данной патологии. Общепризнанным является ведущая роль хирургического вмешательства, направленного на устранение причины перитонита. Для этого, как правило, используется наименее травматичное и легко технически выполнимое оперативное пособие [1, 7].
Не вызывает сомнений необходимость выполнения интраоперационной санации брюшной полости, что позволяет механическим путем удалить микроорганизмы содержащиеся в экссудате и на поверхности брюшины, токсические вещества, инородные тела и др. Благодаря этому удается уменьшить количество микроорганизмов в брюшной полости и тем самым создаются более благоприятные условия для ликвидации инфекции [8–10]. Однако выбор санирующей среды, методики санации и тактики ведения послеоперационного периода остаются не до конца решенными проблемами [7, 8].
В настоящее время при ОРГП в основном применяются три способа ведения послеоперационного периода и лечения послеоперационных осложнений: лапаростомия в сочетании с последующим выполнением программированных санаций брюшной полости, релапаротомия «по программе» и релапаротомия по «требованию» [1, 3, 6]. Каждый из перечисленных методов имеет свои достоинства и недостатки и соответственно своих сторонников и противников.
Изучение влияния интраабдоминальной гипертензии на развитие тех или иных осложнений послеоперационного периода позволяет разработать и внедрить в клиническую практику новые подходы, которые позволяют улучшить результаты лечения пациентов с ОРГП. Измерение внутрибрюшного давления (ВБД) во время операции и в послеоперационном периоде в последнее время применяется все чаще [11–13]. Самым простым и доступным способом определения и мониторинга ВБД является измерение давления внутри мочевого пузыря, что в настоящее время является методом выбора при диагностике синдрома интраабдоминальной гипертензии.
В настоящее время разработаны специальные закрытые системы для измерения внутрипузырного давления. Некоторые из них подключаются к датчику инвазивного давления и монитору (AbVizer™), другие являются полностью готовыми к использованию без дополнительных инструментальных аксессуаров (Unometer™ Abdo-Pressure™, Unomedical). Последние считаются более предпочтительными, так как намного проще в использовании и не требуют дополнительной дорогостоящей аппаратуры.
Вместе с тем многие методы измерения ВБД остаются слишком дорогостоящими, что существенно ограничивает их применение в клинической практике. Выполнение же наиболее часто применяемого измерения ВБД внутри мочевого пузыря является не всегда удобным, особенно в момент выполнения операции, что обусловливает необходимость разработки новых методов измерения внутрибрюшного давления.
Все изложенное свидетельствует о многих нерешенных проблемах лечения пациентов с ОРГП и обусловливает необходимость поиска новых тактических подходов.
Цель исследования: оптимизировать тактику лечения больных с острым разлитым гнойным перитонитом.
Материал и методы исследования
Под нашим наблюдением находился 181 пациент, который был оперирован по поводу ОРГП в клинике хирургии Донецкого национального медицинского университета на базе городской клинической больницы №16 г. Донецка с 1995 по 2013 годы. Мужчин было 102 (56,4%), женщин — 79 (43,6%). Возраст пациентов колебался от 28 до 86 лет. Причем в возрасте до 60 лет было 90 (49,7%) пациентов, а 60 лет и старше был 91 (50,3%). Сопутствующая патология выявлена у 101 (55,8%) больного. Наиболее часто встречалась патология сердечно-сосудистой и дыхательной систем.
Давность заболевания менее 3 суток отмечена у 91 (50,3%) пациента, 4–6 суток – у 43 (23,8%), а более 6 суток — у 47 (25,9%). Таким образом, с давностью заболевания более 3 суток поступило 90 (49,7%) пациентов.
Основными причинами перитонита явились: перфорация язв желудка и двенадцатиперстной кишки — у 96 (53,1%) пациентов, перфорация тощей и/или подвздошной кишки различной этиологии — у 35 (19,3%), острый гангренозный аппендицит — у 33 (18,2%), острый гнойный сальпингоофорит – у 8 (4,4%), острый гангренозный холецистит — у 5 (2,8%), острая спаечная кишечная непроходимость с некрозом участка кишки — у 4 (2,2%).
Первая степень Мангеймского индекса перитонита выявлена у 27 (14,9%) пациентов, вторая — у 112 (61,9%), третья — у 42 (23,2%). Абдоминальный сепсис выявлен у 154 (85,1%) пациентов, а полиорганная недостаточность — у 42 (23,2%).
Результаты и обсуждение
Всем пациентам выполняли оперативное лечение в экстренном порядке. Целью, которого являлось устранение источника перитонита, эвакуация экссудата, тщательная санация брюшной полости, обязательная декомпрессия кишечника (чаще использовалась назоеюнальная интубация), дренирование брюшной полости по А.А.Шалимову.
У пациентов, у которых хирургическое вмешательство завершали наложением лапаростомы с последующим выполнением программированных санаций брюшной полости, придерживались разработанной нами тактики. Основные ее принципы были следующими.
1. Первичное оперативные вмешательство выполняли под общим обезболиванием из срединного доступа, а все последующие санации брюшной полости выполняли исключительно под продленной эпидуральной анестезией.
2. После устранения причины перитонита обязательно у всех пациентов выполняли назоинтестинальнаю интубацию с эвакуацией содержимого кишечника, даже при отсутствии явной дилатации петель кишок. При невозможности произвести назоинтестинальную интубацию использовали другой вид декомпрессии кишечника, например, через гастростому (при дыхательной недостаточности, выполнении операции под эпидуральной анестезией и т.д.).
3. Перед окончанием операции использовали так называемую «экспозиционную санацию» брюшной полости. Суть предложенного варианта обработки брюшной полости заключалась в следующем. После обильного промывания брюшной полости физиологическим раствором в объеме 8–10 литров (механическое очищение) все дренажи, уложенные в брюшную полость перекрывались, и перед окончанием оперативного пособия в брюшную полости вводили водный раствор «октенисепта» в разведении 1:2, с экспозицией в один час. После истечения этого времени, дренажи открывали, в результате чего происходила самопроизвольная эвакуация содержимого брюшной полости.
4. Хирургическое вмешательство завершали формированием лапаростомы. Большой сальник фиксировали в подчревье, внутренние органы изолировали от внешней среды стерильной перфорированной полиэтиленовой пленкой, которую фиксировали к брюшине или апоневрозу по периметру лапаротомной раны узловыми капроновыми швами. На рану брюшной стенки рыхло укладывали салфетки с антисептиком, края кожной раны сближали несколькими швами (рис. 1).
/70/70.jpg)
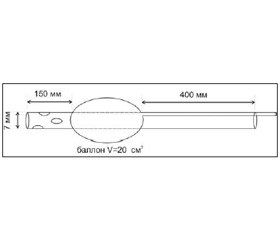
5. При формировании лапаростомы, особенно во время сближения краев раны, обязательно контролировали внутрибрюшной давление, которое не должно было превышать 10–15 мм рт. ст. Для этой цели нами был спроектирован дренаж, который мог использоваться и для измерения ВБД. Он имел вид дренажной трубки диаметром 7 мм, выполненной из полихлорвинила. Дренаж оснащен резиновым баллоном объемом 20 мл, который был закреплен на дренаже на расстоянии 150 мм от его края и имел отдельный независимый канал (рис. 2).
/70/70_2.jpg)
Полученную дренажную систему, после выполнения необходимых этапов операции устанавливали в полость малого таза. После этого фиксировали дренаж к коже отдельным узловым лавсановым швом и перед зашиванием передней брюшной стенки заполняли баллон дренажа стерильным физиологическим раствором объемом 10 мл. С помощью трехходового клапана подключали наружную часть дренажа к прозрачной незамкнутой градуированной шкале. Такой шкалой нам служил прибор для измерения центрального венозного давления. После этого на установленный рядом с операционным столом штатив закреплялась градуированная шкала таким образом, что бы баллон и нижняя часть шкалы были на одном уровне.
Учитывая тот факт, что лапаротомная рана на этот момент не зашита, это значение принимается за нулевое. В последующем операция продолжается по обычному плану. Дополнительные временные затраты на вышеописанные манипуляции не превышают 10 минут. Таким образом, приступая к зашиванию или временному закрытию лапаротомной раны больше не было необходимости проводить этапные измерения внутрибрюшного давления, так как показатели ВБД были доступны в режиме реального времени и позволяли с точностью определять уровень сведения краев раны без опасности развития синдрома интраабдоминальной гипертензии. Результаты измерения получали в см вод. ст., а при необходимости с легкостью пересчитывались в мм рт. ст.
6. Этапные санации брюшной полости, как правило, начинали выполнять не ранее, чем через 48 часов, но не позднее 72 часов после первой операции.
7. Оптимальным считаем выполнение трех программированных санаций брюшной полости. Использование большего числа программированных санаций существенно увеличивает риск развития осложнений (наиболее часто — формирование кишечных свищей). Если за время выполнения трех программированных санаций брюшной полости разрешить перитонит не удалось, мы завершали операцию в пользу «чистой» лапаростомы. В этом случае лапаротомную рану вели по всем принципам гнойной раны.
8. Проведение полноценной комплексной корригирующей инфузионной и медикаментозной терапии, проводилась до, во время и после операции. Основными ее направлениями являлись: коррекция гемодинамики, водно-электролитного баланса и метаболических нарушений, антибактериальная терапия, обеспечение энергетических и пластических потребностей организма, обеспечение нормального газообмена и устранение нарушений микроциркуляции, детоксикационная терапия, повышение естественной резистентности организма, устранение функциональной недостаточности кишечника.
Особое место в лечении разлитого гнойного перитонита занимает антибактериальная терапия, которую начинаем проводить еще до хирургического вмешательства, и продолжаем в послеоперационном периоде. Предпочтение отдаем карбапенемам (меропенему, имепенему-целастатину), цефалоспоринам 4-го (цефепиму) или 3-го (цефоперазону+сульбактаму, цефтазидиму) поколения в сочетании с производными нитроимидазола или клиндамицином. Длительное применение антибиотиков сочетаем с введением противогрибковых препаратов (флуконазолом).
Инфузионная терапия проводилась по общепринятой методике с учетом индивидуальных особенностей пациента и была направлена на коррекцию гемодинамических нарушений, водно-электролитного, белкового, углеводного, жирового обменов, кислотно-основного состояния крови. В предоперационном периоде это достигалось инфузией изотонических полиионных растворов из расчета 30–50 мл на 1 кг массы тела в режиме гемодилюции в течение 2–4 часов. Завершали инфузионную терапию введением коллоидных препаратов.
В послеоперационном периоде объем инфузионной терапии составлял 50–80 мл/кг массы тела, что зависело от объема физиологических и патологических потерь. Управляемая гемодилюция проводилась кристаллоидами и коллоидами в соотношении 2:1 или 1:1.
Профилактику и лечение явлений печеночной недостаточности проводили с помощью гепатопротекторов. При снижении диуреза на фоне адекватной инфузионной терапии применяли торасемид натрия, фуросемид и другие препараты. Для профилактики возникновения острых язв и эрозий слизистой оболочки пищеварительного канала использовали ингибиторы протонной помпы и антацидные препараты. Для стимуляции моторики кишечника и ликвидации явлений паралитической кишечной непроходимости применяли блокаду энтеро–энтерального тормозного рефлекса на разных уровнях (дистигмина бромид, эпидуральную анестезию). До восстановления перистальтики кишечника проводили парентеральное питание.
В зависимости от выбранной тактики лечения все пациенты разделены на 2 группы. В 1-ю группу вошло 105 пациентов, у которых хирургическое вмешательство выполнялось по общепринятой методике и брюшная полость зашивалась наглухо. При развитии осложнений выполняли релапаротомию «по требованию». В послеоперационном периоде осложнения в этой группе больных развились у 22 (21%) пациентов: несостоятельность швов — у 8 (7,6%), абсцессы брюшной полости — у 7 (6,7%), эвентрация — у 3 (2,9%), нагноение послеоперационной раны — у 2 (1,9%), флегмона забрюшинной клетчатки — у 1 (0,95%), перфорация острых язв тонкой кишки — у 1 (0,95%). Умерли 53 пациента, летальность составила 50,5%. Практически у всех пациентов причиной смерти явился не купированный перитонит.
Во 2-ю группу вошло 76 пациентов, у которых хирургическое вмешательство завершали наложением лапаростомы с последующим выполнением программированных санаций брюшной полости по выше описанной методике.
В послеоперационном периоде у данной категории пациентов проводили этапные санации брюшной полости до полного купирования перитонита. У 51 (67,1%) пациента для лечения разлитого гнойного перитонита потребовалось выполнить одну программную санацию брюшной полости, у 18 (23,7%) — две, у 4 (5,3%) — три, у 3 (3,9%) — четыре.
Послеоперационные осложнения развились у 5 (6,6%) пациентов: нагноение послеоперационной раны — у 2 (2,6%), несостоятельность швов — у 1 (1,3%), перфорация острых язв тонкой кишки — у 1 (1,3%), эвентрация — у 1 (1,3%). Умерли 18 пациентов, летальность составила 23,7%. Причиной смерти практически у всех пациентов также явился не купированный перитонит.
Таким образом, приведенные данные свидетельствуют о том, что применение разработанной тактики лечения, которая была применена во 2-й группе по сравнению с 1-й группой позволило у больных с ОРГП снизить летальность с 50,5 до 23,7%, а число послеоперационных осложнений с 21 до 6,6%. При этом во 2–й группе пациентов частота развития несостоятельности швов снизилась с 7,6 до 1,3%, эвентрации с 2,9 до 1,3%. Кроме того, практически отсутствовали такие осложнения как абсцессы брюшной полости и флегмона забрюшинной клетчатки. Лишь нагноение послеоперационной раны во 2-й группе наблюдалось несколько чаще, чем в 1-й — соответственно — у 2,6 и 1,9% пациентов.
Выводы
1. У пациентов с ОРГП хирургическое вмешательство следует завершать наложением лапаростомы с последующим выполнением программированных санаций брюшной полости. Оптимальный интервал между программированными санациями брюшной полости составляет 48 часов.
2. Санацию брюшной полости целесообразно выполнять раствором «октенисепт», используя методику «экспозиционной санации».
3. Контроль ВБД должен осуществляться всем без исключения пациентам с ОРГП. Его необходимо начинать на завершающем этапе первой операции, а завершать после восстановления перистальтики кишечника в послеоперационном периоде после операции, предусматривающей зашивание брюшной полости. При этом показатели интраабдоминального давления не должны превышать 10–15 мм рт. ст.
4. Декомпрессию кишечника необходимо выполнять у всех пациентов с ОРГП независимо от степени дилатации петель кишок во время первой операции. Для этого могут быть использованы как закрытый интестинальный путь введения зонда (через нос), так и открытый (через гастростому и еюностому).
1. Бондарев В.И. Выбор хирургической тактики при остром разлитом перитоните / Бондарев В.И., Бондарев Р.В // Хірургія України. — 2005. — №1(13). — С. 96–99.
2. Борисов Д.Б. Оценка тяжести и интенсивная терапия распространенного перитонита / Д.Б. Борисов, Э.В. Недашковский // Вестник интенсивной терапии. — 2005. — № 1. — С. 5–10.
3. Воронов Н.В. Лапаростомия при послеоперационном перитоните / Н.В. Воронов, Н.И. Стаценко, Рабах Закут Самир // Харківська хірургічна школа. — 2005. — № 1. — С. 18–20.
4. Глабай В.П. Релапаротомии после неотложных операций на органах брюшной полости / В.П. Глабай, А.И. Шаров, А.А. Абрамов // Медицинский академический журнал. — 2003. — № 2, Т. 3, Приложение 3. — С. 28–29.
5. Глухов А.А. Оценка тяжести состояния больных с острым распространенным перитонитом, осложненным абдоминальным сепсисом / А.А. Глухов, А.А. Андреев, О.П. Волобуева // Харківська хірургічна школа. — 2005. — № 1. — С. 21–22.
6. Жебровский В.В. Оптимизация диагностики и лечения послеоперационного перитонита / В.В. Жебровский, И.В. Каминский, Мухаммед Муслих Аль-Ола // Харківська хірургічна школа. — 2005. — № 1. — С. 32–36.
7. Кондратенко П.Г. Роль и место программных санаций брюшной полости в хирургическом лечении разлитого гнойного перитонита / П.Г. Кондратенко, Е.А. Койчев // Украинский журнал хирургия. — 2011. — № 3. — С. 86–91.
8. Кондратенко П.Г. Рациональная стартовая антибактериальная терапия в комплексном лечении больных с распространенным гнойным перитонітом / П.Г. Кондратенко, Л.В. Натрус, Е.А. Койчев // Украинский журнал хирургия. — 2014.– № 1. — С. 50–55.
9. Савельев В.С. Перитонит: Практическое руководство / В.С. Савельева, Б.Г. Гельфанда, М.И. Филимонова [и др.]. — М.: Литера, 2006. — 208 с.
10. Сипливый В. А. Этиологическая структура и чувствительность к антибиотикам возбудителей инфекционных процессов в общехирургическом стационаре / В.А. Сипливый, А.Я. Цыганенко, Е.В. Конь [и др.] // Клиническая хирургия. — 2009. — № 10. — С. 29–32.
11. Intraabdominal hypertension and the abdominal compartment syndrome / A. F . Moore, R. Hargest, M. Martin et al. // Br. J. Surg. — 2004. — Vol. 91 (9). — P. 1102–1110.
12. Muntean V. Acute intraabdominal hypertension and «abdominal compartment syndrome» / V. Muntean, R. Galasiu, O. Fabian // Chirurgia (Bucur). — 2002. — Sep — Vol. 97 (5). — P. 447– 457.
13. Pottecher T. Abdominal compartment syndrome / T. Pottecher, P. Segura, A. Launoy / Serviced’anesthesie reanimation chirurgicale, hopital de Hautepierre, 67098 Strasbourg, France // Ann Chir. — 2001. — Vol. 126 (3). — P. 192 — 200.