Журнал «Здоровье ребенка» 6 (57) 2014
Вернуться к номеру
Стан мікробіоценозу та місцевого імунітету кишечника у здорових дітей раннього віку: результати дослідження
Авторы: Квашніна Л.В., Матвієнко І.М. - ДУ «Інститут педіатрії, акушерства і гінекології» НАМН України, відділ проблем здорової дитини та преморбідних станів, м. Київ
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
Стан мікробіоценозу кишечника є одним із ключових компонентів процесу формування здоров’я дитини. За даними дослідження, проведеного в ІПАГ НАМН України, до 60 % дітей раннього віку (6 місяців — 3 роки) без клінічних ознак захворювання мають дисбіоз 1–2-го ступеня з переважним формуванням дефіциту біфідо- та лактофлори та зі зростанням патогенної флори (патогенний стафілокок, патогенні ентеробактерії, E.coli зі зміненими ферментативними та гемолітичними властивостями), що потенційно призводить до формування патологічних процесів і, як наслідок, захворювань. У 30–68 % дітей (залежно від віку) були виявлені асоціації патогенної флори, представлені переважно стафілококом, клебсієлою та грибами роду Candida. Визначений знижений рівень місцевого кишкового імунітету на тлі дисбіозу призводить до ослаблення опору дітей вірусним та бактеріальним інфекціям, а також зменшує інтенсивність захисних реакцій організму, що може призвести до більш тяжкого перебігу інфекційних захворювань та підвищувати ризик формування хронічної патології.
Состояние микробиоценоза кишечника является одним из ключевых компонентов процесса формирования здоровья у детей. По результатам исследования, проведенного в ИПАГ НАМН Украины, у около 60 % детей раннего возраста (6 месяцев — 3 года) без клинических признаков заболеваний был выявлен дисбиоз 1–2-й степени с преимущественным формированием дефицита бифидо- и лактофлоры с ростом патогенной флоры (патогенный стафилококк, патогенные энтеробактерии, E.coli с измененными ферментативными и гемолитическими свойствами). У 30–68 % детей (в зависимости от возраста) были выявлены ассоциации патогенной флоры, представленные преимущественно стафилококком, клебсиеллой и грибами рода Candida. Также определено снижение уровня местного кишечного иммунитета на фоне дисбиоза, что приводит к ослаблению защиты детей от вирусных и бактериальных инфекций, а также уменьшает интенсивность защитных реакций организма в целом, что приводит к более тяжелому течению заболеваний и формированию хронической патологии.
State of intestinal microbiocenosis is one of the key components of the process of formation of health in children. According to the findings of a survey conducted in IPOG of NAMS of Ukraine, up to 60 % of young children (6 months — 3 years of life) without clinical signs of disease were identified dysbiosis degree 1–2 with the predominant formation of bifido- and lactoflora deficit and with growth of pathogenic flora (pathogenic staphylococci, pathogenic enterobacteria, E.coli with altered enzymatic and hemolytic properties), which potentially leads to the formation of pathological processes and, consequently, diseases. In 30–68 % of children (depending on age) we found associations of pathogenic flora, represented mainly by staphylococcus, Klebsiella and fungi from the genus Candida. Decrease of local intestinal immunity against a background of dysbiosis reduces the resistance of children to viral and bacterial infections as well as the intensity of defense reactions of the organism that can lead to a more severe course of infections and increases the risk of chronic pathology.
імуноглобуліни, діти, місцевий імунітет, мікробіоценоз, патогенна флора.
иммуноглобулины, дети, местный иммунитет, микробиоценоз, патогенная флора.
immunoglobulins, children, local immunity, microbiocenosis, pathogenic flora.
Статья опубликована на с. 38-42
С раннего детства микробиота определяет
направления в становлении метаболизма
и функций организма.
Willem M. de Vos, 2011
На стан здоров’я дитячого населення мають вплив не тільки генетичні фактори та перебіг вагітності і перинатального періоду, але й ціла низка додаткових факторів: екологія та оточуюче дитину середовище; харчування; соціоекономічний рівень як держави, так і родини; рівень освіти батьків; психологічне оточення дитини в родині та суспільстві; якість надання медичної допомоги (а саме своєчасність виявлення проблеми у дитини та адекватне обстеження і лікування); рівень профілактичних заходів у суспільстві та багато інших факторів. Але серед усіх цих факторів особливе місце посідає харчування дитини раннього віку, оскільки саме воно забезпечує зростання, фізичний та психоемоційний розвиток дитини, становлення імунної системи і, як наслідок, формування нормальної діяльності всіх органів та систем [1–3].
В останні роки вітчизняні педіатри констатують, що сучасний тип харчування дітей не тільки не задовольняє їх потребам, але й виявляється небезпечним: за даними ІПАГ НАМН України, значно зросла частота дисгармонійного розвитку дітей як у бік відставання від вікової норми, так і в бік ожиріння [5]. Така сама ситуація склалась і за кордоном: наприклад, в Америці діти отримують близько 35 % енергії з жирів, а лише одна третина дітей отримує рекомендовану кількість фруктів, овочів, каш та м’яса [4].
Не відрізняється ситуація з харчуванням дітей і в Росії: у раціоні дітей віком 12–24 місяці життя визначався підвищений рівень жирів, моно– та полісахаридів; близько 20 % дітей вікової групи 12–18 місяців не отримували необхідної кількості овочів, фруктів, м’ясних та рибних продуктів [3]. На цьому фоні вражає невисока активність медичних працівників із питань навчання населення принципам здорового харчування: близько 20 % лікарів і 40 % медичних сестер не інформують батьків про правила здорового харчування, а батьки отримують інформацію зовсім з інших джерел: 20 % — із реклами харчових продуктів, 37 % — від родичів та сусідів [3, 5]. За даними російської АМН, понад 40 % населення має дефіцит вітамінів групи В, С, А та Е, а також мікроелементів (заліза, цинку, йоду). При цьому виявлений дефіцит має характер комплексної недостатності, що існує не лише взимку та навесні, а й улітку [6, 7].
Якщо враховувати сучасний темп життя і високі вимоги до адаптаційних можливостей не тільки дорослих людей, а й дітей, стає зрозумілим неспокій педіатрів саме стосовно питань раціоналізації харчування дітей.
Але на становлення адекватного функціонування органів дитини та її імунної системи впливає ще й становлення нормального мікробіоценозу кишечника. Відомо, що мікрофлора кишечника включає до 700 різноманітних видів бактерій: загалом в 1 мл вмісту кишечника нараховується до 1012 мікроорганізмів, що в 10 разів перевищує загальну кількість клітин людського організму [8] та становить близько 70 % від усієї кількості мікробів в організмі (шкіра, носова та ротова порожнини, урогенітальний та шлунково-кишковий тракт) [9]. Процес формування та становлення нормального мікробіоценозу кишечника у людини дуже тривалий за часом, і на кожному з етапів існують фактори, що можуть зруйнувати цю важливу захисну систему організму.
Під час пологів та відразу після народження починається колонізація кишкового тракту дитини: протягом 2 днів після народження відбувається дуже швидке заселення кишечника бактеріями, яке пізніше формує відносно стабільну екосистему новонародженої дитини.
Доведено, що у дітей, народжених шляхом кесарського розтину, спостерігається більш тривала колонізація кишечника зі значно меншою кількістю біфідобактерій та іншої непатогенної флори порівняно з дітьми, які народились природним шляхом [10]. Також доведено вплив моделі харчування дитини на становлення екосистеми кишечника: грудне молоко не стерильне і містить у собі біфідобактерії та олігосахариди, у результаті чого у дітей на грудному вигодовуванні при мікробіологічному дослідженні визначається 80–90 % біфідобактерій серед загальної мікрофлори кишечника, у той час як у дітей на штучному вигодовуванні більша пропорція належить E.coli та бактероїдам [8, 11].
Найбільшу роль непатогенна мікрофлора кишечника відіграє в становленні імунної системи дитини: 80 % від усіх імуноактивних клітин організму містять у собі так звану лімфоїдну тканину, асоційовану з кишечником (GALT), формування якої повністю залежить від наявності нормальної мікрофлори в кишечнику [12, 13].
У нормі мікроорганізми кишечника стимулюють рецептори слизової оболонки, що формує адекватний розвиток імунної системи у дітей, включаючи секрецію IgA, IgG та IgM, а також стимулюють активність макрофагів та фагоцитів. На додаток до цього резидентна біфідофлора і лактофлора мають секреторні властивості (продукція антимікробних субстратів), стимулюють синтез муцинів та запобігають адгезії патогенних мікроорганізмів до слизової оболонки кишечника і пригнічують ріст патогенної флори. На сьогодні безперечно доведено вплив пробіотиків на імунну систему (стимуляція системної та місцевої клітинної імунної відповіді на вірусну інфекцію, стимуляція продукції та активності природних протипухлинних клітин, зниження кількості клітин CD 4, підвищення рівня IL-10, зростання продукції цитокінів, підвищення рівня макрофагів та активація фагоцитозу, підсилення захисних властивостей слизової оболонки шлунково-кишкового тракту).
Для того, щоб мікрофлора кишечника виконувала свої захисні функції протягом життя людини, необхідно постійно поповнювати її «запаси», що можуть надходити як із продуктами харчування, так і у вигляді харчових добавок. Абсолютно безперечним є той факт, що припинення або значне зменшення надходження пробіотиків із продуктами харчування призводить до значного зменшення позитивної флори кишечника, і це незважаючи на первинний добре встановлений мікробіоценоз кишечника у дитини. Таким чином, кожна дитина та доросла людина повинні регулярно отримувати пробіотики з продуктами харчування [8, 11, 14–16].
Дослідження, проведені в ДУ «Інститут педіатрії, акушерства і гінекології» НАМН України в групі клінічно здорових дітей, демонструють існування дисбіозу кишечника з наявністю значного мікробно-вірусного навантаження, що не має тенденції до самосанації та призводить до напруження імунної системи, що є перехідним від стану здоров’я до патології і потребує низки певних профілактичних заходів та інколи — фармакопідтримки. Адаптивні процеси при цьому перебувають у стані постійного напруження і в дітей із таким мікробно-вірусним навантаженням спостерігаються зриви адаптації у вигляді підвищення захворюваності, нейровегетативних порушень. Зміни мікробного пейзажу кишечника можуть спричинити розвиток запальних захворювань кишечника, що обов’язково призведе до нутритивного дефіциту: за даними дослідників, нутритивний дефіцит виникає у 30–40 % дітей із запальними захворюваннями кишечника, а надмірна кількість патогенних бактерій може стати причиною розвитку синдрому мальабсорбції [5].
Зміни мікробного пейзажу кишечника не лише ускладнюють метаболічні процеси і травлення, а й утруднюють синтез ряду речовин, у якому бере участь кишкова мікрофлора, що в подальшому призводить до розвитку захворювань. Також доведено, що будь-які кількісні відхилення в рівні речовин, які потрапляють із їжею, або порушення їх збалансованості між собою неминуче ведуть до порушення метаболічних процесів на рівні органів, тканин, клітин та субклітинних структур із подальшим розвитком спочатку передхвороби, а потім і хвороби.
З огляду на наведену вище інформацію співробітниками відділу проблем здорової дитини та преморбідних станів ІПАГ НАМНУ було проведено дослідження з вивчення стану мікробіоценозу та кишкового імунітету у здорових дітей віком від 6 місяців до 3 років життя. У дослідженні взяли участь 80 дітей, які відповідали певним критеріям (табл. 1).
Мікробіологічне обстеження проводилось шляхом мікробіологічного дослідження фекалій при висіві їх у розведенні 10 : 8 в 1 мл на середовища Блаурока, Ендо, Сіменса, Сабуро, ЖСА та 5% кров’яний агар, при відповідних умовах інкубації з наступною мікроскопією. Кількісний склад усіх видів мікроорганізмів в 1 г фекалій визначали за формулою: S = N х A х B, де S — кількість мікроорганізмів у 1 г фекалій; N — кількість колоній, що виросли на чашці; А — коефіцієнт посівної дози; В — ступінь розведення матеріалу. Оцінювались якісні та кількісні показники обсіменіння кишечника облігатною та факультативною мікрофлорою з наступною оцінкою за класифікацією І.Б. Куваєвої та К.С. Ладодо (1991).
Стан місцевого імунітету кишечника був досліджений за результатами визначення протективних факторів (IgG, IgA, IgM, sIgA, лізоциму) у копрофільтраті. Визначення концентрації IgG, IgA, IgM буде проведено за методом радіальної імунодифузії; визначення sIgA — за методом імуноферментного аналізу; визначення рівня лізоциму — за лізисом культури Micrococcus lyzodeiticus. Під час проведення лабораторного дослідження були використані сироватки діагностичні моноспецифічні проти імуноглобулінів G, A, M (ГУ «НИИЭМ им. Н.Ф. Гамалеи РАМН», Росія); сухий ліофілізований порошок одноденної культури Micrococcus lyzodeiticus (Олайнський завод бакпрепаратів, Литва); Agar BioChemica, for microbiology (Fluka, Великобританія); набір для імуноферментного аналізу SIgA-ИФА-БЕСТ (ЗАО «Вектор-Бест», Росія).
Результати бактеріологічного дослідження
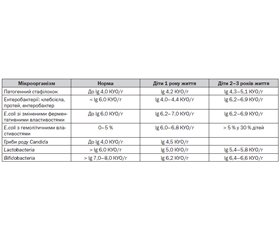
При бактеріологічному дослідженні випорожнень були виявлені дисбіотичні зміни як в анаеробній, так і в аеробній ланках мікробіоценозу кишечника у дітей (табл. 2). Суттєву інформацію про зміни мікроекології кишечника дає аналіз кількісних показників висіву індигенної та факультативної мікрофлори. Результати роботи свідчать, що у дітей першого року життя зареєстровано тенденцію до зростання кількісного рівня висіву грампозитивної кокової мікрофлори, що має патогенні властивості (стафілокок золотистий lg 4,2 КУО/г), також у дітей цієї вікової групи виявлено збільшення контамінації кишечника грибами роду Candida (до lg 4,5 КУО/г).
Концентрація більшості представників ентеробактерій (клебсієла, протей, ентеробактер) не перевищувала показників норми (lg 4,0–4,4 КУО/г), але спостерігалось порушення балансу між окремими біоварами E.coli. Так, зареєстровано збільшення питомої ваги в складі ешерихій E.coli зі зміненими ферментативними властивостями (lg 6,2–7,0 КУО/г) та E.сoli зі зміненими гемолітичними властивостями (lg 6,0–6,8 КУО/г). Негативні зміни встановлено також у системі захисної мікрофлори, що полягали у формуванні дефіциту лактобацил та біфідобактерій (відповідно lg 5,0 КУО/г та lg 6,2 КУО/г). Асоціації різних видів УПМ виявлено у 30 % обстежених дітей цієї вікової групи, які частіше за все були представлені стафілококом і грибами роду Candida.
У дітей вікової групи 2–3 років життя було виявлено збільшення частки обстежених, у яких у значній кількості була виділена умовно–патогенна мікрофлора (реєструвались такі агресивні мікроорганізми, як протей (22 %) та клебсієла (32 %) зі встановленим збільшенням кількісних показників цих видів ентеробактерій (відповідно lg 6,6 КУО/г та lg 6,2 КУО/г)). Також у дітей цієї вікової групи спостерігалось збільшення кількісних показників висіву гемолітичної E.сoli порівняно з нормою. Кількісні показники цих видів потенційно патогенної мікрофлори перевищували діагностичні рівні: E.сoli гемолітична lg 6,0–6,8 КУО/г. Частота виявлення патогенного стафілокока сягала в обстежених цієї вікової групи 32,5 % (у дітей першого року життя вона не перевищувала 17 %), а кількісний рівень контамінації кишечника цим патогенним мікроорганізмом перевищував норму, сягаючи lg 4,3–5,1 КУО/г. Асоціації мікроорганізмів були виявлені в більшості обстежених дітей вікової групи 2–3 років життя (до 68 %). Частіше це були трикомпонентні асоціації, переважно представлені стафілококом, клебсієлою та грибами роду Candida. Комбінований дефіцит нормальної мікрофлори лактобактерій і біфідобактерій спостерігався в більшості обстежених дітей 2–3 років життя (до 64 %), причому концентрація лактобактерій становила lg 5,4–5,8 КУО/г (при нормативних показниках > lg 6,0 КУО/г), а біфідобактерій — lg 6,4–6,6 КУО/г (при нормі > lg 7,0–8,0 КУО/г.).
Таким чином, результати дослідження свідчать про проблеми в стані мікробіоценозу у дітей віком від 6 місяців до 3 років життя, що характеризується зменшенням кількості біфідо- та лактобактерій та зростанням патогенної флори (патогенний стафілокок, патогенні ентеробактерії, E.coli зі зміненими ферментативними та гемолітичними властивостями).
Результати дослідження стану місцевого імунітету
Дослідження вмісту імунних факторів у копрофільтраті залежно від віку дитини продемонструвало, що у всіх обстежених дітей спостерігається зниження рівнів sIgA та IgG; при цьому концентрація IgA та лізоциму не відрізняється від нормативних показників. Також у всіх дітей у копрофільтраті відсутній IgM (табл. 3).
Отримані результати свідчать про те, що в обстежених дітей відсутні гострі запальні процеси в кишечнику, але відмічається часткове зменшення активності місцевого імунітету кишечника, а саме зниження рівнів sIgA і IgG внаслідок мікробіотичного дисбалансу.
Висновки дослідження
1. Результати мікробіологічних досліджень свідчать про те, що у здорових дітей раннього віку спостерігаються проблеми зі встановленням нормального мікробіоценозу з переважним формуванням дефіциту біфідо- та лактофлори, яка є дуже важливою для становлення нормальних процесів травлення та метаболізму.
2. Зростання патогенної флори на тлі недостатнього надходження біфідо- та лактофлори призводить до формування патологічних процесів і, як наслідок, захворювань.
3. Дефіцит біфідо- та лактофлори демонструє відсутність раціонального вигодовування дітей цієї вікової групи, що характеризується недостатньою кількістю в раціоні молочнокислих продуктів (йогуртів, кефіру, кисляку).
4. Знижений рівень місцевого кишкового імунітету на тлі дисбіозу призводить до зниження опору дітей вірусним та бактеріальним інфекціям, а також зменшує інтенсивність захисних реакцій організму, що може призводити до більш тяжкого перебігу інфекційних захворювань та підвищення ризику формування хронічної патології.
5. Дисбіоз відіграє ключову роль у формуванні недостатнього місцевого кишкового імунітету.
6. При кожному зверненні дитини раннього віку до медичного працівника з будь-яких причин (хвороба, або профілактичний огляд) необхідно проводити оцінку харчування дитини та своєчасну корекцію денного раціону з обов’язковим призначенням щоденного вживання кисломолочних продуктів, а за необхідності і пробіотиків/симбіотиків. Всі батьки потребують багаторазового консультування з боку медичних працівників із питань формування адекватного потребам дитини денного раціону.
1. Вскармливание детей грудного и раннего возраста: реальное сотояние вопроса / С.О. Ключников, Н.Л. Нечаева, А.С. Суюндукова, С.Ю. Гвоздева // Вестник педиатрической фармакологии и нутрицилогии. — 2008. — Т. 5, № 5–6. — С. 68–72.
2. The Start Healthy Feeding Guidelines for infants and toddlers / N. Butte, K. Cobb, J. Dwyer [et al.] // J. Am. Diet. Assoc. — 2004. — 104. — 442–454. doi:10.1016/j.jada.2010.09.004.
3. Оценка состояния питания и пищевого статуса детей грудного и раннего возраста в Российской Федерации / В.А. Тутельян, А.К. Батурин, И.Я. Конь [и др.] // Вопросы питания. — 2010. — Т. 79, № 6. — С. 57–63.
4. Food intakes of U.S. children and adolescents compared with recommendations / K.A. Munoz, S.M. Krebs-Smith, R. Ballard-Barbash [et al.] // Pediatrics. — 1997. — 100. — 323–329.
5. Квашніна Л.В. Харчові аспекті формування здоров’я дітей молодшого шкільного віку / Л.В. Квашніна, В.П. Родіонов, В.В. Рачковська // Матеріали науково-практичної конференції з міжнародною участю «Моніторинг здоров’я школярів: міжсекторальна взаємодія лікарів, педагогів, психологів» (21–22 жовтня 2009 р.). — Харків. — 2009. — С. 49–52.
6. Мартинчик А.Н. Методические рекомендации по оценке количества потребляемой пищи методом суточного воспроизведения питания / А.Н. Мартинчик, А.К. Батурин, А.И. Феоктистова. — Москва, 1996. — 28 с.
7. Скурихин И.М. Справочник. Химический состав пищевых продуктов / И.М. Скурихин, М.Н. Волгарев. — Москва: Агропромиздат, 1987. — Кн. 1. — 224 с.
8. Jose M. Saavedra. Safety and Efficacy of probiotics in infants and children / Jose M. Saavedra. Published by Nestle Nutricion Institute.
9. Ley R.E.. Ecological and evolutionary forces shaping microbial diversity in the human intestine / R.E. Ley, D.A. Peterson, J.I. Gordon // Cell. — 2006. — 124. — 837–848. doi: 10.1126/science.1155725.
10. Factors influencing the composition of the intestinal microbiota in early infancy / J. Penders, C. Thijs, C. Vink [et al.] // Pediatrics. — 2006. — 118. — 511–521. doi: 10.1136/gut.2006.100164
11. Newburg D.S. Protection of the neonate by the innateimmune system of developing gut and of human milk / D.S. Newburg, W.A. Walker // Pediatr. Res. — 2007. — 61. — 2–8. doi:10.1203/01.pdr.0000250274.68571.18.
12. Ohtsuka Y. Transforming growth factor-beta: an important cytokine in the mucosal immune response / Y. Ohtsuka, I.R. Sanderson // Curr. Opin. Gastroenterol. — 2000. — 16. — 541–545. DOI: 10.1002/14651858.
13. Rueda R. The role of gangliosides on immunity and the prevention of infection / R. Rueda // Br. J. Nutr. — 2007. — 98 (Suppl. 1). — S68–S73. DOI: 10.1017/S0007114507832946.
14. Impact of diet in shaping gut microbiota revealed by a comparative study in children from Europe and rural Africa / C. De Filippo, D. Cavalieri, M. Di Paola [et al.] // Proc. Natl. Acad. Sci. USA. — 2010. — 107. — 14691–14696. PMID: 20679230.
15. Diet creates metabolic niches in the «immature gut» that shape microbial communities / V. Poroyko, M. Morowitz, T. Bell [et al.] // Nutr. Hosp. — 2011. — 26. — 1283–1295. doi: 10.1073/pnas.1005963107.
16. Three main factors define changes in fecal microbiota associated with feeding modality in infants / C. Gomez-Llorente, J. Plaza-Diaz, M. Aguilera [et al.] // J. Pediatr. Gastroenterol. Nutr. — 2013, E-pub ahead of print. DOI: 10.1097/MPG.0b013e31829d519a.

/40/40.jpg)
/41/41.jpg)