Журнал "Гастроэнтерология" 2 (52) 2014
Вернуться к номеру
Хронический гепатит С и синдром перегрузки железом
Авторы: Бурневич Э.З., Северов М.В., Северова М.М. - ГОУ ВПО «Первый МГМУ им. И.М. Сеченова» Минздравсоцразвития РФ, г. Москва, Россия
Рубрики: Гастроэнтерология, Инфекционные заболевания
Разделы: Справочник специалиста
Версия для печати
В статье рассматриваются вопросы патогенеза и коррекции синдрома перегрузки железом у пациентов с хроническим вирусным гепатитом С. Уделено внимание применению комбинации пегилированного ИФН-α и рибавирина, а также кровопусканиям как адъювантному компоненту противовирусной терапии.
У статті розглядаються питання патогенезу й корекції синдрому перевантаження залізом у пацієнтів із хронічним вірусним гепатитом С. Приділено увагу застосуванню комбінації пегільованого ІФН-α і рибавірину, а також кровопусканням як ад’ювантному компоненту противірусної терапії.
The article deals with the questions of pathogenesis and treatment of iron overload syndrome in patients with chronic viral hepatitis C. The usage of peg-IFN-α and ribaverin combination as well as phlebotomy as an adjuvant component of antiviral therapy have been considered.
хронический гепатит, синдром перегрузки железом, терапия, флеботомия.
хронічний гепатит, синдром перевантаження залізом, терапія, флеботомія.
chronic hepatitis, iron overload syndrome, therapy, phlebotomy.
Статья опубликована на с. 69-74
Актуальность проблемы
В настоящее время противовирусная терапия (ПВТ) хронического гепатита С (ХГС) комбинацией пегилированного интерферона-α (ИФН-α) и рибавирина позволяет достигать стойкого вирусологического ответа (СВО) только у 40–50 % больных, инфицированных HCV 1-го генотипа [1]. Неудовлетворительные результаты лечения данной категории больных требуют поиска как новых вариантов ПВТ (тройная STAT-C-терапия с присоединением ингибиторов вирусной протеазы — боцепревира или телапревира) [2], так и коррекции модифицируемых факторов неблагоприятного ответа на назначение противовирусных препаратов [3]. Среди подобных хорошо известных модифицируемых факторов (наряду с инсулинорезистентностью и неалкогольным стеатогепатитом, алкогольным стеатогепатитом, факторами приверженности к лечению) отдельно выделяют синдром перегрузки железом (СПЖ) [4]. Эта проблема актуальна также в связи с влиянием СПЖ на результативность ПВТ, а также возможностью коррекции СПЖ как адъювантного компонента ПВТ. Проблема СПЖ при HCV-инфекции широко обсуждается и в связи с доказанной ролью данного синдрома как кофактора прогрессирования ХГС до цирроза печени (ЦП) и гепатоцеллюлярной карциномы (ГЦК) [5, 6].
Частота синдрома перегрузки железом при HCV-инфекции
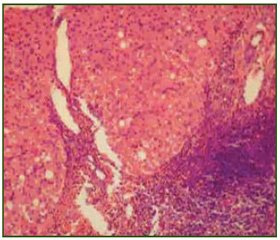
Факт ассоциации ХГС и СПЖ сегодня не вызывает сомнения [7]. A.M. Di Bisceglie и соавт. одними из первых показали, что у 36 % больных ХГС отмечается повышение уровня сывороточного железа с аккумуляцией его в гепатоцитах и печеночных макрофагах [8]. В последующем на группе из 209 больных ХГС было продемонстрировано, что в 42 % наблюдений отмечалось накопление железа в печени [9]. В этой работе также была показана взаимосвязь между индексом гистологической активности по METAVIR и степенью аккумуляции железа в печеночных клетках и клетках Купфера, при этом отложение железа чаще наблюдалось у больных на стадии ЦП. В целом по результатам многочисленных исследований избыточное накопление железа в печени у больных ХГС наблюдается часто — в 7–32 % наблюдений [10, 11].
Патогенез повреждения печени при синдроме перегрузки железом
В настоящее время накоплено много данных о том, что белки HCV стимулируют образование свободных гидроксильных радикалов в гепатоцитах, что является одним из механизмов патогенеза клеточного повреждения при HCV-инфекции: Fe2+ + H2O2 → Fe3+ + – OH + +*OH; H2O2 + O2–→(Fe — катализатор) → – OH + *OH + + O2 [12]. В этом контексте избыток железа при ХГС способствует выраженности окислительного стресса, ведущего как к клеточному повреждению, так и к профиброгенной активации печеночных звездчатых клеток [13, 14].
/70/70.jpg)
На трансгенных мышах было показано, что белки HCV оказывают синергетический с железом эффект в отношении развития ГЦК [15]. С. Chapoutot и соавт. показали, что концентрация железа в печени выше у больных ХГС с ГЦК, чем без опухоли [16]. С. Ko и соавт., изучив частоту СПЖ и ГЦК у 5224 больных с терминальными ЦП различной этиологии, показали, что ГЦК четко ассоциировалась с внутрипеченочной концентрацией железа [17].
Таким образом, СПЖ при HCV-инфекции увеличивает степень некровоспалительных изменений печени, способствует более быстрым темпам прогрессирования фиброза до ЦП и является важным фактором риска развития ГЦК.
Патогенез синдрома перегрузки железом при HCV-инфекции
Как известно, ключевая роль в регуляции обмена железа в организме человека отводится гепсидину. Считается, что белки HCV могут напрямую снижать экспрессию гена гепсидина, тем самым повышая экспрессию ферропортина, что приводит к увеличению всасывания железа из желудочно-кишечного тракта [18]. У больных ХГС продемонстрирован низкий уровень гепсидина [19], а также нарушение экспрессии целого ряда генов, регулирующих обмен железа [20]. Также показана прямая корреляционная зависимость между mRNA гепсидина и накоплением железа в печени больных ХГС [21]. Снижение экспрессии гепсидина при HCV-инфекции реализуется в рост окислительного повреждения [18]. Вирусиндуцированная аккумуляция железа в гепатоцитах, в свою очередь, способствует экспрессии генов HCV, то есть увеличению репликативной активности, что является одним из многочисленных механизмов самосохранения вирусной популяции [22].
Важными аспектами патогенеза СПЖ при HCV-инфекции являются экзогенная нагрузка железом и физиологические потери железа. Так, в экспериментальных исследованиях показано, что диета с большим содержанием железа приводит к нарастанию степени некровоспалительной активности в печени у инфицированных HCV шимпанзе и промотирует канцерогенез на HCV core protein у трансгенных мышей [23, 24]. С другой стороны, у менструирующих женщин активность ХГС ниже, в том числе в связи с более низкими показателями печеночного индекса железа [25].
Степень аккумуляции железа в печени прямо пропорциональна «стажу» HCV-инфекции. Наиболее выражен СПЖ при HCV-инфекции при «продвинутом» фиброзе и сформированном ЦП, в связи с чем СПЖ при ХГС иногда выступает в качестве суррогатного маркера фиброза печени [26, 27].
Мутации HFE-гена и синдром перегрузки железом у больных хроническим гепатитом С
Нет сомнения, что на прогрессирование HCV-инфекции важное влияние оказывают генетические факторы больного. В этом аспекте особый интерес представляют исследования взаимосвязи СПЖ при ХГС и мутаций HFE-гена. Если имеется гомозиготность по мутациям HFE-гена (в том числе компаунд-гетерозиготность), то речь идет о наследственном гемохроматозе. Как известно, гетерозиготность по классическим мутациям C282Y, H63D, S65C не приводит к развитию наследственного гемохроматоза, однако при сочетании с HCV-инфекцией может выступать в качестве генетического фактора развития СПЖ у данной категории больных. Субанализ группы из 363 больных, принимавших участие в исследовании HALT-C [28], равно как и целый ряд других работ, показал, что гетерозиготность по мутациям HFE-гена ассоциируется с формированием СПЖ у больных ХГС, более выраженным фиброзом и более высокой частотой ГЦК [29, 30].
Показатели обмена железа и противовирусная терапия
Во время ПВТ всегда отмечается рост уровня ферритина, что обусловлено иммуностимулирующим и иммунорегуляторным эффектами ИФН-α с активацией множественных ИФН-стимулированных генов [31], индукцией Th1-иммунного ответа путем повышения экспрессии генов и высвобождения провоспалительных цитокинов (ФНО-α, ИЛ-1, ИЛ-6) [32]. Рибавирин также способствует росту уровня ферритина [33]. После завершения ПВТ при условии достижения СВО уровень ферритина нормализуется [33]. Важно, что рост уровня ферритина во время ПВТ является положительным прогностическим фактором ответа на лечение [34].
Таким образом, объективное суждение о наличии СПЖ во время ПВТ невозможно. Принципиально важно оценивать показатели обмена железа до назначения препаратов ИФН-α.
Результаты противовирусной терапии у больных хроническим гепатитом С с синдромом перегрузки железом
Целый ряд исследований подтвердил наличие обратной зависимости между содержанием железа в печени и частотой СВО при монотерапии ИФН-α [35–38]. Очевидна роль СПЖ в снижении частоты СВО при комбинированной терапии ИФН-α и рибавирином [39]. При ПВТ комбинацией пегилированного ИФН-α и рибавирина СПЖ также снижает частоту СВО [27], однако это подтверждают не все авторы [40].
Важно, что гетерозиготное носительство мутации C282Y, ассоциирующееся с формированием СПЖ при ХГС, снижает частоту СВО при ПВТ комбинацией пегилированного ИФН-α и рибавирина [41], в то время как гетерозиготное носительство мутации H63D является благоприятным фактором ответа на ПВТ комбинацией пегилированного ИФН-α и рибавирина [42, 43].
Коррекция синдрома перегрузки железом, уровень аминотрансфераз и морфологические данные при хроническом гепатите С
Самым адекватным методом коррекции СПЖ (как первичного при наследственном гемохроматозе, так и вторичного при ХГС) является кровопускание (флеботомия). Безусловно, диета с ограничением пищевых продуктов, богатых железом, также является методом борьбы с СПЖ. Так, N. Tandon и соавт. на примере 19 больных ХГС и хроническим гепатитом В показали, что диета с 50% уменьшением содержания железа приводит к снижению не только концентрации сывороточного железа и процента насыщения трансферрина железом, но и уровня аминотрансфераз [44]. Y. Sumida и соавт., сравнивая эффект соблюдения диеты и кровопусканий, также показали возможность снижения уровня АЛТ при уменьшении употребления пищевого железа, хотя, конечно, этот эффект был более очевиден при проведении кровопусканий [45].
Считается доказанным факт, что кровопускания снижают уровень АЛТ у больных ХГС, однако этот эффект наиболее выражен при достижении уровня ферритина < 20 нг/мл [46–49]. Так, Yano и соавт. на 33 больных показали эффект 3-месячного периода кровопусканий на средний уровень АЛТ, который снизился с (118 ± 79) Ед/л до (73 ± 39) Ед/л (р < 0,01) [48]. Более длительное (5-летнее) исследование этих же авторов показало снижение уровня АЛТ с (116,8 ± 69,0) Ед/л до (74,9 ± 40,5) Ед/л у 25 больных ХГС, у которых удалось путем регулярных кровопусканий (в среднем 1 раз в 8 месяцев) добиться снижения уровня ферритина < 10 нг/мл [39]. Во многих других исследованиях также продемонстрировано снижение уровня АЛТ в результате регулярных кровопусканий как у первичных больных ХГС [50, 51], так и у больных без ответа на ПВТ [52]. Таким образом, кровопускания уменьшают выраженность некровоспалительных изменений в печени, что доказано также морфологическими данными [49, 53, 54].
Коррекция синдрома перегрузки железом как адъювантный компонент противовирусной терапии
Целый ряд исследований, призванных оценить роль кровопусканий как адъювантного компонента ПВТ, был проведен еще в эпоху монотерапии ИФН-α ХГС (табл. 1).
Необходимо указать, что во всех приведенных исследованиях имелась только тенденция к более высоким показателям частоты СВО у больных с коррекцией СПЖ, так как статистической достоверности не было получено ни в одной из данных работ. Также следует учитывать, что только в исследовании S. Fargion и соавт. принимали участие больные с доказанным СПЖ. С другой стороны, в метаанализе, объединившем результаты 6 проспективных исследований, было продемонстрировано, что частота СВО в группе больных, получавших ПВТ в режиме монотерапии ИФН-α и кровопускания, составила 27 % в сравнении с контрольной группой (ПВТ без кровопусканий) — 12 % (р < 0,0001) [58]. Таким образом, кровопускания повышают частоту СВО при монотерапии ИФН-α.
Целый ряд исследований был посвящен оценке влияния адъювантной флеботомии на эффективность противовирусной терапии у больных без ответа на первый курс лечения ИФН-α (табл. 2), в которых также в целом прослежена тенденция к росту частоты СВО при применении кровопусканий. Необходимо указать на ряд исследований, в которых частота СВО у больных без мутаций HFE-гена составила 30 %, в то время как при их наличии ни в одном случае не удалось достигнуть СВО при применении ИФН-α в комбинации с рибавирином (р = 0,03) [63].
H.L. Bonkovsky и соавт. изучали эффективность комбинированной ПВТ Пег-ИФН-α2а и рибавирином у 363 больных ХГС, не ответивших на первичный курс монотерапии ИФН-α или ИФН-α и рибавирином [64]. Оказалось, что у больных, имевших мутации HFE-гена, частота СВО составила 40 % в сравнении с 29 % у больных без мутаций (р = 0,009); при этом между концентрацией железа в печени и частотой СВО наблюдалась обратная корреляционная взаимосвязь. Таким образом, авторы указали, что не просто формальное наличие мутаций HFE-гена, а фенотипические проявления СПЖ влияют на эффективность ПВТ.
Некоторые исследования не продемонстрировали рост частоты СВО при проведении курса кровопусканий до начала ПВТ комбинацией пегилированного ИФН-α и рибавирина при ХГС [65]. J. Kato и соавт. показали, что кровопускания снижают частоту развития ГЦК у больных с «продвинутым» фиброзом и ЦП [66].
Таким образом, коррекция СПЖ при ХГС отражается на росте частоты СВО, однако данный эффект наименее выражен при использовании современного стандарта ПВТ — комбинации пегилированного ИФН-α и рибавирина. Это позволяет обсуждать тот факт, что действие мощных современных противовирусных препаратов позволяет нивелировать значение такого прогностического фактора овета на лечение, как СПЖ. Можно предположить, что при тройной ПВТ (пегилированный ИФН-α + рибавирин + ингибитор протеазы) СПЖ вовсе перестанет играть роль отрицательного фактора ответа на ПВТ.
Заключение
СПЖ часто ассоциируется с ХГС, демонстрируя нарастание как частоты, так и степени выраженности пропорционально длительности HCV-инфекции. Патогенетически СПЖ при HCV-инфекции во многом связан с гетерозиготным носительством мутаций HFE-гена. При ХГС наличие СПЖ увеличивает степень некровоспалительных изменений в печени, способствует более быстрым темпам прогрессирования фиброза и повышает риск развития ГЦК, а также ассоциируется с более низкой частотой достижения СВО в результате ПВТ. Кровопускания значимо снижают уровень АЛТ у больных ХГС, а также повышают частоту СВО при использовании в качестве адъюванта кровопусканий при проведении ПВТ. Использование комбинации пегилированного ИФН-α и рибавирина позволяет во многом преодолеть отрицательное прогностическое значение СПЖ в достижении СВО при HCV-инфекции.
1. Simin M., Brok J., Stimac D. et al. Cochrane systematic review: pegylated interferon plus ribavirin vs. interferon plus ribavirin for chronic hepatitis C // Aliment. Pharmacol. Ther., 2007, 25, 1153–1162.
2. Tungol A., Rademacher K., Schafer J.A. Formulary management of the protease inhibitors boceprevir and telaprevir for chronic hepatitis C virus // J. Manag. Care Pharm., 2011, 17, 685–694.
3. El-Zayadi A.R. Hepatitis C comorbidities affecting the course and response to therapy // World J. Gastroenterol., 2009, 15, 4993–4999.
4. Price L., Kowdley K.V. The role of iron in the pathophysiology and treatment of chronic hepatitis C // Can J. Gastroenterol., 2009, 23, 822–828.
5. Massard J., Ratziu V., Thabut D. et al. Natural history and predictors of disease severity in chronic hepatitis C // J. Hepatol., 2006, 44 (Suppl.), S19–S24.
6. Fujita N., Sugimoto R., Urawa N. et al. Hepatic iron accumulation is associated with disease progression and resistance to interferon/ribavirin combination therapy in chronic hepatitis C // J. Gastroenterol. Hepatol., 2007, 22, 1886–1893.
7. Haque S., Chandra B., Gerber M.A., Lok A.S. Iron overload in patients with chronic hepatitis C: a clinicopathologic study // Hum. Pathol., 1996, 27, 1277–1281.
8. Di Bisceglie A.M., Axiotis C.A., Hoofnagle J.H., Bacon B.R. Measurements of iron status in patients with chronic hepatitis // Gastroenterology, 1992, 102, 2108–2113.
9. Hezode C., Cazeneuve C., Coue O. et al. Liver iron accumulation in patients with chronic active hepatitis C: Prevalence and role of hemochromatosis gene mutations and relationship with hepatic histological lesions // J. Hepatol., 1999, 31, 979–984.
10. Silva I.S., Perez R.M., Oliveira P.V. et al. Iron overload in patients with chronic hepatitis C virus infection: clinical and histological study // J. Gastroenterol. Hepatol., 2005, 20, 243–248.
11. Alla V., Bonkovsky H.L. Iron in nonhemochromatotic liver disorders // Semin. Liver Dis., 2005, 25, 461–472.
12. Choi J., Ou J.H. Mechanisms of liver injury. III. Oxidative stress in the pathogenesis of hepatitis C virus // Am. J. Physiol. Gastrointest. Liver Physiol., 2006, 290, G847–G851.
13. Isomura T., Yano M., Hayashi H., Sakamoto N. Excess iron in the liver of patients with chronic hepatitis C // J. Clin. Electron. Microsc., 1992, 25, 231–237.
14. Fujita N., Horiike S., Sugimoto R. et al. Hepatic oxidative DNA damage correlates with iron overload in chronic hepatitis C patients // Free Radic. Biol. Med., 2007, 42, 353–362.
15. Furutani T., Hino K., Okuda M. et al. Hepatic iron overload induces hepatocellular carcinoma in transgenic mice expressing the hepatitis C virus polyprotein // Gastroenterology, 2006, 130, 2087–2098.
16. Chapoutot C., Esslimani M., Joomaye Z. et al. Liver iron excess in patients with hepatocellular carcinoma developed on viral C cirrhosis // Gut, 2000, 46, 711–714.
17. Ko C., Siddaiah N., Berger J. et al. Prevalence of hepatic iron overload and association with hepatocellular cancer in end-stage liver disease: Results from the National Hemochromatosis Transplant Registry // Liver Int., 2007, 27, 1394–1401.
18. Nishina S., Hino K., Korenaga M. et al. Hepatitis C virus–induced reactive oxygen species raise hepatic iron level in mice by reducing hepcidin transcription // Gastroenterology, 2008, 134, 226–238.
19. Fujita N., Sugimoto R., Takeo M. et al. Hepcidin expression in the liver: relatively low level in patients with chronic hepatitis C // Mol. Med., 2007, 13, 97–104.
20. Saito H., Fujimoto Y., Ohtake T. et al. Up-regulation of transferrin receptor 1 in chronic hepatitis C: implication in excess hepatic iron accumulation // Hepatol. Res., 2005, 31, 203–210.
21. Trinder D., Ayonrinde O.T., Olynyk J.K. HCV, iron, and oxidative stress: The new choreography of hepcidin // Gastroenterology, 2008, 134, 348–351.
22. Theurl I., Zoller H., Obrist P. et al. Iron regulates hepatitis C virus translation via stimulation of expression of translation initiation factor 3 // J. Infect. Dis., 2004, 190, 819–825.
23. Bassett S.E., Di Bisceglie A.M., Bacon B.R. et al. Effects of iron loading on pathogenicity in hepatitis C virusinfected chimpanzees // Hepatology, 1999, 29, 1884–1892.
24. Furutani T., Hino K., Okuda M. et al. Hepatic iron overload induces hepatocellular carcinoma in transgenic mice expressing the hepatitis C virus polyprotein // Gastroenterology, 2006, 130, 2087–2098.
25. Sartori M., Andorno S., Rigamonti C. et al. Chronic hepatitis C is mild in menstruating women // J. Gastroenterol. Hepatol., 2000, 15, 1411–1417.
26. Guyader D., Thirouard A.S., Erdtmann L. et al. Liver iron is a surrogate marker of severe fibrosis in chronic hepatitis C // J. Hepatol., 2007, 46, 587–595.
27. Lange C.M., Kutalik Z., Morikawa K. et al. Serum ferritin levels are associated with a distinct phenotype of chronic hepatitis C poorly responding to pegylated interferon-α and ribavirin therapy // Hepatology, 2011 (article in press).
28. Bonkovsky H.L., Naishadham D., Lambreacht R.W. et al. Roles of iron and HFE mutations on severity and response to therapy during retreatment of advanced chronic hepatitis C // Gastroenterology, 2006, 131, 1440–1451.
29. Tung B.Y., Emond M.J., Bronner M.P. et al. Hepatitis C, iron status, and disease severity: Relationship with HFE mutations // Gastroenterology, 2003, 124, 318–326.
30. Geier A., Reugels M., Weiskirchen R. et al. Common heterozygous hemochromatosis gene mutations are risk factors for inflammation and fibrosis in chronic hepatitis C // Liver Int., 2004, 24, 285–294.
31. Chevaliez S., Pawlotsky J.-M. Interferon-based therapy of hepatitis C // Adv. Drug Deliv. Rev., 2007, 59, 1222–1241.
32. Torti F.M., Torti S.V. Regulation of ferritin genes and protein // Blood, 2002, 99, 3505–3516.
33. Ladero J.M., López-Alonso G., Devesa M.J. et al. Oscillations in serum ferritin associated with antiviral therapy in chronic hepatitis C // Rev. Esp. Enferm. Dig., 2009, 101, 31–40.
34. Ferrara F., Ventura P., Vegetti A. et al. Serum ferritin as a predictor of treatment outcome in patients with chronic hepatitis C // Am. J. Gastroenterol., 2009, 104, 605–616.
35. Eisenbach C., Gehrke S.G., Stremmel W. Iron, the HFE gene, and hepatitis C // Clin. Liver Dis., 2004, 8, 775–785.
36. Olynyk J.K., Reddy K.R., Di Bisceglie A.M. et al. Hepatic iron concentration as a predictor of response to interferon-alfa therapy in chronic hepatitis C // Gastroenterology, 1995, 108, 1104–1119.
37. Van Thiel D.H., Friedlander L., Fagiuoli S. et al. Response to interferon alpha therapy is influenced by the iron content of the liver // J. Hepatol., 1994, 20, 410–415.
38. Ikura Y., Morimoto H., Johmura H. et al. Relationship between hepatic iron deposits and response to interferon in chronic hepatitis C // Am. J. Gastroenterol., 1996, 91, 1367–1373.
39. Fujita N., Sugimoto R., Urawa N. et al. Hepatic iron accumulation is associated with disease progression and resistance to interferon/ribavirin combination therapy in chronic hepatitis C // J. Gastroenterol. Hepatol., 2007, 22, 1886–1893.
40. Pereira Pda S., Silva I.S., Uehara S.N. et al. Chronic hepatitis C: hepatic iron content does not correlate with response to antiviral therapy // Rev. Inst. Med. Trop. Sao Paulo, 2009, 51, 331–336.
41. Sikorska K., Stalke P., Izycka-Swieszewska E. et al. The role of iron overload and HFE gene mutations in the era of pegylated interferon and ribavirin treatment of chronic hepatitis C // Med. Sci. Monit., 2010, 16, 137–143.
42. Ishizu Y., Katano Y., Honda T. et al. Clinical impact of HFE mutations in Japanese patients with chronic hepatitis C // J. Gastroenterol. Hepatol., 2011, 24, 134–139.
43. Carneiro M.V., Souza F.F., Teixeira A.C. et al. The H63D genetic variant of the HFE gene is independently associated with the virological response to interferon and ribavirin therapy in chronic hepatitis C // Eur. J. Gastroenterol. Hepatol., 2010, 22, 1204–1210.
44. Tandon N., Thaker V., Kumkar R. et al. Beneficial influence of an indigenous low-iron diet on serum indicators of iron status in patients with chronic liver disease // British J. Nutr., 2000, 83, 235–239.
45. Sumida Y., Kanemasa K., Fukumoto K. et al. Effects of dietary iron reduction versus phlebotomy in patients with chronic hepatitis C: Results from a randomized, controlled trial on 40 Japanese patients // Intern. Med., 2007, 46, 637–642.
46. Hayashi H., Takikawa T., Nishimura N. et al. Improvement of serum aminotransferase levels after phlebotomy in patients with chronic active hepatitis C // Am. J. Gastroenterol., 1994, 89, 986–988.
47. Di Bisceglie A.M., Bonkovsky H.L., Chopra S. et al. Iron reduction as an adjuvant to interferon therapy in patients with chronic hepatitis C who have previously not responded to interferon: a multicenter, prospective, randomized, controlled trial // Hepatology, 2000, 32, 135–138.
48. Yano M., Hayashi H., Yoshioka K. et al. A significant reduction in serum alanine aminotransferase levels after 3–month iron reduction therapy for chronic hepatitis C: a multicenter, prospective, randomized, controlled trial in Japan // J. Gastroenterol., 2004, 39, 570–574.
49. Yano M., Hayashi H., Wakusawa S. et al. Long term effects of phlebotomy on biochemical and histological parameters of chronic hepatitis C // Am. J. Gastroenterol., 2002, 97, 133–137.
50. Fontana R.J., Israel J., LeClair P. et al. Iron reduction before and during interferon therapy of chronic hepatitis C: Results of a multicenter, randomized, controlled trial // Hepatology, 2000, 31, 730–736.
51. Fargion S., Fracanzani A.L., Rossini A. et al. Iron reduction and sustained response to interferon-alpha therapy in patients with chronic hepatitis C: Results of an Italian multicenter randomized study // Am. J. Gastroenterol., 2002, 97, 1204–1210.
52. Tsai N., Zuckerman E., Han S.H. et al. Effect of iron depletion on long-term response to interferon-alpha in patients with chronic hepatitis C who previously did not respond to interferon therapy // Am. J. Gastroenterol., 1997, 92, 1831–1834.
53. Sartori M., Andorno S., Rossini A. et al. Phlebotomy improves histology in chronic hepatitis C males with mild iron overload // World J. Gastroenterol., 2010, 16, 596–602.
54. Sartori M., Andorno S., Rossini A. et al. A case-control histological study on the effects of phlebotomy in patients with chronic hepatitis C // Eur. J. Gastroenterol. Hepatol., 2011, 23, 1178–1184.
55. Fong T.L., Han S.H., Tsai N.C. et al. A pilot randomized, controlled trial of the effect of iron depletion on long-term response to alpha-interferon in patients with chronic hepatitis C // J. Hepatol., 1998, 28, 369–374.
56. Carlo C., Daniela P., Giancarlo C. Iron depletion and response to interferon in chronic hepatitis C // Hepatol. Gastroenterol., 2003, 50, 1467–1471.
57. Piperno A., Vergani A., Malosio D. et al. Hepatic iron overload in patients with chronic viral hepatitis: Role of HFE gene mutations // Hepatology, 1998, 28, 1105–1109.
58. Desai T.K., Jamil L.H., Balasubramaniam M. et al. Phlebotomy improves therapeutic response to interferon in patients with chronic hepatitis C: A meta-analysis of six prospective randomized controlled trials // Dig. Dis. Sci., 2008, 53, 815–822.
59. Van Thiel D.H., Friedlander L., Molloy P.J. et al. Retreatment of hepatitis C interferon non-responders with larger doses of interferon with and without phlebotomy // Hepatogastroenterology, 1996, 43, 1557–1561.
60. Di Bisceglie A.M., Bonkovsky H.L., Chopra S. et al. Iron reduction as an adjuvant to interferon therapy in patients with chronic hepatitis C who have previously not responded to interferon: A multicenter, prospective, randomized, controlled trial // Hepatology, 2000, 32, 135–138.
61. Guyader D., Boucher E., Andre P. et al. A pilot study of iron depletion as adjuvant therapy in chronic hepatitis C patients not responding to interferon // Am. J. Gastroenterol., 1999, 94, 1696–1698.
62. Alexander J., Tung B.Y., Croghan A., Kowdley K.V. Effect of iron depletion on serum markers of fibrogenesis, oxidative stress and serum liver enzymes in chronic hepatitis C: Results of a pilot study // Liver Int., 2007, 27, 268–273.
63. Coelho-Borges S., Cheinquer H., Cheinquer N. et al. HFE gene mutations prevent sustained virological response to interferon plus ribavirin in chronic hepatitis C patients with serum markers of iron overload // Am. J. Gastroenterol., 2002, 97, 1570–1572.
64. Bonkovsky H.L., Naishadham D., Lambreacht R.W. et al. Roles of iron and HFE mutations on severity and response to therapy during retreatment of advanced chronic hepatitis C // Gastroenterology, 2006, 131, 1440–1451.
65. Gentile I., Viola C., Paesano L. et al. Iron depletion before HCV antiviral therapy: a pilot, randomized, controlled trial // J. Clin. Apher., 2009, 24, 190–196.
66. Kato J., Miyanishi K., Kobune M. et al. Long-term phlebotomy with low-iron diet therapy lowers risk of development of hepatocellular carcinoma from chronic hepatitis C // J. Gastroenterol., 2007, 42, 830–836.

/71/71.jpg)
/71/71_2.jpg)