Журнал «Neoplasm» 1(13) 2014
Вернуться к номеру
Пути оптимизации лечения больных местнораспространенным раком молочной железы
Авторы: Седаков И.Е., Бондарь А.В. - Донецкий областной противоопухолевый центр
Рубрики: Онкология
Разделы: Клинические исследования
Версия для печати
Представлен способ лечения больных местнораспространенным раком молочной железы, заключающийся в проведении комплексного лечения с использованием двух путей одновременного введения полихимиотерапии — селективного и системного. Полученные результаты продемонстрировали преимущество данной схемы по сравнению с традиционными методами введения препаратов для лечения данной патологии.
The article presents the method to treat patients with locally advanced breast cancer, consisting in complex treatment using two ways for simultaneous introduction of polychemotherapy — selective and systemic one. The findings showed the advantages of this scheme in comparison with traditional methods for administration of preparations for treatment of this pathology.
Наведений спосіб лікування хворих місцевопоширеним раком молочної залози, що полягає в проведенні комплексного лікування з використанням двох шляхів одночасного введення поліхіміотерапії — селективного й системного. Отримані результати продемонстрували переваги даної схеми порівняно з традиційними методами введення препаратів для лікування даної патології.
местнораспространенный рак молочной железы, комплексное лечение.
locally advanced breast cancer, complex treatment.
місцевопоширений рак молочної залози, комплексне лікування.
Статья опубликована на с. 5-12
Введение
Разработка новых методов лечения больных раком молочной железы (РМЖ) в настоящее время ни у кого не вызывает сомнений. Статистические данные свидетельствуют о неуклонном росте заболеваемости РМЖ за последние 20 лет, без тенденции к стабилизации [1, 2]. Таким образом, эта патология выступает на первое место среди женского населения. Показатели заболеваемости (69,8 случая на 100 000 женского населения в 2011 г.) и смертности (32,0 %) в Украине приближаются к уровню стран Европейского союза.
Методика внутриартериального (в/а) введения химио-препаратов, разработанная в Донецком областном противоопухолевом центре (ДОПЦ), показала свой неоспоримый вклад в развитие современной онкологии путем уменьшения первичного опухолевого очага, перевода из неоперабельного состояния в состояние, при котором пациенткам удалось и удается выполнять радикальный объем хирургического вмешательства [4, 8].
Особое внимание уделяется разработке новых методов лечения больных РМЖ (местнораспространенными формами заболевания) с неблагоприятными факторами прогноза опухолевого роста [2, 7].
Цель работы. Улучшить непосредственные и отдаленные результаты лечения больных местнораспространенными формами РМЖ путем оптимизации способов введения химиотерапевтических препаратов, повысить качество жизни пациенток.
Материалы и методы
В основу настоящего исследования были положены данные о 279 больных с местнораспространенными формами РМЖ и неблагоприятными прогностическими факторами, со стадиями T4N0-2M0, лечение которых было проведено в Донецком областном противоопухолевом центре в 2000–2013 гг.
В ходе исследования для адекватного анализа результатов лечения по рассматриваемым методикам были сформированы две группы больных. В первую (исследуемую) группу вошла 221 пациентка, из них при иммуноцитохимическом заключении у 168 чел. диагностирован HER/2-neu-положительный и у 53 — базальноподобный биологический подтип. Программа комплексного лечения больных этой группы включала катетеризацию внутренней грудной артерии через верхнюю надчревную (патент Украины № 29318 от 01.07.2000; патент Российской Федерации № 2169014 от 20.06.2001), проведение двух-трех циклов селективной внутриартериальной и внутривенной (в/в) полихимиотерапии (ПХТ) с интервалом в 21 день, оценку эффекта, лучевую терапию на молочную железу и зоны регионарного лимфооттока в статическом режиме: разовая очаговая доза (РОД) — 2–2,5 Гр, суммарная очаговая доза (СОД) — 40 Гр, интервал, оценку эффекта. Мастэктомия у больных исследуемой группы выполнялась только лишь при достижении полного или частичного ответа опухоли (136 операций в радикальном объеме). Курсы внутриартериальной ПХТ проводили в режиме непрерывной длительной инфузии (4–6 ч) по схеме CMF, CAF или CAMF. Учитывая вероятность развития локальных осложнений на фоне введения некоторых химиотерапевтических агентов (чаще всего доксорубицина), половина дозы препарата вводилась системно.
Инфузия химиопрепаратов в режиме селективного внутриартериального введения по схеме CMF осуществлялась следующим образом:
— циклофосфан: первый день — 200 мг/ч, четвертый, седьмой дни — по 150 мг/ч;
— метотрексат: второй, пятый — в/а по 10 мг/ч, восьмой день — в/в 40 мг;
— фторурацил: третий день — 250 мг/ч, шестой, девятый дни — 180 мг/ч.
Протокол применения схемы CAF в режиме селективной внутриартериальной полихимиотерапии:
— циклофосфан: первый день — 200 мг/ч, четвертый, седьмой дни — по 150 мг/ч;
— доксорубицин: второй, пятый — в/а по 5 мг/ч, восьмой день — в/в 40 мг.
— фторурацил: третий день — 250 мг/ч, шестой, девятый дни — 180 мг/ч.
Протокол применения схемы CAМF в режиме селективной внутриартериальной полихимиотерапии:
— циклофосфан: первый день — 200 мг/ч, четвертый, седьмой дни — по 150 мг/ч в/а;
— метотрексат: второй, пятый, восьмой день — в/а 10 мг/ч;
— доксорубицин: девятый день в/в — 80 мг;
— фторурацил: третий день — 250 мг/ч, шестой, девятый дни в/а — 180 мг/ч.
Суммарные курсовые дозы химиопрепаратов соответствовали расчетным по критериям BSA.
Количество циклов ПХТ определяли, исходя из оценки эффективности лечения, общего состояния пациенток, наличия и степени выраженности местных и системных осложнений. В среднем пациентки получили 2–3 цикла для достижения эффекта в неоадъювантном режиме. При отсутствии эффекта в схему ПХТ включали антрациклины (1–2 цикла) [3–5].
Во вторую (контрольную) группу вошли 58 пациенток, из них у 45 был выявлен HER/2-neu-положительный и у 13 — базальноподобный подтип. На первом этапе лечения пациентки этой группы получали 4–6 циклов системной ПХТ по схемам CMF, CAF или CAMF (препараты вводились согласно известным схемам, системно), предоперационный курс телегамматерапии мелкими фракциями на молочную железу и зоны регионарного лимфооттока в статическом режиме (РОД — 2–2,5 Гр, СОД — 40 Гр), затем им выполняли мастэктомию. После этого больных осматривал консилиум врачей для решения вопроса о проведении дальнейшего специального лечения.
Во время дообследования при первичном обращении пациенток исследуемой и контрольной групп метастазов выявлено не было.
При гистологическом исследовании операционных материалов в первой группе больных преобладали опухоли следующей морфологической структуры:
— инфильтрирующая карцинома 3-й ст. злокачественности — 32 (23,53 ± 2,80 %);
— инфильтрирующая карцинома 2-й ст. злокачественности — 23 (16,91 ± 3,50 %);
— потоковый инвазивный рак — 18 (13,24 ± 2,30 %) наблюдений.
У пациенток в пременопаузе с гормонзависимыми опухолями одномоментно с катетеризацией выполнялась двусторонняя тубовариэктомия либо применялись агонисты рилизинг-гормонов. Больным в постменопаузе на основании иммуногистохимических данных назначена соответствующая консервативная гормонотерапия.
В контрольной группе больных при гистологическом исследовании операционного материала чаще всего опухоли были представлены следующими морфологическими вариантами:
— инфильтрирующая карцинома 3-й ст. злокачественности — 10 (27,03 ± 3,80 %);
— инфильтрирующая карцинома 2-й ст. злокачественности — 15 (40,54 ± 4,50 %);
— потоковый инвазивный рак — 5 (13,51 ± 2,40 %) наблюдений.
Статистически значимых отличий по частоте встречаемости различных морфологических вариантов между больными контрольной и исследуемой групп не выявлено (p = 0,87).
Также не отмечено статистически значимого различия распределения больных контрольной и исследуемой групп по категории N (p = 0,06).
Анализ возрастного состава, распространенности опухолевого процесса, наличия сопутствующей патологии больных показал, что состав обеих групп был однородным.
Все пациентки были детально ознакомлены с задачами исследования, программой лечебно-диагностических мероприятий и дали свое письменное добровольное информированное согласие на данный вид лечения.
В соответствии с протоколом настоящего исследования, в схемы комплексного лечения всех пациенток была включена лучевая терапия, которую проводили в отделениях радиологического отдела Донецкого областного противоопухолевого центра. Облучение первичного очага и регионарных областей осуществляли на гамма-терапевтических установках «Рокус» и «Агат» в режимах классического фракционирования дозы.
Гормональное лечение проводили в соответствии с современными взглядами и подходами к этой проблеме. Хирургическую или медикаментозную абляцию выполняли пациенткам с сохраненной менструальной функцией и наличием в опухоли рецепторов стероидных гормонов, после чего назначали антиэстрогенные препараты в течение 2–3 лет, с последующим приемом ингибиторов ароматазы или продолжением антиэстрогенов до 5 лет. Антиэстрогены или ингибиторы ароматазы назначали всем пациенткам в постменопаузе, у которых не был изучен гормональный статус опухоли, либо гормональный статус опухоли был положительным. В случаях отсутствия в опухоли рецепторов стероидных гормонов гормональная терапия не проводилась.
Результаты и их обсуждение
Непосредственные результаты комплексного лечения больных
Оценка эффекта проведенного лечения проводилась каждые 6 месяцев после окончания неоадъювантной полихимиотерапии.
Традиционно для оценки объективного эффекта химиотерапии использовались общеизвестные критерии комитета экспертов Всемирной организации здравоохранения. При этом применялась оценка размеров опухоли и метастазов как производное двух наибольших перпендикулярных размеров. Следует отметить, что инструментальные исследования производились в одном лечебном учреждении (ДОПЦ) с соблюдением принципов преемственности (одной аппаратурой и одними и теми же специалистами). Для измерения линейных размеров опухолей молочной железы использовался медицинский штангенциркуль фирмы McGhan с ценой деления 0,1 мм.
В ходе работы использована методика оценки эффективности терапии солидных опухолей по шкале RECIST (Response Evaluation Criteria in Solid Tumors). Во всех наблюдениях опухоли оценены как измеряемые. Определяли наибольший размер всех очагов поражения, сумму размеров до лечения рассматривали как базовый размер и сравнивали с таковой после лечения.
Критерии эффективности по шкале RECIST:
— полный ответ — исчезновение всех очагов поражения на срок не менее 4 недель;
— частичный эффект — уменьшение очагов на 30 % и более;
— прогрессирование — увеличение на 20 % наименьшей суммы очагов поражения, зарегистрированное за время наблюдения, или появление новых очагов;
— стабилизация — нет уменьшения, достаточного для оценки как частичный эффект, или увеличения, которое можно оценить как прогрессирование.
При оценке лечебного эффекта учитывали динамику объективного состояния пациенток и результаты клинико-лабораторных обследований, выполняли динамическую трепан-биопсию (оценка патоморфоза опухоли после проведения ПХТ).
Оценка отдаленных результатов проводимого лечения
Клиническое течение заболевания и отдаленные результаты лечения оценивали по следующим параметрам:
— продолжительность жизни без рецидивов и новых метастазов;
— частота лимфогенного и гематогенного метастазирования;
— скорректированная пятилетняя выживаемость.
Перечисленные показатели рассчитывали в целом по всему изученному контингенту больных и отдельно по контрольной и исследуемой группам, в зависимости от проведенного варианта паллиативного лечения.
Оценку отдаленных результатов производили с момента начала лечения.
В исследуемой группе из 136 прооперированных больных у 4 (5,88 ± 1,50 %) выявлен патоморфоз 1-й ст., у 9 (13,24 ± 2,90 %) — 2-й ст., у 24 (35,22 ± 4,90 %) — 3-й ст. и у 28 (41,18 ± 35,00 %) — патоморфоз 4-й ст.
В контрольной группе прооперировано 37 больных. Патоморфоз 1-й ст. диагностирован у 1 (16,67 ± 2,90 %) пациентки, 2-й ст. — у 1 (16,67 ± 2,90 %), 3-й ст. — у 3 (50,00 ± 5,50 %), патоморфоз 4-й ст. отмечен у 1 (16,67 ± 2,90 %) чел. (рис. 1).
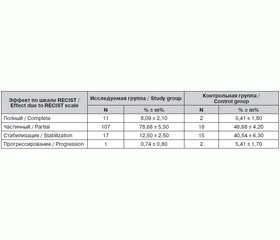
Различия оценки эффективности лечения контрольной и исследуемой групп по шкале RECIST (табл. 1) являются статистически значимыми (p = 0,02).
Эффективность проведенного лечения оценивалась маммографически при изучении двух размеров первичной опухоли в прямой и боковой проекциях.
Отдаленные результаты паллиативного лечения больных
В ходе наблюдения у больных исследуемой группы выявлены следующие варианты продолжения болезни после проведенного лечения: прогрессирование заболевания — у 35 (15,84 ± 3,10 %) чел., из них у 10 (4,52 ± 1,80 %) — метастатические поражения костей. Метастазы в легкие обнаружены у 7 (3,17 ± 1,10 %) больных через 14,21 месяца. Метастатическое поражение печени диагностировано при контрольном осмотре у 4 (1,81 ± 0,50 %) больных спустя 13,41 месяца, метастатический плеврит — у 4 (1,81 ± 0,40 %) через 12,64 месяца, поражение головного мозга — у 2 (0,90 ± 1,20 %) больных в среднем через 7,82 месяца. Внутрикожные метастазы выявлены у 2 больных, средний временной интервал составил 7,27 месяца. Продолженный рост опухоли обнаружен у 1 (0,45 ± 1,40 %) больного, при этом среднее значение временного интервала составило 19,5 месяца. Метастатическое поражение надключичных лимфоузлов выявлено в 1 (0,9 ± 0,2 %) случае через 3,22 месяца. Метастазы в подмышечную область отмечены у 3 (1,36 ± 1,10 %) пациенток через 14,96 месяца с момента завершения лечения. Метастазы в большую грудную мышцу — в 1 (0,9 ± 0,2 %) наблюдении спустя 11,74 месяца после окончания химиолучевого и хирургического лечения.
У больных контрольной группы в процессе динамического наблюдения получены следующие результаты: у 13 (22,41 ± 3,50 %) пациентов выявлено продолжение болезни. У 2 (3,45 ± 1,50 %) чел. отмечен метастатический плеврит, при этом средний временной интервал составил 14,93 месяца. Метастазы в кости — у 4 (6,9 ± 2,3 %) больных через 20,07 месяца, метастазы в печень — у 1 (1,72 ± 1,30 %) пациентки в среднем через 2 года, внутрикожные метастазы — у 3 (5,17 ± 1,20 %) больных при значении среднего временного интервала 13,7 месяца. Продолженный рост опухоли обнаружен у 2 (3,45 ± 1,30 %) чел. в среднем спустя 11,87 месяца, метастазы в головной мозг — у 1 (1,72 ± 1,72 %) пациентки через 16,34 месяца с момента завершения лечения.
Все пациентки с диагностированным продолжением болезни получили паллиативное симптоматическое лечение.
При рассмотрении случаев продолжения заболевания в зоне послеоперационного рубца выявлены следующие результаты: в контрольной группе средний срок метастазирования составил 11,87 месяца, в то время как в исследуемой — 19,5 месяца.
Медианное значение выживаемости больных исследуемой группы составило 14,7 месяца, контрольной группы — 9,6 месяца.
Обсуждение полученных результатов
При сравнении кривых выживаемости в обеих группах пациенток выявлено статистически значимое различие (p < 0,001 при использовании лог-рангового критерия с поправкой Йейтса). Установлено, что больные, у которых достигнут полный или частичный эффект лечения по шкале RECIST, проживают дольше после проведения селективной внутриартериальной полихимиотерапии. Полный или частичный эффект по шкале RECIST чаще регистрировали у больных исследуемой группы, что позволило достичь у них лучших показателей выживаемости.
Все пациентки с выявленным продолжением болезни получали паллиативное химиолучевое и гормональное лечение.
Средняя продолжительность жизни больных исследуемой группы составила 3,43 ± 0,18 года, в то время как в контрольной — 1,8 ± 0,4, что значительно превосходит статистические данные отечественных и зарубежных авторов. Показатели общей 3-летней выживаемости больных исследуемой группы составили 59,9 ± 4,5 %, а 5-летней — 43,1 ± 5,5 %.
В контрольной группе показатели общей 3- и 5-летней выживаемости были достоверно ниже — 58,0 ± 6,3 % и 17,9 ± 8,4 % соответственно (рис. 2).
Выводы
1. Результаты комплексного лечения местнораспространенного рака молочной железы у пациенток с неблагоприятными факторами прогноза опухолевого роста по разработанной методике с применением комбинации введения селективной внутриартериальной и внутривенной полихимиотерапии в бассейне внутренней грудной артерии в сочетании с лучевой и гормональной терапией превосходят результаты стандартных программ лечения больных местнораспространенными формами рака молочной железы с выполнением мастэктомии, проведением системной химиотерапии.
2. Разработанная авторами методика может быть рекомендована к широкому применению у данной категории больных.
Methods to Optimize the Treatment of Patients with the Locally-Advanced Breast Cancer
Introduction
The development of new methods to treat patients with breast cancer (BC) causes to no doubts at anyone at present moment. The statistical data testify to steady growth of BC sickness rate during recent 20 years without tendency to stabilization [1, 2]. Thus this pathology takes the first place among female population. The sickness rates (69.8 cases per 100,000 female populations in 2011) and morbidity rates (32.0 %) in Ukraine approach to the level of countries in European Union.
The methodology on intra-arterial introduction of chemotherapeutic agents, developed at Donetsk Regional Antitumoral Center (DRAC), showed its undisputable contribution into development of modern oncology through decrease of primary tumoral locus, transition from inoperable state into the state, at which it was and it is possible to perform the radical volume of surgical interference to patients [4, 8].
The special attention is paid to development of new methods to treat BC patients (regional forms of disease) with unfavorable factors for forecast of tumor growth [2, 7].
Purpose of work. Improving the direct and remote results of treatment of patients with regional forms of BC through optimization methods of introducing the chemotherapeutic agents and improving the quality of patients’ life.
Materials and Methods
The basis for this research was the data about 279 patients with regional forms of BC and unfavorable predictive factors with stages T4N0-2M0, who were treated at Donetsk Regional Antitumoral Center in 2000–2013.
Two groups of patients were formed during research for adequate analysis of results from treatment according to considered methodologies. The first (study) group included 221 patients, among which 168 patients with HER/2-neu positive subtype and 53 patients with basal like biological subtypes were diagnosed at immunocytochemical conclusion. The program for complex treatment of patients in this group included the catheterization of internal mammary artery through upper epigastric artery (patent of Ukraine № 29318, dd. 01.07.2000; patent of Russian Federation No 2169014, dd. 20.06.2001), performance of two-three cycles for selective intra-arterial and intravenous polychemotherapy (PCT) with the interval of 21 days, evaluation of effect, X-ray therapy (XRT) to mammary gland and zones of regional lymphatic outflow in static mode with single boost dose (SBD) 2–2.5 Gy, total boost dose (TBD) — 40 Gy, interval, evaluation of effect. The mammectomy for patients in study group was made only if the complete or partial response from tumor is received (136 operation within radical volume). The courses of intra-arterial PCT were held in the mode of continuous long infusion (4–6 hours) according to CMF, CAF or CAMF scheme. Taking into consideration the probability for development of local complications at the background of introduction of some chemotherapeutic agents (mostly often — doxorubicin), a half dose of medicine was introduced systematically.
The infusion of chemotherapeutic agents in the mode of selective intra-arterial introduction according to CMF scheme was made by the following way:
— сyclophosphan: first day — 200 mg/h, fourth, seventh day — per 150 mg/h;
— мethotrexate: second, fifth day — intra-arterial introduction per 10 mg/h, eighth day — intravenously 40 mg;
— fluorouracil: third day — 250 mg/h, sixth, ninth day — 180 mg/h.
The protocol; for application of CAF scheme in mode of selective intra-arterial polychemotherapy:
— cyclophosphan: first day — 200 mg/h, fourth, seventh day — per 150 mg/h;
— doxorubicin: second, fifth day — intra-arterial introduction per 5 mg/h, eighth day — intravenously 40 mg;
— fluorouracil: third day — 250 mg/h, sixth, ninth day — 180 mg/h.
The protocol; for application of CAMF scheme in mode of selective intra-arterial polychemotherapy:
— cyclophosphan: first day — 200 mg/h, fourth, seventh day — per 150 mg/h intra-arterial introduction;
— vethotrexate: second, fifth, eighth day — intra-arterial introduction per 10 mg/h;
— doxorubicin: ninth day intravenously — 80 mg;
— fluorouracil: third day — 250 mg/h, sixth, ninth day — intra-arterial introduction 180 mg/h.
The total course doses of chemotherapeutic agents corresponded to design ones according to BSA criteria.
The number of PCT cycles was defined, based on evaluation for efficiency of treatment, performance status of patients, availability and manifestation rate of local and systemic complications. In average the patients received 2–3 cycles to reach the effect in neoadjuvant mode. Anthracyclines (1–2 cycles) were included into PCT scheme at absence of effect [3–5].
The second (control) group included 58 patients, among which HER/2-neu positive subtype was found in 45 persons and basal like subtype — in 13 persons. At the first stage of treatment the patients in this group underwent to 4–6 cycles of systemic PCT due to CMF, CAF or CAMF schemes (the medicines were introduced according to known schemes, systematically), preoperative course of gamma teletherapy by small fractions on mammary gland and zones of regional lymphatic outflow in static mode with SBD — 2–2.5 Gy, TBD — 40 Gy, then mammectomy. Later the council of physicians examined the patients in order to solve the question about further special treatment.
No metastases were found during pre-examination at primary visit of patients in study and control groups.
The tumors of the following morphological structure prevailed at histological examination of operating materials in study group of patients:
— infiltrative carcinoma of the 3rd tumor grade — 32 (23.53 ± 2.80 %);
— infiltrative carcinoma of the 2nd tumor grade — 23 (16.91 ± 3.50 %);
— flow invasive cancer — 18 (13.24 ± 2.30 %) of observations.
The bilateral tubovariectomy was made at patients in pre-menopause with hormone-dependant tumors per saltum with catheterization or agonists of releasing-hormones were applied. The corresponding conservative, hormonal therapy was prescribed to patients in post-menopause according to immunohistochemical data.
The tumors in control group of patients at histological examination of operating material were mostly often presented by the following morphological variants:
— infiltrative carcinoma of the 3rd tumor grade — 10 (27.03 ± 3.80 %);
— infiltrative carcinoma of the 2nd tumor grade — 15 (40.54 ± 4.50 %);
— flow invasive cancer — 5 (13.51 ± 2.40 %) of observations.
No statistically significant differences in frequency of occurrence of different morphological variants between patients in control and study group were found (p = 0.87).
As well, no statistically significant differences in distribution of patients in control and study group due to category N (p = 0.06) were found.
The analysis of age composition, prevalence rate of neoplastic process, availability of co-morbidity at patients showed that the composition of both groups was homogenous.
All patients studied the research tasks, program for diagnostic and treatment measures in details and gave their written voluntary informed consent for this kind of treatment.
According to protocol of this research, the schemes for complex treatment of all patients included X-ray therapy, which was held at units of radiological division in Donetsk Regional Antitumoral Center. The ray treatment of primary site and regional areas was made on gamma-beam teletherapy units Rokus and Agat in modes of classical dose franctionation.
The hormonal treatment was held according to modern views and approaches to this problem. The surgical or medicamental ablation was made to patients with preserved menstrual function and available receptors of steroid hormones in tumor, after that the antiestrogenic agents were prescribed during 2–3 years with further intake of aromatase inhibitors during up to 5 years. Antiestrogens or aromatase inhibitors were prescribed to all patients in post-menopause, at whom the hormonal status of tumor has not been studied, or the hormonal status of tumor was positive. The hormonal therapy was hot held if the receptors of steroid hormones were absent in tumor.
Results and Their Discussion
Short-Term results from Complex Treatment of Patients
The evaluation for effect from performed treatment was carried out during each 6 months after the completion of neoadjuvant polychemotherapy.
Well-known criteria by World Health Organization Committee of Experts were traditionally used to assess the objective effect from chemotherapy. Hereby, we used the evaluation for sizes of tumor and metastases as a derivative from two largest perpendicular sizes. It should be mentioned that the instrumental examinations were held in one medical establishment (DRAC), following to succession principles (using the same equipment and involving the same specialists). Medical trammel with scale interval of 0.1 mm by McGhan Company was used to measure the linear sizes of mammary tumors.
The methodology for evaluation of efficiency in therapy of solid tumors due to RECIST scale (Response Evaluation Criteria in Solid Tumors) was applied during the work. The tumors in all observations were evaluated as measurable ones. The largest size for all damage centers was defined, the sum of sizes before treatment was considered as a basic size and compared with such one after treatment.
Efficiency criteria due to RECIST scale:
— complete response — disappearance of all damage centers for the period of not less than 4 weeks;
— partial effect — decrease of damage centers by 30 % and more;
— progression — increase in the least sum of damage centers by 20 %, registered during observation, or appearance of new damage centers;
— stabilization — no decrease, sufficient to evaluate the partial effect, or increase, which can be evaluated as progression.
The dynamics in objective status of patients and the results from clinical laboratorial examinations were taken into consideration while evaluating the curative effect, the dynamic needle core biopsy (evaluation of tumor pathomorphism after performance of PCT) was made.
Evaluation of Remote Results of Performed Treatment
The clinical progression of the disease and remote results from treatment were evaluated due to the following parameters:
— life duration without recurrences and new metastases;
— frequency of lymphogenic and hematogenic metastasing;
— corrected five-year survival rate.
The abovementioned indices were cumulatively calculated within all studied contingent of patients and individually in control and study group, depending on performed variant of palliative treatment.
The estimation of remote results was made since start of treatment.
4 patients (5.88 ± 1.50 %) in study group of 136 persons, who underwent to operations, had the pathomorphism of the 1st degree, 9 patients (13.24 ± 2.90 %) had the pathomorphism of the 2nd degree. 24 patients (35.22 ± 4.90 %) — pathomorphism of the 3rd degree and 28 patients (41.18 ± 35.00 %) — pathomorphism of the 4th degree.
37 patients were operated in control group. 1 patient (16.67 ± 2.90 %) had the pathomorphism of the 1st degree and 1 patient (16.67 ± 2.90 %) — pathomorphism of the 2nd degree. 3 patients (50.00 ± 5.50 %) had the pathomorphism of the 3rd degree and 1 patient (16.67 ± 2.90 %) — pathomorphism of the 4th degree (Fig. 1).
The difference in distribution of evaluations for efficiency in treatment of patients in control and study group due to RECIST scale (Table 1) is statistically significant (p = 0.02).
The efficiency in performed treatment was evaluated by mammography while studying two sizes of primary tumor in frontal and lateral views.
Remote Results of Palliative Treatment of Patients
The following variants for continuation of the diseases after performed treatment were found during observation in patients from study group: progressive disease — in 35 (15.84 ± 3.10 %) observations, among them metastatic lesions of bones in 10 (4.52 ± 1.80 %) patients. The metastases in the lungs were found in 7 patients (3.17 ± 1.10 %) in 14.21 months. The metastatic lesions of the liver were diagnosed at control examination in 4 patients (1.81 ± 0.50 %) after 13.41 months. The metastatic pleuritis — in 4 patients (1.81 ± 0.40 %) after 12.64 months, lesion of the brain — in 2 patients (0.90 ± 1.20 %) in average after 7.82 months. The intradermal metastases were found in 2 patients, the average time interval was 7.27 months. The continued tumor growth was found in 1 patient (0.45 ± 1.40 %), hereby the average value of time interval was 19.5 months. The metastatic lesion of supraclavicular lymph nodes was found in 1 patient (0.9 ± 0.2 %) after 3.22 months. The metastases to underarms area were found in 3 patients (1.36 ± 1.10 %) after 14.96 months since completion of treatment. The metastasis to the greater pectoral muscle — in 1 patient (0.9 ± 0.2 %) in 11.74 months after completion of chemoradiation and surgical treatment.
The following results were received at patients in control group during dynamic observation: 13 patients (22.41 ± 3.50 %) had the progressive diseases. 2 patients (3.45 ± 1.50 %) had the metastatic pleuritis, hereby the average time interval was 14.93 months. The metastases to the bones were found in 4 patients (6.9 ± 2.3 %) after 20.07 months, the metastases to the liver — in 1 patient (1.72 ± 1.30 %) in average after 2 years, the intradermal metastases — in 3 patients (5.17 ± 1.20 %) with average time interval of 13.7 months. The continued tumor growth was found in 2 patients (3.45 ± 1.30 %) in average after 11.87 months, the metastases to the brain — in 1 patient (1.72 ± 1.72 %) after 16.34 months since completion of treatment.
All patients, diagnosed with progressive disease, received the palliative symptomatic treatment.
The consideration of cases for progressive disease in the zone of postoperative sword-cut found out the following results: the average metastasing period in control group — 11.87 months; while the average period in study group is 19.5 months.
The median survival rate for patients in study group was 14.7 months and for patients in control group — 9.6 months.
Discussion of Received Results
The statistically significant difference (p < 0.001 using log-rank test with Yates’ correction) was found in comparison of survival curves for both groups of patients. It was determined that the patients, who have the complete or partial effect of treatment due to RECIST scale, live longer after performance of selective intra-arterial polychemotherapy. The complete or partial effect due to RECIST scale was more often observed at patients in study group that allowed achieving better survival rates in them.
All patients with detected progressive disease received the palliative chemoradiation and hormonal treatment.
The average life duration of patients in study group was 3.43 ± 0.18 years, while in control group — 1.8 ± 0.4 years that significantly exceeds the statistical data by national and foreign authors. The indices for total 3 years survival rate of patients in study group were 59.9 ± 4.5 % and 5 years survival rate — 43.1 ± 5.5 %.
The indices for total 3 years and 5 years survival rate of patients in control group were significantly lower — 58.0 ± ± 6.3 % and 17.9 ± 8.4 % months, accordingly (Fig. 2).
Conclusions
1. The results from complex treatment of regional breast cancer with unfavorable factors for prognosis of tumor growth due to developed methodology using the combination of introduction of selective intra-arterial and intravenous polychemotherapy in the basin of internal mammary artery in conjunction with radiological and hormonal therapy exceed the results from standard programs for treatment of patients with regional forms of breast cancer with performance of mammectomy and systemic chemotherapy.
2. The methodology, developed by authors, was recommended for wide application in such category of patients.
1. Аксель Е.М. Злокачественные новообразования молочной железы: состояние онкологической помощи, заболеваемость и смертность // Маммология. — 2006. — № 1. — С. 9-13.
2. Рак в Україні, 2010–2011. Захворюваність, смертність, показники діяльності онкологічної служби / Під ред. С.О. Шалімова // Бюлетень національного канцер-реєстру України. — К., 2012. — № 13. — 51 с.
3. Сєдаков І.Є. Морфологічні критерії діагностики, оцінка ефективності і прогноз при комбінованому лікуванні місцево-поширеного первинно-неоперабельного раку молочної залози // Укр. мед. альманах. — 2004. — Т. 7, № 3. — С. 133-137.
4. Сєдаков І.Є. Селективна внутрішньоартеріальна поліхіміотерапія в комплексному лікуванні первинно-неоперабельного раку молочної залози: Автореф. дис.. д-ра мед. наук: 14.01.07. — Донецьк, 2004. — 42 с.
5. Бондар Г.В. Первинно-неоперабельний рак молочної залози / Г.В. Бондар, І.Є. Сєдаков, В.Г. Шлопов. — Донецьк: Каштан, 2005. — 348 с.
6. Гарин А.М. Принципы и возможности современной эндокринотерапии опухолей / Л.П. Гарин. — М., 2000. — 207 с.
7. Семикоз Н.Г., Седаков И.Е., Трухин Д.В., Александров А.И., Болобан Г.В., Хлопушин Е.Ю. Тактика лечения больных с местнораспространенным раком молочной железы // Запорожский медицинский журнал. — 2004. — № 3. — С. 115-117.
8. Седаков І.Е. Місцево-поширений, первинно-неоперабельний рак молочної залози: патоморфологічна оцінка ефективності комбінованого лікування // Медико-соціальні проблеми сім’ї. — 2003. — Т. 8, № 4. — С. 55-61.
9. Miller W. Endocrine therapy in breast cancer / W. Miller, J. Ingle. — New York, 2002. — 378 p.
10. Merrick H.W. 3rd, Hager E., Dobelbower R.R. Jr. Intraopertive radiation therapy for breast cancer // Surg. Oncol. Clin. N. Am. — 2003 Oct. — 12(4). — 1065-78.
11. Meric-Bernstam F. Breast conservation in breast cancer: surgical and adjuvant considerations // Curr. Opin. Obstet. Gynecol. — 2004 Feb. — 16(1). — 31-6.

/10/10.jpg)
/10/10_2.jpg)
/12/12.jpg)