Журнал «Здоровье ребенка» 2 (53) 2014
Вернуться к номеру
Клинический случай редкой наследственной патологии — синдром Клиппеля — Треноне — Вебера — Рубашова в практике врача-педиатра
Авторы: Конюшевская А.А., Ярошенко С.Я. - Донецкий национальный медицинский университет им. М. Горького; Детская городская клиническая больница № 5, г. Донецк
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
Статья посвящена изучению клинических и морфологических особенностей синдрома Клиппеля — Треноне — Вебера — Рубашова (кожные ангиомы, расширение поверхностных вен, гипертрофия пораженной конечности, наличие артериовенозных анастомозов). Представлены данные о сущности, патогенетических механизмах, распространенности синдрома, рассмотрен типичный клинический случай.
Стаття присвячена вивченню клінічних і морфологічних особливостей синдрому Кліппеля — Треноне — Вебера — Рубашова (шкірні ангіоми, розширення поверхневих вен, гіпертрофія ураженої кінцівки, наявність артеріовенозних анастомозів). Наведено дані про патогенетичні механізми, поширеність синдрому, розглянуто типовий клінічний випадок.
The article deals with the study of clinical and morphological features of Klippel-Trenaunay-Weber-Rubashov syndrome (cutaneous angiomas, superficial veins dilatation, hypertrophy of affected extremity, arteriovenous anastomoses). The data about the nature, pathogenetic mechanisms, the prevalence of the syndrome are given, a typical clinical case is considered.
синдром Клиппеля — Треноне — Вебера — Рубашова, дети.
синдром Кліппеля — Треноне — Вебера — Рубашова, діти.
Klippel — Trenaunay — Weber — Rubashov syndrome, children.
Статья опубликована на с. 117-122
Синдром Клиппеля — Треноне — Вебера — Рубашова благодаря многообразию клинических проявлений интересует специалистов разных профилей — хирургов, педиатров, дерматологов, рентгенологов. Полисимптомность заболевания обусловливает множество различных названий, отражающих его те или иные клинические проявления и этиопатогенетические свойства. Синонимы заболевания — остеогипертрофический варикозный невус, ангиоостеогипертрофия, гипертрофическая гемангиэктазия, сосудисто-костная дизэмбриопатия, шестой факоматоз, частичный гигантизм сосудистой системы.
Клиппель и Треноне в 1900 г., Паркс Вебер в 1907 г. описали синдром, характеризующийся односторонним врожденным пороком развития артерио-венозной системы, лимфатических сосудов и вторичными остеогипертрофическими изменениями в одной, реже — в двух конечностях. Вебер в 1918 г. обратил внимание на существование при данном синдроме артериовенозных фистул. Большой вклад в изучение данного синдрома внес также С.М. Рубашов, который уточнил патогенез и клинику этого заболевания.
Сущность синдрома заключается в нарушении кровотока по магистральным венам пораженной конечности. Затруднение оттока крови по глубоким венам может быть вызвано аплазией или гипоплазией вены, сдавливанием вен эмбриональными тяжами, артериальными сосудами, врожденным недоразвитием клапанного аппарата глубоких вен и расширением их просвета. В патогенезе синдрома предполагается роль нарушения эмбриогенеза с дисплазией глубокой венозной системы. Нельзя исключить и вероятность механических повреждений в эмбриональном периоде. Между тем заболевание иногда встречается у родственников, среди которых преобладают женщины. Не всегда передается доминантным путем, окончательных данных о типе наследования синдрома не получено. Болезнь наблюдается спорадически, редко — с полным набором симптомов. Риск наследственной передачи, по мнению многих исследователей, ничтожен. Классическая триада симптомов — кожные ангиомы, расширение поверхностных вен, гипертрофия пораженной конечности — обозначается как синдром Клиппеля — Треноне, а наличие еще и артериовенозных анастомозов типично для синдрома Паркса Вебера.
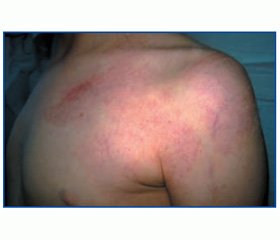
Клинические симптомы отмечаются при рождении. Родители обращают внимание на сосудистые пятна на коже конечности ребенка после рождения. Гемангиомы бывают единичные или множественные; капиллярные, кавернозные, кистозные; различающиеся по размерам и локализации (на любой части тела, но чаще всего на голенях, ягодицах, животе, нижней части туловища). Преобладает одностороннее поражение. Описана гиперпигментация кожи, могут наблюдаться аномалии пигментации в виде пигментных и ахромичных невусов, телеангиэктазии, мраморная кожа. Ангиома обычно видна уже при рождении ребенка (в единичных случаях проявляется в раннем детском возрасте) в виде обширного пятнистого телеангиэктатического сосудистого невуса (пламенеющий, или «винный», невус), в 50 % случаев — кавернозного, расположенного по всей длине одной из нижних конечностей. Немногочисленные рассеянные участки поражения могут быть на коже туловища, значительно реже гемангиома локализуется на верхней конечности. Цвет ангиомы может варьировать от бледно-красного до интенсивно-пурпурного. Ткани пораженной конечности (как мягкие, так и костные) гипертрофируются за счет интенсивной васкуляризации. Пораженная конечность или ее часть удлинена и обычно быстрее растет за счет костной гипертрофии в длину, а также утолщена за счет гипертрофии мягких тканей в условиях повышенного кровоснабжения. Возможны также деформация суставов, утолщение или дистрофия мышцы. В некоторых случаях наступает не гипертрофия, а атрофия костей и мягких тканей конечности. Глубокая венозная сеть может быть плохо развитой или отсутствовать. Нередки трофические язвы, отек подкожной клетчатки. Варикозное расширение вен пораженной конечности становится выраженным в юношеском возрасте и может сопровождаться тромбофлебитом поверхностных вен, возможны кровотечения, развитие гангрены. Нижние конечности поражаются в 2 раза чаще, чем верхние, причем поражаются преимущественно дистальные части конечностей.
В типичных случаях на одной из нижних конечностей, реже — на верхней, виден телеангиэктатический невус различной величины в сочетании с варикозным расширением вен и артериовенозными анастомозами на пораженной стороне, что в большинстве случаев приводит к парциальному гигантизму больной конечности. Тяжесть течения заболевания зависит от распространенности кожных и сосудистых поражений, а также от степени гипертрофии конечности. Удлинение конечности вызывает ее искривление. Возможны другие аномалии развития: полидактилия, синдактилия, макродактилия, диспропорциональная длина пальцев, олигодактилия. У ряда больных могут наблюдаться сколиоз, вывих тазобедренного сустава и такие диспластические симптомы, как врожденная косолапость, деформации коленных суставов, spina bifida.
Патологические врожденные артериовенозные фистулы-шунты неизменно приводят к появлению варикозных вен и отражаются на состоянии гемодинамики. Артериовенозные соустья усиливают венозный отток и тем самым увеличивают минутный объем сердца, вызывают его перегрузку и в зависимости от локализации шунта, длительности его существования и величины артерии иногда приводят к гипертрофии сердца и выраженной сердечной недостаточности. Они ведут к снижению артериального и повышению венозного давления, уменьшению общего периферического сопротивления и укорочению времени кровообращения. За счет артериовенозного сброса происходит повышение содержания кислорода в венозной крови, что является одним из наиболее выраженных и постоянных симптомов артериовенозных фистул. Течение заболевания неуклонно прогрессирующее.
Различают также абортивные варианты синдрома: без сосудистых невусов, без гипертрофии костей или без варикозно расширенных сосудов. Возможны также «перекрещенные» формы, при которых ангиомы кожи выражены на одной конечности, а варикозное расширение — на другой.
Черепно-лицевые аномалии включают асимметричную гипертрофию лица, микро- и макроцефалию, интракраниальные кальцификаты, гипертрофию тканей орбиты. Наблюдаются глаукома, катаракта, колобома и гетерохромия радужки, ангиоматоз глазного дна. Встречаются висцеромегалия, гемангиомы желудочно–кишечного тракта, мочевой системы, добавочные крупные сосуды, аневризмы почечных артерий, гемангиомы почек, таза, матки, ангиоматоз висцеральных органов, варикозные расширения вен легкого, пороки развития висцеральных вен, которые могут быть причиной кровотечений.
Диагноз ставят на основании клинической картины, данных ультразвукового дуплексного сканирования и флебоангиографического исследования. Ультразвуковое, артерио- и флеболимфографическое исследования позволяют дифференцировать эти пороки развития. Функциональная флебоманометрия при синдроме Клиппеля — Треноне регистрирует высокое венозное давление, не изменяющееся как в горизонтальном, так и в вертикальном положении больного. Артериальное давление в большинстве случаев отчетливо понижено. Рентгенологически выявляют утолщение кортикального слоя костей пораженной конечности и остеопороз, что приводит к деформации конечности, образование в костях округлых полостей, расширение гаверсовых каналов, образование узур в компактном костном веществе. Изменения на рентгенограммах костей пораженной конечности обусловлены давлением расширенных сосудов.
/119/119.jpg)
Дифференциальную диагностику проводят с болезнью Штурге — Вебера, Гиппеля — Линдау, Клиппеля — Фейля, Пари — Ромберга, Мильроя, лимфедемой; синдромом Протея; Маффуччи, Бина, нейрофиброматозом I типа и другими пороками развития сосудистой системы.
Лечение синдрома Клиппеля — Треноне — Вебера — Рубашова малоперспективно, и только при агенезии небольших сегментов магистральных вен возможны пластические восстановительные операции. Хирургическое лечение заключается в пересечении и перевязке артериовенозных соустьев между крупными артериями и венами, а при наличии множественных артериоловенулярных фистул — в перевязке приводящего артериального сосуда после тщательного флебографического исследования. Однако перевязка магистральных артерий может сопровождаться некрозом дистальных отделов конечности. Некоторые авторы предлагают проведение люмбальной симпатэктомии, удаление варикозно расширенных вен, лучевую терапию кавернозных гемангиом. Хирургическое вмешательство на костной системе — укорачивающая остеотомия или фиксация костного трансплантата в метафизе для предотвращения дальнейшего роста костей — осуществляется после предварительного устранения тяжелых нарушений со стороны сосудов и мягких тканей. Прогноз неблагоприятный вследствие нарастающей сердечно-сосудистой недостаточности и лимфостаза.
В связи с редкостью данной патологии приводим собственное клиническое наблюдение. Ребенок С., 23.03.2006 года рождения, поступил 08.11.2013 г. в инфекционное отделение городской детской клинической больницы (ГДКБ) № 5 г. Донецка с жалобами на повышение температуры тела до 39 °C, вялость, кашель, насморк. Болеет 3-и сутки, участковым врачом направлен в стационар в связи с подозрением на пневмонию.
При поступлении в отделение 08.11.13 г. состояние ребенка расценено как состояние средней тяжести, температура тела на момент поступления 37,2 °С; ЧСС — 106 в мин., ЧД — 28 в мин. Правильного телосложения, достаточного питания. Кожные покровы бледные, на коже левой верхней конечности, слева в верхних отделах груди и спины — обширная гемангиома. Левая верхняя конечность значительно теплее на ощупь, не разгибается в полном объеме в локтевом суставе (до угла 120°), длиннее правой на 4 см, толще на 3,5 см, левая кисть значительно увеличена в размере. Носовое дыхание затруднено. Слизистая небных дужек гиперемирована. Определяется укорочение перкуторного звука в нижних отделах грудной клетки справа. Аускультативно дыхание жесткое, справа в нижних отделах — ослабленное, сухие свистящие хрипы и крупнопузырчатые влажные хрипы единичные с обеих сторон, справа в нижних отделах выслушиваются влажные мелкопузырчатые хрипы. Отмечается умеренно выраженный сердечный горб. Смещение левой границы относительной сердечной тупости на 2 см кнаружи от левой среднеключичной линии. Тоны сердца приглушены, ритмичные, ЧСС — 100 в минуту, систолический шум в I и V точках. Живот мягкий, доступен глубокой пальпации, печень на 1 см ниже реберного края, умеренно положительны пузырные знаки, селезенка в подреберье.
Обследован: 1. Анализ крови общий от 09.11.13 г.: эритроциты — 4,56 • 1012/л, гемоглобин — 126 г/л, гематокрит — 37 %, лейкоциты — 10 • 109/л, палочкоядерные — 30 %, сегментоядерные — 60 %, лимфоциты — 8 %, моноциты — 2 %, тромбоциты — 227 • 109/л, СОЭ — 28 мм/ч. Анализ крови общий от 16.11.13 г.: эритроциты — 4,52 • 1012/л, гемоглобин — 126 г/л, гематокрит — 37 %, лейкоциты — 5,7 • 109/л, эозинофилы — 3 %, палочкоядерные — 8 %, сегментоядерные — 40 %, лимфоциты — 44 %, моноциты — 5 %, тромбоциты — 277 • 109/л, СОЭ — 14 мм/ч. 2. Фибриноген — 2,25 г/л; свертываемость по Сухареву — 3–4 минуты. 3. Биохимическое исследование крови: мочевина — 6,9 ммоль/л, креатинин — 0,058 мкмоль/л, билирубин общий — 14 мкмоль/л, непрямой — 11 мкмоль/л, прямой — 3 мкмоль/л, АСТ — 58,6 Ед/л (при норме < 36,0), АЛТ — 35,1 Ед/л (при норме < 29,0), К+ — 4,4 ммоль/л, Nа+ — 130,6 ммоль/л, Са — 2,65 ммоль/л. 4. Анализ мочи — норма. 5. УЗИ печени, селезенки, почек — в пределах нормы, УЗИ желчного пузыря — эхо–признаки наличия деформации желчного пузыря. 6. Рентгенография органов грудной клетки от 08.11.13 г. — правосторонняя пневмония.
/120/120.jpg)
В отделении пролечен по поводу внебольничной правосторонней пневмонии, ДН 1, ДЖВП, сопутствующий диагноз — синдром Клиппеля — Треноне — Вебера — Рубашова. ВПС, состояние после эндоваскулярного закрытия ОАП. Проведенная терапия — цефтриаксон, сумамед, виферон, инспирон, аскарил, линекс, лактомун, лазорин, тантум верде, холосас, нурофен.
Особый интерес представляет анамнез жизни ребенка, диагностика синдрома Клиппеля — Треноне — Вебера — Рубашова.
Анамнез жизни: ребенок от 1-й беременности (37–38 недель). Во время беременности мать перенесла ОРВИ в 16 недель, преэклампсию средней степени, угрозу прерывания беременности в 28 недель. Воздействия вредных факторов окружающей среды во время беременности не отмечено. Обследование на ТОRСН-инфекции — отрицательно. Роды I, срочные, нормальные. Состояние при рождении удовлетворительное. Оценка по шкале Апгар 8–9 баллов, масса тела при рождении 3650 г, длина 53 см. В родильном доме выслушивался интенсивный систолический шум на верхушке сердца, распространяющийся на всю предсердную область. Заподозрен врожденный порок сердца (ВПС): открытый артериальный проток (ОАП), открытое овальное окно (ООО). На спине слева, плече, левой руке выявлена обширная капиллярная, частично кавернозная гемангиома с явлениями лимфостаза. В 2 месяца (25.05.06) осмотрен детским хирургом ГДКБ № 5: выявлена обширная гемангиома по типу «винного» пятна грудной стенки слева, спины и левого плеча, с явлениями лимфостаза в верхней конечности. В 6 месяцев (22.09.06) осмотрен детским хирургом: у ребенка парциальный гигантизм левой верхней конечности на почве порока развития сосудов — лимфогемангиоматоз с явлениями ангиоматозного невуса. 22.09.06 г. проведена рентгенография костей предплечья: определяется утолщение и деформация левой лучевой кости в средней и дистальной трети с очагами склероза и остеопороза. Локтевая кость утолщена в дистальном эпифизе и средней трети, очаги разрежения костной структуры без периостальных реакций.
Ребенок осмотрен детским ортопедом областной травматологической больницы. На рентгенограммах костей левого и правого предплечий: кости левого предплечья увеличены в размере, деформированы, особенно дистальный отдел лучевой кости, выраженный мягкотканный компонент, по-видимому, болезнь Олье.
Часто болел ОРВИ. Грудное вскармливание до 1 года 2 месяцев. Профилактические прививки по календарю. Наблюдался по месту жительства в поликлинике ГДКБ № 5.
ЭхоКГ 07.05.08 г. (2 года): ВПС, ОАП (d = 0,25 см), умеренная дилатация левых камер сердца, давление в легочной артерии (ЛА) 22,8 мм рт.ст., фракция выброса (ФВ) 67 %. ЭхоКГ 04.10.10 г. (4,5 года): ВПС, ОАП (d = 0,42 см), дилатация левых камер сердца, давление в ЛА 38 мм рт.ст., ФВ 68 %. Осмотрен детским кардиохирургом Института неотложной и восстановительной хирургии (ИНВХ) 04.10.10 г. (4,5 года): у ребенка ВПС, ОАП, НК 1. Рекомендовано оперативное лечение в плановом порядке с учетом сопутствующей патологии, предпочтительно эндоваскулярным способом. Из семейного анамнеза следует отметить, что у матери и бабушки по линии матери ВПС, ООО. С 25 по 28 октября 2010 г. находился в отделении детской кардиохирургии ИНВХ, где было проведено эндоваскулярное закрытие открытого артериального протока спиралью Flipper, результат операции признан удовлетворительным. Осмотрен 18.07.11 г. в ИНВХ в отделении неотложной и восстановительной хирургии сосудов: синдром Клиппеля — Треноне — Вебера — Рубашова левой руки, ХВН 2-й степени, рекомендовано эластическое бинтование руки, консультация в г. Киеве. Обследован в г. Киеве, Академии медицинских наук Украины, Государственном институте хирургии и трансплантологии им. академика А.А. Шалимова. Ультразвуковая допплероскопия: левая верхняя конечность — определяется ускорение кровотока по пальцевым, ладонным артериям, артериям предплечья, плеча, подмышечной артерии. Подключичные артерии: диаметр d — 0,38 см, s — 1,1 см, пиковая систолическая скорость кровотока ПСС: d — 0,88 м/с, s — 1,3 м/с, слева определяется снижение индекса резистентности сосудов R до 0,83. Подключичные вены: d — 0,52 см, s — неравномерно расширена, d макс. — 1,1 см. Мелкие артериовенозные (АV) соустья на левой верхней конечности, крупных АV–соустьев не выявлено. Реография верхних конечностей: Наблюдается резкое повышение пульсового кровенаполнения левой верхней конечности с асимметрией D < S в 2,7 раза, на уровне предплечья D < S в 2,6 раза, на уровне кисти D < S в 2,8 раза на фоне артериальной гиперемии и сниженного венозного оттока. Периферическое сопротивление сосудов верхних конечностей умеренно повышено.
Электромиография (ЭМГ): снижение биоэлектрической активности мышц левой верхней конечности с асимметрией по передней и средней порциям дельтовидной мышцы плеча D > S на 75 %, по двуглавой мышце плеча — D > S на 75 %, по трехглавой — D > S на 50 %, по сгибателям и разгибателям — D > S на 75 %, по тенору и гипотенору — D > S на 100 %. Хронаксиметрия: снижение нервно–мышечной возбудимости по левому лучевому нерву в 1,3 раза, реакция при раздражении типичная.
Ребенок нуждается в дальнейшем оперативном лечении.
Выводы
Синдром Клиппеля — Треноне — Вебера — Рубашова представляет значительные трудности не только для диагностики, но и для лечения, является разновидностью системных дисплазий и заслуживает внимания как одно из многочисленных наследственных заболеваний, поражающих различные ткани организма. Синдром Клиппеля — Треноне — Вебера — Рубашова — редко встречающаяся наследственная патология, которая является достаточно тяжелой в отношении качества жизни ребенка. Поэтому знание клинических проявлений, дифференциальная диагностика и выбор тактики ведения данного тяжелого контингента больных приобретают особое значение для врачей всех уровней оказания медицинской помощи.
1. Козлова С.И., Демикова Н.С. Наследственные синдромы и медико-генетическое консультирование. — М., 2007.
2. Колесникова О.И., Семенов И.В., Миллер В.Э., Такташов Р.Э. Случай синдрома Клиппеля — Треноне — Вебера — Рубашова в сочетании с тромбоцитопатией // Педиатрия. — 1993. — № 1. — С. 91–92.
3. Samuel M., Spitz L. Klippel-Trenaunay syndrome: clinical features, complications and management in children // Brit. J. Surg. — 1995. — 82. — 757–761.
4. Weibel L.Vascular anomalies in children // Vasa. — 2011. — 40(6). — 439–47.
5. Alomari A.I. Klippel — Trenaunay syndrome: the quest for the proper diagnosis // Ann. Vasc. Surg. — 2012. — 26(3). — 443–444.
6. Okutan O., Yildirim T., Isik S., Gokce B., Saygili B., Konakli E.B. Thoracic vertebral hemangioma causing paraplegia in Klippel — Trenaunay — Weber syndrome: case report // Turk. Neurosurg. — 2013. — 23(4). — 518–520.

/119/119_2.jpg)
/121/121.jpg)