Журнал «Здоровье ребенка» 2 (53) 2014
Вернуться к номеру
Спадковий ангіоневротичний набряк
Авторы: Волоха А.П. - Національна медична академія післядипломної освіти імені П.Л. Шупика, м. Київ
Рубрики: Аллергология , Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
Спадковий ангіоневротичний набряк — рідкісне захворювання, викликане вродженим дефіцитом С1-інгібітора. Клінічні прояви захворювання — рецидивні епізоди ангіоневротичного набряку, які маніфестують у дитячому або підлітковому віці, найчастіше локалізуються підшкірно (кінцівки, обличчя, тулуб, статеві органи) або в слизових оболонках (кишечник, гортань). Набряки гортані є потенційно загрозливими для життя пацієнтів. Рання діагностика дозволяє вчасно проводити адекватну терапію і профілактику епізодів ангіоневротичного набряку. У статті наведений випадок спадкового ангіоневротичного набряку з маніфестацією в ранньому дитячому віці. Описаний випадок демонструє складнощі діагностики і лікування спадкового ангіоневротичного набряку.
Наследственный ангионевротический отек — редкое заболевание, обусловленное врожденным дефицитом С1-ингибитора. Клинические проявления заболевания — рецидивирующие эпизоды ангионевротического отека, которые манифестируют в детском или подростковом возрасте, чаще всего локализуются в подкожной клетчатке (конечности, лицо, туловище, половые органы) или в подслизистом слое (кишечник, гортань). Отеки гортани являются потенциально опасными для жизни пациента. Ранняя диагностика позволяет проводить своевременную адекватную терапию и профилактику ангионевротического отека. В статье приведен случай наследственного ангионевротического отека с манифестацией в раннем детском возрасте. Описанный случай демонстрирует сложности диагностики и лечения наследственного ангионевротического отека.
Hereditary angioedema — a rare disease caused by a congenital deficiency of C1-inhibitor. Clinical manifestations of the disease — recurrent episodes of angioedema, which manifest in childhood or adolescence, more often localized in the subcutaneous tissue (limbs, face, trunk, genitals) or submucosa (intestine, larynx). Swellings of the larynx are potentially harmful to the patient’s life. Early detection enables to carry out timely appropriate treatment and prevention of angioedema. The paper presents a case of hereditary angioedema with manifestation in early childhood. The case study demonstrates the complexity of diagnosis and treatment of hereditary angioedema.
спадковий ангіоневротичний набряк, С1-інгібітор, діти.
наследственный ангионевротический отек, С1-ингибитор, дети.
hereditary angioedema, C1-inhibitor, children.
Статья опубликована на с. 85-90
Спадковий ангіоневротичний набряк (САН) — захворювання, що характеризується рецидивними епізодами ангіоневротичного набряку без кропив’янки або свербежу, які найчастіше виникають у шкірі і підшкірній клітковині або слизових оболонках верхніх дихальних шляхів та шлунково-кишкового тракту [1, 2, 11]. Хоча набряк самостійно ліквідується, при локалізації в ділянці гортані він може викликати смертельну задуху. До появи ефективної терапії рівень смертності становив близько 30 % унаслідок асфіксії від набряку гортані [3].
Поширеність САН становить від 1 : 10 000 до 1 : 50 000 населення, частота не залежить від статі. Спадковий ангіоневротичний набряк розвивається в пацієнтів із вродженою недостатністю синтезу нормально функціонуючого С1-інгібітора. У пацієнтів із САН виникають напади ангіоневротичного набряку внаслідок надлишкової продукції брадикініну — потужного судинорозширювального медіатора. Під час епізодів ангіоневротичного набряку в пацієнтів із САН плазмові рівні брадикініну в 7 разів вищі, ніж зазвичай [3]. Гістамін та інші медіатори тучних клітин не беруть безпосередньої участі в розвитку набряку, що пояснює відсутність реакції на антигістамінні препарати й відрізняє цю форму ангіоневротичного набряку від набряку Квінке алергічної природи, пов’язаного з кропив’янкою.
С1-інгібітор є ключовим регулятором системи комплементу, системи коагуляції крові та калікреїн-кінінової системи [1, 2]. За відсутності С1-інгібітора активація С1-естерази призводить до безконтрольної активації класичного шляху з надмірним розщепленням С4 і С2 компонентів комплементу і утворенням вазоактивного пептиду С2b внаслідок розщеплення С2. Ефект впливу вазоактивного пептиду на посткапілярні венули проявляється розвитком обмеженого набряку. У період гострої атаки ангіоневротичного набряку відбувається розщеплення кініногенів, субстратів калікреїну, зростає концентрація брадикініну (рис. 1).
Відомі 2 типи САН, які є результатом дефіциту (І тип) або функціонального дефекту (ІІ тип) С1-інгібітора. Виділяють також ІІІ тип САН, що характеризується нормальним рівнем C1-інгібітора й має назву спадкового ангіоневротичного набряку з нормальною кількістю С1-інгібітора [5]. Частина пацієнтів із САН ІІІ типу мають мутації в гені фактора XII, в інших не виявлено жодного генетичного або біохімічного дефекту. Набута форма дефіциту С1-інгібітора виникає в літніх пацієнтів без сімейної історії ангіоневротичного набряку й пов’язана в більшості випадків з продукцією автоантитіл до С1–інгібітора.
Тип I САН визначається у 85 % пацієнтів і характеризується суттєвим зниженням концентрації С1-інгібітора в межах 5–30 % від нормальної. При обстеженні визначається зниження кількості й функціональної активності С1-інгібітора. Тип ІІ САН — результат продукції функціонально неактивного протеїну, що наявний у нормальній або підвищеній кількості.
Обидві форми САН успадковуються за автосомно-домінантним типом. Ген С1-інгібітора локалізується в хромосомі 11, різні мутації зумовлюють розвиток різних варіантів САН.
Клініка. Вік початку нападів САН варіабельний. Атаки можуть розпочинатися в перші роки життя, але їх тяжкість посилюється в пубертатний період та в дорослому віці. Близько 40 % пацієнтів мають перші випадки набряку у віці до 5 років, у 75 % захворювання маніфестує до 15 років життя. У більшості випадків діагноз САН установлюють на другій-третій декаді життя [3].
Набряк у пацієнтів із дефіцитом С1-інгібітора може розвиватися в будь-якій частині тіла. Характерна локалізація набряку в трьох анатомічних ділянках: 1) шкіра та підшкірна клітковина; 2) шлунково-кишковий тракт; 3) верхні дихальні шляхи (гортань, ротоглотка).
Напад набряку часто виникає в одному місці, однак можливе поєднання набряку в декількох локусах: набряк шкіри може поширитись на гортань. Напади набряку самообмежувані, тривалістю 2–4 дні, ступінь тяжкості варіює від легких набряків шкіри до загрозливих для життя набряків гортані. Близько 50 % пацієнтів відзначають всі три варіанти локалізації набряку протягом життя. Частота атак варіює від щотижневої до одного або двох епізодів на рік. Без лікування пацієнт із частими нападами може пропустити до 100–150 робочих днів на рік. Тяжкість захворювання відрізняється серед членів сім’ї, незважаючи на однакову мутацію. Тяжкість захворювання може змінюватись у пацієнта з часом [3, 6, 11].
Продромальні симптоми включають втому, нудоту або інші шлунково-кишкові симптоми, міалгії та грипоподібні симптоми [2, 14, 15]. У деяких хворих розвиваються зміни шкіри за типом кільцеподібної еритеми. Ці зміни можуть бути помилково прийняті за кропив’янку, але більше нагадують еrithema marginatum. Зміни шкіри були відзначені у 26 % пацієнтів в одному із спостережень [19]. Продромальні симптоми зазвичай виникають протягом 24 годин до атаки ангіоневротичного набряку.
Шкірні атаки набряку — найчастіші прояви САН, загалом безпечні. Набряк шкіри був наявний у 97 % епізодів у ретроспективному спостереженні 221 пацієнта із САН [3]. Найчастіше страждають кінцівки, обличчя і статеві органи, хоча будь-яка ділянка шкіри може бути залучена. Набряк шкіри або слизових оболонок при САН щільний, без свербежу. Гіперемії, підвищення місцевої температури не спостерігають. Шкірні атаки часто супроводжуються болем. Епізод зазвичай починається у шкірі зі своєрідного поколювання або відчуття переповнення і подразнення, а потім у найближчі 2–3 години розвивається набряк. Ангіоневротичний набряк зростає впродовж перших 24 годин, потім поступово спадає протягом 48 до 72 годин [3, 18]. Набряк може тривати до 5 днів у деяких пацієнтів. Атаки можуть бути довшими, якщо набряк поширюється з одного місця на інше. Набряк на тулубі може бути різного розміру — від незначного (3–4 см у діаметрі) до зливного, що займає груди, спину, сідниці, промежину [2]. Набряк ураженої частини прогресує швидко, без кропив’янки, свербежу, зміни кольору шкіри, інколи навіть без больових відчуттів.
Набряки гортані можуть бути ізольованими або в поєднанні з набряком губ, язика і м’якого піднебіння [6]. Набряк гортані зустрічається приблизно в половини всіх пацієнтів із дефіцитом С1-інгібітора й може бути фатальним. В одному з ретроспективних досліджень на атаки гортані припадало менше 1 % від усіх епізодів ангіоневротичного набряку [19]. Видалення зуба та оперативні втручання щелепно-лицьової ділянки — загальні тригери набряку гортані. Він зазвичай розвивається поступово, протягом кількох годин, у середньому — 3–4 години. Поява перших насторожуючих ознак атаки набряку гортані або набряку шкіри обличчя та шиї, який може поширитись на гортань, вимагає негайного початку адекватного лікування з метою запобігання розвитку набряку, загрозливого для життя пацієнта.
У дослідженні 70 смертельних атак набряку гортані було виділено розвиток симптомів у 3 стадії: предиспное, задишки і втрати свідомості. Стадія предиспное тривала від 20 хвилин до 11 годин. У переважної більшості пацієнтів (63/70) за життя діагноз САН не було встановлено. Середній вік смерті від асфіксії в пацієнтів із невстановленим діагнозом був 40,6 року [2].
Шлунково-кишкові атаки маніфестують у вигляді різного ступеня кишкової кольки з нудотою, блюванням і/або діареєю [2, 11, 19]. Ці симптоми є результатом набряку стінки кишки. Шлунково-кишкові атаки відзначали більшість пацієнтів із САН, вони були основними проявами захворювання у чверті пацієнтів [6, 16]. Описані кілька сімей, у яких набряк кишечника був єдиним проявом САН.
Набряк кишкової стінки завжди супроводжується інтенсивним спастичним болем у животі. Набряки шкіри при цьому можуть бути відсутніми. Пацієнти нерідко потрапляють на операційний стіл або до психіатрів до встановлення справжнього діагнозу. Атака триває 2–3 дні, і потім поступово набряк спадає.
Найчастішим провокуючим фактором є механічна травма, рідше ангіоневротичний набряк може розвиватися після фізичного перевантаження, менструації, емоційного стресу. Тригерами набряку є також стоматологічні процедури, пірсинг. Набряк статевих органів у пацієнтів із САН інколи виникає після статевого акту, верхової їзди, катання на велосипеді. Окрім фізичних тригерів, набряк можуть викликати медикаменти: естрогени, тамоксифен, інгібітори ангіотензин-конвертази. Набутий дефіцит С1-інгібітора може розвиватися в асоціації з В-клітинними пухлинами або за наявності антитіл до С1-інгібітора.
Діагностика. Діагноз спадкового ангіоневротичного набряку І і ІІ типу ґрунтується на клінічних даних та результатах дослідження показників комплементу [3]. Дані сімейного анамнезу є важливими для діагностики захворювання, однак їх відсутність не виключає діагнозу. Показаннями для скринінгу на дефіцит С1-інгібітора є такі клінічні стани, як рецидивний набряк без кропив’янки, нез’ясовані самообмежувані напади кишкової кольки і болю в животі, наявність ангіоневротичного набряку в сімейному анамнезі, нез’ясований набряк гортані (навіть один епізод), низький рівень С4 компонента комплементу.
Скринінгове обстеження при підозрі на САН включає визначення рівня С4, концентрації С1-інгібітора та функціональної активності С1-інгібітора (табл. 1).
Визначення показників системи комплементу не інформативне на тлі проведення лікування САН. Обстеження пацієнта проводять не раніше ніж через 1 тиждень після введення концентрату С1-інгібітора або плазми і через 3 тижні після закінчення лікування андрогенами. Для встановлення діагнозу обстеження системи комплементу проводять не менше ніж 2 рази з інтервалом більше ніж 1 місяць.
Якщо в пацієнта знижені С4, концентрація білка С1-інгібітора і активність С1-інгібітора, це характерно для САН І типу або набутого дефіциту С1-інгібітора. САН І типу більш вірогідний в осіб віком менше ніж 40 років, із характерним сімейним анамнезом. Рівень білка С1-інгібітора у пацієнтів із САН І типу менше ніж 30 % від нормального рівня.
Зниження С4 при нормальній кількості С1-інгібітора і низькій його функціональної активності характерне для САН ІІ типу.
За наявності характерної клінічної картини і нормальних показників С4, концентрації та активності С1-інгібітора слід підозрювати спадковий ангіоневротичний набряк із нормальним рівнем С1-інгібітора [4].
Диференціальна діагностика спадкового ангіоневротичного набряку включає алергічні та анафілактичні реакції, медикаментозно–індукований ангіоневротичний набряк, алергічний контактний дерматит, набряки при автоімунних захворюваннях, набряки при патології щитоподібної залози [15].
Лікування і профілактика ангіоневротичного набряку. Тактика ведення пацієнтів із САН включає заходи з профілактики нападів (довготривала і термінова профілактика) та лікування гострих атак ангіоневротичного набряку.
Основною метою ведення хворих із дефіцитом С1-інгібітора є запобігання розвитку нападів ангіоневротичного набряку. Первинна профілактика нападів набряку передбачає уникнення дії всіх можливих тригерів: фізичних травм, стресів, оперативних втручань, контакту з інфекційними хворими.
Термінова профілактика призначається перед проведенням стоматологічних, хірургічних та інших медичних втручань, що можуть спровокувати розвиток атаки ангіоневротичного набряку. Препаратами вибору для термінової профілактики нападів САН є андрогени (даназол) та концентрат С1-інгібітора [4, 9, 18]. Жоден препарат не може повністю запобігти розвитку набряку, тому в разі виникнення нападу негайно розпочинають лікування. Перевага надається концентрату С1-інгібітора, що вводять із профілактичною метою за 1 годину до процедури (необхідні 2 запасні дози препарату). За відсутності концентрату С1-інгібітора рекомендують премедикацію андрогенами: даназол у дозі від 2,5 до 10 мг/кг на день (максимальна доза 600 мг/добу) впродовж 5 днів до та після процедури. У разі невідкладної ситуації і неможливості проведення премедикації андрогенами можливе введення кріоконсервованої плазми [5].
Довготривалу профілактику ангіоневротичного набряку рекомендують за відсутності ефективних препаратів лікування нападів набряку (концентрат С1-інгібітора, інгібітор рецепторів брадикініну), у пацієнтів із частими атаками набряку (не менше 1 разу на місяць), із повторними атаками набряку гортані [8, 9].
З метою довготривалої профілактики пацієнтам призначають атенуйований андроген даназол. Лікування розпочинають із найнижчої ефективної підтримувальної дози, що дає змогу контролювати появу нападів набряку, 2,5–5 мг/кг на добу (початкова доза — 50 мг) до досягнення ремісії, а потім переходять до вживання препарату через один або два дні. За необхідності добову дозу даназолу можна збільшити до 200 мг. Однак у частини хворих розвивається резистентність до даназолу в разі тривалого його застосування. Препарат протипоказаний у період вагітності. Антифібринолітичні препарати (е-амінокапронова та транексамова кислота) можна рекомендувати для термінової профілактики набряку, зокрема при оперативних втручаннях, стоматологічних маніпуляціях. Антифібринолітичні препарати пригнічують конверсію плазміногену в плазмін, менш ефективні в лікуванні гострих атак ангіоневротичного набряку, ніж андрогени [18]. Транексамову кислоту призначають у дозі 20–40 мг/кг на добу у 2–3 приймання протягом 5 днів до та 2 днів після хірургічного втручання.
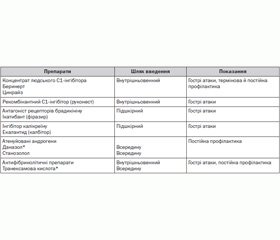
Останніми роками в багатьох країнах для замісної терапії гострих атак ангіоневротичного набряку, а також із метою профілактики при хірургічних втручаннях і стоматологічних маніпуляціях з успіхом застосовують концентрат С1-інгібітора (беринерт) або рекомбінантний С1-інгібітор (руконест) (табл. 2).
Препарати запобігають розвитку набряків та усувають їх прояви в пацієнтів із спадковим ангіоневротичним набряком [6, 9, 10, 14]. Концентрат С1-інгібітора призначають у дозі 10–20 МО/кг (зазвичай 500 МО). Останніми роками в дорослих пацієнтів із метою лікування атак ангіоневротичного набряку застосовують інгібітор рецепторів брадикініну — ікатибант (фіразир) у дозі 30 мг підшкірно (за необхідності вводять до 3 доз препарату) [8, 9, 11]. Однак препарати С1-інгібітора та антагоніст рецепторів брадикініну в Україні на сьогодні не зареєстровані. За відсутності препаратів С1-інгібітора та антагоністів рецепторів брадикініну для невідкладної терапії тяжких нападів набряку з локалізацією в ділянці голови та шиї, набряку гортані вводять адреналіну гідрохлорид 0,1% у дозі 0,3–0,5 мл підшкірно, показане внутрішньовенне введення антифібринолітичних препаратів [1]. Із метою терапії гострих нападів набряку можливе переливання кріоконсервованої плазми (10 мл/кг), однак цей метод інколи супроводжується погіршенням стану пацієнта внаслідок збільшення як рівня С1-інгібітора, так і кількості його субстрату, а також високим ризиком передачі вірусних інфекцій (гепатити, ВІЛ). З метою лікування легких або середньотяжких атак набряку призначають атенуйовані андрогени (даназол 10 мг/кг) або транексамову кислоту всередину протягом 48 годин [13].
Клінічний випадок спадкового ангіоневротичного набряку
Хлопчик, 16 років, скаржиться на часте набрякання рук — до 3 епізодів на місяць, переважно після незначної травми чи фізичного перевантаження (займається баскетболом). Набряк кистей рук утримується протягом 2–4 днів, минає спонтанно. З анамнезу: у віці 2 років з’явився рецидивний набряк стоп. Надалі спостерігалися численні повторні епізоди набряку обличчя, кінцівок, статевих органів після незначних травм, спортивних занять. Набряк не супроводжувався висипкою, свербежем, підвищенням температури тіла. Кілька разів на рік хлопчика госпіталізували з приводу абдомінального болю, нерідко з блюванням і діареєю. Тривалість абдомінальних атак — 2–4 дні. За останній рік відмічено два епізоди набряку гортані після емоційного стресу, з приводу чого пацієнт отримував лікування у відділенні інтенсивної терапії. Позитивний ефект у лікуванні пацієнта дало внутрішньовенне введення е-амінокапронової кислоти.
У сімейному анамнезі — випадки рецидивних набряків у матері та її рідної сестри. Набряки шкіри в родичів характеризувалися меншою частотою та інтенсивністю.
Підозра на спадковий ангіоневротичний набряк виникла після першого епізоду набряку гортані. Дані дослідження рівня компонентів комплементу: зниження рівня С4, нормальний рівень С1-інгібітора та зниження його функціональної активності більше ніж на 50 %; рівень C4 — 2,1 мг/дл (10,0–40,0 мг/дл), рівень С1-інгібітора — 21,7 мг/дл (23,0–41,0 мг/дл), активність С1-інгібітора — 24 мг/дл (42,0–56,0 мг/дл). У пацієнта виявлено високий рівень С1-естерази: 192 Од (70–130 Од), що свідчить про надмірну активацію класичного шляху комплементу на тлі недостатньої функції С1-інгібітора. Рівень С3 — у межах норми, 116,7 мг/дл (90,0–180,0 мг/дл).
На підставі клінічних даних і результатів лабораторного дослідження в пацієнта встановлено діагноз спадкового ангіоневротичного набряку ІІ типу. З метою профілактики епізодів набряку рекомендовано постійне приймання даназолу в дозі 200 мг один раз на добу. З метою екстреної профілактики під час хірургічних втручань і стоматологічних маніпуляцій призначено антифібринолітичні препарати (е-амінокапронову або транексамову кислоту) і даназол у найвищій дозі 600 мг на добу за 3–5 днів до операції. Можливість проведення лікування і профілактики гострих атак набряку гортані в пацієнта за допомогою препарату з найбільшою ефективністю — концентрату С1-інгібітора в Україні на сьогодні відсутня.
1. Дитяча імунологія: підручник / Л.І. Чернишова, А.П. Волоха, Л.В. Костюченко та ін.; за ред. проф. Л.І. Чернишової, А.П. Волохи. — К.: Медицина, 2013. — 720 с.
2. Забродська Л.В. Спадковий ангіоневротичний набряк: клініко-діагностичні критерії // Клиническая иммунология, аллергология, инфектология. — 2009. — № 10.
3. Atkinson J.P., Cicardi M. Hereditary angioedema: Pathogenesis and diagnosis, 2013. www.uptodate.com
4. Atkinson J.P., Cicardi M. Hereditary angioedema: Prevention of attacks, 2013. www.uptodate.com
5. Bork K. Diagnosis and treatment of hereditary angioedema with normal C1 inhibitor // Allergy, Asthma and Clinical Immunology. — 2010. — 6. — 15.
6. Bork K., Barnstedt S.-E. Treatment of 193 episodes of laryngeal edema with C1–inhibitor concentrate in patients with hereditary angioedema // Arch. Intern. Med. — 2001. — 161. — 714–718.
7. Bork K., Meng G., Staubach P., Hardt J. Hereditary angioedema: new findings concerning symptoms, affected organs, and course // The American Journal of Medicine. — 2006. — 119(3). — 267–274.
8. Bowen T. Hereditary angioedema: beyond international consensus — circa December 2010 — the Canadian Society of Allergy and Clinical Immunology Dr. David McCourtie Lecture // Allergyasthma. Clin. Immunol. — 2011. — 7. — 1.
9. Bowen T., Cicardi M., Farkas H. et al. International consensus algorithm for the diagnosis, therapy and management of hereditary angioedema // Allergy, Asthma and Clinical Immunology. — 2010. — 6. — 24.
10. Craig T., Pürsün E.A., Bork K. et al. WAO Guideline for the management of hereditary angioedema // WAO Journal. — 2012. — 5. — 182–199.
11. Ebo D.G., Verweij M.M., De Knop K.J. et al. Hereditary angioedema in childhood: an approach to management // Paediatr. Drugs. — 2010 Aug. — 1, 12(4). — 257–68.
12. Farcas H. Pediatric hereditary angioedema due to C1–inhibitor deficiency // Allergy, Asthma and Clinical Immunology. — 2010. — 6. — 18. http://www.aacijournal.com/content/6/1/24
13. Farkas H., Varga L., Széplaki G. et al. Management of hereditary angioedema in pediatric patients // Pediatrics. — 2007. — 120. — e713–e722.
14. Farkas H., Jakab L., Temesszentandra G. et al. Hereditary angioedema: A decade of human C1-inhibitor concentrate therapy // J. Allergy Clin. Immunol. — 2007. — 120(4). — 941–947.
15. Grigoriadou S., Longhurst H.J. Clinical Immunology Review Series: An approach to the patient with angioedema // Clinical and Experimental Immunology. — 2009. — 155. — 367–377.
16. Morgan B.P. Hereditary Angioedema — Therapies Old and New // N. Engl. J. Med. — 2010. — 363, 6. — 581–583.
17. Zuraw B.L. Hereditary angioedema // N. Engl. J. Med. — 2008. — 359. — 1027–1036.
18. Wahn V., Aberer W., Eberl W. et al. Hereditary angioedema (HAE) in children and adolescents — a consensus on therapeutic strategies // Eur. J. Pediatr. — 2012. — 171. — 1339–1348.
19. Zingale L.C., Beltrami L., Zanichelli A. et al. Angioedema without urticaria: a large clinical survey // CMAJ. — 2006. — 175(9). — P. 1065–1070.

/86/86.jpg)
/87/87.jpg)
/88/88.jpg)