Журнал «Здоровье ребенка» 2 (53) 2014
Вернуться к номеру
Клініко-анамнестичні особливості та оцінка контролю бронхіальної астми фізичного напруження в школярів із поліморфізмом генів біотрансформації ксенобіотиків
Авторы: Григола О.Г., Колоскова О.К. - Буковинський державний медичний університет МОЗ України, м. Чернівці
Рубрики: Аллергология , Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
Проведене комплексне клініко-спірографічне обстеження школярів, які хворіють на бронхіальну астму фізичного напруження, залежно від наявності чи відсутності поліморфізму генів ферментів глютатіон-S-трансферази — GSTT1M1. Показано, що астма перебігає тяжче у хворих із делеціями вказаних генів, частіше мають місце алергічні реакції, проте дезобструктивний ефект під час нападів досягається швидше. Самооцінка контролю захворювання за різними шкалами показала дещо суперечливі результати, проте об’єктивізація за допомогою спірографічного обстеження дозволила встановити ризик досягнення контрольованого перебігу хвороби в дітей із генотипом GSTT1+M1+ (співвідношення шансів — 3,33, відносний ризик — 1,8, абсолютний ризик — 29 %).
Проведено комплексное клинико-спирографическое обследование школьников, которые болеют бронхиальной астмой физического напряжения, в зависимости от наличия либо отсутствия полиморфизма генов ферментов глутатион-S-трансферазы — GSTT1M1. Показано, что астма протекает тяжелее у больных с делециями указанных генов, чаще имеют место аллергические реакции, однако дезобструктивный эффект во время приступов достигается быстрее. Самооценка контроля над заболеванием по различным шкалам показала противоречивые результаты, однако объективизация с помощью спирографического обследования позволила установить риск достижения контролированного течения заболевания у детей с генотипом GSTT1+M1+ (отношение шансов — 3,33, относительный риск — 1,8, абсолютный риск — 29 %).
Complex clinical and spirographic investigation of schoolchildren suffering from exercise-induced bronchial asthma was carried out depending on the presence or the absence of genes polymorphism of the enzymes of glutation-S-transferase — GSTT1M1. The study showed that the course of the disease was more severe in the patients with the deletions of the named genes, the reactions of hypersensitivity were more often, but the desobstructive effect during the attack was reached quicker. The self-assessment of the control of the disease by different scales showed the controversial results, but the objectification by the spirographic investigation allowed to define the risk of achieving the controlled course of the disease in children with genotype GSTT1+M1+ (odds ratio — 3.33, relative risk — 1.8, absolute risk — 29 %).
діти, бронхіальна астма фізичного напруження, контрольованість захворювання.
дети, бронхиальная астма физического напряжения, контроль заболевания.
children, exercise-induced bronchial asthma, control of the disease.
Статья опубликована на с. 14-18
Вступ
Бронхіальна астма (БА) — поширене хронічне запальне захворювання дихальних шляхів, що спостерігається в дитячій популяції в межах від 3,4 до 37,6 % [1, 9, 14], що вимагає прямих та непрямих витрат, які в розвинутих країнах сягають мільярдів доларів [7]. На тлі успадкованої схильності дане захворювання проявляє себе повторними нападами оборотної бронхіальної обструкції при контакті з певними подразниками (тригерами) [8], серед яких чільне місце посідає фізичне навантаження [15].
Бронхіальна астма фізичного напруження (БАФН), або астма, напади якої провокуються фізичним навантаженням, розглядається як неоднорідна група з різними патогенетичними варіантами захворювання [11, 13]. Якщо звичайна бронхоспастична реакція у хворого з порушенням бронхіальної прохідності виникає під час фізичного навантаження, то для хворих на бронхіальну астму фізичного напруження характерне її виникнення після завершення навантаження або упродовж найближчих 10–15 хвилин після нього. У зв’язку з цим повсякчас необґрунтовано такий тригер БА, як фізичне навантаження, лікарі та/або батьки вилучають із повсякденного життя хворих, що погіршує перебіг захворювання, призводить до детренованості, гіподинамії та насамкінець погіршення показників якості життя через кардинальну зміну його стилю. Разом із тим відомо, що більшість хворих на БАФН можуть повною мірою виконувати фізичні вправи за умови попереднього використання засобів, що попереджують розвиток бронхоспазму.
Згідно з сучасними поглядами, внесок генетичної компоненти у розвиток і перебіг бронхіальної астми сягає 40–60 % від усіх чинників ризику, а гени, що пов’язані з даним захворюванням (гени-кандидати), установили у більшості хромосом [10]. Останніми роками прицільну увагу дослідників привертає поліморфізм генів, що кодують ферменти детоксикації в організмі, впливаючи на функціональну здатність останніх. Зокрема, гени глутатіон-S-трансферази (GST), що кодують ферменти, згруповані в альфа-, мю-, пі- і тета-класи (GSTA, GSTM, GSTP та GSTT), впливають на окислювальний стрес у легенях і, таким чином, на формування бронхіальної астми [5, 16].
Проте особливості бронхіальної астми фізичного напруження, зокрема в частині контролю над захворюванням, за умови наявності поліморфізму генів глутатіон-S-трансферази (GSTM1 та GSTT1) вивчені недостатньо.
Мета роботи: для покращання ефективності лікування бронхіальної астми фізичного напруження в дітей вивчити клінічно-анамнестичні особливості та оцінити контроль над захворюванням за наявності поліморфізму генів GSTM1 та GSTT1.
Матеріал і методи
З дотриманням принципів біоетики проведене комплексне клініко-параклінічне обстеження 51 дитини з ознаками фенотипу бронхіальної астми фізичного напруження, яких госпіталізували до пульмо-алергологічного відділення Обласної дитячої клінічної лікарні м. Чернівців. Частка хлопчиків серед обстежених становила 68,3 %, дівчаток — 31,7 %. У міських поселеннях жили 46,7 % дітей, а решта (53,3 %) були жителями сільської місцевості. Легкий персистуючий перебіг БАФН відмічено у 7,5 % хворих, середньотяжкий — у 45,8 % і тяжкий — у 46,7 % обстежених пацієнтів. Атопічна форма астми спостерігалася з частотою 50,8 % випадків, а змішана — у 49,2% спостережень. Більше половини хворих страждали від астми пізнього початку (53,3 % випадків), у віці від 3 до 6 років захворювання дебютувало у 18,3 % хворих, а в ранньому віці — у 28,3 % дітей. До стаціонару діти надходили переважно у зв’язку із загостренням БАФН (73,3 % хворих) і тільки чверть пацієнтів (26,7 %) — планово.
З використанням мультиплексної полімеразної ланцюгової реакції (ПЛР) в обстежених хворих визначали поліморфізм промоторної ділянки генів GSTT1 та GSTM1. Як позитивний контроль успішності ПЛР використовували ампліфікацію фрагментів гена BRCA1. Аналіз результатів ПЛР проводили методом електрофорезу у 2% агарозному гелі за Маніатіс та співавт. (1984). Гомозиготні форми із делецією обох копій генів GSTT1 та GSTM1 (T1del, M1del) ідентифікували за відсутністю відповідного фрагмента на електрофореграмі. Натомість наявність даних фрагментів на електрофореграмах свідчила про гомо- або гетерозиготність за нормальною копією гена, генотип позначали як T1+ та M1+.
Залежно від наявності чи відсутності поліморфізму вивчених генів ферментів глутатіон-S-трансферази сформовано дві групи порівняння. До складу І групи (основна) увійшли 19 дітей, середній вік яких становив 11,80 ± 0,65 року, які страждали від БАФН, і в них не відмічено делецій у досліджуваних генах, отже, їх генотип позначався як GSTT1+M1+. Хлопчиків у даній групі було 57,9 %, дівчаток — 42,1 %, у містах проживало 57,9 % хворих, а решта 42,1 % — у районах області. Для планового обстеження в цій групі надійшли в стаціонар 31,6 % хворих, а для купірування нападу БАФН — 68,4 % дітей. Змішаний характер астма мала у 47,4 %, атопічний — у 52,6 % дітей.
У групу порівняння (ІІ) увійшли 32 дитини, які хворі на БАФН, середній вік становив 10,6 ± 0,5 року (P > 0,05), а генотип вирізнявся наявністю делецій хоча б в одній копії досліджуваних генів. Варіанти даного поліморфізму позначалися так: GSTT1delM1del, GSTT1+M1del або GSTT1delM1+. У даній групі порівняння хлопчиків було 62,5 %, а дівчаток — 37,5 % (P > 0,05). Розподіл за місцем проживання був аналогічним до основної групи: 53,2 % хворих жили в міських, а 46,9 % — у сільських поселеннях (P > 0,05). Кожна четверта дитина (25,0 %) надходила для планового обстеження та лікування, а 75 % — у зв’язку із загостренням хвороби. Атопічну форму захворювання мали 59,4 %, а змішану — 40,6 % дітей (P > 0,05). Отже, за основними клінічними показниками сформовані групи були порівнянними.
Визначення ступеня тяжкості БА, рівня конт–ролю над захворюванням, а також обсягу лікування здійснювали згідно з наказами МОЗ України № 767 від 25.12.2005 р. та № 128 від 19.03.2007 р. [2, 3] відповідно до рекомендацій Глобальної стратегії лікування та профілактики БА (GINA-2006 та її наступні версії) [1, 9]. Зокрема, ступінь контрольованості БАФН визначали за допомогою питальників Asthma Control Test (АСТ) [6], анкети, що рекомендується Глобальною стратегією лікування та профілактики бронхіальної астми (GINA) [12], а також бальної клініко-інструментальної шкали контролю (КІШ). Остання включала 7 запитань, що дозволяли оцінювати клінічні симптоми БАФН в межах від 0 до 4 балів, а також визначати показники функції зовнішнього дихання — об’єм форсованого видиху на 1-й секунді (ОФВ1) та пікову об’ємну швидкість видиху (ПОШ). Оцінка за КІШ до 10 балів свідчила про досягнення контролю над захворюванням, 11–16 балів асоціювались з частковим, а понад 17 балів — із неконтрольованим перебігом БАФН.
Водночас АСТ для дітей віком до 11 років охоплював 7 запитань (на 4 з яких відповідали батьки), а для дітей дорослішого віку — 5 запитань, відповіді на які оцінювалися від 1 до 5 балів включно. Загальна сума балів, що перевищувала 20, свідчила про повний контроль, від 16 до 19 балів — про частковий контроль, 15 і менше — про відсутність контролю над захворюванням.
Натомість GINA-тест передбачав опитування за шістьма запитаннями, що дозволяли встановити відсутність денних, нічних симптомів, фізичного обмеження та загострень, використання швидкодіючих інгаляторів менше ніж 2 рази на тиждень та показник ОФВ1 вище від 80 %. Оцінювання проводилося за двобальною шкалою таким чином, що сума в 6 балів свідчила про повний контроль над захворюванням, 7–9 балів — про частковий, а вище від 9 балів — про відсутність контролю над захворюванням.
Оцінку вираженості бронхообструкції в нападному періоді БАФН у групах порівняння впродовж стаціонарного лікування здійснювали за бальною констеляційною шкалою [4].
Отримані результати дослідження аналізувалися методом біостатистики та клінічної епідеміології, а також за допомогою пакета програм Statistica 7.0 StatSoft, Inc. та Excel XP для Windows на персональному комп’ютері з використанням параметричних і непараметричних методів обчислення. Оцінка ризику реалізації події проводилась з урахуванням вірогідності величин відносного, атрибутивного ризиків та співвідношення шансів (СШ), а також визначення їх довірчих інтервалів (95% ДІ).
Результати та обговорення
За тяжкістю перебігу БАФН вірогідних розбіжностей у групах порівняння не виявлено, хоча у хворих із наявним поліморфізмом вивчених генів ферментів детоксикації випадки легкого персистування БАФН не спостерігаються взагалі, середньотяжкий перебіг хвороби був у 40,6 % дітей і тяжкий — у 59,4 %. Серед представників І клінічної групи легкий перебіг БАФН відмічено в 5,3 % дітей, середньотяжкий і тяжкий — у 36,8 та 57,9 % дітей відповідно (P > 0,05).
Нами не встановлено відмінностей за віком на початку захворювання та, відповідно, тривалістю перебігу БАФН. Так, дебют БАФН у ранньому віці відмічено в 36,8 % дітей І групи та в 34,4 % — ІІ, у віці від 3 до 6 років — у 15,8 та 21,9 % хворих, а фенотип астми пізнього початку серед дітей віком старше 6 років відмічено в 47,4 та 43,8 % випадків відповідно (у всіх випадках P > 0,05).
При анамнестичному обстеженні вірогідних розбіжностей за частотою природного вигодовування в групах порівняння не встановлено. Так, до досягнення піврічного віку грудне вигодовування отримували 36,8 % дітей І та 43,3 % — ІІ групи порівняння, до 1 року — відповідно 52,6 та 40,0 % хворих, решта знаходилися на штучному вигодовуванні (у всіх випадках P > 0,05).
За частотою народження дітей у пору року, коли спостерігається більша концентрація пилкових алергенів у повітрі, що пов’язана з цвітінням рослин (квітень — вересень), суттєвих відмінностей у групах порівняння не встановлено, хоча серед представників ІІ клінічної групи 59,3 % дітей народжувалися в інші сезони календарного року на противагу І групі, де таких випадків було тільки 47,1 % (P > 0,05).
При цьому клінічні прояви ексудативно-катарального діатезу, що в ранньому віці асоціюють переважно з ознаками атопічного дерматиту, спостерігалися в І групі у 36,8 % хворих, більше ніж у половини (56,3 %) представників ІІ групи порівняння (P > 0,05). Супутні алергічні захворювання відмічено в 57,9 % дітей без поліморфізму генів ферментів глутатіон-S-трансферази та в 62,5 % випадків у групі порівняння (P > 0,05).
Відсутність обтяженого власного алергологічного анамнезу мала місце у 26,3 % дітей із генотипом GSTT1+M1+ та удвічі рідше (13,3 %, P > 0,05) серед представників групи порівняння. У дітей із поліморфізмом генів GSTT1M1 значно більше відзначалися реакції на харчові алергени (10,0 проти 5,3 % у І клінічній групі, P > 0,05), побутові тригери (43,3 проти 15,8 % відповідно, P < 0,05).
Отже, на основі наведених даних можна зробити висновок про більшу клінічну вираженість атопічного конституційного типу в дітей із поліморфізмом генів детоксикації, що, можливо, пояснювалося більшим пресингом зовнішніх чинників, зокрема побутових алергенів і тютюнового диму.
Так, серед патогенних факторів оточення, що впливали на перебіг БАФН у представників клінічних груп порівняння, привертало увагу те, що лише кожна друга дитина (50,0 %) І клінічної групи не відчувала на собі згубного впливу тютюнового диму, виступаючи пасивним та/або активним курцем. У цій групі пасивних курців було 37,5 %, а власний досвід тютюнопаління на момент обстеження вже мали 12,5 % школярів (P > 0,05). У групі порівняння контакту з тютюновим димом не мали 37,5 % дітей, стільки же виступали пасивними курцями, а активними курцями була чверть хворих на БАФН (25,0 %, P > 0,05).
Окрім того, в екологічно більш сприятливих умовах проживання знаходилася вірогідно більша кількість пацієнтів І групи (36,4 %) та лише 13,3 % дітей групи порівняння (P < 0,05), натомість в умовах вираженого екогенного забруднення проживали 18,2 % дітей із генотипом GSTT1+M1+ та третина (33,3 %) хворих на БАФН із наявними делеціями вивчених генів (P > 0,05). Це сприяло тому, що прояви БАФН серед представників ІІ клінічної групи в 12,5 % випадків відмічалися цілорічно, хоча в І групі переважала (70,6 %) осінньо-весняна сезонність нападів.
Бальна оцінка тяжкості нападного періоду, що проводилася дітям, які надійшли до відділення у зв’язку із загостренням, дозволила виявити відмінності в тяжкості бронхообструктивного синдрому залежно від наявності чи відсутності поліморфізму генів ферментів біотрансформації ксенобіотиків (табл. 1).
Зокрема, при наявній тенденції до більш тяжкого перебігу бронхообструктивного синдрому при надходженні до стаціонару через наявність загострення БАФН у представників І клінічної групи упродовж тижня лікування ці ознаки набули статистично вірогідної значущості.
Таким чином, особливості клініко-анамнестичних даних стосовно перебігу БАФН у дітей груп порівняння дозволили зробити висновок, що залежно від наявності чи відсутності поліморфізму вивчених генів ферментів глутатіон-S-трансферази спостерігається тенденція до більшої вираженості алергізації організму в дітей із делеціями генів GSTT1M1, що, можливо, пов’язано з гіршими мікро- та макроекологічними умовами проживання та виховання цих дітей. Разом із тим у періоді загострення напади в цих дітей перебігають легше, швидшою є відповідь на застосоване лікування та від 6-ї доби лікування вираженість дезобструкції є вірогідно кращою.
Оцінка ступеня контролю БАФН у хворих, які надійшли до відділення у позанападному періоді захворювання, за питальником АСТ практично збігалася в середніх результатах у сформованих групах порівняння, проте нами відмічено тенденцію до погіршення рівня контролю захворювання в дітей із делеціями у вивчених генах ферментів біотрансформації антигенів. Так, середня сумарна бальна оцінка перебігу БАФН дітьми віком до 11 років та їх батьками за питальником АСТ у І групі становила 19,0 ± 3,2 бала, а в групі порівняння — 17,6 ± 1,5 бала (P > 0,05). Проте оцінка контролю БАФН дітьми старшого віку, навпаки, була кращою в представників ІІ клінічної групи (17,2 ± 1,0 бала проти 15,4 ± 1,2 бала, P > 0,05), зокрема за показником щоденної фізичної обмеженості (4,3 ± 0,2 бала проти 3,2 ± 0,3 бала, P < 0,05).
За питальником GINA виявлена тенденція до покращання контролю БАФН у представників ІІ клінічної групи підтвердилася. Так, середній бал у дітей із генотипом GSTT1+M1+ сягав 9,5 ± 0,4 бала, а у ІІ групі — 8,8 ± 0,5 бала, а найбільш вираженими були відмінності за показником обмеження фізичної активності, що в І групі оцінювався в 1,90 ± 0,08 бала, а в ІІ — в 1,60 ± 0,13 бала (P < 0,05).
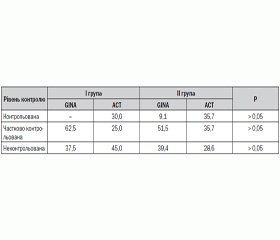
Всупереч відсутності розбіжностей за середнім балом оцінки контролю БАФН, розподіл частоти різного рівня контролю БАФН у групах хворих залежно від наявності чи відсутності в них поліморфізму генів GSTT1M1 віддзеркалював тенденцію до покращання контролю в ІІ групі (табл. 2).
Середні показники клініко-інструментальної шкали оцінки ступеня контролю БАФН, що передбачала верифікацію клінічних ознак (наявність денних та нічних симптомів астми, частота використання бета2-агоністів, фізична обмеженість, частота загострень, госпіталізацій та потреба у позапланових візитах до алерголога), збігалися в групах порівняння (16,1 ± 1,6 бала в І групі проти 16,0 ± 1,4 бала в ІІ групі, P > 0,05). Проте за спірографічними показниками відмічено покращання рівня контролю БАФН у дітей із генотипом GSTT1+M1+ на противагу пацієнтам із наявним поліморфізмом вивчених генів ферментів біотрансформації ксенобіотиків. Так, зменшення ПОШ у дітей І групи оцінювалося в 1,8 ± 0,4 бала, а в ІІ групі — у 2,9 ± 0,3 бала (P < 0,05), а сумарна спірографічна оцінка контролю — відповідно у 2,9 ± 0,7 та 4,5 ± 0,5 бала (P < 0,05).
Таким чином, поліморфізм генів GSTT1M1 у дітей, які хворіють на БАФН, асоціюється з відсутністю легкого персистування захворювання, напади якого у 12,5 % хворих спостерігаються цілорічно, а також з тенденцією до частіших клінічних проявів ексудативно-катарального діатезу й алергічних реакцій на харчові та побутові алергени при меншій експозиції пилку рослин при народженні дітей. Майже 63 % таких дітей знаходяться під впливом тютюнового диму, а кожна четверта є активним курцем, притому що в несприятливому екологічному оточенні проживають 86,7 % хворих. Проте напади бронхіальної астми в цих дітей перебігають легше, швидше досягається дезобструктивний ефект, хоча контроль над захворюванням у міжприступному періоді за АСТ оцінювався по-різному дітьми різного віку.
Незважаючи на те, що за середніми показниками розподілу бальної оцінки контролю БАФН за питальниками GINA і АСТ вірогідних відмінностей у групах не встановлено, оцінка контролю в дітей із поліморфізмом генів GSTT1M1 (ІІ клінічна група) за питальником GINA була незначно кращою і рівень контролю — вірогідно вищим за показником обмеження фізичної активності. Це, можливо, пояснювалося суб’єктивністю відповідей дещо старших за віком представників ІІ групи при встановлених особливостях їх способу життя.
Це частково підтвердилося за допомогою спірографічного обстеження, що входило до КІШ та дозволило дещо об’єктивізувати отримані результати контролю. Так, показники клінічно-епідеміологічного ризику контрольованого перебігу БАФН за показниками спірограми, що входять до КІШ, у дітей із генотипом GSTT1+M1+ (І клінічна група) порівняно з пацієнтами з поліморфізмом указаних генів становили: СШ 3,33 (95% ДІ 0,9–12,9), відносний ризик — 1,8 (95% ДІ 0,7–4,2), абсолютний ризик — 29 %. Отже, сумарна спірографічна оцінка контролю виявилася вірогідно кращою в пацієнтів із генотипом GSTT1+M1+.
Висновки
1. Виявлення поліморфізму генів GSTT1M1 дозволяє встановити ризик недостатньої контрольованості бронхіальної астми фізичного напруження (співвідношення шансів — 3,33, відносний ризик — 1,8, абсолютний ризик — 29 %).
2. Наявність поліморфізму генів GSTT1M1 асоціюється з тяжчим перебігом БАФН, проте швидкими темпами дезобструкції за використання стандартного полегшувального лікування порівняно з хворими з генотипом GSTT1+M1+.
3. У хворих на БАФН за наявності делеційного поліморфізму генів GSTT1M1 слід особливу вагу звернути на оздоровлення навколишнього середовища та нормалізацію способу життя.
4. Для об’єктивізації самооцінки контролю бронхіальної астми фізичного напруження доцільно проводити стандартну спірографію.
Перспективи подальших досліджень полягають у вивченні особливостей місцевого запального процесу в бронхах у дітей, які страждають від БАФН, при поліморфізмі вивчених генів ферментів біотрансформації ксенобіотиків.
1. Глобальная стратегия лечения и профилактики бронхиальной астмы / Под ред. Чучалина А.Г. — М.: Атмосфера, 2007. — 104 с.
2. Наказ МОЗ України № 128 від 19.03.2007 р. «Про затвердження клінічних протоколів надання медичної допомоги за спеціальністю «пульмонологія». — Режим доступу: http://moz.gov.ua/ua/portal/dn_20070319_128.html
3. Наказ МОЗ України № 767 від 27.12.2005 р. «Про затвердження протоколів діагностики та лікування алергологічних хвороб у дітей». — Режим доступу: http://moz.gov.ua/ua/portal/dn_20051227_767.html
4. Сидельников В.М. Практическая аллергология детского возраста / В.М. Сидельников, Л.А. Безруков, В.Г. Мигаль. — К.: Здоровье, 1985. — С. 22-23.
5. Coles B.F. Human alpha class glutathione S-transferases: genetic polymorphism, expression, and susceptibility to disease / B.F. Coles, F.F. Kadlubar // Methods Enzymol. — 2005. — Vol. 401. — P. 9-42.
6. Development and validation of a questionnaire to measure asthma control / E.F. Juniper, P.M. O’Byrne, G.H. Guyatt [et al.] // Eur. Respir. J. — 1999. — Vol. 14(4). — P. 902-907.
7. Economic burden of asthma: a systematic review / K. Bahadori, M.M. Doyle-Waters, C. Marra [et al.] // BMC Pulmonary Med. — 2009. — Режим доступу: http://www.biomedcentral.com/1471-2466/9/24
8. Global strategy for asthma management and prevention (GINA, 2011) [електронний ресурс]. — Режим доступу: http://www.ginasthma.org/pdf/GINA_Report_2011.pgf
9. Global variation in the prevalence and severity of asthma symptoms: Phase Three of the International Study of Asthma and Allergies in Childhood (ISAAC) / C.K.W. Lai, R. Beasley, J. Crane [et al.] // Thorax. — 2009. — Vol. 64. — P. 476-483.
10. Identification of a novel asthma susceptibility gene on chromosome 1qter andits functional evaluation / J.H. White, M. Chiano, M. Wigglesworth [et al.] // Human Molecular. Genetics. — 2008. — Vol. 17, № 13. — P. 1890-1903.
11. Makker A.C. Mechanisms of exercise-induced asthma / A.C. Makker, S.T. Holgate // Eur. J. Clin. Invest. — 1994. — Vol. 24. — P. 571-585.
11. Measuring asthma control. Clinic questionnaire or daily diary? / E.F. Juniper, P.M. O’Byrne, P.J. Ferrie [et al.] // Am. J. Respir. Crit. Care. Med. — 2000. — Vol. 162. — P. 1330-1334.
12. Moreira A. Exercise-induced asthma: why is it so frequent in Olympic athletes? / A. Moreira, L. Delgado, K.-H. Carlsen // Expert Rev. Resp. Med. — 2011. — Vol. 5, № 1. — P. 1-3.
13. National Asthma Educationand Prevention Program: Expert panel report III. Guidelines for the diagnosis and management of asthma [електронний ресурс] / National Heart, Lung, and Blood Institute. — October 2007. — Режим доступу: www.nhlbi.nih.gov
14. Paniti S. Perception of exercise induced asthma by children and their parents / S. Panditi, M. Silverman // Arch. Dis. Child. — 2003. — № 88. — P. 807-811.
15. The GSTP1 gene is a susceptibility gene for childhood asthma and the GSTM1 gene is a modifier of the GSTP1 gene / F. Kamada, Y. Mashimo, H. Inoue [et al.] // Int. Arch. Allergy Immunol. — 2007. — Vol. 144, № 4. — P. 275-286.

/16/16.jpg)
/17/17.jpg)