Журнал «Почки» 2 (04) 2013
Вернуться к номеру
Хронічна хвороба нирок
Авторы: Іванов Д.Д., Пиріг Л.А., Іванова М.Д.
Рубрики: Нефрология
Разделы: Медицинское образование
Версия для печати
Члени ради KDIGO
Основоположники KDIGO, співголови
Garabed Eknoyan, MD
Norbert Lameire, MD, PhD
Kai-Uwe Eckardt, MD, у недавньому минулому співголова
Співголови KDIGO
Bertram L. Kasiske, MD
David C. Wheeler, MD, FRCP
Автори, члени робочої групи
Omar I. Abboud, MD, FRCP
Sharon Adler, MD, FASN
Rajiv Agarwal, MD
Sharon P. Andreoli, MD
Gavin J. Becker, MD, FRACP
Fred Brown, MBA, FACHE
Daniel C. Cattran, MD, FRCPC
Allan J. Collins, MD, FACP
Rosanna Coppo, MD
Josef Coresh, MD, PhD
Ricardo Correa-Rotter, MD
Adrian Covic, MD, PhD
Jonathan C. Craig, MBChB, MM (ClinEpi), DCH, FRACP, PhD
Angel L.M. de Francisco, MD
Paul E. de Jong, MD, PhD
Ana Figueiredo, RN, MSc, PhD
Mohammed Benghanem Gharbi, MD
Gordon Guyatt, MD, MSc, BSc, FRCPC
David Harris, MD
Lai Seong Hooi, MD
Enyu Imai, MD, PhD
Lesley A. Inker, MD, MS, FRCP
Michel Jadoul, MD
Simon Jenkins, MBE, FRCGP
Suhnggwon Kim, MD, PhD
Martin K. Kuhlmann, MD
Nathan W. Levin, MD, FACP
Philip K.-T. Li, MD, FRCP, FACP
Zhi-Hong Liu, MD
Pablo Massari, MD
Peter A. McCullough, MD, MPH, FACC, FACP
Rafique Moosa, MD
Miguel C. Riella, MD
Adibul Hasan Rizvi, MBBS, FRCP
Bernardo Rodriquez-Iturbe, MD
Robert Schrier, MD
Justin Silver, MD, PhD
Marcello Tonelli, MD, SM, FRCPC
Yusuke Tsukamoto, MD
Theodor Vogels, MSW
Angela Yee-Moon Wang, MD, PhD, FRCP
Christoph Wanner, MD
Elena Zakharova, MD, PhD
Персонал із розробки настанови NKF-KDIGO
Kerry Willis, PhD, Senior Vice-President for Scientific Activities
Michael Cheung, MA, Guideline Development Director
Sean Slifer, BA, Guideline Development Manager
Ключові посилання
Номенклатура та опис градацій рекомендацій настанов
У кожній рекомендації сила рекомендації позначається як рівень 1, рівень 2 або не оцінюється, і якість підтвердження доказів — A, B, C або D.
У кожній рекомендації сила рекомендації позначається як рівень 1, рівень 2 або не оцінюється, і якість підтвердження доказів — A, B, C або D (табл. 1).
Примітка
Kidney International Supplements (2013) 3, 1; doi. 10.1038/kisup. 2012. 73
Розділ 1. Використання клінічних настанов
Клінічні настанови базуються на систематичному літературному пошуку, проведеному востаннє на червень 2011 року, доповнені додатковими доказами по листопад 2012 року. Настанови розроблені для надання інформації та допомоги в прийнятті рішення. Вони не призначені для визначення стандартів медичної допомоги та не можуть бути відповідно тлумачені, а також не можуть бути інтерпретовані як ексклюзивний курс ведення хворих. Варіації в практиці неминуче будуть виникати, коли клініцисти братимуть до уваги індивідуальність пацієнта, наявні можливості та обмеження відповідно до типу лікувального закладу. Кожний фахівець при використанні цих рекомендацій є відповідальним за оцінку і доречність їх застосування у будь-якій конкретній клінічній ситуації. Рекомендації для досліджень, що містяться в цьому документі, є узагальненими і не є офіційним протоколом.
Розділ 2. Інформаційне підґрунтя
Kidney Disease: Improving Global Outcomes (KDIGO) докладає всіх можливих зусиль, щоб уникнути фактичного або передбачуваного конфлікту інтересів, який може виникнути як наслідок сторонніх втручань або персональних, професійних чи ділових інтересів членів Робочої групи. Від усіх учасників Робочої групи вимагались повні підписані представлення інформації та атестаційні форми, що відображали всі взаємовідносини, які могли сприйматися або бути фактичними ознаками конфлікту інтересів. Цей документ щорічно оновлюється, а інформація відповідно коректується. Уся доведена до відома інформація опублікована в повному обсязі наприкінці цього документа в біографії членів робочої групи і в розділі «Розкриття інформації», і вона зберігається у файлі в NKF, керуючого агента для KDIGO.
Члени робочої групи
Співголови робочої групи
Adeera Levin, MD, FRCPC
University of British Columbia
Vancouver, Canada
Paul E. Stevens, MB, FRCP
East Kent Hospitals University
NHS Foundation Trust
Canterbury, United Kingdom
Робоча група
Rudy W. Bilous, MD
Newcastle University and James Cook University Hospital
Middlesbrough, United Kingdom
Josef Coresh, MD, PhD, MHS
Johns Hopkins University
Baltimore, USA
Angel L.M. de Francisco, MD, PhD
Hospital Universitario Valdecilla
Santander, Spain
Paul E. de Jong, MD, PhD
University Medical Center Groningen
Groningen, The Netherlands
Kathryn E. Griffith, BM, BS, MSc, MRCP, MRCGP
University Health Centre, York University
York, United Kingdom
Brenda R. Hemmelgarn, MD, PhD, FRCP(C)
University of Calgary
Alberta, Canada
Kunitoshi Iseki, MD
University Hospital of the Ryukyus
Nishihara, Okinawa, Japan
Edmund J. Lamb, PhD, FRCPath
East Kent Hospitals University
NHS Foundation Trust
Canterbury, United Kingdom
Andrew S. Levey, MD
Tufts Medical Center
Boston, USA
Miguel C. Riella, MD, PhD, FACP
Evangelic University Hospital
Curitiba, Brazil
Michael G. Shlipak, MD, MPH
VA Medical Center, UCSF
San Francisco, USA
Haiyan Wang, MD
Peking University First Hospital
Beijing, China
Colin T. White, MD, FRCPC
University of British Columbia
Vancouver, Canada
Christopher G. Winearls, MB, DPhil, FRCP
Oxford Radcliffe Hospitals NHS Trust
Oxford, United Kingdom
Група аналізу доказовості
Tufts Center for Kidney Disease Guideline Development and Implementation
Tufts Medical Center, Boston, MA, USA:
Katrin Uhlig, MD, MS, Project Director; Director, Guideline Development
Dana Miskulin, MD, MS, Staff Nephrologist
Amy Earley, BS, Project Coordinator
Shana Haynes, MS, DHSc, Research Assistant
Jenny Lamont, MS, Project Manager
Крім того, підтримка і нагляд були надані:
Ethan M. Balk, MD, MPH; Program Director, Evidence Based Medicine
Цитування документа: Kidney Disease. Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidneyinter., Suppl. 2013; 3: 1–150.
Резюме положень рекомендацій
Частина 1. Визначення та класифікація ХХН
1.1. Визначення ХХН
1.1.1. ХХН визначається як порушення структури або функції нирок, що тривають протягом понад 3 місяці та негативно впливають на здоров’я. (Не оцінюється.) (табл. 3).
1.2. Визначення стадій ХХН
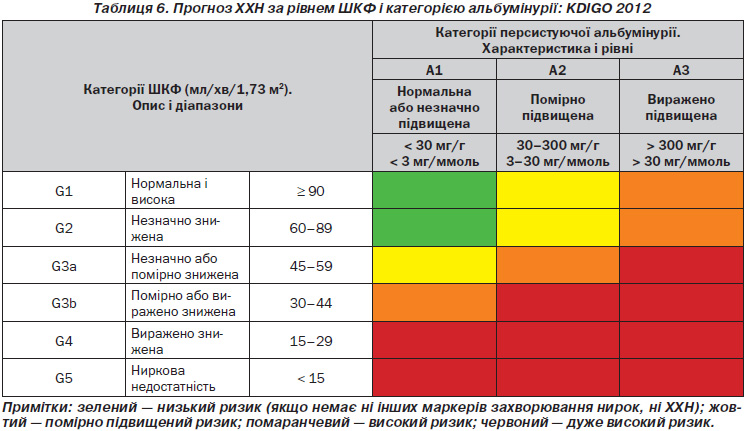
1.2.1. Ми рекомендуємо, щоб ХХН класифікувалась на основі причини, категорій ШКФ і категорій альбумінурії (КША) (1B) (або CGA, як це в оригіналі подано в настановах).
1.2.2. Визначайте причину ХХН на підставі наявності або відсутності системного захворювання і присутності його ознак у нирках із існуючими або передбачуваними патологоанатомічними характеристиками. (Не оцінюється.)
1.2.3. Визначайте категорії ШКФ таким чином (Не оцінюється.) — табл. 4:
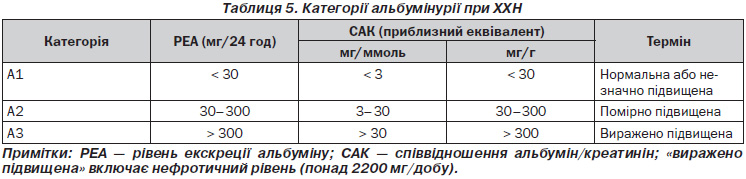
1.2.4. Визначайте категорію альбумінурії таким чином (Не оцінюється.) — табл. 5.
У випадках, коли визначення альбумінурії недоступне, результати визначаються за допомогою смужки з реагентом.
1.3. Визначення прогнозу ХХН
1.3.1. У прогнозуванні ризику наслідків ХХН визначайте такі параметри: 1) причину ХХН; 2) категорію ШКФ; 3) категорію альбумінурії; 4) інші фактори ризику та супутні захворювання. (Не оцінюється.)
1.3.2. У людей із ХХН використовуйте оцінений ризик наявних ускладнень і майбутніх наслідків для прийняття рішень щодо обстеження та лікування ускладнень ХХН. (Не оцінюється.)
1.3.3. У популяціях із ХХН групуйте категорії ШКФ і альбумінурії зі схожими відносними ризиками наслідків ХХН у категорії ризиків. (Не оцінюється.) (табл. 6).
1.4. Оцінка ХХН
1.4.1. Оцінка хронічності
1.4.1.1. У людей зі ШКФ < 60 мл/хв/1,73 м2 (ШКФ категорії G3a–G5) або з наявними маркерами пошкодження нирок перевірте історію хвороби і результати попередніх досліджень для визначення тривалості захворювання нирок. (Не оцінюється.)
— Якщо тривалість становить понад 3 місяці, ХХН підтверджується. Дотримуйтесь подальших рекомендацій щодо ХХН.
— Якщо тривалість не перевищує 3 місяців або невідома, ХХН не підтверджується. Пацієнти можуть мати ХХН або гостре захворювання нирок (у тому числі ГУН) або обидва, і дослідження повинні повторюватися відповідно.
1.4.2. Оцінка причин
1.4.2.1. Оцінюйте клінічну ситуацію, у тому числі особисту та сімейну історії, соціальні та екологічні фактори, застосування ліків, дані фізикального обстеження, лабораторні дані, результати візуалізаційних досліджень та патоморфологічний діагноз, щоб визначити причини захворювання нирок. (Не оцінюється.)
1.4.3. Оцінка ШКФ
1.4.3.1. Ми рекомендуємо використовувати концентрацію сироваткового креатиніну і формулу оцінки ШКФ для первинної оцінки. (1А)
1.4.3.2. Ми пропонуємо використовувати додаткові тести (наприклад, цистатину С або вимірювання кліренсу) для підтверджуючого тестування за конкретних обставин, коли рШКФ на підставі сироваткового креатиніну є менш точною. (2B)
1.4.3.3. Ми рекомендуємо, щоб лікарі (1B):
— використовували формулу оцінки ШКФ для її розрахунку на основі рівня креатиніну (рШКФк), а не покладалися лише на концентрацію креатиніну сироватки;
— розумійте клінічні обставини, за яких рШКФк є менш точною.
1.4.3.4. Ми рекомендуємо клінічним лабораторіям (1B):
— визначати концентрацію креатиніну сироватки крові за допомогою спеціального аналізу з калібруванням згідно з міжнародними стандартами визначення матеріалів і мінімальними відхиленнями в порівнянні з ізотопною мас-спектрометрією;
— представляти рШКФк додатково до концентрації сироваткового креатиніну у дорослих і точно визначати формулу, що використана у всіх представлених результатах рШКФк;
— представляти рШКФк у дорослих згідно з формулою GFR-EPI, 2009. Альтернативна формула на основі концентрації креатиніну є прийнятною, якщо було продемонстровано підвищення точності оцінки ШКФ в порівнянні з GFR-EPI, 2009.
При представленні значення концентрації сироваткового креатиніну:
— Ми рекомендуємо представляти концентрацію креатиніну сироватки округленою до найближчого цілого значення і вираженою в стандартних міжнародних одиницях (мкмоль/л) з округленням найближчих сотих до цілого числа, коли виражається в умовних одиницях (мг/дл).
При представленні рШКФк:
— Ми рекомендуємо, щоб рШКФк була округлена до найближчого цілого числа, співвіднесена до площі поверхні тіла в 1,73 м2 у дорослих і представлена з використанням одиниць мл/хв/1,73 м2.
— Ми рекомендуємо, щоб рШКФк нижче за 60 мл/хв/1,73 м2 була представлена як «зменшена».
1.4.3.5. Ми пропонуємо вимірювання цистатину С у дорослих із рШКФк 45–59 мл/мін/1,73/м2, які не мають маркерів пошкодження нирок, у тих випадках, коли потрібне підтвердження наявності ХХН (2C):
— Якщо рШКФц/рШКФк-ц також < 60 мл/хв/1,73 м2, діагноз ХХН є підтвердженим.
— Якщо рШКФц/рШКФк-ц є і 60 мл/хв/1,73 м2, діагноз ХХН не підтверджується.
1.4.3.6. Якщо цистатин С визначається, ми пропонуємо, щоб медичні працівники (2C):
— використовували формулу розрахунку ШКФ для її визначення за рівнем концентрації цистатину C сироватки, а не покладалися лише на сироваткове значення цистатину С;
— розуміли клінічні умови, за яких рШКФц і рШКФк-ц є менш точними.
1.4.3.7. Ми рекомендуємо клінічним лабораторіям, які визначають концентрацію цистатину C (1B):
— визначати сироватковий вміст цистатину С з використанням калібрування відповідно до міжнародних стандартів референтних матеріалів;
— представляти рШКФц і рШКФк-ц у дорослих, використовуючи формули GFR-EPI, 2012 для цистатину С та креатиніну-цистатину відповідно, або альтернативні формули, що базуються на визначенні цистатину С, якщо вони продемонстрували підвищення точності оцінки ШКФ порівняно з формулами CKD-EPI, 2012 для цистатину С і CKD-EPI, 2012 для креатиніну-цистатину C.
При представленні концентрації цистатину C сироватки:
— Ми рекомендуємо представляти сироватковий вміст цистатину С у величині концентрації, округленої до найближчих сотих цілого числа, коли він виражається в умовних одиницях (мг/л).
При представленні рШКФц і рШКФк-ц:
— Ми рекомендуємо представляти рШКФц і рШКФк-ц округленими до найближчого цілого числа і щодо площі поверхні тіла в 1,73 м2 у дорослих із використанням одиниць мл/хв/1,73 м2.
— Ми рекомендуємо, щоб значення рШКФц і рШКФк-ц менше 60 мл/хв/1,73 м2 повинні бути представлені як «зменшені».
1.4.3.8. Ми пропонуємо вимірювання ШКФ із використанням екзогенних маркерів фільтрації в умовах, коли більш точне визначення ШКФ вплине на рішення про лікування. (2B)
1.4.4. Оцінка альбумінурії
1.4.4.1. Ми пропонуємо використовувати такі визначення для первинного тестування протеїнурії (у порядку зменшення переваг, в усіх випадках у ранній ранковій порції сечі тестування є кращим) (2B).
1) співвідношення альбуміну і креатиніну сечі (САК);
2) співвідношення білок-креатинін сечі (СБК);
3) аналіз сечі за реагент-смужкою на загальний білок з автоматизованим представленням;
4) аналіз сечі за реагент-смужкою на загальний білок із ручним представленням.
1.4.4.2. Ми рекомендуємо клінічним лабораторіям представляти САК і СБК у випадкових (не за часом) зразках сечі додатково до концентрації альбуміну або протеїнурії, а не саму концентрацію поодинці. (1B)
1.4.4.2.1. Термін «мікроальбумінурія» більше не повинен використовуватись лабораторіями. (Не оцінюється.)
1.4.4.3. Клініцисти повинні враховувати параметри, які можуть вплинути на інтерпретацію визначення ступеня альбумінурії і призначати підтверджуючі тести, якщо це потрібно. (Не оцінюється.):
— Підтверджуйте наявність альбумінурії або протеїнурії за реагент-смужкою кількісним вимірюванням у лабораторії та представляйте у співвідношенні до креатиніну, де це можливо.
— Підтверджуйте САК і 30 мг/г (і 3 мг/ммоль) за випадковими (не за часом) зразками сечі з подальшим аналізом зразка ранкової сечі.
— Якщо необхідна точніша оцінка альбумінурії або загальної протеїнурії, вимірюйте величину екскреції альбуміну або загальну екскрецію білка в сечі у зразку із визначеним часовим інтервалом.
1.4.4.4. Якщо є підозра на значну неальбумінну протеїнурію, використовуйте для аналізу тести на специфічні білки сечі (наприклад, a1-мікроглобуліну, моноклональних важких або легких ланцюгів (відомих у деяких країнах як білок Бенс-Джонса)). (Не оцінюється.)
Частина 2. Визначення, ідентифікація та прогнозування прогресування ХХН
2.1. Визначення та виявлення прогресування ХХН
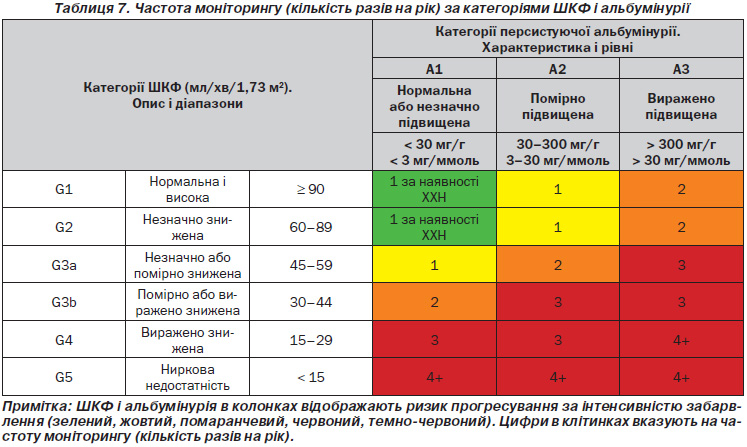
2.1.1. Оцінюйте ШКФ і альбумінурію принаймні щорічно у людей із ХХН. Оцінюйте ШКФ і альбумінурію частіше в осіб із високим ризиком прогресування та/або у тих випадках, де такі дослідження будуть впливати на терапевтичні рішення (табл. 7). (Не оцінюється.)
2.1.2. Усвідомлюйте, що невеликі коливання ШКФ є можливими і можуть не відображати прогресування. (Не оцінюється.)
2.1.3. Визначайте прогресування ХХН на основі однієї або більше з наступних ознак (Не оцінюється.):
— Категорії ШКФ у порядку зниження становлять (і 90 [G1], 60–89 [G2], 45–59 [G3a], 30–44 [G3b], 15–29 [G4], < 15 [G5] мл/хв/1,73 м2). Вірогідне зниження категорії за рШКФ визначається як її зниження у разі 25% або більшого зниження рШКФ порівняно з її вихідним значенням.
— Швидке прогресування визначається як стійке зниження рШКФ понад на 5 мл/хв/1,73 м2/рік.
— Надійність у встановленні прогресування збільшується зі зростанням кількості вимірювань креатиніну сироватки і тривалості спостереження.
2.1.4. У людей із прогресуванням ХХН, як це визначено в рекомендації 2.1.3, переглядайте поточне ведення, вивчайте зворотні причини прогресування і розглядайте можливість направлення до фахівця (Не оцінюється.)
Частина 3. Контроль прогресування і ускладнень ХХН
3.1. Профілактика прогресування ХХН
АТ і порушення РААС
3.1.1. Індивідуалізуйте цільовий АТ і засоби лікування у відповідності з віком, супутніми серцево-судинними захворюваннями та іншими супутніми захворюваннями, ризиком прогресування ХХН, наявністю або відсутністю ретинопатії (у пацієнтів із ХХН на тлі цукрового діабету) і переносимістю лікування згідно з настановою KDIGO 2012 з артеріальної гіпертензії. (Не оцінюється.)
3.1.2. Довідуйтесь про постуральне запаморочення і перевіряйте регулярно наявність постуральної гіпотензії при лікуванні антигіпертензивними препаратами пацієнтів із ХХН. (Не оцінюється.)
3.1.3. Витримуйте у суворому режимі лікування АТ у літніх пацієнтів із ХХН, ретельно враховуючи вік, супутні захворювання та інші методи лікування, з поступовим посиленням лікування і пильною увагою до несприятливих явищ, пов’язаних із терапією АТ, у тому числі електролітних розладів, гострого ураження функції нирок, ортостатичної гіпотензії та побічних ефектів лікарських засобів. (Не оцінюється.)
3.1.4. Ми рекомендуємо, щоб дорослі пацієнті з діабетом або без діабету з ХХН і добовою екскрецією альбуміну з сечею < 30 мг (або еквівалентною*), у яких офісний систолічний АТ стабільно > 140 мм рт.ст. або діастолічний АТ стабільно > 90 мм рт.ст., були ліковані антигіпертензивними препаратами для підтримки цільового систолічного АТ стабільно Ј 140 мм рт.ст. і діастолічного АТ стабільно Ј 90 мм рт.ст. (1B)
3.1.5. Ми вважаємо, що дорослі пацієнти з діабетом або без діабету з ХХН і екскрецією альбуміну з сечею і 30 мг на добу (або еквівалентною*) і офісним систолічним АТ стабільно > 130 мм рт.ст. або діастолічним стабільно > 80 мм рт.ст. можуть бути ліковані антигіпертензивними препаратами для підтримки цільового систолічного АТ стабільно Ј 130 мм рт.ст. і діастолічного стабільно Ј 80 мм рт.ст. (2D)
3.1.6. Ми вважаємо виправданим використання БРА або ІАПФ у дорослих із цукровим діабетом із ХНН та екскрецією альбуміну з сечею 30–300 мг/24 години (або еквівалентною*). (2D)
3.1.7. Ми рекомендуємо використання БРА або ІАПФ у дорослих з діабетом або без діабету з ХХН та екскрецією альбуміну з сечею > 300 мг/24 години (або еквівалент*). (1B)
3.1.8. Існує недостатньо доказів, щоб рекомендувати поєднання інгібіторів АПФ із БРА для запобігання прогресуванню ХХН. (Не оцінюється.)
3.1.9. Ми рекомендуємо, щоб у дітей із ХХН антигіпертензивне лікування починалося, коли рівень АТ стабільно вищий за 90-й процентиль для даного віку, статі та зросту. (1C)
3.1.10. Ми вважаємо, що у дітей із ХХН (зокрема, з протеїнурією) АТ знижується послідовно для досягнення систолічного і діастолічного менше або рівним 50-му процентилю для даного віку, статі та зросту, якщо досягнення цих цілей не обмежене ознаками або симптомами гіпотензії. (2D)
3.1.11. Ми вважаємо доцільним, щоб БРА або ІАПФ були використані у дітей із ХХН, яким показано лікування антигіпертензивними препаратами незалежно від рівня протеїнурії. (2D)
ХХН і ризик ГУН
3.1.12. Ми рекомендуємо всіх людей із ХХН вважати такими, які мають підвищений ризик ГУН. (1А)
3.1.12.1. Людям із ХНН, рекомендації для яких докладно описані в настановах KDIGO з ГУН, слід контролювати ці ризики ГУН під час супутніх захворювань або при проходженні досліджень та процедур, що можуть збільшити ризик ГУН. (Не оцінюється.)
Споживання білка
3.1.13. Ми пропонуємо зниження споживання білка до 0,8 г/кг/день дорослими пацієнтами з цукровим діабетом (2C) або без діабету (2B) і ШКФ < 30 мл/хв/1,73 м2 (ШКФ категорії G4–G5) з відповідним навчанням.
3.1.14. Ми пропонуємо уникнути високого споживання білка (> 1,3 г/кг/добу) дорослими пацієнтами з ХХН, які мають ризик прогресування. (2C)
Контроль глікемії
3.1.15. Ми рекомендуємо цільовий рівень A1c (HbA1c) до » 7,0 % (53 ммоль/моль), щоб запобігти або уповільнити прогресування мікроваскулярних ускладнень цукрового діабету, в тому числі діабетичної хвороби нирок. (1А)
3.1.16. Ми рекомендуємо не лікувати до досягнення цільового HbA1c < 7,0 % (< 53 ммоль/моль) у пацієнтів із ризиком гіпоглікемії. (1B)
3.1.17. Ми вважаємо, що цільовий рівень HbA1c може перевищувати 7,0 % (53 ммоль/моль) у осіб із супутніми захворюваннями або обмеженою тривалістю життя і ризиком розвитку гіпоглікемії. (2C)
3.1.18. У людей із ХХН і цукровим діабетом контроль глікемії повинен бути частиною стратегії багатофакторного втручання, направленого на контроль АТ і серцево-судинного ризику, із залученням до використання ІАПФ або БРА, статинів і антиагрегантів, де це клінічно показано. (Не оцінюється.)
Споживання солі
3.1.19. Ми рекомендуємо зниження споживання солі до < 90 ммоль (< 2 г) натрію на день (відповідає 5 г натрію хлориду) у дорослих, якщо немає протипоказань (див. обґрунтування). (1C)
3.1.19.1. Ми рекомендуємо обмеження споживання натрію для дітей із ХНН та гіпертензією (систолічний та/або діастолічний тиск > 95-й процентиль) або прегіпертензією (систолічний та/або діастолічний артеріальний тиск > 90-й процентиль і < 95-й процентиль) у відповідності до віку на основі рекомендованої добової дози. (1C)
3.1.19.2. Ми рекомендуємо додавати вільну воду і натрій для дітей із ХХН та поліурією, щоб уникнути хронічного внутрішньосудинного виснаження і сприяння оптимальному росту. (1C)
Гіперурикемія
3.1.20. Існує недостатньо доказів, що підтверджують або спростовують використання препаратів для зниження сироваткової концентрації сечової кислоти у людей із ХХН та симптоматичною або безсимптомною гіперурикемією з метою сповільнення прогресування ХНН. (Не оцінюється.)
Спосіб життя
3.1.21. Ми рекомендуємо, щоб людей із ХХН заохочувати до фізичної активності відповідно до наявних серцево-судинних захворювань і толерантності (маючі на меті принаймні 30 хвилин 5 разів на тиждень), досягнення здорової маси тіла (ІМТ від 20 до 25, залежно від конкретної демографічної належності країни) і припинення паління. (1D)
Додаткові поради з харчування
3.1.22. Ми рекомендуємо особам із ХХН отримувати експертні дієтичні рекомендації та інформацію в контексті освітніх програм, адаптованих до тяжкості ХХН та необхідності споживання солі, фосфату, калію і білка, де це показано. (1B)
3.2. Ускладнення, пов’язані з втратою функції нирок
Визначення та виявлення анемії у хворих на ХНН
3.2.1. Діагностуйте анемію у дорослих і дітей > 15 років із ХХН, коли концентрація гемоглобіну < 13,0 г/дл (< 130 г/л) в осіб чоловічої статі і < 12,0 г/дл (< 120 г/л) у жіночої. (Не оцінюється.)
3.2.2. Діагностуйте анемію у дітей із ХХН, якщо концентрація гемоглобіну < 11,0 г/дл (< 110 г/л) у дітей 0,5–5 років, < 11,5 г/дл (115 г/л) у дітей 5–12 років, < 12,0 г/дл (120 г/л) у дітей 12–15 років. (Не оцінюється.)
Оцінка анемії у пацієнтів із ХХН
3.2.3. Щоб визначити анемію у пацієнтів із ХХН, вимірюйте концентрацію гемоглобіну (не оцінюється):
— за клінічними показаннями у людей із ШКФ і 60 мл/хв/1,73 м2 (ШКФ категорії G1–G2);
— принаймні щорічно у людей із ШКФ 30–59 мл/хв/1,73 м2 (ШКФ категорії G3a–G3в);
— принаймні двічі на рік у людей із ШКФ < 30 мл/хв/1,73 м2 (ШКФ категорії G4–G5).
3.3. Метаболічна хвороба кісток при ХХН, включаючи лабораторні порушення
3.3.1. Ми рекомендуємо вимірювання сироваткових рівнів кальцію, фосфату, ПТГ та активності лужної фосфатази принаймні одноразово у дорослих із ШКФ < 45 мл/хв/1,73 м2 (ШКФ категорії G3в–G5) з метою визначення базових значень і внесення до прогностичних рівнянь, якщо ті використовуються. (1C)
3.3.2. Ми пропонуємо не проводити рутинно тестування мінеральної щільності кісткової тканини у пацієнтів із ШКФ < 45 мл/хв/1,73 м2 (ШКФ категорії G3в–G5), тому що отримана інформація може вводити в оману або бути марною. (2B)
3.3.3. У людей із ШКФ < 45 мл/хв/1,73 м2 (ШКФ категорії G3в–G5) ми пропонуємо підтримувати сироваткову концентрацію фосфату в межах норми у відповідності до референтних значень місцевої лабораторії. (2C)
3.3.4. У людей із ШКФ < 45 мл/хв/1,73 м2 (ШКФ категорії G3в–G5) оптимальний рівень ПТГ не відомий. Ми пропонуємо у людей із рівнями інтактного ПТГ понад верхню межу норми спочатку оцінювати наявність гіперфосфатемії, гіпокальціємії і дефіциту вітаміну D. (2C)
Доповнення вітаміном D і бісфосфонатами у пацієнтів із ХХН
3.3.5. Ми пропонуємо не призначати рутинно вітамін D або його аналоги за відсутності підозрюваного чи документально підтвердженого його дефіциту для стримування підвищеної концентрації ПТГ у пацієнтів із ХХН, які не отримують діаліз. (2B)
3.3.6. Ми пропонуємо не призначати лікування бісфосфонатами у людей із ШКФ < 30 мл/хв/1,73 м2 (ШКФ категорії G4–G5) без переконливого клінічного обґрунтування. (2B)
3.4. Ацидоз
3.4.1. Ми пропонуємо для людей із ХХН і сироватковою концентрацією бікарбонату < 22 ммоль/л проводити лікування пероральними добавками бікарбонату для підтримання його концентрації у сироватці в межах норми, якщо немає протипоказань. (2B)
Частина 4. Інші ускладнення ХХН: серцево-судинні захворювання, дозування препарату, безпека пацієнта, інфекції, госпіталізації і застереження про ускладнення при проведенні досліджень
4.1. ХХН і серцево-судинні захворювання
4.1.1. Ми рекомендуємо вважати всіх людей із ХХН такими, які мають підвищений ризик серцево-судинних захворювань. (1А)
4.1.2. Ми рекомендуємо, щоб рівень медичної допомоги при ішемічній хворобі серця, запропонований людям із ХХН, не обмежувався лише ХХН. (1А)
4.1.3. Ми вважаємо, що дорослим із ХХН, в яких є ризик атеросклеротичних ускладнень, має бути запропоновано лікування антиагрегантами, окрім випадків, коли наявний підвищений ризик кровотечі, що потребує балансування з можливими перевагами для серцево-судинної системи. (2B)
4.1.4. Ми вважаємо, що рівень медичної допомоги при серцевій недостатності, що пропонується людям із ХХН, повинен бути таким же, як пропонується для тих, хто не має ХХН. (2А)
4.1.5. У людей із ХНН і серцевою недостатністю будь-яка ескалація терапії і/або клінічне погіршення повинно спонукати до моніторингу ШКФ і концентрації сироваткового калію. (Не оцінюється.)
4.2. Застереження при інтерпретації тестів для серцево-судинних захворювань у людей із ХХН BNP/N-terminal-proBNP (NT-proBNP)
4.2.1. У людей із ШКФ < 60 мл/хв/1,73 м2 (ШКФ категорії G3a–G5) ми рекомендуємо інтерпретувати сироваткову концентрацію BNP/N-terminal-proBNP (NT-proBNP) з обережністю і у зв’язку з ШКФ, беручи до уваги діагноз серцевої недостатності та волемічний статус. (1B)
Тропоніни
4.2.2. У людей із ШКФ < 60 мл/хв/1,73 м2 (ШКФ категорії G3a–G5) ми рекомендуємо інтерпретувати сироваткову концентрацію тропоніну з обережністю при діагностиці гострого коронарного синдрому. (1B)
Неінвазивне тестування
4.2.3. Ми рекомендуємо людям із ХХН, які мають загрудинний біль, перевірятись на наявність серцевих захворювань та інших порушень відповідно до прийнятої місцевої практики, як і людям без ХХН (і подальше лікування повинно бути також аналогічно призначено). (1B)
4.2.4. Ми вважаємо, що лікарі знайомі з обмеженнями неінвазивних серцевих тестів (наприклад, електрокардіографія при фізичному навантаженні (ЕКГ), променева візуалізація, ехокардіографія та ін.) у дорослих пацієнтів із ХХН та належним чином інтерпретують такі результати. (2B)
4.3. ХНН і захворювання периферичних артерій
4.3.1. Ми рекомендуємо, щоб дорослі з ХХН регулярно перевірялись на наявність ознак захворювання периферичних артерій і вважались готовими для належних підходів до терапії. (1B)
4.3.2. Ми вважаємо, що дорослим із ХХН і цукровим діабетом слід пропонувати регулярну допомогу з догляду за стопами. (2А)
4.4. Медикаментозна підтримка та безпека пацієнтів із ХХН
4.4.1. Ми рекомендуємо тим, хто призначає ліки, брати до уваги рівень ШКФ при розрахунку дози препарату. (1А)
4.4.2. У випадках, коли потрібна точність дозування (у зв’язку з вузьким терапевтичним або токсичним діапазоном) і/або оцінка може бути недостатньо надійною (наприклад, при низькій м’язовий масі), ми рекомендуємо методи, засновані на визначенні цистатину C або прямого вимірювання ШКФ. (1C)
4.4.3. Ми рекомендуємо тимчасове припинення потенційно нефротоксичних та тих, що виводяться нирками, препаратів у людей із ШКФ < 60 мл/хв/1,73 м2 (ШКФ категорії G3a–G5), які мають серйозні інтеркурентні захворювання, що збільшують ризик ГУН. Ці засоби включають, але не обмежуються: блокатори РААС (у тому числі ІАПФ, блокатори рецепторів до ангіотензину II, інгібітори альдостерону, прямі інгібітори реніну), діуретики, НПВС, метформін, літій та дигоксин. (1C)
4.4.4. Ми рекомендуємо, щоб дорослі з ХХН зверталися до лікаря або фармацевта за порадою, перш ніж використовувати безрецептурні ліки або харчові білкові добавки. (1B)
4.4.5. Ми рекомендуємо не використовувати рослинні лікарські засоби у людей із ХХН. (1B)
4.4.6. Ми рекомендуємо продовження застосування метформіну у людей із ШКФ і 45 мл/хв/1,73 м2 (ШКФ категорії G1–G3a); його використання має бути переглянуте у разі ШКФ 30–44 мл/хв/1,73 м2 (ШКФ категорії G3b) і повинно бути припинено у людей із ШКФ < 30 мл/хв/1,73 м2 (ШКФ категорії G4–G5). (1C)
4.4.7. Ми рекомендуємо у людей, які приймають потенційно нефротоксичні агенти, такі як літій та інгібітори кальциневрину, регулярно контролювати ШКФ, концентрацію електролітів та рівень препарату. (1А)
4.4.8. Людям із ХХН не повинно бути відмовлено у терапії інших захворювань, таких як рак, але повинно бути відповідне коригування дози цитостатиків у відповідності до поінформованості щодо ШКФ. (Не оцінюється.)
4.5. Візуальні методи дослідження
4.5.1. Треба тримати баланс ризику між розвитком гострого порушення функції нирок від використання радіоконтрастного агента та діагностичною цінністю і терапевтичним значенням дослідження. (Не оцінюється.)
Радіоконтраст
4.5.2. Ми рекомендуємо всім людям із ШКФ < 60 мл/хв/1,73 м2 (ШКФ категорії G3a–G5), які підлягають дослідженню із застосуванням внутрішньосудинного введення йодовмісних рентгеноконтрастних засобів, керуватись відповідними настановами для клінічної практики KDIGO для ГУН, у тому числі:
— уникнення високоосмотичних агентів (1В);
— використовуйте мінімально можливу дозу радіоконтрасту (не оцінюється);
— відмова від потенційно нефротоксичних агентів до і після процедури (1С);
— адекватна гідратація фізіологічним розчином до, під час і після процедури (1А);
— вимірювання ШКФ протягом 48–96 годин після процедури (1С).
Контрастні засоби на основі гадолінію
4.5.3. Ми рекомендуємо не використовувати гадолінійвмісних контрастних засобів у людей із ШКФ < 15 мл/хв/1,73 м2 (ШКФ категорії G5), окрім випадків, коли йому немає альтернативи. (1B)
4.5.4. Ми припускаємо, що люди з ШКФ < 30 мл/хв/1,73 м2 (ШКФ категорії G4–G5), які вимагають застосування гадолінійконтрастної речовини, переважно потребують підготовки з призначенням макроциклічних хелатів. (2B)
Підготовка кишечника
4.5.5. Ми рекомендуємо не використовувати пероральні кишкові фосфатумісні препарати людям із ШКФ < 60 мл/хв/1,73 м2 (ШКФ категорії G3a–G5) або тим, у кого відомо про ризик фосфатної нефропатії. (1А)
4.6. ХХН і ризики інфекцій, ГУН, госпіталізацій і смертності
ХХН і ризик інфекцій
4.6.1. Ми рекомендуємо, щоб усім дорослим із ХХН пропонувалась щорічна вакцинація проти грипу вакциною, якщо не має протипоказань. (1B)
4.6.2. Ми рекомендуємо усім дорослим із ШКФ < 30 мл/хв/1,73 м2 (ШКФ категорії G4–G5) і особам із високим ризиком пневмококової інфекції (наприклад, нефротичний синдром, діабет, або ті, хто отримує імуносупресію) отримувати вакцинацію полівалентною пневмококовою вакциною за відсутності протипоказань. (1B)
4.6.3. Ми рекомендуємо усім дорослим із ХХН, які отримали пневмококову вакцинацію, пропонувати ревакцинацію протягом 5 років. (1B)
4.6.4. Ми рекомендуємо усім дорослим, які мають високий ризик прогресування ХХН і ШКФ < 30 мл/хв/1,73 м2 (ШКФ категорії G4–G5) вакцинацію проти гепатиту В із підтвердженням наявної відповіді відповідним серологічним тестуванням. (1B)
4.6.5. Міркування щодо застосування живої вакцини повинні включати оцінку імунного статусу пацієнта і відповідати рекомендаціям офіційних або державних органів. (Не оцінюється.)
4.6.6. Дитячі календарі щеплень повинні відповідати офіційним міжнародним і регіональним рекомендаціям для дітей із ХХН. (Не оцінюється)
ХХН і ризик ГУН
4.6.7. Ми рекомендуємо всіх людей із ХХН вважати тими, які мають підвищений ризик ГУН. (1А)
4.6.7.1. Люди з ХХН повинні дотримуватись рекомендацій, що докладно описані в настановах KDIGO з ГУН, для контролю ризику ГУН під час супутніх захворювань або при проходженні досліджень і процедур, що можуть збільшити ризик ГУН. (Не оцінюється.)
ХХН і ризик госпіталізації та смертності
4.6.8. Програми боротьби з ХХН повинні бути розроблені з метою оптимізації громадського управління і зниження ризику госпіталізації для людей із ХХН. (Не оцінюється.)
4.6.9. Заходи зі скорочення госпіталізації і смертності для людей із ХХН повинні звернути пильну увагу на контроль асоційованих супутніх захворювань та серцево-судинних захворювань зокрема. (Не оцінюється.)
Частина 5. Направлення до фахівців і моделі допомоги
5.1. Направлення у спеціалізовані служби
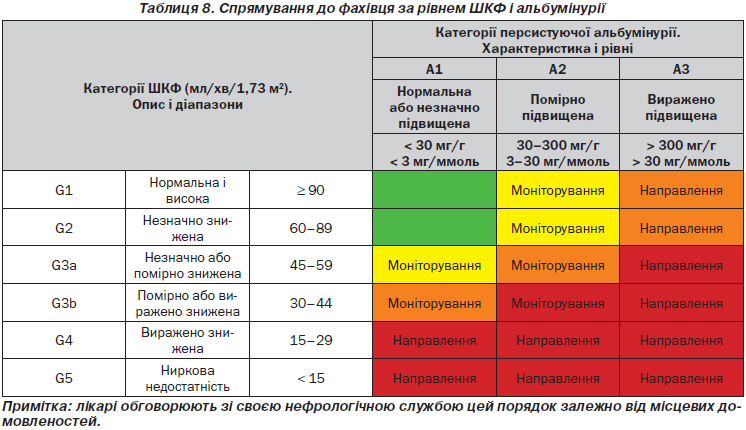
5.1.1. Ми рекомендуємо звертатись до фахівців (нефрологів), які надають допомогу людям із ХХН, у таких випадках (1B):
— ГУН або різке стійке зниження ШКФ;
— ШКФ < 30 мл/хв/1,73 м2 (категорії G4–G5 за ШКФ);
— наявність стійкої значної альбумінурії (СAК і 300 мг/г (і 30 мг/ммоль) або РЕА і 300 мг/24 години, що приблизно еквівалентне СБК і 500 мг/г (і 50 мг/ммоль) або і 500 мг/24 години);
— прогресування ХХН (див. рекомендацію 2.1.3 для визначення);
— еритроцитарні циліндри сечі, еритроцити понад 20 у полі зору великого збільшення, що не має пояснення;
— ХХН і гіпертензія, рефрактерна до лікування 4 і більше антигіпертензивними препаратами;
— стійкі порушення рівня калію в сироватці крові;
— рецидивуюча або прогресуюча сечокам’яна хвороба;
— спадкові захворювання нирок.
5.1.2. Ми рекомендуємо своєчасне направлення для планування замісної ниркової терапії (ЗНТ) людей із прогресуючою ХХН, в яких ризик ниркової недостатності протягом 1-го року становить 10–20 % або вище, що визначається за допомогою підтвердженого ризику прогностичними засобами. (1B)
Примітка: метою є уникнення пізнього звернення, що визначається як направлення до фахівця менше ніж за 1 рік до початку НЗТ (табл. 8).
5.2. Догляд за пацієнтом із прогресуючою ХХН
5.2.1. Ми вважаємо, що люди з прогресуючою ХХН повинні отримувати багатопрофільну медичну допомогу. (2B)
5.2.2. Мультидисциплінарна (багатопрофільна) команда повинна включати в себе або мати доступ до дієтичного консультування, навчання та консультування щодо різних форм НЗТ, варіантів трансплантації, хірургічного судинного доступу, а також етичну, психологічну та соціальну допомогу. (Не оцінюється.)
5.3. Час початку НЗТ
5.3.1. Ми вважаємо, що діаліз слід розпочинати за наявності одного або декількох із таких ознак: симптоми та ознаки, пов’язані з нирковою недостатністю (серозит, порушення кислотно-лужного балансу або електролітні порушення, свербіж); нездатність контролювати волемічний статус або артеріальний тиск; прогресуюче погіршення нутритивного статусу, рефрактерного до дієтичних втручань, або когнітивні порушення. Це часто, але не завжди, відбувається в діапазоні ШКФ між 5 і 10 мл/хв/1,73 м2. (2B)
5.3.2. Ниркова трансплантація від живого донора у дорослих повинна розглядатися при ШКФ < 20 мл/хв/1,73 м2 за наявності доказів прогресивної і незворотної ХХН за попередні 6–12 місяців. (Не оцінюється.)
5.4. Структура і процес всебічного консервативного лікування
5.4.1. Консервативний менеджмент повинен бути опцією у людей, які вирішили не проводити НЗТ, і це повинно бути підтримано комплексною програмою контролю (ХХН). (Не оцінюється.)
5.4.2. Всі програми з ХХН і відповідні працівники повинні бути в змозі забезпечити завчасне планування допомоги людям із визнаною необхідністю догляду до кінця життя, у тому числі людям, які отримують консервативне лікування нирок. (Не оцінюється.)
5.4.3. Скоординована медична допомога до кінця життя повинна бути доступна для людей і сімей або через первинну медичну допомогу, або спеціалізовану медичну допомогу, залежно від місцевих обставин. (Не оцінюється.)
5.4.4. Комплексна консервативна програма контролю (ХХН) повинна включати протоколи симптоматичної і антиангіальної допомоги, психологічну допомогу, духовну допомогу і культурні особливості догляду за вмираючим пацієнтом та допомоги його сім’ї (вдома, в хоспісі або лікарні), з подальшим наданням культурально належної підтримки у зв’язку з тяжкою втратою. (Не оцінюється.)
Переклад настанови здійснено групою фахівців у складі:
Іванов Д.Д., Пиріг Л.А., Іванова М.Д.