Журнал «Внутренняя медицина» 4(4) 2007
Вернуться к номеру
Анемія при хронічних захворюваннях нирок. Перспективи лікування
Авторы: C.М. Крутіков, д.м.н., професор, Є.С. Крутіков, к.м.н., В.О. Цвєтков Кафедра пропедевтики внутрішньої медицини, Кримський державний медичний університет ім. С.І. Георгієвського, м. Сімферополь
Рубрики: Нефрология
Разделы: Справочник специалиста
Версия для печати
Дана стаття присвячена актуальній проблемі сучасної нефрології — анемії при хронічних захворюваннях нирок. У роботі проаналізовані основні патогенетичні механізми розвитку анемічного синдрому у хворих з патологією нирок. На сьогодні основними з них визнані порушення продукції еритропоетина нирками та зміна еритропоезу. Сучасні погляди на проблему дозволяють розглядати уремічні токсини і порушення обміну заліза як суттєві фактори патогенезу анемії. Та все ж, незважаючи на всі існуючі на сьогодні дані, патогенез нефрогенної анемії достатньо складний і до кінця не вивчений. Лікування анемічного синдрому у пацієнтів з хронічними захворюваннями нирок також є складним завданням. У статті розглянуті основні напрямки лікування анемії, провідне місце серед них належить замісній терапії рекомбінантним людським еритропоетином. Однак, незважаючи на переваги еритропоетинтерапії, продовжується розробка нових методів та заходів лікування нефрогенної анемії.
хронічні захворювання нирок, анемія, лікування.
Взаємозв'язок анемії із захворюваннями нирок був описаний багатьма науковцями та клініцистами [6, 8, 15]. На те, що при хронічних захворюваннях нирок (ХЗН) частіше за все відбувається зміна еритроцитарного складу крові, вперше звернув увагу ще Christison у 1841 р. У наш час достатньо добре вивчена роль нирок в забезпеченні багатьох процесів, порушення яких в умовах патології, що розвивається, може призвести до розвитку анемії [15, 21]. Накопичені експериментальні та клінічні дані вказують на багатофакторність причин, що призводять до анемії при захворюваннях нирок. На сьогодні патогенез анемії при ХЗН можна представити таким чином (рис. 1).
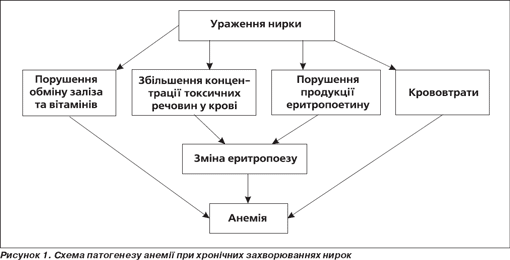
Підсумком численних досліджень, що проводилися у другій половині ХХ сторіччя, є створення еритропоетиндефіцитної теорії патогенезу нефрогенної анемії [8, 17, 21]. Так, на думку багатьох авторів, запальний процес, що супроводжується фіброзом і склерозом тканин нирок, призводить до такого зменшення популяції еритропоетинпродукуючих клітин, що синтез гормону не може підтримуватися у межах припустимих значень [4, 6, 15]. Ця теорія підкріплюється затвердженим постулатом про провідну роль еритропоетина в регуляції темпу проліферації та диференціювання стовбурових та еритроїдних попередників.
Однак слід зазначити, що дослідження механізмів розвитку анемії у пацієнтів із захворюваннями нирок продовжуються і в наш час. За результатами досліджень цілого ряду авторів встановлено, що в патогенезі нефрогенної анемії відіграють роль також інші фактори, такі як, наприклад, порушення кістковомозкового кровотворення [6, 13]. Дані, отримані С.І. Рябовим і Г.Д. Шосткою (1998), свідчать, що у хворих із патологією нирок на фоні гіперплазії кісткового мозку має місце так званий неефективний еритропоез. Під неефективним еритропоезом мається на увазі та частина еритроїдних попередників, що руйнується в межах кісткового мозку під час дозрівання клітин. Внутрішньокістковомозковий гемоліз при патології нирок частково обумовлений присутністю в крові уремічних токсинів, що негативно впливають на клітини. Доведено, що уремічні токсини неспецифічно інгібують проліферацію та диференціювання еритроїдних попередників, а також знижують синтез гему в ядровміщуючих еритроїдних клітинах, утилізацію заліза.
Уремічні токсини, що у великій кількості накопичуються в організмі пацієнтів із ХЗН, можуть у свою чергу інгібувати продукцію еритропоетина, знижуючи його імунологічну та біологічну активність. Інгібіторами еритропоетина, що передбачаються, виступають паратиреоїдний гормон, спермін, рибонуклеаза, деякі цитокіни та інші речовини.
При захворюваннях нирок завжди порушується метаболізм заліза. Існує думка про розвиток у хворих із патологією нирок сидеропенії, обумовленої крововтратами, однак є також дані про наявність у нефрологічних хворих і гемосидерозу. Імовірно, це пов'язано зі зниженням екскреції заліза нирками в умовах розвитку захворювання. Разом з тим дослідження останніх років показали, що з розвитком уремії відмічено значне пригнічення поглинання заліза клітинами слизової кишечника [6]. Зі зростанням уремії в організмі хворих порушується і метаболізм вітамінів (фолієвої та аскорбінової кислот, вітаміну В12), із наступним розвитком їхнього дефіциту.
Для хворих, які страждають від ХЗН, характерні також підвищені крововтрати. Вивченню причин кровотеч у даній категорії пацієнтів присвячена велика кількість досліджень. Підсумовуючи їх, багато авторів указують на дефекти капілярів, плазмових коагулюючих факторів і пластинок. Вважається, що ступінь зниження проникності судин здебільшого залежить від природи основного захворювання (ураження судинної стінки при гломерулонефриті, нефросклерозі), а не від тяжкості уремії [8, 17, 18].
Отже, у пацієнтів із ХЗН можуть спостерігатися різноманітні порушення, кожне з яких самостійно або в сполученні з іншими змінами може призвести до розвитку анемії.
Лікування нефрогенної анемії завжди було важким завданням. Використання стимуляторів еритропоезу для лікування нефрогенного недокрів'я практикується вже багато років. Спочатку як стимулятор еритропоезу застосовувалися андрогени [6], позитивний ефект терапії проявлявся після 4–6 тижнів від початку внутрішньом'язового введення препарату. Ефект проводимої терапії, як правило, нестійкий, і найчастіше був потрібний повторний курс лікування вже через декілька місяців. На жаль, лікування андрогенами пов'язане з побічними реакціями, типовими для тривалої і масивної терапії цими препаратами. Припинення менструального циклу, рясні вугроподібні висипання, прогресування нападів стенокардії у хворих з ішемічною хворобою серця, токсичний вплив на печінку є приводом для відмови від терапії андрогенами. Лікування анемії андрогенами протипоказане за наявності у хворих неконтрольованої гіпертензії, схильності до тромбозів, гострих запальних та інфекційних захворювань, злоякісних новоутворень.
Використання рекомбінантного людського еритропоетина (рлЕПО) для лікування анемії відкрило нову еру в терапії хворих з патологією нирок [1]. На сьогодні замісна еритропоетинтерапія є найефективнішою і належить до стандартів лікування хворих на ХЗН, які мають анемію [4, 9, 20]. Еритропоетин не дає побічних реакцій, так часто і сильно виражених при введенні андрогенів. Крім того, парентеральне введення добре очищеного та позбавленого побічних реакцій препарату не тільки стимулює проліферацію нормобластів, але й знижує неефективну еритроїдну продукцію [1, 3]. Крім того, еритропоетин позитивно впливає на перебіг ішемічної хвороби серця у хворих (знижуючи кількість нападів стенокардії) і підвищує толерантність до фізичних навантажень. При цьому він може зменшувати гіпертрофію лівого шлуночка, покращуючи кардіоваскулярний прогноз [9, 10]. Наявність хронічного вірусного гепатиту не є протипоказанням до лікування еритропоетином. Пацієнти з ХЗН, у яких концентрація гемоглобіну < 100 г/л мають розглядатися як кандидати для проведення еритропоетинтерапії. Призначення препаратів рлЕПО контролюється показниками гематокриту. На сьогодні цільовий гематокрит, що рекомендується, складає 35–36 %. Розроблені різні способи лікування анемії з використанням рлЕПО. Це внутрішньовенний спосіб введення препарату, внутрішньом'язовий, підшкірний і навіть внутрішньоочеревинний. При цьому в багатьох клініках перевага віддається підшкірному призначенню еритропоетина як більш економічному та безпечному, оскільки внутрішньовенна терапія може потребувати на 30–50 % більшої кількості рлЕПО [4, 8, 12].
При еритропоетинтерапії можуть бути такі ускладнення: артеріальна гіпертензія (погіршення чи її поява de novo), збільшене тромбоутворення, біль у кістках, алергічні реакції, ейфорія та психоемоційне збудження [3, 21]. До ускладнень при тривалому застосуванні препаратів еритропоетину можна також віднести дефіцит заліза та грипоподібний (flu like) синдром. Слід нагадати і про болючість підшкірних ін'єкцій. При розвитку ускладнень необхідно знижувати дозу або відміняти препарат [16]. Крім того, суттєвим недоліком еритропоетинтерапії є висока ціна препарату. Ще далеко не кожний пацієнт у нашій країні, який страждає від ХЗН, ускладненого анемічним синдромом, може дозволити собі повний курс рлЕПО, а тим більше повторити його у разі необхідності. У результаті пацієнт отримує або недостатню (мінімальну) дозу препарату або курс лікування не в повному обсязі. Отже, виникає необхідність пошуку нових рішень даної проблеми.
Дослідження останніх років показали, що деякі фактори можуть підвищувати ефективність терапії рлЕПО [17]. Інакше кажучи, при використанні деяких речовин, синергічно діючих з еритропоетином, можливо ефективно використовувати останній у мінімальній кількості. Такими факторами є: андрогени, інтерлейкін-3, карнітин, вітамін Е, фізичне навантаження і високоефективний діаліз [7, 11, 19]. Це дуже важливо, враховуючи високу вартість препарату рлЕПО. Нещодавно була доведена ефективність використання сполуки еритропоетина з вітаміном D3 (кальцитріолом) у хворих з анемією ниркового походження [11]. Така комбінація теоретично обгрунтована, оскільки у хворих з ХЗН одночасно з анемією з'являється дефіцит активних метаболітів вітаміну D3 (кальцитріола). Причому вираженість дефіциту кальцитріолу й тяжкість відповідних гормональних порушень (остеодистрофії, міопатії) прогресують із розвитком хронічної ниркової недостатності. Доведено, що у пацієнтів, які отримують комбіновану терапію рлЕПО—кальцитріол, цільове гематокритне число було досягнуте в середньому на 5 тижнів раніше, ніж у контрольній групі, що отримувала тільки рлЕПО.
На наш погляд, особливий інтерес викликає комбінація еритропоетина та гормону щитоподібної залози — тироксину. Дана комбінація також може бути обгрунтована багатьма факторами. Так, у літературі є дані про вплив гормонів щитоподібної залози на ріст і диференціювання клітин крові, у тому числі й еритроцитів (за допомогою збільшення синтезу ядерних і мітохондріальних білків, підвищення активності багатьох ферментів) [2]. До того ж деякі автори також відзначають пригнічення еритропоезу при дефіциті тиреоїдних гормонів, пов'язуючи це з порушенням метаболічної активності і споживанням О2 [14]. У попередніх експериментальних і клінічних дослідженнях нами отримані дані, що свідчать про позитивний вплив тироксину на функціональний стан еритроцитів при ХЗН. Було доведено, що на фоні прийому тироксину в мембранах еритроцитів вірогідно знижуються процеси перекісного окислення ліпідів, нормалізуються обмінні процеси всередині клітин, що призводить до підвищення резистентності еритроцитів до різних агресивних факторів [5]. Також відомо, що з патологією нирок у хворих розвивається гіпоплазія та недостатність функції щитоподібної залози [5, 6]. Отже, існують передумови для успішного використання комбінації цих двох препаратів у лікуванні анемії при ХЗН. На наш погляд, комбіноване використання еритропоетина дозволить впливати одразу на декілька різних ланок патогенезу анемії, тим самим підвищуючи ефективність терапії.
Узагальнюючи вищенаведене, слід зазначити, що на сьогодні патогенез нефрогенної анемії не є повністю розкритим і потребує продовження досліджень. При цьому, незважаючи на значний прогрес у терапії цього ускладнення, завдяки еритропоетину актуальними залишаються питання оптимізації лікування.
1. Алексеева Т.Б., Николаев А.Ю., Дасаева Л.А. Препараты эритропоэтина у больных с хронической почечной недостаточностью в стадии консервативного лечения. Эффективность и побочные явления // Тер. архив. — 2000. — Т. 72, № 6. — С. 58-60.
2. Белецкая О.М. Патогенез и перспективы лечения синдрома низкого трийодтиронина при нетиреоидных заболеваниях: Научный обзор. — Харьков, 1992. — 84 с.
3. Зак К.П. Особливості біологічної та лікувальної дії різних лізоформ рекомбінантних препаратів еритропоетину // Ліки України. — 2004. — № 12. — С. 91-92.
4. Іванов Д., Кушніренко С., Іванова Т. Еритропоетиндефіцитна анемія та її медикаментозна корекція // Ліки України. — 2003. — № 4. — С. 11-12.
5. Крутиков Е.С. Клиническая оценка различных методов диагностики и лечения хронического гломерулонефрита (клинико-экспериментальное исследование): Автореф. дис... канд. мед. наук: 14.01.02. — Симферополь, 2001. — 16 с.
6. Лечение хронической почечной недостаточности / Под ред. С.И. Рябова. — СПб., 1997. — 448 с.
7. Морщакова Е.Ф., Узбекова Д.Г., Павлов А.Д. Механизмы гормональных влияний на эритропоэз и продукцию эритропоэтина в почках: Мат-лы V Закавказской конф. патофизиологов. — Баку, 1982. — С. 306-308.
8. Николаев А.Ю., Милованов Ю.С. Лечение почечной недостаточности. — М.: МИА, 1999. — 363 с.
9. Милованова Л.Ю., Николаев А.Ю., Козлова Т.А., и др. Прогностическое значение ранней коррекции анемии у больных хронической почечной недостаточностью // Нефрол. и диал. — 2004. — Т. 6, № 1. — С. 54-57.
10. Волгина Г.В., Перепеченных Ю.В., Бикбов Б.Т. и др. Факторы риска кардиоваскулярных заболеваний у больных с хронической почечной недостаточностью // Нефрол. и диал. — 2000. — Т. 2, № 4. — С. 252-259.
11. Николаев А.Ю., Клепиков П.В., Лашутин С.В., Кухтевич А.В. Эффективность сочетания эритропоэтин — кальцитриол у больных с хронической почечной недостаточностью, находящихся на программном гемодиализе // Тер. архив. — 1995. — № 6. — С. 27-31.
12. Cody J., Daly C., Campbell M. et al. Recombinant human erythropoietin for chronic renal failure anemia in pre-dialysis patients (Cochran Review). // Cochran Library. — Issue 3. — Oxford: Update Software, 2003.
13. Donnelly S. Why erythropoietin made in the kidney? A commentary // Dialysis and Transplantation. — 2002. — Vol. 31, № 11. — P. 751-759.
14. Fandrey J., Pagel H., Frede S. et al. Thyroid hormones enhance hypoxia-induced erythropoietin production in vitro // Exp. Hematol. — 1994. — Vol. 22. — P. 272-277.
15. Hsu C.Y., McCulloch C.E., Curhan G.C. et al. Epidemiology of anemia associated with chronic renal insufficiency among adults in the United States: results from the Third National Health and Nutrition Examination Survey // J. Am. Soc. Nephrol. — 2002. — 13. — 504-510.
16. Locatelli F. et al. Treatment of anemia in dialysis patients with unit dosing of darbepoetin alfa at a reduced dose frequency relative to recombinant human erythropoietin // Nephrol. Dial. Transplant. — 2002. — Vol. 18, № 2. — P. 362-369.
17. Mc d ougall J.C. Novel strategies for erythropoietic stimulation // Ann. Hematol. — 2001. — Vol. 79 (Suppl. 3). — P. B13.
18. Revised European Best Practice Guidelines for the Management of anemia in Patients with Chronic Renal Failure // Nephrol. Dial. Transplant. — 2004. — 19 (Suppl. 2). — 1112-1145.
19. Usberti M., Gerardi G., Bufano G. et al. Effects of erythropoietin and vitamin E — modified membrane on plasma oxidative stress markers and anemia of hemodialysed patients // Am. Jorn. Kidney Dis. — 2002. — № 40. — P. 590-599.
20. Weiss G., Clyne N., Fihlho J.D. et al. The efficacy of one weekly compared with two or three times weekly subcutaneous epoetin beta: results from a randomized controlled multicenter trial // Nephrol. Dial. t ransplant. — 2000. — 15. — 2014-19.
21. Weiss G., Goodnough L.T. Anemia of Chronic Disease // N. Engl. J. Med. — 2005. — 352. — 1011-23.
