Международный неврологический журнал 4(4) 2005
Вернуться к номеру
Эффекты винпоцетина (Кавинтона®) на перераспределение церебрального кровотока и метаболизма глюкозы у больных с хроническими нарушениями мозгового кровообращения – данные позитрон-эмиссионной томографии
Авторы: Geza Szilagyi, Zoltan Nagy, Национальный центр нарушений мозгового кровообращения, Отдел сосудистой неврологии, Университет Земмельвейса, Будапешт, Венгрия; Laszlo Balkay, Istvan Boros, Miklos Emri, Szabolcs Lehel, Terez Marian, Tamas Molnar, Szabolcs Szakall, Lajos Tron, Центр позитрон-эмиссионной томографии, Медицинский факультет Дебреценского университета, Дебрецен, Венгрия; Daniel Bereczki, Laszlo Csiba, Istvan Fekete, Levente Kerenyi, Департамент неврологии, Медицинский факультет Дебреценского университета, Дебрецен, Венгрия; Laszlo Galuska, Jozsef Varga, Центральная лаборатория ядерной медицины, Медицинский факультет Дебреценского университета, Дебрецен, Венгрия; Peter Bonoczk, Adam Vas, Гедеон Рихтер Кемикал Воркс Лимитед (Gedeon Richter Chemical Works Ltd.), Будапешт, Венгрия; Balazs Gulyas, Департамент неврологических исследований. Департамент клинических неврологических исследований (Секция психиатрии). Каролинска институт, Стокгольм, Швеция
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
Фармакологические эффекты лекарственного препарата нейропротекторного действия винпоцетина (Кавинтона®) в отношении церебрального кровотока и метаболизма глюкозы при внутривенном введении в ходе 14-суточного режима терапии изучались у больных с хроническими нарушениями мозгового кровообращения (n=13) методом позитрон-эмиссионной томографии (ПЭТ) в рамках двойного слепого дизайна. Показатели региональной и общей интенсивности церебрального метаболизма глюкозы (ИЦМglc), церебрального кровотока (ЦК), наряду с витальными физиологическими параметрами, показателями шкал клинической эффективности и транскраниальной допплерографии определяли до и после периода лечения посредством ежедневных внутривенных инфузий раствора винпоцетина (Кавинтона®) или плацебо. Притом что общемозговые показатели ИЦМglc в результате инфузионной терапии с использованием винпоцетина (Кавинтона®) (n=6) или без него (n=7) существенно не изменялись, со стороны общего ЦК, а также региональных ЦК и ИЦМglc наблюдалось заметное усиление в ряде мозговых структур в обоих случаях с более выраженными эффектами на фоне применения винпоцетина (Кавинтона®). В последнем варианте наибольшие изменения ЦК регистрировались в структурах головного мозга с максимальным (по данным прочих исследований методом ПЭТ) региональным накоплением меченого винпоцетина (Кавинтона®) (таламус и хвостатое ядро – рост на 36 и 37% соответственно). Согласно полученным результатам, внутривенное введение винпоцетина (Кавинтона®) на протяжении 14 суток способно эффективно влиять на перераспределение ЦК у больных хроническими нарушениями мозгового кровообращения. При этом эффекты наиболее выражены в участках головного мозга с максимальным накоплением препарата.
винпоцетин (Кавинтон®), позитрон-эмиссионная томография, церебральный кровоток, церебральный метаболизм глюкозы, нарушение мозгового кровообращения.
1. Введение
На протяжении последних десятилетий многочисленными исследованиями было доказано, что винпоцетин (Кавинтон®) (этилаповинкаминат — синтетическое соединение, родственное алкалоиду винкамину из растения Vinca minor) является высокоэффективным нейропротекторным средством [1-4]. Агент обладает достоверно документированным действием на церебральный метаболизм глюкозы и кровоток [5-13]. Препарат характеризуется также хорошо известными сосудистыми и реологическими эффектами, в том числе снижением величины церебрального сосудистого сопротивления, а также позитивными изменениями способности деформироваться эритроцитов и агрегантных свойств тромбоцитов [14-18]. Винпоцетин (Кавинтон®) является широко применяемым в неврологической практике препаратом, в особенности – при цереброваскулярной патологии, включая хронические ишемические нарушения мозгового кровообращения [19, 20]. В то же время, несмотря на большой объем накопленных клинических данных в отношении нейропротекторного эффекта и терапевтической эффективности препарата, основные фармакологические и физиологические механизмы его действия продолжают оставаться подробно не изученными.
В предшествующем исследовании методом позитрон-эмиссионной томографии (ПЭТ) с использованием [11С]-меченого винпоцетина (Кавинтона®) [21] нами было показано, что винпоцетин (Кавинтон®) свободно проникает через гематоэнцефалический барьер и гетерогенно распределяется в различных участках головного мозга, что указывает на специфичность связывания агента с определенными церебральными структурами. Наибольший региональный уровень накопления регистрировался в таламусе, а также базальных ганглиях и участках коры больших полушарий. Распределение [11С]-винпоцетина (Кавинтона®) в головном мозге было идентичным, независимо от парентерального (внутривенного) или перорального пути введения препарата [22, 23]. При этом церебральное распределение было показательно отличным от такового для [11С]-этанола, образующегося в результате энтеролиза молекулы винпоцетина (Кавинтона®) [24]. Результаты исследований у человека in vivo подтверждались данными постмортальных авторадиографических измерений в ткани головного мозга пациентов [25].
Предшествующее исследование методом ПЭТ у больных хроническими нарушениями мозгового кровообращения показало, что винпоцетин (Кавинтон®) при однократном внутривенном введении обусловливал региональное увеличение интенсивности метаболизма глюкозы в ткани головного мозга здоровых лиц. Данный эффект, как было показано, имеет место в связи с изменением кинетических констант для процессов поступления и высвобождения глюкозы, а не вследствие прямого воздействия на метаболизм моносахарида исходя из величины гексокиназной активности [26, 27]. При этом осталось неизвестным, в какой мере длительный режим терапии, что типично в клинической практике, оказывает влияние на состояние церебрального кровообращения и метаболизма, а также насколько параллельно в таких условиях происходят и коррелируют друг с другом изменения показателей обмена глюкозы и кровотока в головном мозге.
Главной задачей настоящего исследования было изучить среди типичной «целевой» клинической группы терапии винпоцетином (Кавинтоном®) – больных с хроническими нарушениями мозгового кровообращения, вызывает ли лечение путем внутривенного введения винпоцетина (Кавинтона®) на протяжении 2 недель изменение общемозгового и регионального кровотока наряду с интенсивностью метаболизма глюкозы, а если да, то способны ли такие изменения обусловливать клинические эффекты препарата.
2. Материалы и методы
2.1. Субъекты исследования
В настоящем исследовании принимало участие 15 пациентов, страдающих ишемическими нарушениями мозгового кровообращения. Исследования проводились на базе Департамента неврологии, Центральной лаборатории ядерной медицины и Центра позитрон-эмиссионной томографии Медицинского факультета Дебреценского университета. Завершающий этап обработки и анализа результатов нейровизуализации осуществлялся сотрудниками Департамента неврологических исследований и Секции психиатрии Департамента клинических неврологических исследований, Каролинска института. Участвовавшие пациенты (11 мужчин и 4 женщины; средний возраст 59,7 ± 13,2 года; масса тела 68,8 ± 7,2 кг; рост 165,5 ± 3,4 см; индекс массы тела 25,2 ± 5,3) страдали ишемическими нарушениями мозгового кровообращения за 12,4 ± 17,3 месяца до момента проведения исследований. Объем первичного очага ишемического поражения составлял в среднем 74,3 ± 61,9 см3. Пациенты и их ближайшие родственники были полностью информированы о задачах, подробностях и рисках в связи с проведением исследования, от них было получено письменное информированное согласие в соответствии с Хельсинкской Декларацией [28]. Проведение исследования было одобрено этическим комитетом Медицинского факультета Дебреценского университета.
2.2. Дизайн исследования и ведение пациентов
Было проведено двойное слепое исследование. Кодировка препаратов была раскрыта после завершения анализа результатов визуализации. Группа больных для исследования была отобрана из большого числа пациентов с хроническими ишемическими нарушениями мозгового кровообращения, проходивших лечение в условиях Департамента неврологических исследований Медицинского факультета Дебреценского университета. У всех больных область инфаркта располагалась в пределах бассейна средней мозговой артерии (СМА).
В целях настоящего исследования физический и неврологический статус отобранных пациентов оценивали согласно Шкале Оргогозо (Orgogozo Scale) [20], Скандинавской неврологической шкале (SNS) [30], моторной шкале [31] и индексу Бартела (Barthel Index) [32]. Проводилась магнитно-резонансная томография (МРТ, режимы Т1, Т2, PD), ультразвуковая допплерография сонных артерий (ДСА) (прибор Ultramark 4 Plus), а также ультразвуковая транскраниальная допплерография (ТКД, на 50 мм выше главного ствола СМА) наряду с рутинными лабораторными исследованиями. Исследование выполнялось на протяжении 15-суточного периода госпитализации пациентов, после чего какого-либо дальнейшего наблюдения за ними не проводилось.
Точный протокол исследования представлен на рисунке 1. Все субъекты получали внутривенные инфузии 500 мл физиологического раствора (Salsol) длительностью 45 минут ежедневно на протяжении 14 суток. В первой подгруппе (8 пациентов — «группа плацебо») винпоцетин (Кавинтон®) в раствор для инфузии не добавлялся, в другой (7 пациентов — «группа активной терапии») субъекты исследования получали препарат (Кавинтон®, Гедеон Рихтер, Будапешт) в инфузии из расчета 1 мг/кг массы тела.
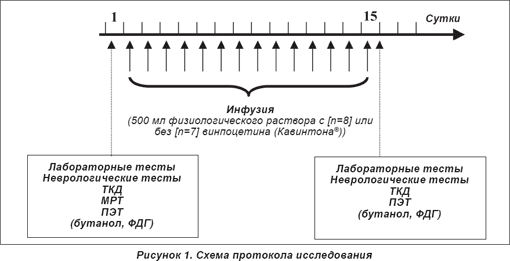
При подготовке данных к завершающему анализу двое пациентов были исключены (по одному из групп плацебо и активной терапии) на основании (а) технических проблем (при проведении ПЭТ в поле зрения был захвачен недостаточный объем ткани головного мозга) и (б) подозрения в отношении развития острого цереброваскулярного явления в период между двумя сессиями сканирования. Таким образом, заключительные группы пациентов в ходе анализа изображений состояли из 7 (группа плацебо) и 6 субъектов (групп активной терапии). Подробные индивидуальные данные пациентов представлены в таблице 1.
2.3. Процедура сканирования
Условная линия от угла глаза до отверстия наружного слухового прохода использовалась при проведении МРТ для идентичного позиционирования головы пациента, то есть тем самым обеспечивалась параллельность срезов изображений сканирования при каждом из режимов визуализации. МРТ-исследования всем пациентам проводили на сканере Shimadzu SMT-100 ´ 1,0 Т (Т1-, Т2- и PD-взвешенные результаты визуализации). В ходе МРТ и ПЭТ использовали индивидуально изготовленные пластиковые шлемы для фиксации головы пациента в одинаковом положении во время сканирования [33, 34]. В локтевую вену пациентам вводили катетер для забора венозной крови в целях определения активности вводимого трейсера в крови и плазме и построения соответствующих кривых. Материал венозной крови использовали для дальнейшего анализа в соответствии с методикой, описанной M.E. Phelps и соавторами [35] и S.C. Huang и соавторами [36]. Забор проводили во время ПЭТ с бутанолом каждые 10 секунд в течение 2 минут, в ходе же ФДГ-ПЭТ (ПЭТ со фтордезоксиглюкозой в качестве трейсера — прим. ред. НМТ) порции крови получали каждые 10 секунд в первую минуту, 15 секунд — во вторую, 30 секунд — в третью, далее каждую минуту до 15-й, после чего — каждые 10 минут до 60-й. ПЭТ-исследование проводили в условиях сенсорной супрессии в затемненной комнате согласно P.E. Roland и L. Friberg [37]. В первом случае процедуру бутанол-ПЭТ проводили с последующим ФДГ-ПЭТ-сканированием. Промежуток времени между двумя сканированиями составлял в среднем 45 минут. Количественные ПЭТ-исследования проводились с использованием позитронной камеры для всего тела GE 4096 Plus с плоскостным разрешением 5 мм и расстоянием между слоями срезов 6,5 мм [38]. При аксиальном поле зрения камеры 103 мм ею производили 15 трансаксиальных визуализационных срезов головного мозга. В качестве метаболического и гемодинамического трейсеров использовали 18 F-дезокси-D-глюкозу (ФДГ) и 15О-бутанол соответственно. Трейсеры получали путем стандартной процедуры [35, 39] и вводили в виде болюсной инъекции (величина активности в одной болюсной инъекции ФДГ — 10 мКи, бутанола — 45 мКи). Получение данных на ПЭТ-камере и забор крови для исследования начинали синхронно с болюсной инъекцией. На эмиссионных сканограммах данные регистрировали в общей сложности в течение 2 минут для бутанол-ПЭТ и 60 минут — для ФДГ-ПЭТ. ПЭТ-изображения реконструировали с помощью фильтра Ханнинга (Hanning filter) до получения эффективного разрешения результатов визуализации (FWHM) 5 мм и учитывая поправку на затухание по результатам отдельного сеанса сканирования. Кривые изменения во времени активности трейсера в крови рассчитывали на основе интервальных измерений активности трейсера в образцах крови, полученных у больных вручную.
2.4. Обработка и анализ данных визуализации
На основе данных ПЭТ и кривых активности трейсеров в крови во времени показатели региональной концентрации радиоактивности в ткани головного мозга преобразовывали для каждого пациента в количественные показатели региональной церебральной интенсивности обмена глюкозы относительных кинетических констант в пределах изучаемых объемных участков мозга («объемов интереса» — ОИ) с использованием обновленной версии модели Кувабара (Kuwabara model) [40] при фиксированной величине сосредоточенной постоянной (СП = 0,42) для каждого пациента [41]. Возможные ошибки ввиду перестановки двух ПЭТ-сканограмм вследствие ограничения степени фиксации головы обследуемого корректировались посредством автоматизированного алгоритма по R.P. Woods и соавт. [42] в описании M. Emri и соавт. [43]. Сканограммы на фоне введения бутанола реконструировали с использованием соответствующего программного обеспечения (McConnel Imaging Center, Montreal Neurological Institute) на основе двухобъемной модели по S. Ohta и соавторам [44].
МРТ-сканограммы и реконструированные результаты визуализации ИЦМglc и ЦК далее обрабатывались с использованием Системы Атласа головного мозга человека (АГМЧ) Каролинска института [45]. На первом этапе индивидуальные результаты МРТ приводились к стереотаксической координатной системе Talairach, так что основные условные оси и плоскости головного мозга выравнивались по отношению к таковым указанной системы [46], хотя индивидуальные изображения не были стандартизированы по форме и размеру. После выравнивания МТР-сканограмм по контурам условного стандартного головного мозга по АГМЧ, ПЭТ-изображения совмещали также стереотаксически. ОИ очерчивали в условиях стереотаксически совмещенных изображений.
На индивидуальных МРТ-сканограммах (Т2-изображения) ОИ определялись двумя независимыми экспертами-наблюдателями с охватом следующих областей: все пораженное полушарие, все контрлатеральное полушарие; в контрлатеральном полушарии — лобная, теменная, височная, затылочная область коры, таламус, путамен, хвостатое ядро, мозжечок, ствол мозга; в пораженном полушарии — зона инсульта, здоровая зона вне зоны инсульта в бассейне передней мозговой артерии, таламус, мозжечок, ствол мозга. ОИ, определенные на индивидуальных МРТ-сканограммах, переносились на индивидуальные ПЭТ-изображения с расчетом параметрических показателей (ЦК, ИЦМglc) в пределах ОИ. Рассчитывались средние значения и стандартные ошибки среднего. Статистический анализ проводили на основании принципа ОИ-связанной «управляемой гипотезой» или «тенденциозной» статистики. В первую очередь, метаболические (ИЦМglc) и гемодинамические (ЦК) данные анализировали методом ANOVA с использованием трехстороннего взаимодействия (1: до и после лечения; 2: плацебо и винпоцетин (Кавинтон®); 3: ОИ — кора больших полушарий, полушария мозжечка, таламус и базальные ганглии). При получении только трендов в направлении достоверности (p<0,05) с использованием ANOVA (см. Результаты и обсуждение) с целью ограничения величины целевого объема статистической процедуры оценивали статистические различия между (1) (ОИ-показатели в группе плацебо и активной терапии) и (2) (показатели до и после лечения в соответствующих группах) при помощи двустороннего парного или гомоскедастического, зависимого от соответствующих наборов данных t-критерия Стьюдента.
3. Результаты
3.1. Исходные величины и изменения церебрального кровотока
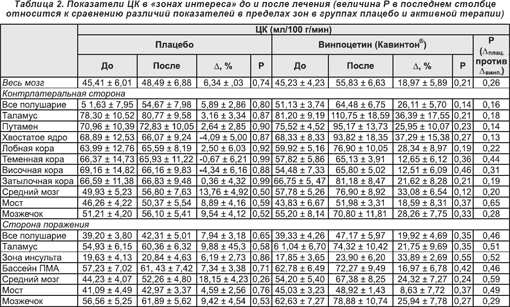
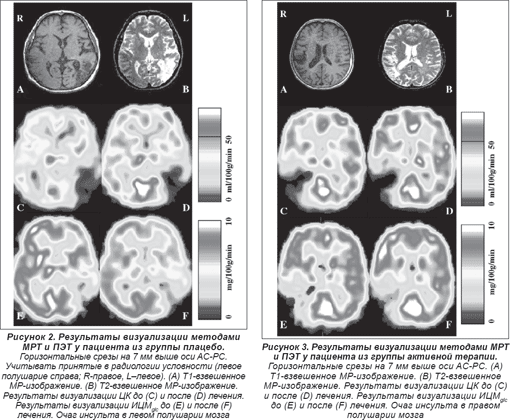
Т1- и Т2-взвешенные результаты визуализации методом МРТ (см. рисунки 2А и 2В, 3А и 3В) отчетливо показали расположение патологического очага в ткани головного мозга, а метаболические и гемодинамические данные ПЭТ продемонстрировали снижение ЦК в зоне инсульта до лечения (рисунки 2С и 2Е, 3C и 3E) при относительном его увеличении после лечения (рисунки 2D и 3D), а также исходный уровень и изменения метаболизма глюкозы (рисунки 2F и 3F).
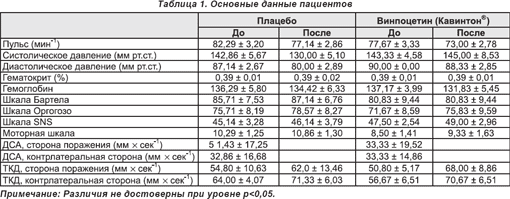
Показатели общего ЦК во всей группе пациентов до лечения составляли 45,33 ± 3,63 мл/100 г/мин. Существенных различий исходных величин общего ЦК между группами плацебо и активной терапии винпоцетином (Кавинтоном®) не имелось (45,41 ± 6,01 мл/100 г/мин и 45,23 ± 4,23 мл/100 г/мин соответственно). Значения параметра после 14 суток терапии составили 48,49 ± 6,88 мл/100 г/мин среди реципиентов плацебо и 55,83 ± 6,63 мл/100 г/мин после применения винпоцетина (Кавинтона®). Различия были недостоверны (p = 0,74 и 0,21 соответственно).
Наибольшее увеличение кровотока после терапии в группе плацебо обнаруживалось в среднем мозге (13,76 ± 4,92%), мосте (8,89 ± 4,16%) и мозжечке (9,54 ± 4,12%), в то время как в группе активной терапии таковое определялось в тех же структурах (средний мозг — 33,08 ± 6,54%, мост — 18,59 ± 8,31%, мозжечок — 28,26 ± 7,75), а также неповрежденном таламусе (36,39 ± 17,55), хвостатом ядре (37,29 ± 15,38%) и зоне инсульта (33,89 ± 2,69%) (таблица 2, рисунки 2 и 3). Тест ANOVA с трехсторонним взаимодействием показал несомненную тенденцию к увеличению показателей ЦК после лечения при особой заинтересованности таламуса (F(5,55) = 1,81; p < 0,12). Тем не менее, обусловленные терапией изменения в контрлатеральной гемисфере после применения винпоцетина (Кавинтона®) характеризовались отчетливой тенденцией к более выраженному повышению (величины p в пределах от 0,12 до 0,46), нежели в группе плацебо (от 0,50 до 0,99 соответственно) (таблица 2). Сравнение различий показателей кровотока (группа плацебо/до и после лечения и соответствующие величины в группе получавших винпоцетин (Кавинтон®)) также показало четкую тенденцию, а именно что интенсификация кровотока в группе активной терапии характеризуется тенденцией к отчетливому превышению таковой в группе плацебо (для базальных ганглиев, таламуса, среднего мозга, затылочной и лобной коры, а также всего незаинтересованного полушария p < 0,25).
3.2. Исходные уровни и изменения церебрального метаболизма глюкозы
Базальные уровни ИЦМglc для всего мозга (см. таблицу 3) составили 6,96 ± 0,37 во всей группе пациентов и 7,30 ± 0,32 и 6,50 ± 0,73 мг/100 г/мин в подгруппах плацебо и активной терапии соответственно (p = 0,32). После инфузии, в отличие от изменений ЦК, происходило как общее, так и региональное снижение ИЦМglc в обеих подгруппах пациентов. В пораженном полушарии снижение ИЦМglc было более выраженным среди реципиентов плацебо по сравнению с получавшими винпоцетин (Кавинтон®). Данный эффект наблюдался, главным образом, в зоне инсульта (трехсторонний ANOVA-анализ: (F(5,5) = 0,39; p < 0,85); двуточечные t-критерии приведены в таблице 3).
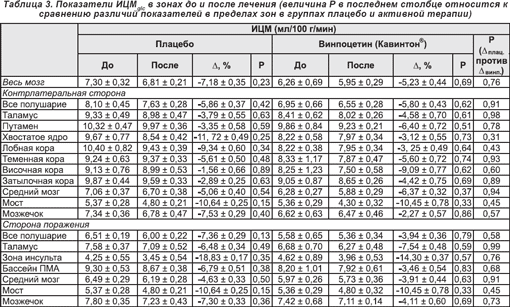
4. Обсуждение
Главной задачей настоящего исследования было определение методом ПЭТ эффектов винпоцетина (Кавинтона®) при ежедневном внутривенном введении на протяжении 2-недельного курса в отношении церебрального кровотока и метаболизма. При использовании нескольких трейсеров для мечения различных физиологических/ биохимических процессов в организме ПЭТ дает уникальную возможность получить представление о взаимосвязи метаболизма и кровотока. В данном случае использовали [18F]-ФДГ для исследования количественного обмена глюкозы и [15O]-бутанол для определения изменений показателей кровотока в тканях головного мозга. В качестве вспомогательных методов проводили мониторинг и документирование некоторых дополнительных физиологических и клинических параметров. Оценки по основным клиническим шкалам (Бартела, Оргогозо, SNS, моторной шкале) не выявили каких-либо значительных изменений после длительного лечения винпоцетином (Кавинтоном®). Несмотря на увеличение скорости кровотока в СМА, ТКД-связанные физиологические параметры характеризовались отсутствием существенных изменений также и после 15 дней терапии. Этот факт не вызывает удивления, поскольку период времени после эпизода острого нарушения мозгового кровообращения и настоящим исследованием у данных пациентов был свыше 1 года, так что все они могут считаться популяцией «хронических» больных.
4.1. Изменения церебрального кровотока
Показатели общего ЦК (45,33 ± 3,63 мл / 100 г/мин) во всей группе исследования превышали таковые согласно опубликованным данным для идентичной по возрасту здоровой популяции (37,3 мл/ 100 г/мин; [52]). Такой результат был неожиданным, поскольку пациенты характеризовались наличием относительно крупных очагов поражения (11,9 ± 9,2% объема всего заинтересованного полушария), а предполагалось получить меньшие показатели общего ЦК, что не было обнаружено по данным ПЭТ. Следует отметить, что величина гематокрита у пациентов (39,0 ± 1,0) была достоверно ниже (p ≤ 0,05; критерий Вилкоксона) по сравнению с физиологическими значениями в здоровой популяции (42,3 ± 2,7; [47]). Поскольку уменьшение величины гематокрита приводит к снижению показателей ЦК [48], то этот факт в данном случае может объяснить более высокие, нежели ожидалось, величины общего ЦК у обследованных пациентов.
Как и ожидалось, величины ЦК в двух полушариях достоверно отличались. В заинтересованной гемисфере мозга ЦК был ниже общего ЦК у идентичных по возрасту лиц группы контроля, что имело место из-за наличия обширной зоны дисфункции в пораженном полушарии. С другой стороны, ЦК в контрлатеральной гемисфере был отчетливо выше по сравнению с нормальными значениями в группе возрастного контроля, и такого рода относительно высокий ЦК вносил свой вклад в формирование упоминавшегося выше «псевдонормального» уровня общего ЦК во всей группе пациентов.
В сущности говоря, величины общего ЦК после 2 недель терапии возрастали как в группе плацебо, так и активной терапии. Имелись заметные, однако недостоверные различия между двумя группами в отношении роста общего ЦК. Данный факт указывает на то, что увеличение общего ЦК может отчасти происходить в результате эффекта инфузий, обусловливающего улучшение микроциркуляции в ткани головного мозга и увеличение ЦК как у здоровых лиц, так и пациентов [49]. Феномен увеличения ЦК в результате инфузий изотонического раствора можно далее объяснить снижением церебрального сосудистого сопротивления и системными эффектами, включая рост величины сердечного выброса [50].
Несмотря на отсутствие достоверности изменений по уровню p < 0,05, имелись заметные различия степени увеличения ЦК в двух группах, что проявлялось как большим диапазоном изменений, так и явно меньшими значениями Р согласно ANOVA и t-критерию в группе активной терапии (таблица 2).
Увеличение показателей ЦК в группе получавших винпоцетин (Кавинтон®) было в различных участках головного мозга неоднородным. В контрлатеральном полушарии показатель был явно выше в большинстве мозговых структур. Увеличение было наибольшим в тканях таламуса, хвостатого ядра и среднего мозга. При этом винпоцетин (Кавинтон®) повышал наиболее заметно ЦК в области хвостатого ядра (37,29%), таламуса (36,39%) и среднего мозга (3,08%), далее в ряду располагались мозжечок, лобная область коры, путамен и затылочная кора больших полушарий. Эти структуры головного мозга соответствуют зонам, где обнаруживается наибольший захват [11C]-винпоцетина (Кавинтона®) как у лабораторных обезьян [21], так и у человека [22, 23, 25]. Этот факт может указывать на выраженную связь фармакологических и физиологических эффектов препарата в некоторых структурах мозга. В действительности, усиление перфузии в неповрежденной ткани после ишемического инсульта было описано ранее на основании определения параметров регионального церебрального кровотока методом ПЭТ (см. напр. [51]).
В заинтересованном полушарии имело место увеличение ЦК во всех структурах как после контрольной инфузии, так и после введения винпоцетина (Кавинтона®). Аналогично данным в отношении незаинтересованного полушария, в большинстве структур увеличение ЦК после инфузии винпоцетина (Кавинтона®) было более заметным, нежели в результате введения изотонического солевого раствора. Это явление было особо выраженным в зоне инсульта (33,89%), таламусе (21,75%), среднем мозге (24,32%) и мозжечке (25,94%), что указывает на перераспределение кровоснабжения между структурами головного мозга под влиянием винпоцетина (Кавинтона®).
4.2. Метаболизм глюкозы до и после лечения
Общие показатели ИЦМglc до лечения у больных с нарушениями мозгового кровообращения (6,96 ± 0,37 мг/100 г/мин) были ниже таковых у здоровых пациентов того же возраста (7,04-7,54 мг/100 г/мин; см. [52, 53]). Упомянутые общемозговые величины имеют место из-за отчетливого снижения ИЦМglc в заинтересованном полушарии (6,08 ± 0,39 мг/100 г/мин), в то время как соответствующие показатели в контрлатеральной гемисфере пребывали в пределах, характерных для здоровых лиц идентичного возраста (7,56 ± 0,40 мг/100 г/мин).
Как инфузии солевого раствора, так и введение винпоцетина (Кавинтона®) вызывали незначительное и статистически недостоверное снижение общего показателя ИЦМglc, что может быть проявлением хорошо известного эффекта улучшения кровообращения на изменение соотношения аэробного и анаэробного синтеза АТФ [54]. Улучшение микроциркуляции приводит к большему поступлению кислорода, а в энергетическом отношении степень увеличения его потребления превышает степень снижения утилизации глюкозы на единицу продукции АТФ согласно соответствующему уравнению A. Gjedde и соавторов:
JАТФ = 2Jglc + 6J02,
где JАТФ — продукция аденозинтрифосфата,
Jglc — утилизация глюкозы,
J02 — потребление кислорода [55].
Такая тенденция имелась в отношении всех структур в обоих полушариях. Относительные различия между степенью снижения величин ИЦМglc в контрлатеральной гемисфере были сомнительными. Паттерн был однородным в заинтересованном полушарии мозга, где снижение ИЦМglc во всех структурах после инфузии винпоцетина (Кавинтона®) было меньше, чем после введения плацебо, что указывает на улучшение под влиянием винпоцетина (Кавинтона®) утилизации глюкозы в пределах пораженного полушария. В самом деле, в ходе предшествующего исследования с использованием ПЭТ авторы обнаружили, что однократное внутривенное введение винпоцетина (Кавинтона®) обусловливало значительное повышение констант метаболизма глюкозы k1 и k2 в заинтересованном полушарии большого мозга [26, 27]. Такого рода наблюдения подтвердились в ходе анимальных экспериментальных работ [56-58], так же как и исследований у человека [20].
Интересен тот факт, что снижение уровня метаболизма после лечения было наиболее выраженным в зоне инсульта у больных в группе плацебо (18%), так же как и в группе активной терапии (14%). Последний факт может указывать на сложность строения зоны инсульта (включая «область полутени») — в ней могут быть представлены афункциональные (некротические), гипофункциональные, а также нормо- и гиперфункциональные участки ткани, а метаболические изменения после терапии могут отражать реактивность ткани в такого рода неоднородной зоне [59, 60].
Аналогично нашим наблюдениям эффектов изолированных инфузий в отношении ИЦМglc, предшествующие исследования с использованием метода ПЭТ также показали, что введение плацебо снижает интенсивность метаболизма глюкозы в такни головного мозга [61]. Примечательно также, что в ходе повторных тестов по исследованию достоверности с более продолжительными периодами (6-35 недель) между двумя сеансами сканирования, второе ПЭТ-исследование показало наличие сниженных уровней ИЦМglc, хотя различия были недостоверными [62, 63].
5. Заключение
Чистая инфузия обусловливает повышение общемозгового показателя ИК и, в некоторой мере, – снижение общей ИЦМglc. Общие эффекты инфузии солевого раствора в отношении ИК свидетельствуют, в соответствии с данными предшествующих наблюдений, что изоволемическая инфузия улучшает состояние кровообращения в головном мозге и повышает ЦК. Как следствие благоприятных циркуляционных эффектов, происходит также улучшение соотношения интенсивности окислительного фосфорилирования и продукции АТФ в ходе гликолиза [54], что может несомненно приводить к снижению общей ИЦМglc согласно определению по методике ФДГ-ПЭТ. Этот факт, тем не менее, указывает на улучшение обмена глюкозы, что дает в результате увеличение соотношения интенсивности аэробного и анаэробного метаболизма моносахарида.
В предшествующих исследованиях [26, 27] авторы определяли кинетические константы K1 (однонаправленный клиренс глюкозы кровь - головной мозг, характеризующий утилизацию моносаахрида), k2 (константа скорости элиминации глюкозы из ткани головного мозга) и k3 (константа скорости гексокиназной активности) в различных участках ткани мозга больных с хроническими ишемическими нарушениями мозгового кровообращения до и после лечения с использованием винпоцетина (Кавинтона®). Притом что существенные изменения k3 отсутствовали, имело место достоверное изменение как k1, так и k2 в в пределах всех участков большого мозга за исключением очагов инсульта и периинсультных зон. Эти наблюдения указывают на модулирование переноса глюкозы в капиллярах головного мозга, что может быть причиной или поддерживать изменения региональной ИЦМglc, наблюдаемые также в настоящем исследовании.
Инфузии винпоцетина (Кавинтона®) вызывали также увеличение общих показателей ИЦМglc, однако изменения были идентичными таковым на фоне инфузий плацебо, что указывает на связь такого эффекта преимущественно с проведением собственно инфузии раствора. В то же время региональные изменения церебрального кровотока после инфузии винпоцетина (Кавинтона®) при сравнении с таковыми на фоне плацебо показали региональное перераспределение кровоснабжения головного мозга под влиянием лечения винпоцетином (Кавинтоном®), причем наибольшая интенсификация кровотока имеет место в области таламуса, базальных ганглиев и ствола мозга. Региональный захват 11С-винпоцетина в этих структурах был наибольшим, что указывает также на корреляцию фармакологических и физиологических эффектов препарата [22].
Винпоцетин (Кавинтон®) также вызывал снижение общего показателя ИЦМglc аналогично эффектам инфузии плацебо. В то же время уменьшение величины ИЦМglc было менее значительным после инфузии винпоцетина (Кавинтона®), нежели плацебо. Как было показано выше, это можно объяснить улучшением соотношения интенсивности аэробного и анаэробного метаболизма глюкозы. Снижение потребления глюкозы идет параллельно с улучшением утилизации моносахарида вследствие позитивного сдвига в соотношении интенсивности аэробного и анаэробного метаболизма моносахарида. То есть в результате интенсификации аэробного метаболизма глюкозы меньшее число ее молекул требуется для образования того же количества АТФ, нежели при более низком аэробно/анаэробном соотношении. Региональные изменения обмена моносахарида были наибольшими в заинтересованном полушарии, аналогично эффектам однократной инфузии [26, 27].
Полученные данные подтверждают результаты прежних наблюдений об отсутствии зависимости интенсивности метаболизма глюкозы и показателей церебрального кровотока в условиях патологии [53]. В то время как инфузия изотонического раствора (плацебо) обусловливает улучшение состояния церебрального кровообращения и, тем самым, увеличивает мозговой кровоток, так же как и способствует восстановлению физиологического соотношения интенсивности окислительной и гликолитической продукции АТФ, винпоцетин (Кавинтон®) модифицирует данный общий и системный эффект путем, вероятнее всего, непосредственного влияния на ЦНС. В соответствии с данными настоящего исследования, винпоцетин (Кавинтон®) влияет на региональное перераспределение церебрального кровотока таким образом, что относительно большее количество крови достигает участков мозга, в которых, по данным других исследований, происходит наибольшее накопление радиоактивно меченого винпоцетина (Кавинтона®). Кроме того, винпоцетин (Кавинтон®) способен топически модифицировать уровень утилизации глюкозы в тканях головного мозга, причем эго эффект более выражен в заинтересованном полушарии. Такого рода комплексные эффекты винпоцетина (Кавинтона®) указывают на способность препарата, в силу его непосредственного влияния на ЦНС, благотворно влиять на восстановление физиологических состояний у больных с нарушениями мозгового кровообращения.
Признательность
Настоящее исследование проводилось при поддержке «Гедеон Рихтер», Будапешт.
Авторы выражают благодарность д-ру Albert Gjedde за его замечания по предыдущей версии настоящей рукописи.
1. Bonoczk P., Gulyas B., Adam-Vizi V., Nemes A., Karpati E., Kiss B. et al. Role of sodium channel inhibition in neuroprotection: effect of vinpocetine // Brain Res Bull 2000; 53 : 245-54.
2. Biro K., Karpati E., Szporny L. Protective activity of ethyl apovincaminate on ischemic anoxia of the brain // Arzneim-Forsch 1976; 26 : 1918-20.
3. Miyamoto M., Murphy T.H., Schnaar R.L. Antioxidants protect against glutamate-induced cytotoxicity in a neuronal cell line // J. Pharmacol Exp Ther 1989; 250 : 1132-40.
4. Tohgi H., Sasaki K., Chiba K., Nozaki Y. Effect of vinpocetinee on oxygen release of hemoglobin and erythrocyte organic polyphosphate concentrations in patients with vascular dementia of the Binswanger type // Arzneim-Forsch 1990; 40 : 640-3.
5. Tretter L., Adam-Vizi V. The neuroprotective drug vinpocetine prevents veratridine-induced [Na+]i and [Ca2+]i rise in synaptosomes // Neuroreport 1998; 9 : 1849-53.
6. Bukanova Y.V., Solntseva E.L. Nootropic agent vinpocetine blocks delayed rectified potassium currents strongly than high-threshold calcium currents // Neurosci Behav Physiol 1998; 28 : 116-20.
7. Erdo S., Molnar P., Lakics V., Bence J.Z., Tomoskozi Z. Vincamine and vincanol are potent blockers of voltage-gated Na+ channels // Eur J. Pharmacol 1996; 314 : 69-73.
8. Molnar P., Erdo S.L. Vinpocetine is as potent as phenytoin to block voltage-gated Na+ channels in rat cortical neurons // Eur J. Pharmacol 1995; 273 : 303-6.
9. Kiss B., Cai N.S., Erdo S.L. Vinpocetine preferentially antagonizes quisqualate / AMPA receptor responses: evidence from release and ligand binding studies // Eur J. Pharmacol 1991; 209 : 109-12.
10. Krieglstein J., Rischke R. Vinpocetine increases the neuroprotective effect of adenosine in vitro // Eur J. Pharmacol 1991; 205 : 7-10.
11. Rischke R., Krieglstein J. Effects of Vinpocetine on local cerebral blood flow and glucose utilization seven days after forebrain ischaemia in the rat // Pharmacology 1990; 41 : 153-60.
12. Rischke R., Krieglstein J. Protective effect of Vinpocetine against brain damage caused by ischaemia // Jpn J. Pharmacol 1991; 56 : 349-56.
13. Jucker M., Meier-Ruge W., Baettig K. Relative regional changes in 2-deoxyglucose uptake reflect cognitive performances in aged and adult rats. Effects of brovincamine and Vinpocetine // Psychopharmacology 1988; 96 : 29.
14. Miyazaki M. The effect of a cerebral vasodilator, vinpocetine, on cerebral vascular resistance evaluated by the Doppler ultrasonic technique in patients with cerebrovascular diseases // Angiology 1995; 46 : 53-8.
15. Kuzuya F. Effects of vinpocetinee on platelet aggregability and erythrocyte deformability // Ther Hung 1958; 33 : 22-34.
16. Szobor A., Klein M. Examinations of the relative fluidity in cerebrovascular disease patients // Ther Hung 1991; 40 : 8-11.
17. Hayakawa M. Effect of vinpocetinee on red blood cell deformability in vivo measured by a new centrifiigation method // Arzneim-Forsch 1992; 42 : 281-3.
18. Hayakawa M. Effect of vinpocetinee on red blood cell deformability in stroke patients // Arzneim-Forsch 1992; 42 : 425-7.
19. Bereczki D., Fekete I. Vinpocetine for acute ischemic stroke // Cochrane Database Syst Rev 2000; 2 : CD000480.
20. Bonoczk P., Panczel G., Nagy Z. Vinpocetine increases cerebral blood flow and oxygenation in stroke patients: a near infrared spectroscopy and transcranial Doppler study // Eur J. Ultrasound 2002; 15 : 85-91.
21. Gulyas B., Halldin C., Karlsson P., Chou Y.H., Swahn C.G., Farde L. Brain uptake and plasma metabolism of C-vinpocetine. A PET-study in cynomolgus monkey // J. Neuroimaging 1999; 9 : 217-22.
22. Gulyas B., Halldin C., Sandell J., Swahn C.G., Bonock P., Kiss B. et al. PET studies on the uptake and regional distribution of [11C] vinpocetine in human subjects // Acta Neurol Scand 2002; 106 : 325-32.
23. Gulyas B., Sovago J., Sandell J., Halldin C., Cselenyi Z.M., Vas A. et al. Drug distribution in man: a positron emission tomography study after oral administration of the labelled europrotective drug vinpocetine // Eur J. Nucl Med Mol Imaging 2002; 29 : 1031-8.
24. Gulyas B., Vas A., Halldin C., Sovago J., Sandell J., Fredriksson A. et al. Cerebral uptake of [ethyl-11C] vinpocetine and l-[HC] ethanol in cynomolgous monkeys: a comparative preclinical PET study // Nucl Med Biol 2002; 29 : 753-9.
25. Hall H., Varnas K., Sandell J., Halldin C., Farde L., Vas A. et al. Autoradiographic evaluation of [11C] vinpocetine binding in the human postmortem brain // Acta Biol Hung 2002; 53 : 59-66.
26. Gulyas B., Csiba L., Kerenyi L., Galuska L., Tron L. The effect of a single-dose intravenous vinpocetine on chronic stroke patients. A PET study. In: Gulyas B, Muller-Gartner HW, editors. Positron emission tomography: a critical assessment of recent trends // Dordrecht: Kluwer Academic Publishers; 1998. p. 291-306.
27. Szakall S., Boros I., Balkay L., Emri M., Fekete I., Kerenyi L. et al. The cerebral effects of a single dose intravenous vinpocetine in chronic stroke patients: a PET study // J. Neuroimaging 1998; 8 : 197-204.
28. Helsinki Declaration // Br Med J. 1964 (18 July) : 177.
29. Orgogozo J.M. Evaluation of treatments in ischemic-stroke patients. In: Amery WK, editor. Clinical trial methodology in stroke. London: Malliere Tindall; 1989. p. 35-53.
30. Scandinavian Stroke Study Group. Multicenter trial of hemodilution in ischemic stroke: background and study protocol // Stroke 1985; 16 : 885-90.
31. Loewen S.C., Anderson B.A. Reliability of the modified motor assessment scale and the barthel index // Phys Ther 1988; 68 : 1077-81.
32. Gresham G.E., Phillips T.F., Labi M.L. ADL status in stroke: relative merits of three standard indexes // Arch Phys Med Rehabil 1980; 61 : 355-8.
33. Greitz T., Bergstrom M., Boothius J,, Kingsley D,, Ribbet T. Head fixation device for integration of radiodiagnostic and radiotherapeutic procedures // Neuroradiology 1980; 19 : 1-6. 34. Bergstr5m M, Boethius J, Eriksson J, Greitz T, Ribbe T, Widen L. Head fixation device for reproducible positron alignment in transmission CT and positron emission tomography // J. Comput Assist Tomogr 1981; 5: 136-41.
35. Phelps M.E., Huang S.C., Hoffman E.J., Selin C., Sokoloff L., Kuhl D.E. Tomographic measurement of local cerebral glucose metabolic rate in humans with (F-18)2 -fluoro-2-deoxy-D-glucose: validation of method // Ann Neurol 1979; 6: 371-88.
36. Huang S.C., Phelps M.E., Hoffman E.J. Noninvasive determination of local cerebral glucose metabolic rate in man // Am J. Physiol 1980; 238: E69-82.
37. Roland P.E., Friberg L. Localization of cortical areas activated by thinking // J. Neurophys 1985; 53: 1219-43.
38. Rota-Kops E., Herzog H., Schmid A., Holte S., Feinendegen L.E. Performance characteristics of an eight-ring whole body PET scanner // J. Comput Assist Tomogr 1990; 14: 437-45.
39. Berridge M.S., Cassidy E.H., Terris A.H. A routine, automated synthesis of oxygen-15-labeled butanol for positron tomography // J. Nucl Med 1990; 31: 1727-31.
40. Kuwabara H., Evans A.C., Gjedde A. Michaelis-Menten constrains improved cerebral glucose metabolism and regional lumped constant measurement with F18-fluorodeoxyglucose // J. Cereb Blood Flow Metab 1990; 110: 180-9.
41. Balkay L., Molnar T., Boros I., Lehel S., Galambos T. Quantification of FDG uptake using kinetic models. In: Gulyas B., Muller-Gartner H.W., editors. Positron emission tomography: a critical assessment of recent trends // Dordrecht: Kluwer; 1998. p. 153-62.
42. Woods R.P., Cherry S.R., Mazziotta J.C. Rapid automated algorithm for aligning and reslicing PET images // J. Comput Assist Tomogr 1992; 16: 620-33.
43. Emri M., Marian T., Kover G. Registration: a powerful tool to combine information provided by different imaging modalities. In: Gulyas B, Muller-Gartner HW, editors. Positron emission tomography: a critical assessment of recent trends // Dordrecht: Kluwer; 1997. p. 143-51.
44. Ohta S., Meyer E., Fujita H., Reutens D.C., Evans A., Gjedde A. Cerebral [15O] water clearance in humans determined by PET: I. Theory and normal values // J. Cereb Blood Flow Metab 1996; 16: 765-80.
45. Roland P.E., Graufelds C.J., Wahlin J., Ingelman L., Andersson M., Ledberg A. et al. Human Brain Atlas: for high-resolution functional and anatomical mapping // Hum Brain Mapp 1994; 1: 173-84.
46. Talairach J., Tournoux P. Coplanar stereotaxic atlas of the human brain. Stuttgart: Thieme Verlag; 1988.
47. Metry G., Wikstrom B., Valind S., Sandhagen B., Linde T., Beshara S. et al. Effect of normalization of hematocrit on brain circulation and metabolism in hemodialysis patients // J. Am Soc Nephrol 1999; 10: 854-63.
48. Brun J.F., Bouchahda C., Chaze D., Benhaddad A.A., Micallef J.P., Mercier J. The paradox of hematocrit in exercise physiology: which is the «normal» range from an hemorheologist's viewpoint? // Clin Hemorheol Microcirc 2000; 22: 287-303.
49. Shackford S.R., Zhuang J., Schmoker J. Intravenous fluid tonicity: effect on intracranial pressure, cerebral blood flow, and cerebral oxygen delivery in focal brain injury // J. Neurosurg 1992; 76: 91-8.
50. Voorhees III W.D., Ralston S.H., Kougias C., Schmitz P.M. Fluid loading with whole blood or Ringer's lactate solution during CPR in dogs // Resuscitation 1987; 15: 113-23.
51. Marchal G., Young A.R., Baron J.C. Early postischemic hyperperfusion: pathophysiologic insights from positron emission tomography // J. Cereb Blood Flow Metab 1999; 19: 467-82.
52. Bentourkia M., Bol A., Ivanoiu A., Labar D., Sibomana M., Coppens A. et al. Comparison of regional cerebral blood flow and glucose metabolism in the normal brain: effect of aging // J. Neurol Sci 2000; 181 : 19-28.
53. Willis M.W., Ketter T.A., Kimbrell T.A., George M.S., Herscovitch P., Danielson A.L. et al. Age, sex and laterality effects on cerebral glucose metabolism in healthy adults // Psychiatry Res Neuroimaging 2002; 114 : 23-37.
54. Cave A.S., Ingwal J.S., Friedrich J., Liao R., Saupe K.W., Apstein C.S. et al. ATP synthesis during low-flow ischemia: influence of increased glycolytic substrate // Circulation 2000; 101: 2090-6.
55. Gjedde A., Marrett S., Vafaee M. Oxidative and nonoxidative metabolism of excited neurons and astrocytes // J. Cereb Blood Flow Metab 2002; 22: l-14.
56. Matkovics B., Szabo L., Kiss B., Szporny L. Effect of ethyl apovincaminate on the utilization of 14C glucose by rat brain in vitro. Arzneim-Forsch / Drug Res 1991; 41 : 107-8.
57 Shibota M., Kakihana M., Nagaoka A. The effect of vinpocetine on the brain glucose uptake in mice // Folia Pharmacol Jpn 1982; 80: 221-4.
58. Kakihana M., Suno M., Hamajo K., Nagaoka A., Shibota M. Protective effect of vinpocetine on experimental brain ischaemia // Folia Pharmacol Jpn 1982; 80: 225-9.
59. Hossmann J.C.A. Viability thresholds and the penumbra of focal ischemia // Ann Neurol 1994; 36: 557-65.
60. Selman W.R., Lust W.D., Pundik S., Zhou Y., Ratcheson R.A. Compromised metabolic recovery following spontaneous spreading depression in the penumbra // Brain Res 2004; 999 : 167-74.
61. Huber M., Kittner B., Hojer C., Fink G.R., Neveling M., Heiss W.D. Effect of propentofylline on regional cerebral glucose metabolism in acute ischemic stroke // J. Cereb Blood Flow Metab 1993; 13: 526-30.
62. Wang G.J., Volkow N.D., Overall J., Hitzemann R.J., Pappas N., Pascani K. et al. Reproducibility of regional brain metabolic responses to lorazepam // J. Nucl Med 1996; 37 : 1609-13.
63. Schaefer S.M., Abercrombie H.C., Lindgren J.C.A., Larson C.L., Ward R.T., Oakes T.R. et al. Six-month test-retest reliability of MRI-defined PET measures of regional cerebral glucose metabolic rate in selected subcortical structures // Hum Brain Mapp 2000; 10 : 1-9.
