Журнал «Здоровье ребенка» 5 (32) 2011
Вернуться к номеру
Рибонуклеазы А — древнейшие компоненты неспецифической защиты респираторного тракта
Авторы: Абатуров А.Е. Днепропетровская государственная медицинская академия
Рубрики: Педиатрия/Неонатология
Версия для печати
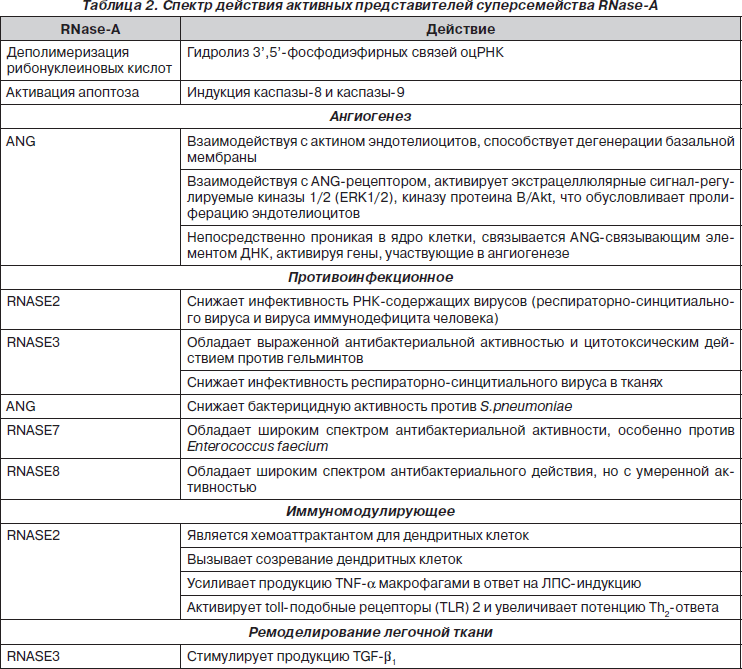
Из 13 представителей суперсемейства RNase-A в неспецифической защите респираторного тракта участвуют RNASE2, RNASE3 и RNASE7. RNASE3 и RNASE7 обладают выраженной бактерицидной активностью по отношению к грамотрицательным и грамположительным бактериям. RNASE2 и RNASE3 обладают противовирусной активностью по отношению к респираторно-синцитиальному вирусу. RNASE2 оказывает непосредственное влияние на иммунную систему, способствуя матурации и хемотаксису DC, а также индукции Th2-ответа.
Введение
Представители группы эндонуклеаз — рибонуклеазы A (RNase-A) представляют большое семейство дивергентных протеинов, молекулы которых содержат специфические элементы гомологичных последовательностей аминокислот с уникальной дисульфидной третичной структурой. Эндонуклеазы RNase-A относятся к наиболее изученным белкам млекопитающих. Первый представитель данного семейства был выделен Renй Dubos в 1938 году из поджелудочной железы быка и определен как фермент, участвующий в процессе пищеварения [4, 8, 36, 37]. В последующем было показано, что RNase-A участвуют не только в процессах деградации РНК пищи в кишечном люмене, но и выполняют деполимеризацию РНК в тканях организма, регулируя процессы транскрипции и трансляции. В настоящее время у человека идентифицировано 13 представителей суперсемейства RNase-A. Гены всех членов суперсемейства RNase-A человека расположены на хромосоме 14 [31]. Многочисленные данные научных исследований значительно изменили представление о физиологическом значении этого протеинового суперсемейства. В частности было установлено, что представители RNase-A обладают цитотоксическим и антибактериальным свойствами [39], которые позволяют им участвовать в разнообразных физиологических процессах, в том числе в регуляции ангиогенеза, клеточного апоптоза, неспецифической защите респираторного тракта [2, 8, 15].
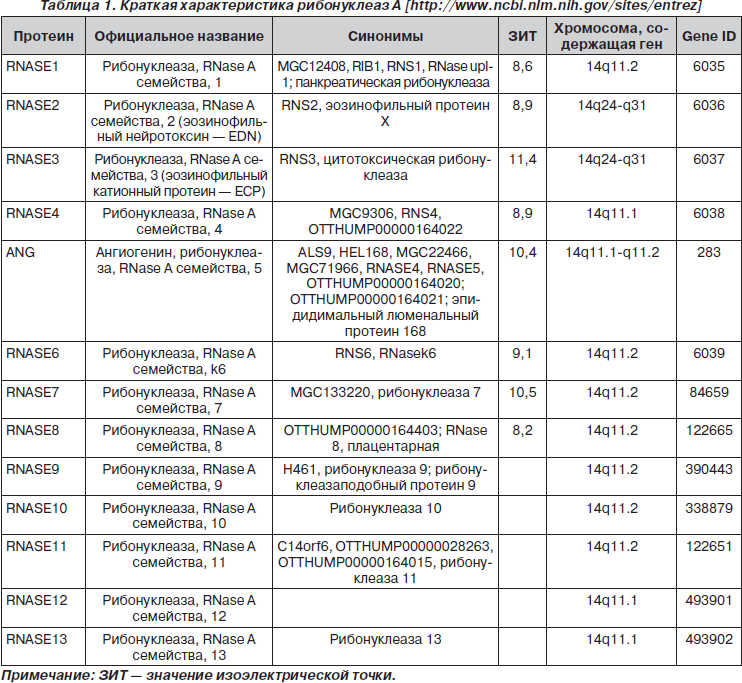
Краткая характеристика рибонуклеаз A
Рибонуклеазы A человека — суперсемейство, состоящее из 13 ферментов (12–16 кДа) (табл. 1) [10, 28, 32, 52].
В зависимости от наличия рибонуклеазной активности различают активные и неактивные RNase-A человека.
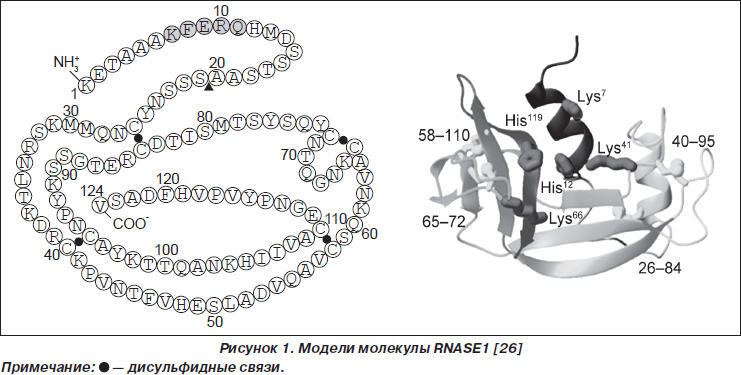
Активными являются восемь представителей суперсемейства RNase-A, молекулы которых имеют три специфических каталитических аминокислотных остатка: один — лизиновый в пределах консервативной последовательности CKXXNTF и два гистидиновых в N- и C-терминальных регионах, образующих каталитическую щель и определяющих рибонуклеазную активность. Молекулы семи зрелых представителей суперсемейства RNase-A содержат 8 цистеиновых остатков, которые образуют 4 дисульфидных мостика. Молекула ANG содержит 6 цистеиновых остатков. Форма молекул RNase-A напоминает почку (рис. 1, на примере RNASE1) [3, 4, 10, 44, 52].
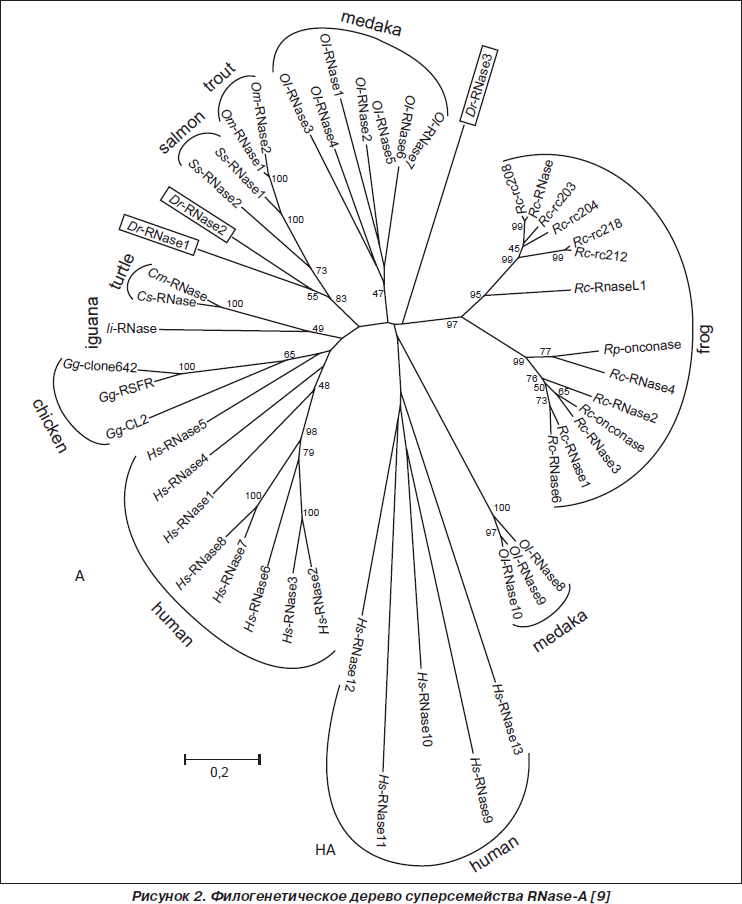
Анализ филогенетических отношений членов суперсемейства RNase-A показал, что RNASE человека разделены на две группы — субсемейство активных (А) и субсемейство неактивных рибонуклеаз (HA) (рис. 2).
В свою очередь, активные RNase-A представляют две подгруппы, первая из которых включает RNASE1, участвующую в пищеварении, RNASE4, RNASE5, стимулирующую формирование сосудов и обладающую бактерицидным действием; вторая — два эозинофильных катионоактивных белка (RNASE2/эозинофильный нейротоксин, RNASE3/эозинофильный катионный белок) и RNASE6, RNASE7, RNASE8 [5, 21, 24, 27, 39, 40, 42, 47].
Неактивными являются пять представителей суперсемейства RNase-A человека — RNASE9, RNASE10, RNASE11, RNASE12, RNASE13, которые в процессе эволюции потеряли каталитические элементы [10, 28, 32].
Гены, кодирующие RNase-A, расположены на длинном плече хромосомы 14 [10, 28, 32, 55].
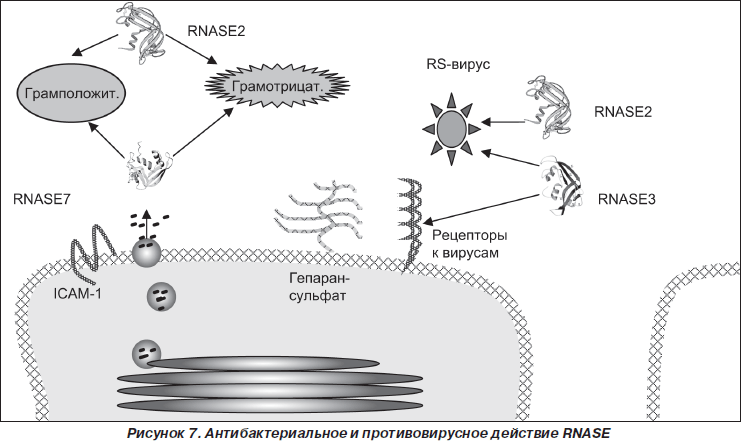
Показано, что в защите от инфекционных агентов, тропных к респираторному тракту, участвуют такие представители суперсемейства RNase-A, как RNASE2, RNASE3, RNASE7.
Основными продуцентами RNASE2, RNASE3 (рис. 3, 4) являются эозинофилы. Эти два представителя RNase-A входят в группу четырех основных эозинофильных протеинов, к которой также относятся эозинофильная пероксидаза (EPO) и главный базисный протеин (MBP) [7, 50]. Helene F. Rosenberg [39] считает, что гены RNASE2, RNASE3 возникли около 50 миллионов лет назад в результате процесса дупликации. Кроме эозинофилов, RNASE2 также продуцируют гепатоциты и нейтрофилы [41].
Молекула RNASE2 (молекулярная масса 15,5 кДа) состоит из 134 аминокислотных остатков. RNASE2 была идентифицирована в 1981 году как эозинофильный протеин, обладающий токсическим действием на клетки и вызывающий поражение мозжечка (феномен Гордона), в связи с чем получивший название «эозинофильный нейротоксин» (eosinophil-derived neurotoxin — EDN) [14]. RNASE3 (15,5 кДа) представляет собой аргининобогащенный (19 из 133 аминокислот) катионоактивный протеин [33]. Оба протеина близки по биохимическим характеристикам, но RNASE3 проявляет более выраженную противогельминтную активность [39]. В неактивном состоянии эозинофилов рибонуклеазы RNASE2, RNASE3 накапливаются в больших специфических цитоплазматических гранулах [41].
Протеин RNASE7 (14,5 кДа) был идентифицирован Jьrgen Harder и Jens-Michael Schrцder в 2002 году (рис. 5) [23]. Молекула RNASE7 обогащена лизиновыми остатками (18 из 128 аминокислот) [53]. Было показано, что RNASE7 продуцируется как кератиноцитами кожи, так и эпителиоцитами слизистой оболочки носовой полости, трахеи и бронхов. Для RNASE7 характерна конститутивная и индуцибельная продукция. Основными триггерами механизмов синтеза RNASE7 являются патоген-ассоциированные молекулярные структуры, IL-1b, IFN-g [11, 23].
Механизм действия рибонуклеаз A
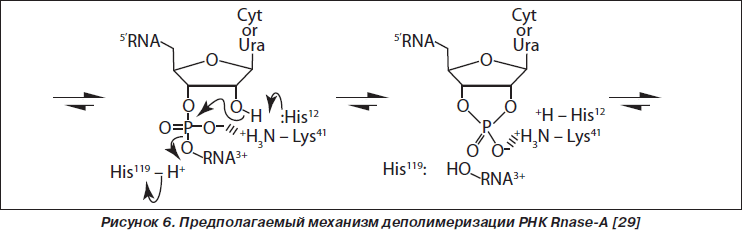
Основной функцией RNase-A является деполимеризация рибонуклеиновых кислот путем гидролиза 3’,5’-фосфодиэфирных связей одноцепочечных РНК (оцРНК) при участии двух гистидиновых (His12 и His119) и одного лизинового остатка (Lis41), формирующих каталитическую щель [3, 12, 37, 43].
Благодаря каталитической активности представители суперсемейства RNase-A участвуют как в регуляции синтеза белка, предопределяя скорость гидролиза матричных РНК, защите макроорганизма от РНК-содержащих вирусов [39], так и в разнообразных физиологических и патологических процессах (табл. 2) [8, 15, 39].
Противоинфекционное действие RNASE2, RNASE3 и RNASE7
Практически с момента идентификации RNASE3 и RNASE7 было установлено, что они обладают бактерицидной активностью по отношению к грамотрицательным и грамположительным бактериям [1, 8, 53]. Показано, что RNASE3 подавляет рост колоний Staphylococcus aureus и Escherichia coli [23, 40]. RNASE7 характеризуется как очень мощной антибактериальной активностью, превосходящей по силе действия дефензины, против различных патогенных микроорганизмов, включая Staphylococcus aureus, Escherichia coli, Pseudomonas aeruginosa, Enterococcus faecium, Propionibacterium acnes, так и противогрибковой активностью, в частности против Candida albicans [23, 53]. Jьrgen Harder и Jens-Michael Schrцder показали [23], что RNASE7 проявляет очень высокую бактерицидную активность против ванкомицинустойчивого Enterococcus faecium (LD90 < 0,03 микромоль), даже более выраженную, чем человеческий b-дефензин-3 (LD90 ~ 0,5 микромоль). По всей вероятности, RNASE3 играет существенную роль в процессе саногенеза острых инфекционных заболеваний респираторного тракта, вызванных бактериальными внутриклеточными инфекциями. Так, Chun-Jen Chen и соавт. [47] показали, что в сыворотке крови у детей, больных микоплазменной пневмонией, достоверно повышается концентрация RNASE3, достигая уровня 28,88 мкг/мл при норме 4,48 мкг/мл.
Молекулярные механизмы бактерицидного действия RNASE3 и RNASE7 остаются недостаточно ясными. В настоящее время существует несколько гипоз. Предполагают, что протеин RNASE3, дестабилизируя липидный слой мембран, организует поры в мембранах бактериальных клеток [51, 53] и активирует бактериальный аутолизис [22]. Yu-Chie Huang и соавт. [46] считают, что бактерицидное действие RNASE7 связано с литической активностью четырех специфически сгруппированных лизиновых остатков (Lys1, Lys3, Lys111, Lys112). Молекула RNASE7 может связываться катионоактивными аминокислотными остатками с отрицательно заряженными компонентами бактериальной мембраны и лизировать мембрану бактерии. Однако авторы не исключают возможности взаимодействия RNASE7 с RNASE7-связывающими протеинами бактериальной мембраны, которые представляют собой субъединицы мембранных пор бактерий. Данное взаимодействие приводит к открытию пор и фатальному высвобождению внутриклеточного содержимого микроорганизмов.
RNASE2 и RNASE3 обладают противовирусной активностью по отношению к респираторно-синцитиальному вирусу [13, 17, 41, 54]. Simon Phipps и соавт. [20] показали, что оцРНК респираторно-синцитиального вируса, являясь лигандом TLR7, индуцирует функциональную активность эозинофилов, в частности специфическую дегрануляцию, высвобождение рибонуклеаз, экспрессию фагоцитарного рецептора CD11b. Участие эозинофилов в процессе ответной реакции на инфекцию сопровождается более быстрой элиминацией вируса из организма. Также было продемонстрировано, что рекомбинантная RNASE2 снижает способность респираторно-синцитиального вируса проникать в эпителиальные клетки [38].
RNASE2 обладает противовирусной активностью и по отношению к вирусу иммунодефицита человека [30]. По всей вероятности, в основе противовирусного эффекта RNASE лежит не прямое протеолитическое действие рибонуклеазы на внеклеточные формы вириона, а взаимодействие RNASE и с клеткой-мишенью, и с вирусными поверхностными компонентами [55]. У RNASE7 не установлено противовирусного действия [53].
Иммуномодулирующее действие RNASE2
В настоящее время показано непосредственное влияние RNASE2 на иммунную систему. Так, установлено, что RNASE2 является исключительным хемоаттрактантом, обладающим высокоспецифическим действием на дендритные клетки (DC). RNASE2, прямо или косвенно взаимодействуя с неидентифицированным пертуссисчувствительным G-протеиновым рецептором, вызывает активацию p44/42 MAPK, обусловливая хемотаксис DC [18]. Сила хемотаксической активности RNASE2 сопоставима с эффектом стромального фактора роста 1a (stromal-derived growth factor — 1a/SDF-1a). RNASE2 предопределяет и созревание DC (CD34), которые ответственны за продукцию физиологически существенных объемов IL-6, регулятора активации нормальной Т-клеточной экспрессии и секреции (RANTES, CCL5), TNF-a, макрофагального хемоаттрактантного протеина 2 (MCP-2), макрофагального воспалительного протеина 1a (MIP-1a, CCL3) и интерферон-g-индуцируемого протеина 10 кДа (IP-10, CXCL10) [39]. Продемонстрировано, что RNASE2 является эндогенным лигандом TLR2, взаимодействие с которым приводит к активации адаптерной молекулы MyD88 и возбуждению внутриклеточных сигнальных путей. RNASE2 способствует индукции Th2-ответа [19, 39]. Некоторые исследователи не без основания относят RNASE2 к особой молекулярной группе, представители которой получили название смерть-ассоциированных молекулярных структур (damage-associated molecular pattern proteins — DAMP). Представители DAMP-группы участвуют в функционировании сигнальной системы раннего оповещения иммунной системы. При высвобождении из внутриклеточного пространства DAMP проявляют высокую провоспалительную или даже повреждающую активность [6, 34].
Участие RNASE3 в ремоделировании легочной ткани
RNASE3 стимулирует продукцию TGF-b1 фибробластами легочной ткани, предопределяя развитие фиброза [16]. В настоящее время остается неизученным вопрос, участвует ли катионоактивный протеин RNASE2, как RNASE3, EPO и MBP [35], в ремоделировании легочной ткани.
Заключение
Филогенетически древнейшее суперсемейство RNase-A, которое у человека организовано 13 представителями эндонуклеаз, участвует во множестве физиологических процессов организма, в том числе в регуляции транскрипции и трансляции, ангиогенеза, апоптоза клеток, неспецифической защите респираторного тракта и ремоделировании легочной ткани. RNASE3 и RNASE7 обладают выраженной бактерицидной активностью по отношению к грамотрицательным и грамположительным бактериям. RNASE3 играет существенную роль в процессе саногенеза острых инфекционных заболеваний респираторного тракта, вызванных бактериальными внутриклеточными инфекциями. RNASE2 и RNASE3 обладают противовирусной активностью по отношению к респираторно-синцитиальному вирусу. RNASE2 оказывает непосредственное влияние на иммунную систему, способствуя матурации и хемотаксису DC, а также индукции Th2-ответа. Разработка новых лекарственных средств на основе Rnase-A, которые в своем большинстве характеризуются высокой активностью и минимальной иммуногенностью, поможет разрешить многие противоинфекционные и онкологические проблемы [45]. В частности, в настоящее время для лечения злокачественной мезотелиомы и рака легкого проходит клинические испытания препарат Ranpirnase (Onconase), полученный на основе RNase лягушки (Rana pipiens) (ONC, Alfacell Inc, Нью-Джерси, США) [46].
Список литературы находится в редакции