Журнал «Здоровье ребенка» 4 (31) 2011
Вернуться к номеру
Хеликобактерная инфекция у детей: особенности диагностики и лечения
Авторы: Абатуров А.Е., Герасименко О.Н. Днепропетровская государственная медицинская академия Леоненко Н.Й. Коммунальное учреждение «Детская городская клиническая больница № 1» г. Днепропетровска
Рубрики: Педиатрия/Неонатология
Версия для печати
В статье представлены литературные данные о механизмах и роли хеликобактерной инфекции в развитии заболеваний гастродуоденальной зоны, особенности диагностики и терапии.
Helicobacter pylori, факторы патогенности, эрадикационная терапия.
Заболевания пищеварительного тракта занимают одно из ведущих мест в патологии детского возраста, их распространенность среди детского населения в Украине достигла 148,95 ‰ [6]. В структуре заболеваний органов пищеварения ведущее место (50–75 %) занимает патология желудка и двенадцатиперстной кишки [4, 6].
Открытие в 1983 г. австралийскими учеными R. Warren и B. Marshall микроорганизма Helicobacter pylori (Н.pylori) радикально изменило научный взгляд на патогенез воспалительных заболеваний желудочно-кишечного тракта человека. Исследователи Barry James Marshall и Robin Warren сумели выделить и культивировать спиралевидные микроорганизмы, найденные на слизистой оболочке желудка (СОЖ) больного, страдающего гастритом. Описанный микроорганизм был включен в международную таксономию бактерий в 1985 году как Campylobacter pyloridis. В 1987 году его переименовали в Campylobacter pylori, а в 1989 году C.S. Goodwin и группа ученых окончательно идентифицировали бактерию как Helicobacter pylori, доказав, что генетически она не принадлежит к роду Campylobacter [9]. Последний термин отражает 2 морфологических признака: in vivo — микроорганизм спиралевидный (helical), in vitro — палочковидный (bacter). В 1998 году геном Н.pylori был полностью расшифрован. В 2005 году первооткрыватели медицинского значения бактерии Robin Warren и Berry Marshall были удостоены Нобелевской премии по медицине. Патологоанатом Robin Warren и его молодой 28-летний коллега интернист Berry Marshall сделали свое открытие, работая в г. Перте в Западной Австралии, где имелась всего 1 больница. Значение открытия R. Warren и B. Marshall трудно переоценить: оно потребовало пересмотра традиционных взглядов на возникновение, развитие и терапию широкого круга заболеваний. В дальнейшем активное изучение Н.pylori выявило многочисленные факты его участия в развитии и прогрессировании ряда заболеваний не только гастродуоденальной зоны, но и внегастральных проявлений [5, 7, 11, 13, 17, 18, 23], а эпидемиологические исследования свидетельствуют о высокой распространенности хеликобактерной инфекции, прежде всего у детей [15].
Н.pylori является клинически значимым патогеном, ответственным за существенную часть общей заболеваемости и смертности по всему миру. В 1987 г. создана Европейская группа по изучению пилорического хеликобактера (The European Helicobacter pylori Study Group) — неправительственная структура, призванная координировать усилия различных групп исследователей. В 1990 г. на IX Международном конгрессе гастроэнтерологов принята Сиднейская классификация гастритов, отводящая H.pylori роль одного из пяти диагностических критериев. В 1994 г. согласительная комиссия Американского национального института здоровья (U.S. National Institute of Health) признала ведущую роль H.pylori в возникновении и развитии язвенной болезни, а Международное агентство по изучению рака (International Agency for Research on Cancer, Франция) отнесло H.pylori к канцерогенам I типа вследствие существования эпидемиологической связи Н.pylori с развитием аденокарцином и лимфом слизистой оболочки желудка. Н. pylori является первой бактерией, которая классифицирована Международным агентством по исследованию рака как доказанный канцероген.
Хеликобактерная инфекция представляет собой одну из наиболее распространенных хронических инфекций человека. Инфицированность Н.pylori у взрослого населения в различных регионах мира варьирует от 40 до 90 %, в странах СНГ — 70–80 %. Распространенность пилорического хеликобактера в различных регионах мира определяется как уровнем экономического развития страны, так и социальным уровнем отдельных групп населения внутри страны. В Китае инфицировано 55–85 % населения, в Колумбии — 93 %, в Великобритании — 15 %, в Дании — 25 %, в Италии — 10–63 %, в США — 15–80 %.
Заселяя желудок человека, Н.pyloriможет персистировать годы, десятилетия и даже всю жизнь. У многих пациентов Н.pylori может определяться как симбиотический и непатогенный микроорганизм, что усложняет решение вопроса о целесообразности назначения специфической терапии. Н.pylori является особенным патогенным агентом, который у большинства инфицированных вызывает бессимптомное течение. Однако пациенты с бессимптомным течением являются группой риска, в которой со временем развивается хронический гастрит, язвенная болезнь желудка, язвенная болезнь двенадцатиперстной кишки, экстранодальная В-клеточная MALT-лимфома или аденокарцинома желудка [7, 18].
Человек приобретает H.pylori в раннем детстве, обычно после первого года жизни. Наиболее вероятна передача инфекции от матери к ребенку и от ребенка к ребенку, риск приобретения инфекции высоко коррелирует с инфекционным статусом матери и родных братьев/сестер, а также связан с условиями жизни в перенаселенных семьях [11, 12, 23].
Механизм передачи — контактно-бытовой. Однако Н.pyloriбыстро гибнет за пределами желудка человека вследствие воздействия более высокой концентрации кислорода и даже света [15]. Наиболее вероятные пути передачи — гастро-оральный (возможен при гастроэнтерите с рвотой); орально-оральный — при попадании слюны инфицированного человека к здоровому (при поцелуях, т.к. Н.pyloriмогут выживать в слюне и зубном налете; облизывании сосок, пользовании общими столовыми приборами и др.); редко — ятрогенный (доказана возможность переноса Н.pyloriот одного человека к другому через плохо обработанные инструменты при различных зондовых процедурах, через недостаточно продезинфицированные эндоскопы и щипцы для биопсий). Фекально-оральная передача возможна в условиях, при которых Н.pyloriпроходит транзитом через нижние отделы желудочно-кишечного тракта, что маловероятно. Не исключается возможность передачи Н.pyloriс микроаэрозолями, которые образуются при разговоре или кашле [22].
Раннее детство — критический период по инфицированию Н.pylori. С возрастом вероятность Н.pylori-инфицирования уменьшается. Н.pylori — единственный известный на сегодняшний день микроорганизм, который способен к колонизации в условиях агрессивной кислой среды желудка человека (но быстро погибает при низком значении рН в просвете желудка). Н.pylori — особый микроорганизм, который инфицирует человека на протяжении тысячелетий, имеет специфичную среду обитания — адгезия Н.pylori происходит только на эпителии желудка и на участках желудочной метаплазии двенадцатиперстной кишки или гетеротопии в толстой кишке [18, 11]. Бактерия Н.pylori имеет развитые сложные защитные механизмы, позволяющие ей избегать агрессивного воздействия желудочного сока, выживать в слизистой оболочке желудка, прикрепляться к желудочному эпителию и взаимодействовать как с ним, так и с иммунными клетками хозяина [1, 7, 8, 12].
Н.pylori — микроаэрофильная грамотрицательная бактерия, имеющая изогнутую S-образную или слегка спиралевидную форму с полярно расположенными жгутиками. Другая форма Н.pylori — кокковидная. Пептидогликан стенки кокковидной формы бактерии является слабым активатором естественного иммунного ответа. Переход в кокковидную форму может быть следствием трансформации клеточной стенки в целях модуляции иммунитета. Н.pylori превращается в кокковидную форму в анаэробном пространстве тонкого кишечника, фагоцитируется дендритными клетками и стимулирует иммунитет хозяина путем воздействия на пейеровы бляшки. H.pylori-положительные лица имеют популяцию иммуноцитов, включая регуляторные Т-клетки, которая отсутствует у H.pylori-отрицательных лиц. Эти клетки могут проявлять системную иммуномодулирующую активность. H.pylori обладает способностью формировать биопленки, что способствует устойчивости бактерии к антибиотикотерапии и защищает от иммунного ответа хозяина, тем самым увеличивая ее выживаемость в кислой и агрессивной среде желудка [20].
Н.pylori имеет выраженные энзимные системы. Уреаза, главный фермент Н.pylori, расщепляет мочевину (в т.ч. пищевых продуктов, мочевину из кровяного русла) до аммиака и углекислоты. Уреазная активность выражена практически у всех штаммов Н.pylori, в связи с чем используетсядля диагностики хеликобактериоза. Наличие в своем микроокружении «облачка» щелочных продуктов предохраняет возбудителя от воздействия кислой среды (буферный эффект аммиака) и способствует размножению Н.pylori (рН 6,0–8,0). Происходит своеобразный «обман» секреторного аппарата — стимуляция гастрина, снижение секреции соматостатина и постоянная стимуляция соляной кислоты.
Наличие в желудочном соке аммиака нарушает митохондриальное и клеточное дыхание, вызывая некротическое повреждение слизистой оболочки желудка и способствуя развитию антрального гастрита и гипергастринемии. Н.pylori выделяет муциназу, которая вызывает деполимеризацию и растворение защитной слизи желудка, способствуя повышению проницаемости для ионов водорода. Н.pylori продуцирует также такие повреждающие СОЖ ферменты, как каталаза (предотвращает фагоцитоз Н.pylori), фосфолипаза (разрушает сурфактаноподобный фосфолипидный защитный слой СОЖ), гемолизин, липаза, протеаза, оксидаза, многочисленные адгезины.
Наиболее изученными факторами вирулентности НР являются вакуолизирующий цитотоксин А (VacA), «островок патогенности» генов Сag-PAI, встроенный в геном наиболее вирулентных штаммов НP, и его маркер цитотоксин-ассоциированный ген A (cytotoxic-associated gene — СagА) [8, 10, 14, 18, 21].
Более 40 генов патогенности (вирулентности) Н.pylori не разбросаны по хромосоме, а собраны в одном из ее сегментов, названном «островком патогенности» — CаgPAI. «Островок патогенности» встроен в геном наиболее вирулентных штаммов Н.pylori. Его маркер — белок CagA с мол. массой 120–140 кД, кодируемый геном citotoxin associated gene А — СagA. Обязательный атрибут вирулентности — наличие в Cаg-PAI генов системы секреции IV типа (type IV secretion system — TFSS), которые кодируют макромолекулярные структуры, функционирующие как мелкие иголки для передачи бактериальных агентов от Н.pylori в клетки хозяина, вводят плазмидную ДНК, что позволяет НР модулировать метаболизм эпителиоцитов слизистой оболочки желудка, включая и экспрессию протоонкогенов. Существует гипотеза, что СagА PAI H.pylori может служить новой транспортной системой для секреции факторов вирулентности [8, 18, 21].
VacA — это цитотоксин, формирующий поры. VacA играет важную роль в жизнедеятельности Н.pyloriв организме человека. Чтобы оказать токсическое действие, VacA должен быть секретирован бактерией и доставлен в активной форме к мембране клетки хозяина, в которой он формирует поры, выпускающие наружу ионы хлора [60]. У VacA есть несколько токсигенных свойств, которые могут влиять на исход инфекции и колонизации Н.pylori. Наиболее изученным у VacA является эффект эндосомной мутации, приводящий к вакуолизации эпителиальных клеток. Предполагается, что VacA встраивается в мембраны эндосомных пузырьков, формирует поры с активными каналами ионов хлора и изменяет состав анионов внутри эндосом, что впоследствии приводит к осмотическому набуханию. VacA способен также вызывать утечку ионов мелких молекул, таких как железо, никель, сахара и аминокислоты, нарушая барьерную функцию плотных соединений без больших разрушений их целостности. Возможно, это и есть механизм, с помощью которого Н.pylori получает питательные вещества через неповрежденный эпителиальный барьер [14].
Другой важной особенностью патогенности Н.pylori является его способность блокировать протонные помпы париетальных клеток, в результате чего преходящая гипохлоргидрия способствует другим инфекциям, например гельминтозам. При неблагоприятных условиях Н.pylori может трансформироваться в атипичную кокковую форму, т.е. менее уязвимую для антибиотиков, затем вновь в полноценную S-образную форму.
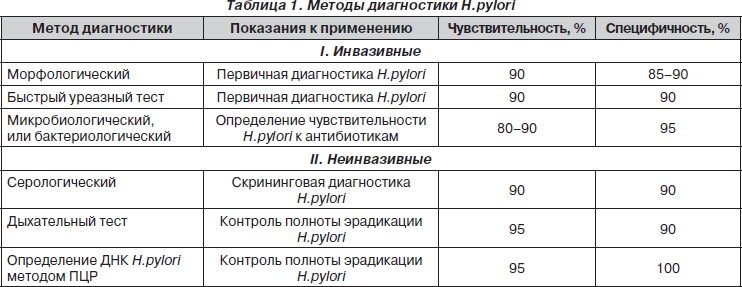
Среди всех методов диагностики Н.pylori выделяют две большие группы — инвазивные и неинвазивные методы. Инвазивные основаны на исследовании биоптатов при проведении ФЭГДС, неинвазивные не требуют проведения эндоскопического исследования. До настоящего времени не разработано универсального метода диагностики Н.pylori, который бы достиг 100% чувствительности и специфичности. Каждый метод обладает своими преимуществами и недостатками, которые определяют его показания к применению в клинической практике [2, 4].
Методы диагностики представлены в табл. 1.
Современная терапия хеликобактер-ассоциированной гастродуоденальной патологии предполагает эрадикацию Н.pylori. Первые Европейские рекомендации по диагностике и лечению хеликобактерной инфекции — Маастрихтский консенсус — были приняты в Маастрихте (Нидерланды) в 1996 г. К 2000 г. стала очевидной необходимость пересмотра рекомендаций 1996 г., и в 2000 г. появляется «Маастрихт-2». 17–18 марта 2005 г. во Флоренции (Италия) ведущими мировыми экспертами были рассмотрены проблемы хеликобактер-ассоциированной патологии ЖКТ. Вероятно, чтобы не нарушать традиции, рекомендации по диагностике и лечению инфекции Н.pylori получили название Маастрихтского соглашения-3 («Mаастрихт-3»). Уже в «Маастрихте — 2» предлагалось рассматривать возможность неудачного лечения хеликобактерной инфекции, поэтому планировать сразу не только терапию первой линии (first-line therapy), но и терапию второй линии (second-line therapy). Такая рекомендация присутствует и в «Маастрихте-3» [16].
В соответствии с современными положениями лечение НР-инфекции должно быть экономически доступным для больного, хорошо переноситься, обеспечивая достаточно высокую частоту эрадикации НР (не менее 80 %).
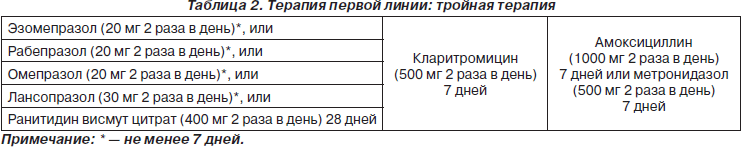
Наиболее широко используется семидневная трехкомпонентная схема с ингибитором протонной помпы (ИПП) и двумя антибиотиками. Действие этих препаратов направлено как на снижение кислотообразующей функции желудка, так и на уничтожение Н.pylori на поверхности слизистой оболочки. ИПП не обладает антихеликобактерной активностью, но повышает рН желудочного секрета. При этом вегетативные формы Н.pylori, существующие на поверхности слизистой оболочки антрального отдела желудка, защищающие себя от воздействия кислоты аммиачной оболочкой, в щелочных условиях погибают под воздействием образованного ими же аммиака. Происходит своеобразное «самоубийство» Н.pylori. Те бактерии, которые сохранились в фундальном отделе в виде кокков, при увеличении рН в желудке переходят в вегетативную форму и становятся доступными воздействию антибиотиков.
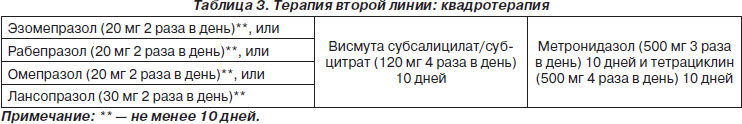
Состав эрадикационных схем первой и второй линий, согласно Маастрихтскому консенсусу 2005 г., представлен в табл. 2, 3.
В соответствии с положениями Маастрихтского консенсуса-3, эрадикация Н.pylori у детей проводится теми же препаратами, что и у взрослых, но с расчетом суточных доз лекарств исходя из массы тела.
Если проводимая схема лечения не привела к эрадикации Н.pylori, необходимо считать, что бактерия устойчива к препаратам, входящим в данную схему, и для эрадикации Н.pylori используется четырехкомпонентная висмутсодержащая схема. При отсутствии эффективности повторного курса лечения необходимо определить чувствительность штамма Н.pylori ко всему спектру используемых антибиотиков.
Контрольное исследование необходимо провести через 6 недель после окончания антихеликобактерной терапии и использовать для этого два разных диагностических метода. Биопсия должна проводиться не только из антрального отдела, но и из тела желудка, куда могут мигрировать бактерии на фоне лечения препаратами, угнетающими желудочную секрецию.
Несмотря на то, что in vitro Н.pylori высокочувствителен к медикаментозному воздействию, лечение Н.pylori-ассоциированного заболевания представляет собой длительный процесс, требующий определенных усилий как от врача, так и от пациента
Согласительное совещание «Маастрихт-3» настоятельно рекомендовало осуществление стратегии test and treat (тестирование на Н.pylori и последующее лечение), которая считается особенно показанной в странах с высокой инфицированностью населения H.pylori. Однако ни одна из рекомендованных схем эрадикационной терапии не достигает 100% эффекта. Почему же все рекомендации так или иначе обращают внимание врача на возможность неудачного исхода эрадикационной терапии?
Более чем 25-летний опыт лечения хеликобактерной инфекции показал, что эрадикация становится все более трудной задачей, поскольку микроорганизм быстро приобретает устойчивость к антибактериальным препаратам.
Неудовлетворительные результаты классических эрадикационных схем заставляют проводить повторные курсы лечения, в связи с чем существует необходимость не только поиска новых эффективных схем эрадикации первой линии, оптимально работающих в условиях высокой антибиотикорезистентности, но и разработки новых направлений в проведении антихеликобактерной терапии, воздействуя на другие звенья патогенеза хеликобактерной инфекции.
Раскрытие молекулярных механизмов неспецифического врожденного иммунитета, в частности роли Toll-like рецепторов (TLR) и TLR-аксессуарных молекул, позволило уточнить значение последних в развитии хеликобактерной инфекции у детей. Особую роль в развитии инфекционно-воспалительного процесса, вызванного грамотрицательными инфекционными агентами, в том числе H.pylori, играет TLR4. TLR4 участвует в распознавании широкого диапазона лигандов, в частности LPS грамотрицательных бактерий, в том числе и LPS H.pylori. Рекогниция PAMP инфекционных агентов TLR происходит при непосредственном их взаимодействии или при взаимодействии, опосредованном аксессуарными молекулами [1, 3, 12, 19, 23].
Учитывая важную роль TLRs в реализации врожденного иммунного ответа TLR-аксессуарных молекул, участвующих в рекогниции LPS H.pylori, в частности sCD14, новым направлением в лечении хеликобактерной инфекции у детей может быть медикаментозная регуляция активности TLR4 и продукции sCD14.
1. Абатуров О.Є., Герасименко О.М. Модуляція активності TLR4 епітеліоцитів слизової оболонки шлунка при хелікобактерній інфекції (огляд літератури) // Современная педиатрия. — 2009. — № 6 (28). — С. 141-146.
2. Паролова Н.И., Корниенко Е.А., Дмитриенко М.А. Сравнительная оценка эффективности современных методов диагностики инфекции Helicobacter pylori // Consilium Medicum. Педиатрия. — 2008. — № 1. Режим доступа: http://www.consilium-medicum.com/magazines/cm/
3. Сківка Л.М., Позур В.В. Реакції за участю toll-like-рецепторів у проективному імунітеті та за патологічних станів // Укр. біохім. журн. — 2008. — Т. 80, № 3. — С. 5-20.
4. Сучасна діагностика хелікобактерної інфекції у дітей: Методичні рекомендації / Білоусов Ю.В., Павленко Н.В., Солодовниченко І.Г., Ганзій О.Б., Савицька К.В. — К., 2006. – 22 с.
5. Фадеенко Г.Д. Инфекция Helicobacter pylori: итоги 20-летнего изучения ее патогенности // Вісн. Харк. нац. ун-ту. Серія «Медицина». — 2004. — Вип. 7, № 614. — С. 115-118.
6. Шадрин О.Г., Герасимюк С.И. Язвенная болезнь в практике детского гастроэнтеролога // Сучасна гастроентерологія. — 2009. — № 4 (48) — С. 76-82.
7. Шкитин В.А., Шпирна А.И., Старовойтов Г.Н. Роль Helicobacter pylori в патологии человека // Клиническая микробиология и антимикробная химиотерапия. — 2002. —Т. 4, № 2. — С. 128-145.
8. Algood Holly M. Scott, Cover Timothy L. Helicobacter pylori Persistence: an Overview of Interactions between H.pylori and Host Immune Defenses // Clinical Microbiology Reviews. — 2006. — Т. 19, № 4. — С. 597-613.
9. Andamme P., Falsen E., Rossau R., Hoste B., Segers P., Tytgat R., De Ley J. Revision of Campylobacter, Helicobacter, and Wolinella Taxonomy: Emendation of Generic Descriptions and Proposal of Arcobacter // International Journal of Systematic Bacteriology. — 1991. — V. 41, № 1. — С. 88-103.
10. Baghaei K., Shokrzadeh L., Jafari F. et al. Determination of Helicobacter pylori virulence by analysis of the Cag pathogenicity island isolated from Iranian patients // Digestive and Liver Disease. — 2009. — № 41. — Р. 634-638.
11. Blaser M.J., Atherton J.C. Helicobacter pylori persistence: biology and disease // J. Clin. Investig. — 2004. — V. 113. — Р. 321-333.
12. Pacifico L., Anania C., Osborn F J., Ferraro F., Chiesa C. Consequences of Helicobacter pylori infection in children // World J. Gastroenterol. — 2010. — № 16 (41). — P. 5181-5194.
13. Franceschi F., Gasbarrini A. Helicobacter pylori and extragastric diseases // Clinical Gastroenterology. — 2007. — V. 21, № 2. — Р. 325-334.
14. Ivie S.E., McClain M.S., Torres V.J., Holly M. Scott Algood, Lacy D.B., Yang R., Blanke S.R., Cover T.L. Helicobacter pylori VacA Subdomain Required for Intracellular Toxin Activity and Assembly of Functional Oligomeric Complexes // Infection and Immunity. — 2008. — Т. 76, № 7. — С. 2843-2851.
15. Malaty Hoda M. Epidemiology of Helicobacter pylori infection // Clinical Gastroenterology. — 2007. — Vol. 21, № 2. — P. 205-214.
16. Malfertheiner P. Maastricht guidelines: an evolving concept. Maastricht-3 Guidelines for Helicobacter pylori infection. United European Gastroenterology Week. Copenhagen 2005.
17. Malfertheiner P., Fry L.C., Monkemuller K. Can gastric cancer be prevented by Helicobacter pylori eradication? // Clinical Gastroenterology. — 2006. — V. 20, № 4. — Р. 709-719.
18. Manuel R. Amieva, Emad M. El-Omar. Нelicobacter pylori. Взаимодействие хозяина и инфекции // Клиническая гастроэнтерология и гепатология. Украинское издание. — 2008. — Т. 1, № 2. — С. 91-107.
19. Robinson K., Argent R., Atherton J. The inflammatory and immune response to Helicobacter pylori infection // Clinical Gastroenterology. — 2007. — Vol. 21, № 2. — P. 237-259.
20. Stark R.M., Gerwig G.J., Pitman R.S., Potts L.F., Williams N.A., Greenman J., Weinzweig I.P., Hirst T.R., Millar M.R. Biofilm formation by Helicobacter pylori // Letters in applied microbiology. — 1999. — Т. 28, № 2. — С. 121-126.
21. Shibata W., Hirata Y., Maeda S. et al. CagA protein secreted by the intact type IV secretion system leads to gastric epithelial inflammation in the Mongolian gerbil model // J. Pathol. — 2006. — V. 210. — P. 306-314.
22. Vale F.F., Vitor J.M.B. Transmission pathway of Helicobacter pylori: Does food play a role in rural and urban areas? // International Journal of Food Microbiology. — 2010. — № 138. — Р. 1-12.
23. Veres Gabor, Pehlivanoglu Ender. Helicobacter pylori Infection in Pediatrics // Helicobacter. — 2007. — № 12 (Suppl. 1). — P. 38-44.