Журнал «Здоровье ребенка» 1(1) 2006
Вернуться к номеру
Етіологія, патогенез, діагностика, лікування та профілактика сепсису новонароджених
Авторы: О.П. Волосовець, д.м.н., С.П. Кривопустов
Національний медичний університет ім. О.О. Богомольця, м. Київ
Рубрики: Медицина неотложных состояний, Акушерство и гинекология, Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
Сепсис — це генералізована реакція макроорганізму на інфекцію, а сепсис новонароджених — це клінічний синдром системного захворювання, що супроводжується бактеріємією та зустрічається в неонатальному періоді життя. Наявність клінічних проявів відрізняє цей стан від транзиторної бактеріємії, що може виявлятися в деяких здорових немовлят.
Згідно з визначенням, прийнятим у 1991 р. на Узгоджувальній конференції Американської колегії пульмонологів та Асоціації медицини критичних станів (American College of Chest Physicians / Society of Critical Care Medicine Consensus Conference), діагноз сепсису встановлюється лише тоді, коли має місце синдром системної запальної відповіді, що розвинувся внаслідок інфекції, тобто спостерігаються клінічні докази існування інфекційного процесу та (або) виділення із внутрішнього середовища організму культури збудників.
Класифікація неонатального сепсису передбачає виділення: внутрішньоутробного (антенатальна або інтранатальна контамінація мікроорганізмами), постнатального сепсису, а також розрізнення видів сепсису за вхідними воротами: умбілікальний, шкіряний, легеневий, кишковий, уросепсис, отогенний тощо. Часто встановити вхідні ворота неонатального сепсису неможливо, навіть при паталогоанатомічному дослідженні, з цієї причини питома вага випадків сепсису без чіткої локалізації первинного вогнища інфекції значна (38% за даними Ю.Ф. Ісакова, Н.В. Белобородової, 2001).
Виділяють також септицемію — сепсис без метастазів, та септикопіємію — сепсис із гнійними метастазами; ранній (early-onset), що виникає протягом 72 годин після народження, та пізній (late-onset), що виникає після перших трьох діб життя дитини. Окремо виділяють внутрішньолікарняний сепсис, що вкрай актуально для новонароджених груп високого ризику при інфікуванні флорою неонатального відділення.
Головні фактори ризику при неонатальному сепсисі: недоношеність, безводний період понад 24 години, чоловіча стать, гарячка матері 38,3°С та більше, меконіальні, сморідні, мутні навколоплідні води, хоріоамніоніт, материнські інфекції, особливо сечостатевої системи, колонізація шийки матки бета-гемолітичним Str. групи В, асфіксія при нарожденні або інша патологія, що по-требувала реанімаційних заходів та/або тривалого утримання від ентерального харчування. До факторів ризику розвитку нозокоміального сепсису в новонароджених відносять: низьку масу тіла при народженні, наявність периферичного венозного катетеру понад 3 доби, пупкового венозного катетеру понад 7 днів, центрального катетеру понад 10 днів, респіраторного дистрес-синдрому при надходженні дитини до відділення, використання Н2-блокаторів, повне парен-теральне годування, наявність назогастрального зонду, некротичний ентероколіт, ураження шкіри, переведення в інші лікувальні установи тощо.
Навпаки, грудне вигодовування підвищує резистентність новонародженої дитини до інфекції шляхом передачі йому материнських антитіл та інших захисних чинників.
Етіологія неонатального сепсису є різноманітною. Для ранньої неонатальної інфекції характерні наступні збудники: Str.B, E.coli, Klebsiella spp., En-terococ., Listeria m., Str.pneum., Str.A., Hem. influenzae, N.gonoc., Clostrid.spp., Bacteroides spp. Для пізньої інфекції: Staph.aureus, E.coli, Klebs.spp., Str.epiderm., Candica alb., Pseudomonas spp., Serratia spp. При трансплацентарному інфікуванні (гематогенному) переважають віруси, трепонеми, лістерії, кандиди, при інтранатальному — інші мікроорганізми.
Існує також певна взаємозалежність між локалізацією вогнища сепсису й характером мікрофлори, що ініціює розвиток генералізованого інфекційно-запального процесу. Так, при інтраабдомінальному сепсисі це, як правило, ентеробактерії, анаероби, ентерококи. У дітей з імунодефіцитним станом знач-ну роль в етіології відіграють нозокоміальні штами грамнегативних та грампозитивних бактерій (Pseudomonas aeruginosa, Acinetobacter spp., Klebsiella pneumoniae, E.coli, Enterobacter spp., Staph.aureus). Ангіогенний сепсис, як правило, викликається стафілококами. У різних стаціонарах можуть бути різні збудники інфекції. У цілому, у доантибіотикову еру домінував бета-гемолітичний стрептокок групи А, у п’ятдесяті роки — золотистий стафілокок, в останні де-сятиріччя підвищилось значення грамнегативної флори, потім за рахунок надто широкого застосування цефалоспоринів ІІІ генерації стали розглядати понов-лення значення грампозитивної флори. Сьогодні дуже важливе значення мають епідермальний стафілокок, протей, клебсієли, підвищується роль неклостридіальних анаеробів, грибів та вірусів.
Надзвичайно серйозна проблема сучасності — розвиток резистентності госпітальних штамів збудників до поширених антимікробних засобів. Розвиток цієї стійкості, зокрема, пов’язаний з продукцією бактеріями бета-лактамаз розширеного спектру, з гіперпродукцією хромособних бета-лактамаз. Крім продукції бета-лактамаз — головного механізма резистентності, мають значення й інші механізми: звуження поринового канальцу бактеріальної стінки з порушенням проникності, зміна рецептора-мішені як результат хромосомних мутацій бактерії, активне виділення антибіотиків із клітини, перехресна резистентність за рахунок наявності R-плазмід (ДНК-носіїв генів резистентності).
З огляду на це цікавим є повідомлення Американського товариства інфекційних хвороб, що опублікувало в 2006 році перелік найбільш небезпечних інфекцій, що є розповсюджені та резистентні до антибіотикотерапії: метицилін-резистентний Staphylococcus aureus, Аcinetobacter baumannii, Escherichia coli, Klebsiella, Aspergillus, ванкоміцинрезистентний Enterococcus faecium та Pseudomonas aeruginosa.
У патогенезі неонатального сепсису слід особливу увагу приділяти таким питанням, як вхідні ворота інфекції, позабар’єрне проникнення мікроорганізму, наявність у мікроорганізма факторів вірулентності (ліпополісахариди, пептидо-глюкан, екзотоксин у зв’язку із суперантигеном) та неадекватну імунологічну відповідь «хазяїна». Сепсис не можна вважати результатом прямої дії мікроорганізмів на макроорганізм, необхідно розглядати цей стан як наслідок суттєвих порушень в іммунній системі, що проходить у своєму розвитку від стану збит-кової активації (фаза гіперзапалення) до стану імунодефіциту (фаза імунопараліча). При цьому макроорганізм є активним учасником цього аутодеструктивного процесу.
При інвазії збудника захист організму новонародженої дитини відбувається за рахунок двох реакцій: 1) запалення та 2) імунітет. Виділяють три головні лінії клітинного захисту: 1) макрофаги, клітини ендотелію, тромбоцити; 2) поліморфноядерні лейкоцити, мікрофаги; 3) Т-, В-лімфоцити. Активізовані ма-крофаги виробляють протизапальні цитокіни: фактор некрозу пухлин TNF, інтерлейкіни IL-1, IL-6. Ці цитокіни активують поліморфноядерні лейкоцити, що виділяють медіатори запалення ІІ порядку (ефекторні медіатори): простагландини, лейкотриєни, оксид азоту, вільні радикали кисню. Зокрема окис азоту при взаємодії з супероксидними радікалами може перетворюватися в токсичний пероксинітрит-радикал. Якщо баланс між медіаторами запалення і їх антагоністами не відновлюється, запальні цитокіни спричиняють виникнення клінічних симптомів сепсису.
Ендотоксин (найбільш активний — ліпополісахарид) грає роль тригера, тобто пускового механізму в розвитку септичного шоку. У відповідь на дію ендотоксину відбувається утворення великої кількості медіаторів системної запальної відповіді — цитокіни (IL-1, IL-6, IL-8, IL-10, TNF, простгагландинів, лейкотрієнів, PAF, ф-ра ХІІ, системи компліменту), що викликають вазодилятацію, підвищення проникності судин, стимулюють агрегацію та активізацію тромбоцитів, нейтрофілів, формують розвиток ДВЗ-синдрому. Ефекторні меді-атори призводять до порушення термінальної перфузії, пошкодження клітинних та субклітинних мембран, інтерстиціальному та внутрішньоклітинному набряку й гибелі клітини.
Вазодилятація, ендотеліальні ушкодження, підвищення проникності судин, синдром втрати рідини з капілярів, зменшення наповнення судинного рус-ла призводить до розвитку шоку. При цьому внаслідок неадекватної перфузії життєво важливих органів, порушення метаболізму, накопичення молочної ки-слоти і розвитку декомпенсованого ацидозу відбуваються морфологічні зміни в органах і тканинах, розвивається синдром поліорганної недостатності.
Цікаві прогностичні критерії рівня молочної кислоти при розвитку септичного шоку в новонароджених запропонували T.D. Dure, W. Batt, M. Soth (1997) (табл. 1).
Таблиця 1. Прогностичні критерії рівня молочної кислоти (L) при розвитку септичного шоку в новонароджених за T.D. Dure, W. Batt, M. Soth (1997)

Тому так важливо правильно проаналізувати анамнез, фактори ризику, оцінити загальний клінічний стан дитини. У новонародженого порушення мікроциркуляції й ознаки недостатньої перфузії тканин найбільш ярко проявляються з боку шкіри — виявляють блідість, мраморність, сіруватий або жовтяничний її колір. Нерідко живіт здутий, можлива венозна сітка та набряки на передній черевній стінці, гепатомегалія, ділянки склереми, дитина вкрай швидко охолоджується під час огляду, вираз обличчя стражденний, сердитий. Дитина млява або, навпаки, значно збуджена.
У цілому, можливі наступні клінічні прояви неонатального сепсису з боку різних органів та систем:
— недостатній температурний контроль, лихоманка понад 37,7°С / гіпотермія менше 36,5°С, різниця між пахвовою і базальною температурою;
— ЦНС: млявість / збудливість, гіпорефлексія, тремор / судоми, кома, напруження / вибухання переднього тім’ячка, аномальний рух очей, м’язова гіпотонія / збільшення тонусу;
— респіраторний тракт: тахіпное, апное, ціаноз / підвищена потреба в кисні, за-дишка, стогін на видиху, нерегулярні дихання, ретракція, хрипи;
— гастроінтестинальний тракт: слабке смоктання, блювання, діарея, метеоризм, набряк / еритема черевної стінки, гастроінтестинальна кровотеча, позитивний тест на кров у стулі, гепатомегалія, ехографічно збільшений жовчний міхур;
— шкіра: висип / еритема, пурпура / петехії, пустули / параніхії, омфаліт, плями, склерема, набряки;
— система крові: жовтяниця, пряма гіпербілірубінемія, кровотеча, спленомегалія, згущення крові;
— система кровообігу: симптом «білої плями», блідість / ціаноз, холодна шкіра, тахікардія, аритмія, артеріальна гіпотензія;
— метаболізм: метаболічний ацидоз, гіпер- або гіпоглікемія, глюкозурія, синдром порушеної секреції антидіуретичного гормону тощо.
Часто новонароджені із сепсисом мають різноманітну супутню патологію, що вносить особливості в клінічні прояви (внутрішньошлуночкові крововиливи, відкрита артеріальна протока тощо).
Діагностичні заходи при сепсисі новонародженого включають:
2. Аналіз сечі загальний та бактеріологічний посів.
4. Забарвлення за Грамом та бактеріологічне дослідження виділень з ендотрахе-альної трубки, уражених ділянок шкіри, порожнин суглобів, з очей, з носоглотки, при амніоніті — із зовнішнього слухового проходу, а також дослідження плеврального випоту.
5. Посів кала.
6. При підозрі на ДВЗ-синдром — коагулограма
7. За показаннями — специфічна вірусологічна діагностика: сечі, кала, крові (полімеразна ланцюгова реакція, електронна мікроскопія, виділення вірусу, дослідження імуноглобулінів, зокрема IgM у пуповинній крові)
8. Бактеріологічне та патологічне дослідження плаценти.
9. Рентгенографія грудної клітки, черевної порожнини, ехографія нирок, нейро-сонографія, ехокардіографія тощо.
Таблиця 2. Деякі лабораторні ознаки, що характерні для сепсису новонароджених
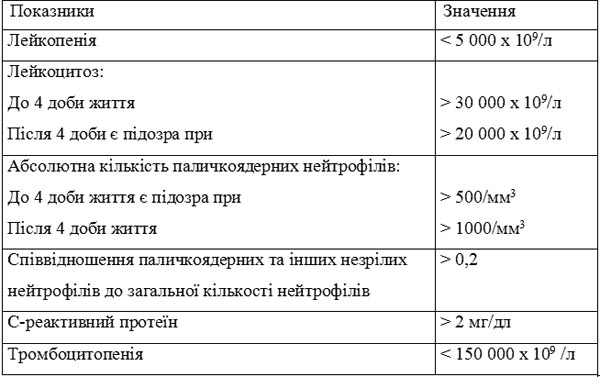
Одним з перспективних маркерів сепсису сьогодні вважають прокальцитонін. Збільшення концентрації його виявляють уже через 2-3 години після роз-витку сепсису (при важких бактеріальних, грибкових та протозойних інфекціях), натомість при вірусних захворюваннях він майже не знаходиться. Протягом перших двох діб життя його концентрація фізіологічно підвищена до 21 нг/мл (норма у дітей — до 0,5 нг/мл) за відсутності сепсису, починаючи з третьої доби життя вона нормалізується.
Терапія неонатального сепсису передбачає:
— організацію спеціального догляду та вигодовування;
— вплив на збудник інфекції;
— інфузійну терапію, зокрема з метою підтримки гемодинаміки, об’єму — циркулюючої крові, корекції осмолярності плазми, проведення дезінтоксикації, корекції порушень обмінних процесів тощо;
— респіраторну підтримку (за показаннями);
— імунотерапію;
— місцеву санацію гнійних вогнищ (за показаннями);
— посиндромну та ситуаційну терапію.
Новонароджена дитина з наявністю сепсису має отримувати лікування в спеціалізованому відділенні в кувезі або на спеціальному неонатальному столику з підігрівом із дотриманням усіх правил температурного режиму та асептики.
Вигодовувати дитину краще материнським молоком, шлях його введення залежить від загального стану дитини. Звичайно застосовують назо- або орогастральний зонд. При виходжуванні немовлят з масою тіла при народженні менше 1500 г, за наявності некротичного ентероколіту, синдрому мальабсорбції, гострої ниркової недостатності, коми та інших важких станів потрібне проведення парентерального харчування (слід пам’ятати, що в програмі парентерального харчування в дітей із сепсисом знижується доза інтерліпіду).
Обов’язковою є наявність адекватного венозного доступу для проведення адекватної інфузійної терапії. Потрібно забезпечити дитині підтримку гемодинаміки, адекватне надходження рідини, електролітів, енергії. Проводяться дезінтоксикація, корекція порушень обмінних процесів (корекція ацидозу за умови адекватної вентиляції легенів) тощо. При цьому слід враховувати толерантність дитини до глюкози та осмолярність плазми крові.
Внутрішньовенна реанімація об’ємом — перша ланка у невідкладній до-помозі новонародженому з шоком, до цієї терапії за умови нормоволемії в подальшому додають дофамін або добутамін. Свіжозаморожена плазма, зокрема, застосовується у разі гіповолемії на тлі синдрому екстравазації рідини. При розвитку септичного шоку досить ефективна екстракорпоральна мембранна окси-генація.
Режим оксигенотерапії визначається залежно від показників насичення крові киснем та даних газів крові. Зволожений та підігрітий кисень може пода-ватися безпосередньо в кувез, у кисневу палатку, через «вуси» або маску, а також з використанням ендотрахеальної трубки. Залежно від стану дитини визна-чають режим штучної вентиляції легенів — підконтрольна, допоміжна вентиляція, режим самостійного дихання під постійним позитивним тиском тощо.
Головна мета штучної вентиляція легенів — забезпечення потрібної окси-генації та вентиляції дитини, вона показана при наявності будь-якого з перерахованих нижче станів: апное з брадикардією та ціанозом або важке періодичне дихання на тлі зниженого насичення гемоглобіну киснем або апное, частота дихання більше 70 за хвилину, ціаноз, що зберігається під час проведення оксигенотерапії, виражені ретракції або дихання типу «гаспінг», артеріальна гіпотензія, блідість і знижена периферична перфузія, тривала важка брадікардія, Ра-СО2 понад 60 мм рт.ст., РаО2 менше 50 мм рт.ст., рН менше 7,25 переважно за рахунок дихального ацидозу, значні відхилення від норми на рентгенографії органів грудної клітини (С. Езутачан, Д. Добрянський, 2002).
Центральне місце в лікуванні сепсиса посідають антибіотики. Золоте пра-вило їх застосування — краще розпочати лікування ними завчасно й виявити, що це було непотрібно, ніж очікувати підтвердження діагнозу сепсису, тоді вже може бути занадто пізно! Стартова внутрішньовенна антибіотикотерапія розпочинається емпірично, з препаратів широкого спектру. І лише з часом, після отримання результатів бактеріологічного дослідження, вона може бути скорегованою. Після отримання бакпосівів антибіотик змінюється, тільки якщо відсутній його клінічний ефект на тлі недоведеної його чутливості. При виборі стартової антимікробної терапії слід враховувати мікрофлору та її чутливість у даній лікувальній установі.
Можливими її варіантами можуть бути:
— ампіцилін + гентаміцин;
— ампіцилін + цефотаксим (особливо при ураженні нирок);
— ванкоміцин + гентаміцин або ампіцилін + цефуроксим (при підозрі на стафілококову інфекцію);
— ампіцилін + цефотаксим + гентаміцин (при менінгіті);
— при некротичному ентероколіті додатково призначають метронідазол.
При лікуванні новонароджених групи високого ризику на тлі застосування двох антибіотиків з п’ятої доби застосовують профілактично флуконазол, а при розвитку кандидозного сепсису застосовують амфотерицин Б, 5-флуороцитозин чи флуконазол. Проблема застосування гентаміцину — формування резистентних штамів Klebsiella pn., що має місце протягом останніх років.
Проблема застосування ампіциліну — збільшення адгезивності умовно-патогенних мікроорганізмів.
Препаратами резерву є карбапенеми (іміпінем / циластатин), цефалоспо-рини IV генерації (цефепім, цефпіром). Фторхінолони (ципрофлоксацин) заборонені до застосування в неонатології і використовуються інколи лише за життєвими показаннями, що має бути чітко обгрунтовано в історії хвороби.
Тривалість лікування звичайно при сепсисі не менше 10-14 діб, при менінгіті 14-28 діб, але сьогодні доцільно відмовитися від поняття «тривалість курсу антибіотико терапії», їх застосовувати треба стільки, скільки продовжується їх клініко-лабораторний ефект.
Цілеспрямована антимікробна терапія при неонатальних інфекціях: Streptococcus gr. B — пеніциліни + аміноглікозиди; Staphylococcus aur. та Staphylococcus ep. — ванкоміцин або нафцилін; Pseudomonas aur. — тикарцилін або цефалоспорини ІІІ генерації + амікацин; Anaerobic bacteria — кліндаміцин; Chlamidia — макроліди (Sh.B. Korones, 1993).
В інтервенційній імунотерапії викорисовують внутрішньовенне введення імуноглобулінів (пентаглобін 500 мг/кг на добу протягом трьох діб, сандоглобін, інтерглобін та ін.).
Здійснюється різноманітна посиндромна терапія (боротьба із серцевою недостатністю, ДВЗ-синдромом тощо).
Щодо експериментальної терапії, що розробляється (блокування ефектів ендотоксину та цитокінів), слід згадати такі відомості, що пентоксифілін гальмує утворення TNF, цитопротекторні антиоксидантні властивості мають вітамін Е та есенціале, ібупрофен знижує продукцію вільних радикалів. З’явилися відомості щодо успішного застосування гранулоцитарного колонійостимулюю-чого та гранулоцитарно-макрофагального колонійостимулюючого факторів. Ро-зробляються й інші препарати (анти-LPS, анти-TNF, антагоністи рецепторів IL-1, інгібітори NO-синтетази, антилейкотрієнові та антипростагландинові речовини тощо) та імунні засоби, включаючи методи генної інженерії.
Профілактика сепсису полягає в суворому дотриманні санітарно-епідемічного режиму на всіх етапах медичного обслуговування новонародженого згідно з нормативними документами МОЗ України.
Дуже важливо ретельно використовувати на практиці рекомендації щодо інфекційного контролю. При вході до палати новонароджених, відділення інтенсивної терапії слід мити руки, нігті та передпліччя протягом 2-3 хвилин щіткою з антимікробним засобом. Також перед і після кожного контакту з дитиною руки слід ретельно мити антимікробним милом. Усі каблучки, браслети та годинник треба зняти. Ці рекомендації дуже важливі для запобігання розвитку перехресних інфекцій. Слід пам’ятати, що головні шляхи передачі інфекції — апаратура та руки медичного персоналу.
Потрібно жорстко дотримуватися стандартів маніпуляцій, нормативів ку-батури приміщень, проводити грамотну спеціальну обробку кувезів, шлангів, зволожувачів, клапанів, фільтрів тощо, використовувати маркери інфекцій у відділенні, здійснювати раціональний розподіл медичних сестер, які обслуговують дітей з різними інфекціями у відділенні, застосовувати малі розфасовки для внутрішньовенних розчинів, здійснювати суровий контроль за роботою молочної кухні тощо.
В анте- та інтранатальній профілактиці слід розглядати питання здоров’я жінок, профілактики ускладнень вагітності, грамотне ведення пологів, раннє прикладання новонародженого до грудей, природнє вигодовування, спільне перебування дитини та матері в пологовому будинку.
1. Шабалов Н.П. Неонатология. У 2-х томах. — Том 2. — СПб.: Спеціальна література. — 1996. — 505 с.
2. Sprung C.L. Definitions of sepsis — Have we reached a consensus? // Crit. Care Med. — 1991. — V. 19. — P. 849-851.
3. Lacques J., Proulx F. Multiple Organ Dysfunction Syndrome / Fourth European Postgraduate Course in Neonatal and Pediatric Intensive Care. — Chapter 23. — Berne, Switzerland. — March 11-13, 1999.
4. Livingston D.H. , Mosenthal A.C., Deitch E.A. Sepsis and multiple organ dysfunction syndrome: A clinical-mechanistic overview // New Horizons. — 1995. — V. 3. — P. 257-266.
5. Nathens A.B., Marshall J.C. Sepsis, SIRS, and MODS: What's in a name? // World J. Surg. — 1996. — V. 20. — P. 386-391.
6. Добрянський Д. Сепсис новонароджених: новий погляд на стару проблему / III Міжнародна конференція «Актуальні проблеми неонатології». — Львів — Детройт: Львівський обласний неонатальний центр, 1998. — С. 8-23.
7. Неонатология: Пер. з англ. / Під ред. Т.Л. Гомеллы, М.Д. Каннигам. — М.: Медицина, 1995. — 640 с.
8. Педіатрія: Пер. з англ. / Під ред. Дж.Грефа. М.: Практика. — 1997. — 912 с.
9. Lacques J. Cytokines and Metabolism / Fourth European Postgraduate Course in Neonatal and Pediatric Intensive Care. — Chapter 16. — Berne, Switzerland. — March 11-13, 1999.
10. Korones S.B. , Bada-Ellzey H.S. Neonatal Decision Making. — St. Louis: Mosby — Year Book, Inc, 1993. — 286 p.
11. Klein J.O., Marcy S.M. Bacterial sepsis and meningitis // Klein J.O., Remington J.S. (Eds.) In-fection Diseases of the Fetus and Newborn Infant. — Philadelphia: W.B. Saunders Company. — 1983. — P. 697.
12. Nathens A.B. , Marshall J.C. Sepsis, SIRS, and MODS: What's in a name? // World J. Surg. — 1996. — V. 20. — P. 386-391.
13. Newborn Manual / Ed. J. R. Pleasure. — 5th Ed. — Philadelphia: Hospital of the University of Pennsylvania, 1993. — 303 p.
14. Pediatric Medicine / Ed. M.E. Avery, L.R. First. — Baltimore: Williams & Wilkins. — 1989. — P. 115-215, 301-403.
15. Ферсмольд Х. Основные положення неонатологии: Пер. с нем. — 7-е изд. — Клініка педіатрії Вільного університету м.Берліна, Клініка ім. Б. Франклина, 1997. — 185 с.
16. Young T.E., Mangum O.B. NeoFax ‘93: A Manual of Drugs Used in Neonatal Care. — 6th Ed. — Columbus, Ohio: Ross Laboratories, 1993. — 209 p.
