Журнал «Здоровье ребенка» 3 (30) 2011
Вернуться к номеру
Роль адреномедуллина в системе неспецифической защиты респираторного тракта
Авторы: Абатуров А.Е. Днепропетровская государственная медицинская академия
Рубрики: Педиатрия/Неонатология
Версия для печати
Полифункциональный пептид кальцитонинового суперсемейства ADM и РАМР участвует во множестве пато- и физиологических процессов организма, в том числе в неспецифической защите респираторного тракта от инфекционных агентов. ADM и РАМР проявляют выраженную антибактериальную активность против как грамположительных, так и грамотрицательных бактерий. ADM принимает активное участие в регуляции процесса воспаления, апоптотической смерти клетки, продукции сурфактанта.
Введение
Адреномедуллин (ADM) — полифункциональный пептид кальцитонинового суперсемейства, в которое также входят кальцитонин, два пептида, связанные с геном кальцитонина (aCGRP, bCGRP — calcitonin gene-related peptide), амилин, интермедин (адреномедуллин-2) [58]. Впервые ADM был выделен японскими учеными K. Kitamura и соавт. [17] в 1993 году как вещество с выраженным гипотензивным и натрийуретическим действием у больных с феохромоцитомой. В последующем было показано, что ADM обладает антибактериальным, иммунорегулирующим, бронхо-, вазодилатирующими и другими свойствами [43, 61]. В настоящее время представлены доказательства участия ADM в различных пато- и физиологических процессах. Показано, что у пациентов с артериальной гипертензией, протекающей с гипертрофией миокарда, наблюдается постепенное увеличение концентрации ADM в сыворотке крови и усиление представления его рецепторов на поверхности цитоплазматической мембраны различных клеток, особенно эндотелиоцитов и гладкомышечных клеток сосудов. Данные изменения способствуют снижению артериального давления [28, 48]. Уровень ADM в сыворотке крови повышен и у больных бронхиальной астмой, хроническими обструктивными заболеваниями легкого, с синдромом системного воспалительного ответа, инфекционно-токсическим шоком, сердечной недостаточностью, инфарктом миокарда, легочной артериальной гипертензией, хронической почечной недостаточностью, IgA-нефропатией, гломерулонефритом, циррозом печени, сахарным диабетом I типа, осложненным микроангиопатией, тиреотоксикозом, первичным гиперальдостеронизмом, злокачественными опухолями легких, пищеварительного тракта [49]. Концентрация ADM в сыворотке крови коррелирует с тяжестью заболевания [55, 61]. Показано, что введение ADM и натрийуретического пептида при декомпенсированной сердечной недостаточности способствует улучшению состояния пациентов [42].
Экспрессия ADM эпителиоцитами и макрофагами трахеи, бронхов и легких предполагает его активное участие в функционировании системы неспецифической защиты респираторного тракта [24, 54].
Краткая характеристика адреномедуллина
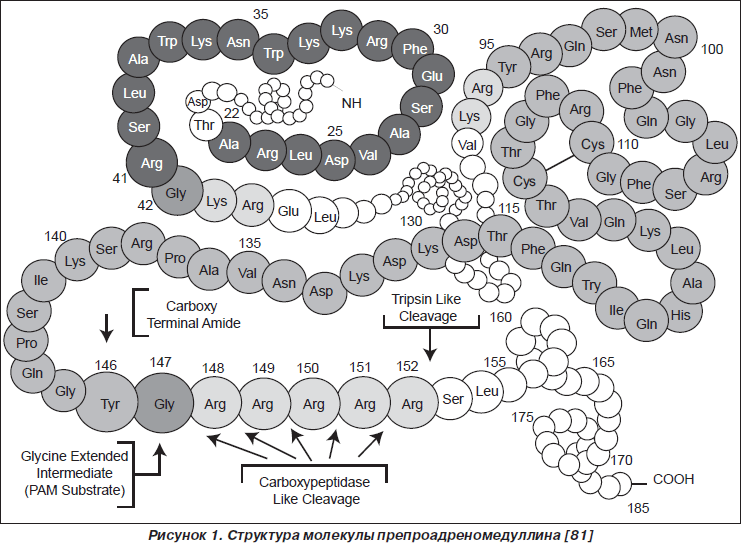
Первично в результате работы гена ADM синтезируется препроадреномедуллин, состоящий из 185 аминокислотных остатков (рис. 1), который после отщепления 21-го аминокислотного остатка N-конца становится проадреномедуллином. Последующее расщепление проадреномедуллина приводит к образованию двух биологически активных молекул ADM и РАМР (proadrenomedullin N-terminal 20-peptide) (рис. 2). [74, 76]. Ген, кодирующий синтез ADM, расположен на хромосоме 11 (11p11.1-3), состоит из 4 экзонов и 3 интронов [38].
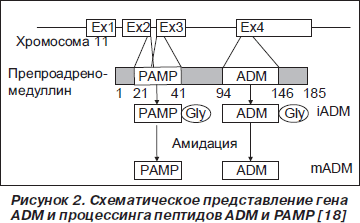
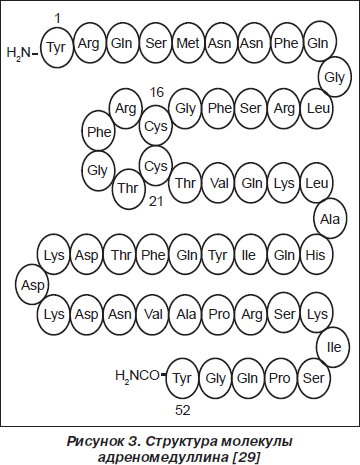
Молекула ADM состоит из 52 аминокислотных остатков и содержит кольцевую структуру из 6 аминокислотных остатков, поддерживаемую внутримолекулярным дисульфидным мостиком между 16-м и 21-м аминокислотными остатками (рис. 3) [38, 48]. PAMP состоит из 20 аминокислотных остатков проадреномедуллина [25].
Из клетки продуцента ADM секретируется в виде так называемого незрелого пептида (iADM), состоящего из 53 (52 + глициновый остаток) аминокислотных остатков, который в экстрацеллюлярном пространстве конвертируется в зрелую энзиматическую форму mADM. Однако 85 % сывороточного ADM составляет iADM [29].
Период полураспада ADM составляет 22,0 ± 1,6 минуты [35]. ADM разрушается нейтральными эндопептидазами [41].
Белки ADM и, по всей вероятности, РАМР находятся во всех биологических жидкостях и экспрессированы на поверхности практически всех слизистых оболочек человека, в том числе респираторного тракта, и играют существенную роль в неспецифической защите макроорганизма от бактериальной агрессии [5, 8, 9, 23, 45, 47, 61]. У людей в состоянии клинического здоровья ADM обнаруживается в сыворотке крови в концентрации 2–10 пикомоль/л, PAMP < 1 пикомоль/л, в слюне (60 пикомоль/л). При развитии инфекционного процесса уровень концентрации ADM повышается в 20 раз. Бактерицидный эффект ADM проявляется при его концентрации выше 500 пикомоль/л [24]. В сыворотке крови iADM находится в ассоциации с адреномедуллинсвязывающим белком (AMBP-1), который идентифицирован как фактор комплемента H (ингибитор классических и альтернативных путей активации комплемента) [37]. Связывание ADM с AMBP-1 снижает его антибактериальную активность и увеличивает способность активировать специфические рецепторы [29].
В респираторном тракте ADM продуцируется эпителиоцитами слизистой оболочки трахеи, бронхов, накапливаясь на апикальной поверхности мембраны клеток [31, 48, 60], нейтрофилами, альвеолярными макрофагами [55, 63, 81], эндотелиоцитами, гладкомышечными клетками сосудов [21], нейронами парасимпатической нервной системы [45].
Продукция ADM носит как конститутивный, так и индуцибельный характер. Усиление синтеза ADM клетками-продуцентами происходит в ответ на воздействие гипоксии через активацию HIF-1, бактериального липополисахарида (ЛПС), провоспалительных цитокинов (IL-1b и TNF-a), ангиотензина II, эндотелина I, оксида азота и гипергликемии [8, 50, 51, 60, 65, 66]. Продукция ADM эпителиоцитами преимущественно обусловлена индуктивным действием ЛПС; макрофагами — индуктивным действием ЛПС, ретиноевой кислоты, IFN-g; нейтрофилами — индуктивным действием IL-1b [55, 63, 81].
Повышение экспрессии мРНК ADM после индуцирующего воздействия ЛПС наблюдается в эпителиоцитах слизистой оболочки, эндотелиоцитах сосудов, альвеолярных макрофагах, макрофагах и клетках паренхимы легкого [30, 79]. Секреция ADM при индукции патогенассоциированными молекулярными структурами бактериального генеза осуществляется преимущественно макрофагальными клетками, а при гипоксическом воздействии — эпителиоцитами [20]. Усилению синтеза ADM макрофагами после воздействия ЛПС предшествует продукция IL-1b и TNF-f, которая опосредована возбуждением Toll-подобных рецепторов 4 (TLR-4) [57, 78].
Глюкокортикоиды, эстрадиол, TGF-b, IL-6 ингибируют продукцию ADM [81].
Эмбрионы мышей с нокаутным геном ADM погибают вследствие сердечно-сосудистых пороков на 13–14-й день внутриутробного развития [32, 33].
Механизм действия адреномедуллина
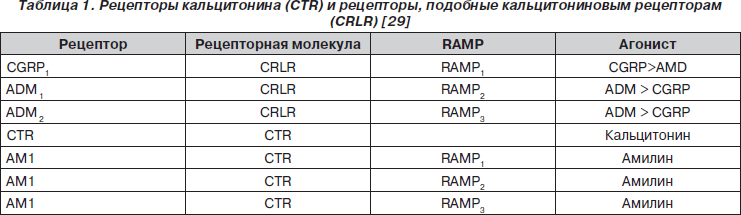
ADM реализует свое влияние на клетки организма через взаимодействие с рецепторами, подобными кальцитониновым рецепторам, которые относятся к G-рецепторам (табл. 1).
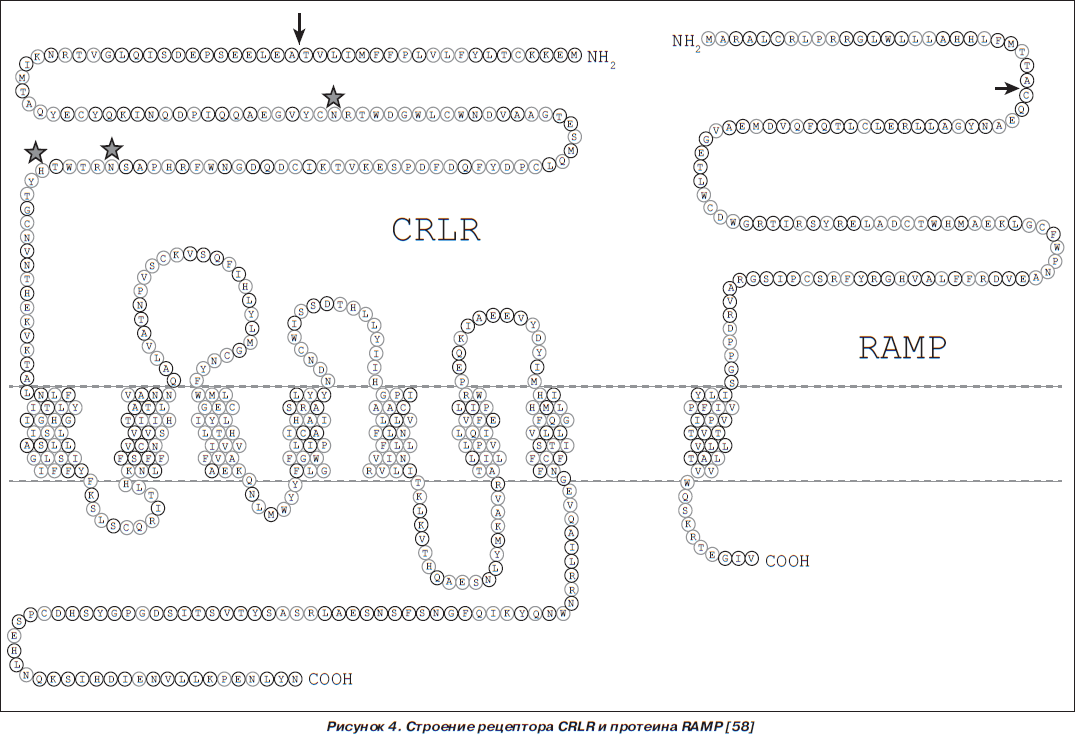
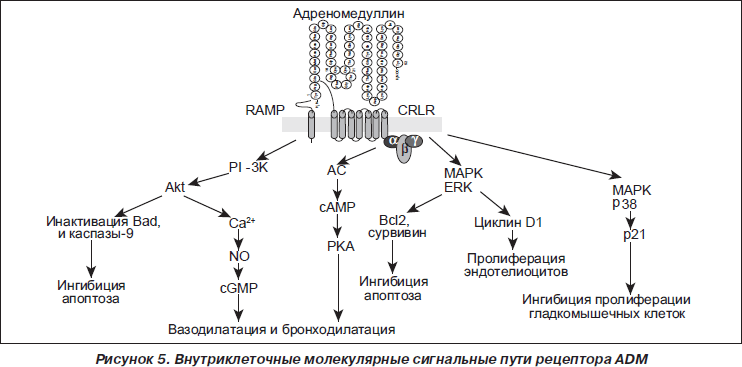
Гетеродимерные рецепторы CTR и CRLR, характеризующиеся высокой экспрессией в ткани легкого, функционируют в ассоциации с протеинами, модифицирующими активность рецептора (RAMP — receptor activity-modifying proteins) (рис. 4). В случае ассоциации CRLR с RAMP1 рецептор преимущественно взаимодействует с протеином CGRP, а в ассоциации с RAMP2 (ADM1-рецептором) или RAMP3 (ADM2-рецептором) — с ADM [70, 71, 77].
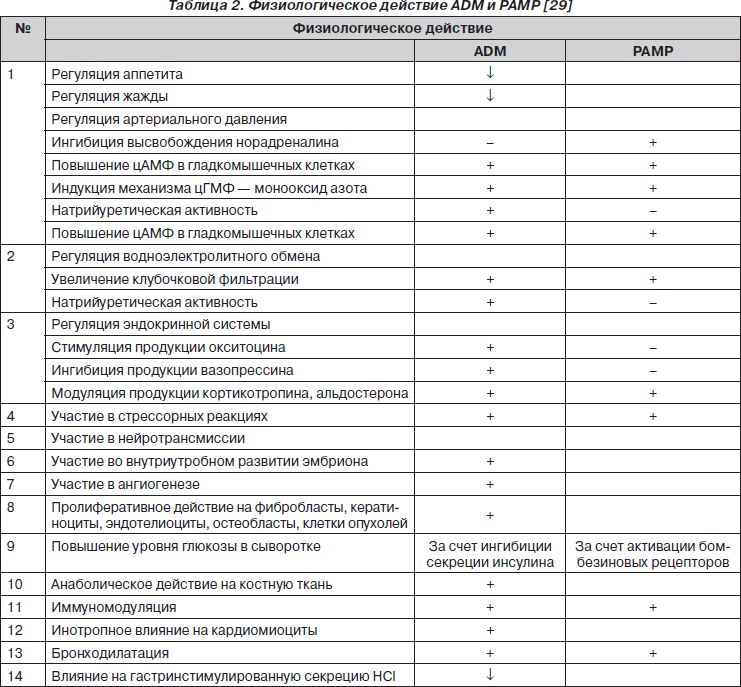
Плотность распределения ADM-связывающих сайтов в легких значительно выше, чем в других тканях человеческого организма [26, 39]. Во многих клетках организма активация рецепторов CRLR приводит: 1) к возбуждению аденилатциклазы, вызывая вазо- и бронходилатацию; 2) активации фосфатидилинозитол-3-киназы (PI-3K) и Akt, обеспечивая увеличение синтеза эндотелиальной нитрооксидсинтазы и сосудистого эндотелиального фактора роста (VEGF) в эндотелиоцитах; 3) индукции митогенактивируемых протеинкиназ (MAPK) экстрацеллюлярных сигналрегулируемых киназ (ERK), способствуя выживанию эндотелиоцитов (под влиянием ADM усиливается пролиферация и снижается уровень апоптоза эндотелиоцитов); 4) индукции MAPK в гладкомышечных клетках, обусловливая ингибицию их пролиферации (рис. 5) [4, 29, 49]. Характеристика физиологического действия ADM и РАМР представлена в табл. 2.
Противоинфекционное действие адреномедуллина
При развитии воспаления слизистых оболочек, вызванного микробными инфекционными агентами, концентрация ADM в надэпителиальном слое жидкости достигает достаточного уровня для оказания антибактериального эффекта [44]. ADM и РАМР проявляют антибактериальную активность против как грамположительных, так и грамотрицательных бактерий [23, 24, 48]. Установлено, что ADM проявляет выраженное антибактериальное действие против Escherichia coli, Streptococcusmutans и Actinomycesnaeslundii[8, 38]. Антибактериальный эффект ADM сопоставим с активностью нейтрофильного пептида (HNP), человеческого b-дефензина (hBD‑2) [54]. Было показано, что ADM через 30 минут после взаимодействия с Escherichiacoli вызывает разрушение ее внешней мембраны [64]. РАМР проявляет более выраженную антибактериальную активность, чем ADM, в частности, против Escherichiacoli [54].
Механизм противобактериального действия ADM до настоящего времени остается неизвестен. Учитывая подобие катионной активности ADM с антибактериальными пептидами (hBD-2 и цекропином), предполагают, что в основе его противобактериального действия лежит порообразующий механизм [34, 47]. Также исследования действия ADM против Escherichia coli и Staphylococcus aureus показали, что постсекреторная деградация ADM приводит к образованию множества фрагментов, которые обладают более выраженной антибактериальной активностью. Так, C-терминальные фрагменты (остатки 13-52, 16-52, 22-52 и 34-52) более чем в 200 раз активнее родительской молекулы ADM [64].
ADM не оказывает противогрибкового действия [8].
Иммуномодулирующее действие адреномедуллина
ADM принимает активное участие в регуляции процесса воспаления, проявляя про- и противовоспалительную активность в зависимости от условий и его концентрации [40, 43]. Так, низкие концентрации ADM и РАМР обусловливают хемотаксис тучных клеток, а их высокие концентрации индуцируют рецепторнезависимую дегрануляцию тучных клеток [6, 13]. Под действием ADM в различных условиях может происходить как индукция [14], так и ингибиция продукции IL-6 макрофагами и фибробластами [46, 78].
Преимущественно, ADM оказывает противовоспалительное действие. Так, внутривенное введение ADM 0,1 мкг/кг/мин крысам с экспериментальным острым респираторным дистресс-синдромом, который вызван ингаляциями ЛПС в дозе 1 мг/кг, приводило к уменьшению: 1) гистологических признаков поражения легочной ткани; 2) количества нейтрофилов, концентрации общего белка и уровней TNF-a, цитокининдуцированного нейтрофильного хемоаттрактанта (CINC) в бронхоальвеолярной жидкости; 3) активности апоптоза клеток альвеол [3].
ADM проявляет противовоспалительную активность, индуцируя продукцию IL-10 и ингибируя синтез IL-1b, IL-12, IFN-g, TNF-a, макрофагального воспалительного протеина (MIP-2), регулятора активации нормальной Т-клеточной экспрессии и секреции (RANTES/CCL5) [43, 46, 78, 81]. ADM способствует пролиферации натуральных Т-регулирующих CD4+CD25+-клеток, подавляющих активность Th1-зависимой воспалительной реакции [46]. ADM ингибирует formyl-Met-Leu-Phe-индуцированную экспрессию молекулы адгезии CD11b нейтрофилами через цАМФ-зависимый механизм, препятствуя активации и миграции нейтрофилов [15].
Комплекс ADM/AMBP-1 достоверно активнее, чем ADM, ингибирует продукцию провоспалительных цитокинов — TNF-a, IL-6. Противовоспалительный эффект ADM/AMBP-1 опосредован активацией аденилатциклазы и Pyk-2 (proline-rich tyrosine kinase-2) — ERK1/2 (extracellular signal-regulated kinase)-зависимой индукции рецепторов, активируемых пероксисомальным пролифератором g-типа (PPARg) [73]. Tatsuo Shimosawa и соавт. [68] показали, что ADM оказывает антиоксидантное действие, ингибируя генерацию активированных кислородсодержащих метаболитов. Представлены доказательства, что ADM предупреждает развитие сосудистого коллапса, некроза тканей и снижает уровень смертности при эндотоксическом шоке [52, 59, 80].
Провоспалительное действие ADM связано с его способностью вызывать деградацию ингибирующего фактора IkB — фактора транскрипции NF-kB, что обусловливает перемещение протеинов данного фактора транскрипции p50/p65 в ядро клетки и последующую активацию транскрипции генов провоспалительных цитокинов [69]. В начале инфекционного заболевания ADM стимулирует синтез IL-1b, IL-6, TNF-a [14]. Показано, что ADM индуцирует экспрессию адгезивных молекул E-селектина, VCAM-1 и ICAM-1, продукцию оксида азота (NO) эндотелиоцитами, фактора, ингибирующего миграцию (MIF — migratory inhibitory factor) активированными Т-лимфоцитами, моноцитами и макрофагами [2]. Пептид ADM является важным фактором выживания антигенактивированных Т-лимфоцитов [53].
ADM проявляет выраженное антиапоптотическое действие через PI-3K/Akt внутриклеточный сигнальный путь на различные типы клеток [1, 18, 28, 67], в связи с чем ADM играет не последнюю роль в развитии злокачественных опухолей [7]. Исключение составляют почечные мезенгиальные клетки, на которые ADM оказывает апоптотическое действие. В данных клетках ADM активирует каспазы-3 и -8, индуцирует c-Jun NH2-терминальную киназу (JNK) и p38 MAPK [72].
Другие эффекты адреномедуллина
ADM через 5–45 минут после взаимодействия с рецептором CRLR гладкомышечных клеток сосудов увеличивает внутриклеточную концентрацию цАМФ, что приводит к выраженной вазодилатации и продукции RAMP2, VEGF [36, 70, 75]. По мнению D. Smith и соавт. [19], ADM является одним из самых мощных эндогенных вазодилататоров, особенно для сосудов капиллярного региона кровеносного русла. ADM обладает не только вазодилатирующим, но и бронходилатирующим действием. Высокая конкордантность процессов синтеза ADM и NO, их способность вызывать бронхо- и вазодилатацию, оказывать антибактериальное действие позволили J. Agorreta и соавт. [20] предположить наличие единых или биохимически близких механизмов, регулирующих синтез этих факторов.
Взаимодействие ADM с рецепторами L1 альвеолоцитов II типа сопряжено с усилением продукции основного компонента сурфактанта — фосфатидилхолина [10, 62]. Ингаляции ADM достоверно уменьшают выраженность экспериментального гистамин-, ацетилхолин- и антигениндуцированного бронхоспазма у морских свинок [11, 16]. Дефицит ADM экспрессии в легочной ткани сопровождается развитием гиперчувствительности бронхиального дерева. H. Yamamoto и соавт. [12] считают, что ADM предупреждает развитие бронхоконстрикции, не только возбуждая внутриклеточный цАМФ-путь, но и ингибируя стрессиндуцированную пролиферацию гладкомышечных клеток стенок бронхиального дерева.
Заключение
Полифункциональный пептид кальцитонинового суперсемейства ADM и РАМР участвует во множестве пато- и физиологических процессов организма, в том числе в неспецифической защите респираторного тракта от инфекционных агентов. В ответ на микробное поражение слизистой оболочки эпителиоциты, макрофаги и нейтрофилы бысто реагируют продукцией ADM и РАМР, которые являются компонентами первой линии защиты и оказывают выраженное антибактериальное действие против как грамположительных, так и грамотрицательных бактерий. ADM принимает активное участие в регуляции процесса воспаления, апоптотической смерти клетки, продукции сурфактанта.
Список литературы находится в редакции