Журнал «Здоровье ребенка» 3 (30) 2011
Вернуться к номеру
Состояние перекисного окисления липидов и антиоксидантной защиты при остром гломерулонефрите у детей, проживающих в экологически неблагополучном регионе
Авторы: Конюшевская А.А. Донецкий национальный медицинский университет им. М. Горького
Рубрики: Педиатрия/Неонатология
Версия для печати
Острый гломерулонефрит у детей протекает с активацией перекисного окисления липидов и угнетением системы антиоксидантной защиты. Степень активации перекисного окисления липидов и угнетения системы антиоксидантной защиты зависит от многих факторов, в частности от формы гломерулонефрита, степени метаболических нарушений и других факторов, среди которых важная роль принадлежит неблагоприятным экофакторам, влиянию латентной вирусной инфекции. Уровень диеновых конъюгат и малонового диальдегида в плазме крови в начальный период острого гломерулонефрита превышал контроль в 1,6 раза, перекисный гемолиз эритроцитов был выше возрастной нормы в 1,8 раза. Уровень витамина Е в плазме крови снижался в 1,4 раза, уровень супероксиддисмутазы — в 1,3 раза, в меньшей степени уменьшалась общая антиокислительная активность плазмы крови — в 1,2 раза.
Дети, острый гломерулонефрит, перекисное окисление липидов, антиоксидантная система.
Введение
В развитии острого гломерулонефрита (ОГН) у детей и его исходе наряду с иммунными механизмами важную роль играют неиммунные, неспецифические механизмы — гемодинамические и метаболические. Мембранодеструктивные процессы при ОГН выражаются в усилении процессов перекисного окисления липидов (ПОЛ) и истощении факторов антиоксидантной защиты (АОЗ) [2, 4, 6, 11, 14]. У детей эти процессы выражены более ярко из-за незрелости физиологических и метаболических систем детского организма и влияния различных неблагоприятных факторов внешней среды [8]. Факторы техногенного загрязнения окружающей среды (загрязнение воздуха выбросами транспорта и промышленных предприятий, радиационное и ультрафиолетовое излучение, ксенобиотики, в том числе лекарства, пестициды, промышленные растворители и др.), ухудшение качества питания, чрезмерная физическая нагрузка, стресс и переутомление приводят к снижению уровня защитно-приспособительных механизмов детского организма и сопровождаются увеличением образования свободных радикалов и истощением системы АОЗ [1, 3, 5, 7–10].
Состояние ПОЛ и АОЗ у детей различного возраста с разными формами ОГН, проживающих в экологически неблагоприятном Донецком промышленном регионе, частота и особенности течения ОГН, наличие дисплазии соединительной ткани (ДСТ) изучены недостаточно, что отражается на отсутствии индивидуализированных программ применения антиоксидантов при данных заболеваниях у детей. Эти положения явились целью данного исследования.
Материалы и методы исследования
Обследовано 123 ребенка с различными формами ОГН в возрасте от 1 года до 15 лет, проживающих в разных городах Донецкого региона.
Среди обследованных у 69 (56,10 ± 5,97 %) больных ОГН протекал с нефритическим синдромом, у 22 (17,89 ± 8,36 %) — с нефротическим синдромом (НС), у 18 (14,63 ± 8,57 %) — с НС и гематурией, у 14 (11,38 ± 8,81 %) — с изолированным мочевым синдромом.
У всех больных проведено общепринятое клинико-лабораторное обследование. Об интенсивности процессов ПОЛ судили по содержанию в плазме крови продуктов ПОЛ — диеновых конъюгат (ДК), малонового диальдегида (МДА), перекисного гемолиза эритроцитов (ПГЭ). Состояние системы АОЗ оценивали по уровню общей антиокислительной активности (АОА) плазмы крови, супероксиддисмутазы (СОД), каталазы, по содержанию в плазме крови естественного антиоксиданта — альфа-токоферола.
Результаты и их обсуждение
Клинические проявления ОГН у детей Донецкого промышленного региона зависели от формы заболевания и существенно не отличались от описанных в литературе [12, 13], но характеризовались некоторыми особенностями. Уменьшилась частота моносимптомных случаев болезни. Отеки имелись у всех больных. Достоверно чаще встречались значительно и умеренно выраженные отеки (55,96 ± 4,75 %). Увеличилась длительность отечного синдрома, которая при НС в среднем составила 18,09 ± 2,08 дня, при НС с гематурией — 12,28 ± 1,30 дня, при нефритическом синдроме — 8,30 ± 0,60 дня. Артериальное давление при поступлении было повышенным у 77,06 ± 4,03 % больных. Длительность гипертонии зависела от формы ОГН. Средняя продолжительность артериальной гипертензии при нефритическом синдроме составила 9,39 ± 0,84 дня, при НС с гематурией — 12,44 ± 1,44 дня. Гематурия отмечена у всех больных, но при НС она была кратковременной, непостоянной и имела характер микрогематурии. При других формах ГН наблюдалась более стойкая гематурия разной степени выраженности. Чаще встречалась макрогематурия (67,48 ± 4,22 %). Особенностью ОГН у детей является наличие почти у половины больных (44,72 ± 4,48 %) наряду с протеинурией и гематурией лейкоцитурии, что, вероятно, является следствием тубулоинтерстициальных поражений при ОГН и, возможно, связано с массивным воздействием неблагоприятных экологических факторов.
Стигмы ДСТ были выявлены у 84,04 ± 3,78 % больных с ОГН, множественные стигмы ДСТ (3 и более) — у 39,36 ± 5,04 %, то есть у каждого третьего больного с ОГН. Стигмы дизэмбриогенеза выявлены у 91,49 ± 2,88 % больных ОГН, множественные стигмы дизэмбриогенеза — у 51,06 ± 5,16 % детей, то есть у каждого второго больного ОГН. Сочетание более 5 стигм ДСТ и дизэмбриогенеза имели 54,26 ± 5,13 % больных, то есть каждый второй больной с ОГН. Достоверно чаще 5 и более стигм ДСТ и дизэмбриогенеза выявлялись при ОГН с нефротическим синдромом (68,18 ± 10,16 %), с нефротическим синдромом с гематурией и гипертензией (78,57 ± 11,38 %).
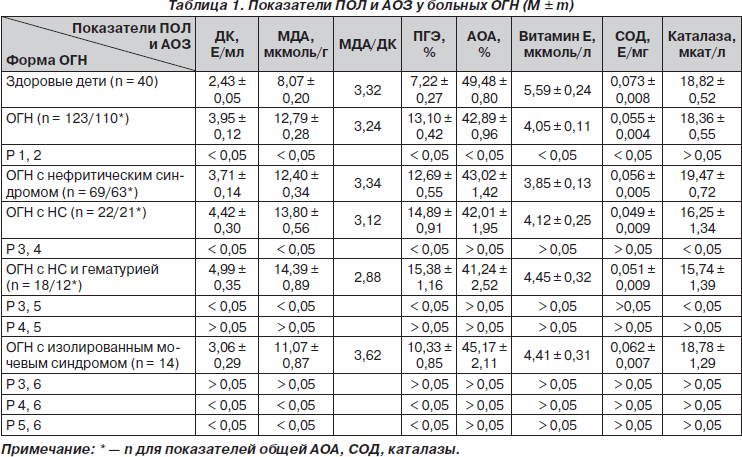
Состояние системы ПОЛ и АОЗ у детей с ОГН было нарушено (табл. 1). У всех больных ОГН отмечалась выраженная активация системы ПОЛ. Так, уровень ДК и МДА в плазме крови в начальном периоде ОГН превышал контроль в 1,6 раза, ПГЭ был выше возрастной нормы в 1,8 раза. Особенно значительно показатели ПОЛ повышались при ОГН с НС и ОГН с НС и гематурией, так уровень ДК был в 1,2–1,4 раза выше, чем при нефритическом синдроме, и в 1,4–1,6 раза выше, чем при изолированном мочевом синдроме. Наличие выраженных и длительных отеков, анасарки, высокой суточной протеинурии сопровождалось более выраженной активацией ПОЛ, тогда как выраженность и длительность гематурии не оказывали влияния на его показатели.
Степень активности ОГН коррелировала со степенью активации показателей ПОЛ: высокий уровень сиаловых кислот, ДФА, серомукоида, С-реактивного белка, циркулирующих иммунных комплексов, фибриногена, альфа2-глобулинов, СОЭ коррелировал с высокими показателями ПОЛ. Возраст детей не оказывал достоверного влияния на степень повышения показателей ПОЛ (р > 0,05). При гормонорезистентном варианте ОГН показатели ПОЛ в начальном периоде ОГН были более высокими, чем при гормоночувствительном варианте. Так, уровень МДА при гормоночувствительном варианте был 13,47 ± 0,64 мкмоль/г, при гормонорезистентном — 16,98 ± 0,86 мкмоль/г, соответственно ПГЭ — 14,44 ± 0,82 % и 19,69 ± 2,79 % (р < 0,05). Таким образом, высокие показатели ПОЛ могут быть одним из критериев, указывающих на наличие определенной гормонорезистентности. Наличие стигм ДСТ и дизэмбриогенеза оказывало влияние на степень повышения ПОЛ при ОГН у детей. У детей с 3 и более стигмами ДСТ уровень ДК в плазме крови составил 4,78 ± 0,29 Е/мл, тогда как у детей, имевших менее 3 стигм ДСТ, — 3,79 ± 0,14 Е/мл, соответственно уровень МДА — 14,03 ± 0,44 и 12,64 ± 0,36 мкмоль/г, ПГЭ — 15,05 ± 0,88 и 12,68 ± 0,58 % (р < 0,05).
Наряду с активацией системы ПОЛ у больных ОГН отмечалось умеренное снижение показателей АОЗ, степень снижения которых не соответствовала степени активации ПОЛ. Наиболее значительным было снижение уровня витамина Е в плазме крови, который при ОГН снижался в 1,4 раза, уровень СОД уменьшился в 1,3 раза, в меньшей степени снижалась общая АОА плазмы крови — в 1,2 раза. Уровень каталазы уменьшался в 1,2 раза только при ОГН с НС, с НС и гематурией. При нефритическом и изолированном мочевом синдромах каталаза была в пределах нормы. Форма ОГН, тяжесть течения, активность процесса, возраст детей, наличие стигм ДСТ достоверно не влияли на степень снижения показателей АОЗ.
Следовательно, у больных с ОГН отмечалась выраженная активация ПОЛ с некоторым угнетением системы АОЗ. Активация ПОЛ была более выражена при ОГН с НС, с НС и гематурией, у больных с высокой степенью активности процесса, у гормонорезистентных больных, у имеющих множественные стигмы ДСТ и дизэмбриогенеза.
Выводы
1. У больных ОГН отмечается значительная активация ПОЛ и умеренное снижение показателей АОЗ.
2. Особенно повышается ПОЛ при ОГН с НС, ОГН с НС и гематурией, гормонорезистентных формах, высокой активности процесса, при наличии множественных стигм ДСТ и дизэмбриогенеза.
3. Форма ОГН, тяжесть течения, активность процесса, наличие стигм ДСТ достоверно не влияют на степень снижения показателей АОЗ.
4. Более высокие показатели ПОЛ и угнетение АОЗ могут быть критерием тяжелого и неблагоприятного течения ОГН.
1. Агарков В.И., Бугашева Н.В., Коктышев И.В. и др. Закономерности и особенности морфофункциональных показателей здоровья подростков, постоянно проживающих в социально-экологических условиях Донбасса // Вестник гигиены и эпидемиологии. — 2007. — Т. 11, № 1. — С. 3-7.
2. Актуальные вопросы диагностики и лечения заболеваний почек. Учебно-методическое пособие для студентов. — Волгоград: Волгоградский государственный медицинский университет, 2006. — С. 12-92.
3. Антипкiн Ю.Г. Стан здоров’я дiтей в умовах дiї рiзних екологiчних чинникiв // Мистецтво лiкування. — 2007. — № 5. — С. 45-47.
4. Головачова В.О. Вплив факторiв зовнiшнього середовища на фосфолiпiдний спектр сироватки кровi дiтей, хворих на нефропатiю // Здоровье ребенка. — 2010. — № 3(24). — С. 38-41.
5. Грищенко С.В., Грищенко И.И., Абакумова А.В. и др. Гигиеническая оценка состояния окружающей среды Донецкой области и степени ее опасности для здоровья населения // Вестник гигиены и эпидемиологии. — 2007. — Т. 11, № 1. — С. 8-12.
6. Куликова А.И., Тугушева Ф.А., Митрофанова О.В. и др. Влияние антиоксидантной терапии на перекисное окисление липидов и фосфолипиды крови больных с хроническим гломерулонефритом // Нефрология. — 2000. — Т. 4, № 1. — С. 28-33.
7. Лук’янова О.М. Проблема здоров’я здорової дитини та науковi аспекти профiлактики його порушень // Мистецтво лiкування. — 2007. — № 9. — С. 42-47.
8. Нагорная Н.В., Четверик Н.А. Оксидативный стресс: влияние на организм человека, методы оценки // Здоровье ребенка. — 2010. — № 2(23). — С. 140-145.
9. Нагорная Н.В., Четверик Н.А., Дубовая А.В. и др. Антиоксидантный статус у детей, проживающих в экологически неблагоприятных условиях, и возможности его коррекции // Здоровье ребенка. — 2010. — № 1(22). — С. 66-70.
10. Нагорная Н.В., Четверик Н.А., Дубовая А.В. и др. Оксидативный стресс у детей, проживающих в экологически неблагоприятных условиях. Возможности нейровитана в его коррекции // Современная педиатрия. — 2009. — № 1(23). — С. 124-129.
11. Одинець Ю.В., Горбач Т.В., Ярова К.К. Змiни складу лiпiдiв мембран та енергозабезпечення клiтин при гломерулонефритi у дiтей // ПАГ. — 2000. — № 6. — С. 71-72.
12. Майданник В.Г. Педиатрия: Учебник для студентов высших мед. учеб. заведений III–IV уровней аккредитации. — 3-е изд. — Харьков: Фолио, 2006. — С. 474-535.
13. Тяжка А.В., Винницкая Е.П., Лутай Т.И. и др. Педиатрия: Учебное пособие / Под ред. проф. А.В. Тяжкой. — К.: Медицина, 2008. — С. 310-318.
14. Шабалтас Н.Л. Изменение состояния перекисного окисления липидов и уровня нитритов у больных прогрессирующими нефропатиями в динамике лечения // Врачебная практика. — 2003. — № 2. — С. 11-15.