Журнал «Здоровье ребенка» 3 (30) 2011
Вернуться к номеру
Ріабал у комплексному лікуванні ацетонемічного синдрому в дітей
Авторы: Крючко Т.О., Остапенко В.П., ВДНЗУ «Українська медична стоматологічна академія», м. Полтава
Рубрики: Педиатрия/Неонатология
Версия для печати
У статті наведені характеристика й механізми розвитку ацетонемічного синдрому в дітей, обґрунтована необхідність призначення спазмолітика при цьому стані. Наведено порівняльну оцінку ефективності Ріабалу й неселективного міотропного спазмолітика дротаверину гідрохлориду в комплексному лікуванні дітей з ацетонемічним синдромом.
Ацетонемічний синдром, біль, спазмолітик.
Актуальність ацетонемічного синдрому (АС) у дітей за останні десятиріччя значно збільшилася. Це пов’язано з тенденцією до підвищення його частоти та розвитком ускладнень у вигляді кризів із тяжким перебігом. Цей факт можна пояснити прогресуючим ростом негативного впливу шкідливих факторів навколишнього середовища, психотравмуючим інформаційним навантаженням на дітей, а також уживанням в їжу продуктів, до складу яких входять консерванти, емульгатори та генетично модифіковані продукти. Всі ці фактори призводять до хвороб адаптації, що супроводжуються метаболічними порушеннями, які в дитячому віці можуть перебігати як ацетонемічний синдром.
Поширеність ацетонемічного синдрому маловивчена. За даними вітчизняних авторів, первинний ацетонемічний синдром зустрічається у 4–6 % дітей віком від 1 до 13 років, дебют АС частіше припадає на вік 5 років [1].
Ацетонемічний синдром — це сукупність симптомів, обумовлених підвищенням у крові кетонових тіл: ацетону, ацетооцтової кислоти и бета-оксимасляної кислоти — продуктів неповного окислення жирних кислот. Вітчизняні педіатри розглядають первинний та вторинний АС. У виникненні первинного ацетонемічного синдрому головна роль відводиться особливостям обміну речовин, низькій ацетилюючій здатності ацетил-коензиму А (ацетил-КоА), тенденції до гіперурикемії, підвищеній збудливості та швидкому виснаженню нервової системи, порушенню ендокринної регуляції [2].
За кордоном прояви АС давно розглядаються як окреме захворювання під назвою «синдром циклічного блювання» (Cyclic Vomiting Syndrom — CVS) [3]. На сьогоднішній день Римські критерії III (2006) у класифікації функціональних розладів системи травлення чітко визначають спеціальну педіатричну рубрику: H. Функціональні розлади: діти та підлітки. H1b. Синдром циклічного блювання.
Вторинний ацетонемічний синдром найбільш часто реєструється у дітей на фоні ГРВІ, патології шлунково-кишкового тракту (ШКТ), при цукровому діабеті, голодуванні та ін. Пусковим фактором є стресогенна ситуація (інфекція, біль, голод, переохолодження, конфлікт, травма, соматичні хвороби та ін.) з відносним переважанням контрінсулярних гормонів та аліментарні порушення у вигляді голодування або надмірного вживання жирної та білкової їжі за нестачі вуглеводів. У результаті стимуляції ліполізу у печінку надходить велика кількість неестерифікованих жирних кислот, які трансформуються в ацетил-КоА, перехід якого в цикл Кребса обмежується у зв’язку зі зменшеною кількістю оксалоацетату, що зумовлено недостатністю вуглеводів. Унаслідок цього активується процес кетогенезу [4]. Надлишок кетонових тіл призводить до метаболічного ацидозу, справляє наркотичний вплив на центральну нервову систему та подразнює слизову оболонку ШКТ, що клінічно проявляється блюванням та болем у животі [5–7]. За даними закордонних авторів більше ніж у 80 % дітей з АС серед основних симптомів спостерігається больовий абдомінальний синдром. Біль має дифузний характер без чіткої локалізації та обмежується епігастральною та гіпогастральною ділянками. Характерні супутні вегетативні реакції вісцерального болю, такі як слабкість, блідість, пітливість, нудота, блювання [8]. Слід зауважити, що в генезі болю при АС вагоме місце також займає порушення моторики, особливо у дітей з АС на фоні патології ШКТ, тому виникає обґрунтована необхідність у призначенні спазмолітичної терапії у дітей з даною патологією, адже подолання болю, який спричиняє страждання хворого, позитивно впливає на перебіг захворювання та якість життя пацієнта.
При виборі спазмолітичного препарату для дітей потрібно враховувати такі вимоги: швидкість, тривалість та селективність дії препарату, доказову базу, мінімальний спектр побічних ефектів та економічну доступність. Цим вимогам відповідає препарат Ріабал (профініум), що має достатньо великий досвід застосування в дітей та має ряд переваг перед іншими препаратами цієї групи. Ріабал селективно блокує М-холінорецептори органів черевної порожнини та малого таза, коригує моторику ШКТ (нормалізує перистальтику та випорожнення шлунка, знижує тонус гладкої мускулатури), нормалізує секрецію соляної кислоти та практично не впливає на М-холінорецептори інших органів [8–12].
Порівняльна оцінка ефективності Ріабалу та неселективного міотропного спазмолітика дротаверину гідрохлорид у комплексному лікуванні дітей з АС стала метою нашого дослідження.
Матеріали та методи дослідження
Під спостереженням знаходились 47 дітей з ацетонемічним синдромом віком від 3 до 12 років, які перебували на лікуванні в педіатричному відділенні № 1, № 2 та поліклініці Полтавської обласної дитячої клінічної лікарні, відділенні пульмонології та раннього дитинства Полтавської міської дитячої клінічної лікарні.
Усі діти були розподілені на дві групи: до 1-ї групи (n = 23) увійшли діти з АС, які приймали в комплексній терапії Ріабал, до 2-ї (n = 24) — діти з АС, які приймали в комплексній терапії дротаверину гідрохлорид у вікових дозах. Тривалість лікування визначалася характером та ступенем тяжкості захворювання (у середньому — 5–7 днів).
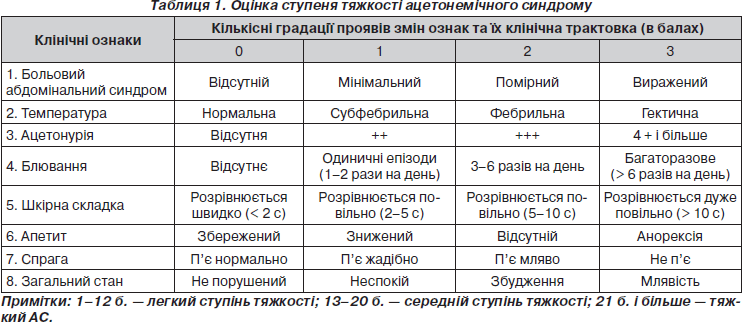
Комплекс обстеження включав: загальні клінічні методи (опитування, огляд, пальпація, перкусія, аускультація), збір анамнестичних даних, оцінку ступеня тяжкості ацетонемічного синдрому та ступеня прояву больового абдомінального синдрому (БАС) за 3-бальною шкалою (табл. 1), лабораторні методи дослідження: (клінічний аналіз крові, загальний аналіз сечі, якісна проба Ланге (визначення кетонових тіл у сечі), глюкоза крові, копрограма), інструментальні методи (УЗД органів черевної порожнини; верифікацію підвищення секреції соляної кислоти за допомогою рН-метрії експрес методом із використанням ацидогастрографа АГМ-1 за методикою В.М. Чернобрового). Додаткове проведення деяких досліджень (біохімічний аналіз крові, копрограма, інструментальні методи) залежало від супутньої патології.
Ефективність лікування оцінювалась у динаміці через 24–72 години терапії, на 5-й та 7-й дні після початку спазмолітичної терапії. У ході дослідження також визначалась безпечність та переносимість спазмолітичних препаратів з урахуванням побічних дій та на підставі вербальної оцінки батьків за системою балів: 1 бал — відмінна, 2 бали — добра, 3 бали — задовільна, 4 — незадовільна.
Результати дослідження та їх обговорення
Результати обстеження дозволили діагностувати у більшості дітей (68,1 %) АС легкого ступеня тяжкості, у меншої кількості (31,9 %) — АС середнього ступеня тяжкості, тяжкого перебігу в жодної дитини зареєстровано не було. Серед обстежених пацієнтів значну частину (76,6 %) становили діти віком 3–7 років, меншу кількість (23,4 %) — діти 8–12 років. Розподіл за статтю був майже рівномірним: 53,2 % дівчаток та 46,8 % хлопчиків.
Ацетонемічний синдром у більшості обстежених пацієнтів (62,2 %) діагностувався на фоні функціональної диспепсії (ФД) ШКТ, у 23 % — на фоні гострої респіраторної вірусної інфекції, та у незначної частини дітей (15 %) — на фоні функціональних розладів жовчного міхура та сфінктера Одді. У дітей з АС на фоні функціональної диспепсії превалювала епігастрально-больова форма 82,8 %, меншу кількість становили діти з постпрандіальним синдромом ФД — 13,8 % та лише 3,4 % — діти з поєднанням клінічних варіантів ФД.
До початку лікування у всіх дітей були виявлені больовий та диспептичні синдроми. Біль в основному мав приступоподібний характер, його інтенсивність до лікування становила в середньому 3,0 ± 0,2 бала. Так, БАС у 1-й групі до лікування мав помірну інтенсивність у більшості дітей (69,6 %), виражену інтенсивність у 21,7 % та у невеликої кількості пацієнтів (8,7 %) він був мінімальним. У 2-й групі також значна кількість дітей (71,3 %) мала помірно виражену інтенсивність БАС, 19,3 % — виражену інтенсивність, мінімальний БАС визначався у невеликої кількості дітей (9,4 %). Серед диспептичних проявів у всіх пацієнтів були нудота та блювання, у більшості зниження апетиту (85,1 %) та відрижка (31,9 %), рідко відзначалися діарея (8,5 %), запор (10,6 %) та гіркий присмак у роті (6,3 %). При лабораторному дослідженні лейкоцитоз до 10,123 ± 0,132 х 109/л був виявлений у 6,4 % дітей, ацетонурія (++) — у 38,3 % дітей, (+++) — у 36,2 %, (++++ і більше) у 25,5 % дітей.
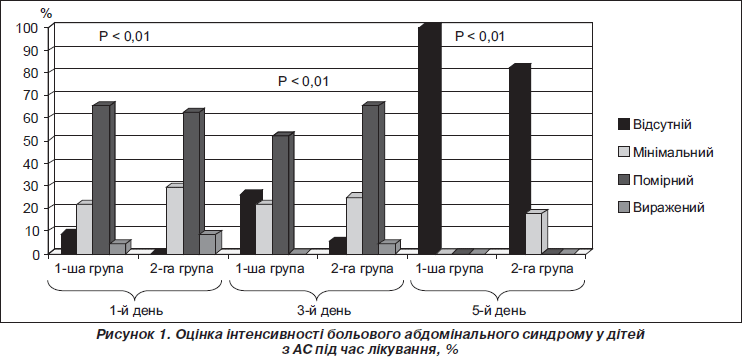
У результаті дослідження (рис. 1) у дітей, які приймали Ріабал у складі комплексної терапії, тривалість БАС порівняно з групою дітей, які отримували дротаверину гідрохлорид, була вірогідно менша. Так, уже на першу добу лікування 8,7 % дітей 1-ї групи констатували відсутність БАС на відміну від 2-ї групи, де у всіх дітей ще зберігався біль різної інтенсивності. Повний регрес БАС у дітей першої групи спостерігався вже на 5-ту добу комплексного лікування на відміну від пацієнтів другої групи, де мінімальний БАС зберігався у 18 % пацієнтів до 7-го дня лікування. Використання Ріабалу також сприяло більш вираженому зменшенню інтенсивності БАС на відміну від 2-ї групи. Так, у дітей першої групи вже до 3-го дня лікування інтенсивність болю зменшилась із вираженої до мінімальної на відміну від пацієнтів 2-ї групи, де виражений БАС у цей же час зберігався у 4,2 % дітей. Значна перевага Ріабалу в подоланні тривалості та інтенсивності больового синдрому обумовлена насамперед здатністю цього препарату не тільки опосередковано впливати на гладку мускулатуру, але й діяти на етапі проведення нервового імпульсу та селективно блокувати М-холінорецептори на відміну від дротаверину гідрохлориду, що має прямий вплив на клітини гладкої мускулатури, змінюючи іонний баланс у клітинній мембрані, та справляє неселективну спазмолітичну дію в органах ШКТ.
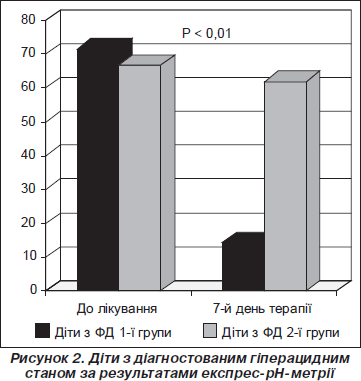
Враховуючи здатність Ріабалу впливати на секреторну функцію шлунка, за рахунок зменшення соляної кислоти та зниження зовнішньосекреторної функції підшлункової залози, у дітей із функціональною диспепсією проводилось дослідження секреції соляної кислоти за допомогою рН-метрії на початку та в кінці лікування. У більшої частини дітей із ФД 1-ї та 2-ї групи (71,4 та 66,7 % відповідно) на початку лікування діагностувався гіперацидний стан. Слід зазначити, що використання Ріабалу сприяло нормалізації кислотопродукуючої функції шлунка на відміну від групи порівняння. Так, у більшості (57,1 %) дітей із зареєстрованим гіперацидним станом 1-ї групи на 7-й день лікування спостерігалось зниження продукції соляної кислоти до нормальних показників на відміну від 2-ї групи, де підвищені показники рН-грами залишались практично на початковому рівні (рис. 2). Діти, у яких зберігався гіперацидний стан, потребували додаткового призначення препаратів антисекреторної дії.
Ефективність препарату оцінили як відмінну — 91,3 %, добру — 8,7 % пацієнтів 1-ї групи. Діти 2-ї групи, які приймали дротаверину гідрохлорид, оцінили ефективність препарату як відмінну — у 62,5 %, добру — у 29,2 % та задовільну у 8,3 % випадків. Серед побічних ефектів, що найбільш часто зустрічалися у дітей 2-ї групи, було підвищене потовиділення (8,3 %).
Регрес виявлених змін показників мав єдину спрямованість, але випередження нормалізації показників у групі дітей, які отримували препарат Ріабал у складі комплексної терапії ацетонемічного синдрому, та виявлення його антисекреторного ефекту робить можливим висновок про перевагу призначення даного препарату з метою патогенетичної корекції симптомів захворювання у дітей.
1. Ацетонемический синдром у детей / С. Сенаторова, Е.В. Осипенко // Здоровье ребенка. — 2007. — № 5(8). —
С. 38-40.
2. Ацетонемический синдром у детей: современный взгляд на проблему / Волосовец А.П., Кривопустов С.П., Кожина А.Н., Щербинская Е.Н. // Здоровье ребенка. — 2009. — № 6(21). — С. 14-22.
3. Boles R., Powers A., Adams K. Cyclic Vomiting Syndrome Plus // J. Child Neuro. — 2006. — 21(3).
4. Ацетонемические состояния в педиатрической практике / М.А. Георгиянц // Здоровье ребенка. — 2006. — № 4(5). — С. 15-18.
5. Шабалов Н.П. Детские болезни. — С.-Петербург: Питер, 1999. — 1080 с.
6. Чибирас П.П. Гипогликемическая кетонемия как причина нейротоксикоза у детей // Вопросы охраны материнства и детства. — 1982. — № 2. — С. 30-33.
7. Закирова Р.А., Кузнецова Л.А. Кетоацидоз у детей // Казанский медицинский журнал. — 1988. — № 1.
8. Li B.U.K., Jennifer Howard. CME: New hope for children with cyclic vomiting syndrome // Contemporary Pediatrics. — 2002. — 3. — 121.
9. Денисова М.Ф., Донде С.М. Клиническая оценка применения препарата риабал у детей с заболеваниями органов пищеварения // Соврем. педиатрия. — 2006. — № 2. — С. 73-74.
10. Нагорная Н.В., Бордюгова Е.В., Дубовая А.В. Болевой абдоминальный синдром у детей. Место спазмолитических препаратов в его устранении // Здоров’я України. — 2009. — № 4(19). — С. 49-52.
11. Белоусов Ю.В., Шутова Е.В. Риабал в детской гастроэнтерологической практике // Соврем. педиатрия. — 2008. — № 3. — С. 84-86.
12. Марушко Ю.В., Бойко Н.С, Лисовець Н.С. Досвід застосування препарату Ріабал у комплексній терапії дисфункції біліарної системи у дітей // Здоров’я України. — 2009. — № 19(1). — С. 54-56.
13. Шадрін О.Г., Марушко Т.Л., Марушко Р.В., Фисун В.М. Щодо оптимізації лікування синдрому зригування в дітей із перинатальною патологією центральної нервової системи // Здоров’я України. — 2010. — № 2(23). — С. 43-48.