Журнал «» 4(18) 2011
Вернуться к номеру
Симпозиум «Место кандесартана в современной терапии сердечно-сосудистых заболеваний: обзор доказательств»
Авторы: Сиренко Ю.Н., ННЦ «Институт кардиологии им. Н.Д. Стражеско» НАМН Украины, Донченко Н.В., Донецкий национальный медицинский университет им. М. Горького
Рубрики: Семейная медицина/Терапия, Кардиология, Терапия
Версия для печати
Проводят: Ассоциация кардиологов Украины, Всеукраинское общественное объединение против гипертензии, ННЦ «Институт кардиологии им. Н.Д. Стражеско» НАМН Украины.
Рекомендован: кардиологам, терапевтам, семейным врачам.
Введение
Блокаторы рецепторов ангиотензина II (БРА) — в настоящий момент наиболее динамично развивающийся класс антигипертензивных препаратов. Они появились на рынке в начале 90-х годов прошлого века и достаточно долго считались резервными препаратами: основной нишей для их назначения являлась плохая переносимость ингибиторов ангиотензинпревращающего фермента (АПФ), в первую очередь из-за развития кашля. С накоплением доказательной базы БРА изменили свой статус резервного лекарственного средства для лечения артериальной гипертензии (АГ) стали одним из основных классов лекарственных средств в кардиологии, доказавших свою эффективность в предотвращении сердечно-сосудистых и мозговых осложнений у пациентов с АГ, сердечной недостаточностью (СН), фибрилляцией предсердий, после инфаркта миокарда (ИМ), с хроническим заболеванием почек. Хотя все БРА имеют общий механизм действия, фармакологические особенности могут привести к различиям в их способности блокировать рецепторы, что, вполне возможно, может привести к различиям в клинической эффективности.
Цель
Целью настоящей работы явилось ознакомление практических врачей с доказательной базой, которая накоплена в отношении одного из наиболее изученных БРА — кандесартана. В отличие от имеющихся в доступной литературе [PubMed] работ мы попытались отразить весь спектр доказательств эффективности кандесартана как при АГ, так и при других заболеваниях и состояниях.
Фармакологические свойства
Химическая структура
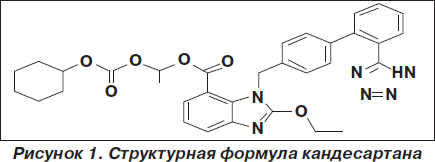
Кандесартана цилексетил является пролекарством. В организме при всасывании из желудочно-кишечного тракта гидролизуется до активного вещества кандесартана. По химической структуре кандесартана цилексетил так же, как и первый БРА лозартан, является бифениловым производным тетразола, однако он обладает более высокой липофильностью. Химическое название 1-[[(циклоксигексилокси) карбонил] окси] этил 2-этокси-1-[[2'(1Н-тетразол-5-ил)-1,1’-бифенил]-4-ил] метил]-1Н-бензимидазол-7-карбоновой кислоты. Его эмпирическая формула C33H34N6O6, а структурная формула представлена на рис. 1.
Механизм действия
Кандесартан селективно блокирует связывание ангиотензина II (АII) с первым типом рецепторов ангиотензина II (АТ1) в тканях организма, например в гладкомышечных клетках сосудов и надпочечников, блокируя сосудосуживающие и альдостеронсекретирующие эффекты ангиотензина II. Поэтому его действие не зависит от пути синтеза АII. Кандесартан имеет избирательную тропность к АТ1-рецепторам по сравнению с рецепторами второго типа (больше в 10 000 раз). Кандесартан не ингибирует АПФ и, соответственно, не влияет на брадикинин. Кандесартан не связывается с другими типами рецепторов других гормонов или блокирует ионные каналы, участвующие в регуляции сердечно-сосудистой системы. Блокада рецепторов АII подавляет отрицательную обратную связь влияния АII на секрецию ренина, но увеличение активности ренина плазмы и уровня АII в результате этого не преодолевает влияние кандесартана на уровень артериального давления (АД).
Фармакокинетика
Абсолютная биодоступность кандесартана цилексетила при приеме внутрь составляет 42 % (одновременный прием пищи не влияет на биодоступность). Максимальная концентрация в плазме крови достигается на протяжении 3–4 ч. Концентрация кандесартана в плазме крови пропорционально возрастает при повышении дозы в диапазоне 2–32 мг. Степень связывания с белками плазмы крови (преимущественно с альбумином) составляет 99,8 %, объем распределения — 0,13 л/кг массы тела. Проникает через плацентарный барьер, не проникает через гематоэнцефалический барьер. Период полувыведения препарата составляет 9 ч. Общий клиренс из плазмы крови — 0,37 мл/мин/кг, почечный клиренс — 0,19 мл/мин/кг. Кандесартан метаболизируется в печени (20–30 %) при участии цитохрома CYP 2C с образованием неактивного метаболита. Медленно выводится с мочой (33 %) и желчью (67 %), в основном в неизмененном виде. После однократного приема на протяжении 72 ч экскретируется более 90 % дозы [Hubner]. Препарат не кумулируется в организме. У лиц пожилого возраста максимальная концентрация в крови повышается на 50 %, AUC — на 78 %.
Фармакодинамика
Кандесартан дозозависимо подавляет прессорные эффекты инфузии ангиотензина II. Через одну неделю приема 8 мг кандесартана 1 раз в сутки прессорный эффект подавляется примерно на 90 % на пике концентрации препарата в крови и приблизительно на 50 % через 24 часа после последнего приема. Плазменные концентрации ангиотензина I, АII, а также активность ренина плазмы возрастали в зависимости от дозы после однократного и повторного введения кандесартана как у здоровых добровольцев, так и у больных АГ. Активность АПФ у здоровых добровольцев не менялась даже после повторного приема кандесартана. Назначение до 16 мг кандесартана один раз в день здоровым лицам не влияло на уровень альдостерона в плазме, однако у больных АГ при приеме 32 мг препарата наблюдалось достоверное снижение содержания альдостерона в плазме. Несмотря на влияние кандесартана на секрецию альдостерона, препарат очень мало влиял на уровень калия в сыворотке крови. Во множественных исследованиях у больных АГ не было выявлено достоверных клинически значимых изменений метаболических функций, в том числе содержания в сыворотке крови общего холестерина (ХС), триглицеридов (ТГ), глюкозы или мочевой кислоты. В 12-недельном исследовании у 161 пациента с инсулинонезависимым (тип 2) сахарным диабетом (СД) и АГ не было выявлено никаких изменений уровня гликозилированного гемоглобина [Trenkwalder].
Особенности кандесартана
Кандесартан прочно связывается с AT1-рецепторами и медленно диссоциирует из образовавшейся связи с ними. Даже избыточное количество АII не может вытеснить кандесартан из связи с AT1-рецепторами [Inada, McClellan]. Такой тип связи с рецептором получил название непреодолимой (необратимой) блокады AT1-рецепторов. Медленная диссоциация кандесартана из связи с рецепторами способствует его накоплению в среде и повторному связыванию с АТ1-рецепторами. По способности вытеснять АII из связи с AT1-рецепторами человека кандесартан также превосходит другие БРА. Сродство кандесартана к AT1-рецепторам оказалось примерно в 80 раз выше, чем лозартана, и в 10 раз выше, чем его активного метаболита (ЕХР-3174) [Abrahamsson, Linger]. Vanderheyden с соавт. (2000) установили, что диссоциация полувыведения из АТ1-рецепторов составляет 152 мин для кандесартана, 5 мин — для лозартана и 31 мин — для EXP 3174. Сила же вытеснения ангиотензина II у разных БРА убывает в такой последовательности: кандесартан > ЕХР-3174 > ирбесартан > лозартан [Van Liefde]. Данные о прочности связи различных БРА с АТ1-рецепторами представлены на рис. 2.

Таким образом, высоким сродством к рецепторам, прочностью связывания кандесартана с AT1-рецепторами, его медленной диссоциацией из связи с ними и повторным связыванием объясняют, почему кандесартан оказывает более выраженное и более длительное антигипертензивное действие, чем другие БРА [McClellan].
Эффективность в лечении АГ
Эффективность в снижении АД
Антигипертензивные эффекты кандесартана были изучены в 14 плацебо-контролируемых исследованиях продолжительностью от 4 до 12 недель [Кобалава, Easthope]. Ежедневные дозы составили от 2 до 32 мг в сутки у пациентов с исходным уровнем диастолического АД от 95 до 114 мм рт.ст. В большинстве этих исследований кандесартан назначался в качестве монотерапии, но кроме этого были изучены эффекты добавления к кандесартану гидрохлортиазида или амлодипина. Эти исследования включали в общей сложности 2350 больных, рандомизированных в группу приема одной из указанных доз кандесартана, и 1027 — в группу плацебо. За исключением исследования у больных сахарным диабетом, все исследования показали значительный дозозависимый антигипертензивный эффект. По данным суточного мониторирования АД, эффект кандесартана в дозе 2–32 мг на этапе корыта (перед приемом следующей дозы) составил приблизительно 8–12/4–8 мм рт.ст. У этих пациентов не отмечался эффект гипотензии первой дозы. Указанный антигипертензивный эффект наблюдался в течение первых 2 недель от начала лечения, а его реализация в полном объеме наступала через 4 недели. При приеме 1 раз в сутки эффект на АД сохранялся в течение 24 часов при соотношении эффекта на этапе корыта к пику более 80 %. Антигипертензивный эффект был аналогичен у мужчин и женщин, а также у больных старше и моложе 65 лет. Кандесартан был эффективен в снижении АД независимо от расы и этнической принадлежности, хотя эффект был несколько меньше у темнокожих (контингент с низкой активностью ренина). В долгосрочных исследованиях в течение до 1 года антигипертензивная эффективность кандесартана была стабильной и феномен отмены не наблюдался. В контролируемых исследованиях не выявлено никаких изменений в частоте сердечных сокращений у пациентов, получавших кандесартан. При сочетании кандесартана с гидрохлортиазидом наблюдался дополнительный антигипертензивный эффект [Кобалава, Sever].
У больных с неосложненной АГ проведен ряд исследований, в которых сравнивали эффективность кандесартана с другими известными антигипертензивными препаратами из класса ингибиторов АПФ [Norris]. Так, эффективность кандесартана сравнивали с эналаприлом в 3 исследованиях (2 исследования достаточного качества и 1 исследование с неудовлетворительным качеством дизайна). При эквивалентном снижении АД в обоих исследованиях с достаточным качеством не выявлено существенных различий в качестве жизни между группами лечения кандесартаном и эналаприлом. Побочные эффекты: в одном из исследований различий между препаратами в частоте побочных эффектов и отмены вследствие этого не выявлено. В 2 исследованиях частота кашля в группе кандесартана была достоверно ниже.
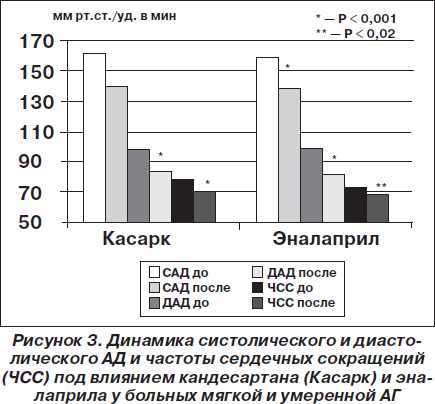
В нашем исследовании мы сравнивали антигипертензивную эффективность кандесартана производства корпорации «Артериум» (препарат Касарк) с эффективностью ингибитора АПФ эналаприла у 80 больных мягкой и умеренной АГ без осложнений в течение одного месяца [Сиренко]. Назначение приводило к достоверному снижению уровня офисного систолического/диастолического АД с 161,4 ± 0,9/97,5 ± 0,7 до 139,9 ± 1,7/83,7 ± 0,9 мм рт.ст., что достоверно не отличалось от снижения САД/ДАД на фоне приема эналаприла — с 158,4 ± 1,2/98,5 ± 0,9 до 137,9 ± 1,9/81,3 ± 0,6 мм рт.ст. Эти данные о сравнительной антигипертензивной эффективности кандесартана и эналаприла представлены на рис. 3. При этом целевой уровень офисного АД достигался у 56 % пациентов при применении кандесартана и у 63,3 % — эналаприла. Дозы препаратов в исследовании были для кандесартана 8 и 16 мг в сутки, а для эналаприла — 20 и 30 мг в два приема. На фоне лечения в обеих группах наблюдалось достоверное снижение уровней среднесуточного, дневного, ночного систолического/диастолического АД в группе кандесартана соответственно на 12,4/12; 12,8/12,2 и 10,6/7 мм рт.ст., а в группе эналаприла — соответственно на 17,2/15,9; 15,8/14,8 и 19,9/8,8 мм рт.ст. Целевой уровень среднесуточного АД (< 120/80 мм рт.ст.) был достигнут у 20 (40 %) пациентов группы кандесартана и у 13 (43,3 %) больных группы эналаприла. Побочные явления в нашем исследовании наблюдались у 4 (8 %) пациентов в группе кандесартана и 5 (16,7 %) — в группе эналаприла.
Влияние на органы-мишени при АГ
Сердце. В лечении пациентов с АГ важно не только достижение целевых уровней АД, но и защита органов-мишеней, что само по себе является самостоятельной целью терапии. В исследовании CATCH изучалась способность кандесартана и ингибитора АПФ эналаприла уменьшать массу миокарда у пациентов с АГ и признаками гипертрофии левого желудочка (ЛЖ). В обеих группах был достигнут целевой уровень АД, однако в группе кандесартана у большего количества пациентов нормализовалась масса миокарда ЛЖ по сравнению с группой эналаприла (38 % пациентов, принимавших кандесартан, и 28 % больных, принимавших эналаприл) [Cuspidi]. В исследовании СASE-J, включавшем 4728 жителей Японии, страдавших АГ высокого риска, кандесартан и амлодипин обеспечивали практически одинаковое снижение риска внезапной смерти и основных органных осложнений АГ. У включенных в исследование CASE-J пациентов, исходно имевших гипертрофию левого желудочка, кандесартан приводил к достоверно более выраженному по сравнению с амлодипином снижению индекса массы миокарда левого желудочка, что свидетельствовало о регрессе его гипертрофии [Ogihara]. В исследовании SARA кандесартан также обусловливал уменьшение выраженности электрокардиографических признаков гипертрофии левого желудочка у больных с АГ, в том числе при наличии у них метаболического синдрома [Escobar]. Способность БРА уменьшать гипертрофию левого желудочка была также впервые показана с использованием кандесартана при необструктивной гипертрофической кардиомиопатии — заболевании, медикаментозное лечение которого считается крайне малоэффективным. Эффективность кандесартана оказалась максимальной у носителей отдельных генетических детерминант гипертрофической кардиомиопатии — мутаций генов ss-миозина и сердечного миозинсвязывающего протеина С [Penicka].
Почки. Эффективность ингибиторов АПФ при заболеваниях почек как для предотвращения их прогрессирования, так и для улучшения выживания в настоящий момент не вызывает сомнения, тогда как БРА длительное время считались только резервными препаратами. Такое положение и определило дизайн исследований эффективности БРА при поражении почек. Эффективность кандесартана сравнивали с лизиноприлом и периндоприлом в одном исследовании достаточного качества у взрослых больных АГ с СД 2-го типа. При эквивалентной антигипертензивной эффективности степень снижения протеинурии в сравниваемых группах была одинакова. Частота отмены вследствие побочных эффектов была самой низкой в группе лизиноприла. Различие между группами кандесартана и периндоприла по числу побочных эффектов и частоте отмены было недостоверным. В доступной литературе имеются данные двух исследований, в которых сравнивали эффективность кандесартана с ингибиторами АПФ при хроническом заболевании почек без СД. В первом из них эффективность кандесартана сравнивали с лизиноприлом. При эквивалентном уменьшении АД снижение протеинурии также было аналогичным. При этом частота гиперкалиемии в группе кандесартана была достоверно меньше по сравнению с лизиноприлом. В другом исследовании сравнивали эффективность кандесартана, трандолаприла и периндоприла. Степень снижения протеинурии достоверно не различалась, также не наблюдалось изменений клиренса креатинина.
Эффективность в предупреждении сердечно-сосудистых осложнений при АГ
Наибольшая доказательная база для оценки влияния кандесартана на жесткие конечные точки у больных АГ была получена в исследовании SCOPE [Lithell]. Это было проспективное рандомизированное двойное слепое параллельное исследование эффективности применения кандесартана у пациентов преклонного возраста (70–89 лет) с умеренной АГ (АД 160–179/ 90–99 мм рт.ст.). В исследование было включено 4937 больных в 12 странах мира. Срок наблюдения составлял 3–5 лет. Задачи исследования: 1) определить эффективность лечения АГ в преклонном возрасте блокатором рецепторов ангиотензина ІІ кандесартаном (8–16 мг) по сравнению с плацебо; 2) выявить, лучше ли обеспечивается защита ментальных функций при снижении АД у больных преклонного возраста. При применении кандесартана по сравнению с плацебо наблюдалось достоверное (на 28 %) снижение частоты нефатальных инсультов (р = 0,041). Кроме этого, выявлена тенденция к снижению частоты развития основных сердечно-сосудистых осложнений на 11 % (р = 0,19) и новых случаев сахарного диабета на 20 % (р = 0,083). К сожалению, авторы исследования исходно спланировали его таким образом, что подавляющее большинство больных в группе плацебо (84 %) параллельно принимали другие антигипертензивные препараты. Таким образом, эффективность кандесартана сравнивали преимущественно с другой терапией. Разница в уровне достигнутого АД между группами составляла 3,2/1,6 мм рт.ст. (р < 0,001 для обеих цифр). В исследовании не выявлена достоверная разница между группами по частоте возникновения ИМ и сердечно-сосудистой смерти. При лечении кандесартаном достоверно реже возникала необходимость в отмене препарата из-за появления побочных эффектов или плохой переносимости. Анализ подгруппы больных, которые не принимали дополнительно других антигипертензивных лекарств (только кандесартан по сравнению с плацебо), показал уменьшение частоты возникновения основных сердечно-сосудистых осложнений на 32 % (р = 0,01). При выполнении второй задачи исследования не была выявлена достоверная разница между группами в частоте развития когнитивных осложнений и деменции. Анализ подгруппы больных с изначально сниженным уровнем ментальных функций (по шкале MMSE от 24 до 28) показал более достоверное сохранение ментальных функций при применении кандесартана. Анализ стандартизированных показателей качества жизни выявил, что соответствующее качество жизни на протяжении исследования удовлетворительно поддерживалось в обеих группах с некоторым преимуществом при лечении кандесартаном. Результаты этого исследования вопреки всем недостаткам при его планировании и выполнении открывают возможности стратегии лечения больных преклонного возраста с АГ, что базируется на применении специфической антигипертензивной терапии.
Важная информация о влиянии кандесартана на частоту развития сердечно-сосудистых осложнений была получена в исследовании под эгидой японского института сердца HIJ-CREATE [Kasanuki]. Целью исследования была оценка влияния БРА кандесартана у больных ишемической болезнью сердца (ИБС) и АГ по сравнению с другими режимами антигипертензивной терапии, в первую очередь с ингибиторами АПФ. Использовали PROBE-дизайн. В исследование было включено 2049 больных АГ с ангиографически доказанной ИБС и уровнем АД ≥ 140/90 мм рт.ст. Они были рандомизированы в группы приема кандесартана (n = 1024) или медикаментозного лечения не БРА, в том числе ингибиторами АПФ (n = 1025). Срок наблюдения составлял 4,2 года. Первичной конечной точкой было возникновение какого-либо первого эпизода сердечно-сосудистого осложнения. На протяжении наблюдения возникло 552 первичных события: 264 (25,8 %) в группе кандесартана и 288 (28,1 %) в группе сравнения (соотношение риска (СР) 0,89; 95% доверительный интервал (ДИ) 0,76–1,06). Никаких существенных отличий не было выявлено между группами в частоте возникновения сердечно-сосудистой смерти (2,7 % против 2,4 %; СР 1,14; 95% ДИ 0,66–1,95), нефатального инфаркта миокарда (2,8 % против 2,5 %; СР 1,12; 95% ДИ 0,66–1,88) или СН (3,9 % против 4,3 %; СР 0,91; 95% ДИ 0,59–1,40). Новые случаи сахарного диабета в группе кандесартана наблюдались достоверно реже, чем в группе сравнения (СР 0,37; 95% ДИ 0,16–0,89). Прекращение приема препарата из-за развития побочных эффектов в группе кандесартана было реже, чем в группе сравнения (5,7 % против 12,2 %; р < 0,001). У больных с нарушенной функцией почек (скорость клубочковой фильтрации < 60 мл/мин) кандесартан был достоверно более эффективен в предупреждении сердечно-сосудистых осложнений и смерти, чем другой лечебный режим. Также в группе кандесартана не наблюдалось увеличения частоты коронарных событий, как могло бы предполагаться.
Эффективность в лечении больных сахарным диабетом и АГ
В доступной литературе имеются данные 2 исследований, в которых эффективность кандесартана сравнивали с ингибиторами АПФ у больных с диабетической нефропатией [Norris]. В первом из них препаратом сравнения был лизиноприл. При эквивалентном уменьшении АД не выявлено существенной разницы в степени снижения соотношения альбумин/креатинин, а также частоте отмены вследствие побочных эффектов, в т.ч. кашля, головокружения, слабости. В другом исследовании кандесартан сравнивали с рамиприлом. Эффективность лечения была одинаковой в обеих группах: не было достоверной разницы в динамике содержания креатинина, его клиренса, экскреции альбумина с мочой. Также не выявлено различий в частоте побочных эффектов и случаев отмены препарата из-за их появления.
Предгипертензия
Фармакотерапия предгипертензии остается малоизученным и спорным вопросом. Однако имеется убедительная доказательная база для эффективности кандесартана. В исследование TROPHY были включены 809 больных с предгипертензией, рандомизированных к приему кандесартана или плацебо. В течение первых 2 лет кандесартан снижал риск развития АГ I степени на 66,3 % (p < 0,001), к 4-му году исследования — на 15,6 % (p < 0,001) [Julius]. Прием кандесартана не ухудшал качества жизни больных с предгипертензией [Williams]. Таким образом, предупреждая взаимодействие ангиотензина II с рецепторами типа 1 и за счет этого, по-видимому, препятствуя избыточной вазоконстрикции и способствуя сохранению активности системы эндотелиального релаксирующего фактора и поддержанию достаточного натрийуреза, кандесартан может задерживать формирование АГ у лиц с предгипертензией.
Эффективность в лечении СН
Наибольшая доказательная база для оценки эффективности кандесартана была получена в исследовании CHARM [Pfeffer]. Программа CHARM включала три отдельных исследования: CHARM-Added (n = 2548), в котором больные СН с фракцией выброса левого желудочка < 40 % (в среднем 28 %), принимавшие терапию ингибиторами АПФ, дополнительно к этому лечению были рандомизированы в группы приема кандесартана и плацебо; CHARM-Alternative (n = 2028), в котором больные СН с фракцией выброса левого желудочка < 40 % (в среднем 30 %), не переносившие ингибиторы АПФ, были рандомизированы в группы приема кандесартана и плацебо; CHARM-Preserved (n = 3025), в котором больные СН с фракцией выброса левого желудочка > 40 % (в среднем 54 %), принимавшие ингибиторы АПФ или не принимавшие их, были рандомизированы в группы приема кандесартана и плацебо. Первичной точкой всей программы была общая смертность, а для всех составных исследований — сердечно-сосудистая смерть или госпитализация вследствие обострения СН. Срок наблюдения в среднем составлял 37,7 месяца. Доза кандесартана постепенно увеличивалась до 32 мг/сут; 63 % больных получали целевую дозу препарата. На протяжении наблюдения 886 (23 %) пациентов в группе кандесартана и 945 (25 %) в группе плацебо умерли (нестандартизированное СР 0,91; 95 % ДИ 0,83–1,00; p = 0,055). В исследовании CHARM-Added в группе кандесартана первичная конечная точка — смерть от сердечно-сосудистых причин и госпитализация по поводу СН — была меньше на 15 % (p = 0,010) [McMurray]. В CHARM-Alternative в группе кандесартана та же самая точка была меньше на 23 % (p < 0,0001) [Granger]. В CHARM-Preserved в группе кандесартана наблюдалась недостоверная тенденция к снижению — на 11 % (p = 0,051) [Yusuf]. Не было ни одного важного расхождения относительно эффективности кандесартана в разных подгруппах пациентов. Достоверно больше пациентов прекратили прием кандесартана, чем плацебо, из-за проблем с функцией почек, гипотензии и гиперкалиемии. Авторы исследования считают, что применение БРА кандесартана в виде монотерапии высокоэффективно при СН с систолической дисфункцией левого желудочка. При добавлении кандесартана к терапии ингибиторами АПФ у больных такой же категории могут быть получены дополнительные положительные результаты. В то же время в группе больных с сохраненной функцией левого желудочка эффективность применения кандесартана остается менее доказанной.
Прочие эффекты
Антиатеросклеротическое действие
T. Suzuki с соавт. (2011) в недавно опубликованной работе изучали антиатеросклеротический потенциал кандесартана в клинике. Они использовали 64-срезную компьютерную томографию для оценки общей площади поражения сосудистой стенки и площади поражения стенки ствола левой коронарной артерии, проксимальной части правой коронарной артерии и нисходящего отдела грудной аорты у пациентов с ИБС до и после 2-летней терапии комбинацией аторвастатина и кандесартана (n = 20) или монотерапии аторвастатином (n = 16). В этих группах не было выявлено значительной разницы в уровне холестерина, его фракций, С-реактивного белка, матричной металлопротеазы-9 в крови и 8-изо-простагландина F2a в моче. Спустя 2 года общая площадь поражения ствола левой коронарной артерии, проксимальной части правой коронарной артерии и нисходящего отдела грудной аорты достоверно увеличилась в группе аторвастатина в отличие от группы, принимавшей комбинированную терапию. Кроме того, увеличение площади сосудистой стенки в группе комбинированной терапии оказалось меньшим по сравнению с группой аторвастатина: площади сосудистой стенки нисходящего отдела грудной аорты — 3,6 ± 23,1 мм против 28,6 ± 25,5 мм (р = 0,004), проксимальной части правой коронарной артерии — –1,6 ± 1,6 мм против 0,6 ± 2,5 мм (р = 0,005) и общая площадь сосудистой стенки ствола левой коронарной артерии — –0,9 ± 3,5 мм против 1,3 ± 2,4 мм (р = 0,095). Уровни биомаркеров в целом не влияли на увеличение площади поражения сосудистой стенки. Авторы сделали вывод, что для предотвращения прогрессирования атеросклероза коронарных артерий и аорты у пациентов с ИБС комбинированная терапия кандесартаном со статином более эффективна, чем монотерапия статином.
Церебропротекция
Результаты некоторых исследований указывают на то, что существуют другие механизмы предотвращения инсультов, не зависящие от непосредственного снижения АД. По-видимому, они связаны с уменьшением отрицательного влияния на организм ренин-ангиотензиновой системы (РАС). АII, стимулируя гипертрофию гладкомышечных клеток сосудистой стенки и вызывая ремоделирование сосудов головного мозга, нарушает эндотелийзависимое расслабление сосудистой стенки, ускоряет развитие и прогрессирование цереброваскулярных заболеваний у пациентов с АГ. Антигипертензивные препараты, блокирующие эффекты РАС, такие как ингибиторы АПФ и БРА, могут оказывать церебропротективное действие вне их влияния на уровень АД. Метаанализ 26 проспективных рандомизированных исследований, включавших более 200 000 пациентов без симптомов СН (у 7000 из которых зафиксировано острое нарушение мозгового кровообращения), позволил F. Boutitie и соавт. сделать вывод о том, что препараты, потенциально снижающие уровень АII (бета-адреноблокаторы и ингибиторы АПФ) на 17 %, повышают риск развития инсульта по сравнению с антигипертензивными препаратами, повышающими уровень циркулирующего АII (тиазидные диуретики, дигидропиридиновые антагонисты кальция и БРА) [Avila-Funes]. Полученные результаты можно объяснить гипотезой о том, что при повышении уровня АII вследствие приема БРА он взаимодействует с незаблокированными АТ2-рецепторами, тем самым улучшая коллатеральный кровоток в головном мозге и повышая устойчивость нейронов к гипоксии и аноксии. Экспериметальные данные, полученные на биологических моделях, свидетельствуют о том, что внутривенное введение кандесартана после ишемического инсульта снижает риск развития постинсультных осложнений и повторного инсульта, улучшает моторные функции [Kurella]. Как уже указывалось, в исследовании SCOPE изучалась профилактика деменции и инсультов у пожилых пациентов с АГ. Важной характеристикой действия кандесартана у пожилых является отсутствие нежелательного эффекта ортостатической гипотонии, к которой склонны пациенты этой возрастной группы и которой могут способствовать некоторые другие антигипертензивные препараты. Кроме того, одним из наиболее спорных вопросов в кардиологии в течение многих лет являлась безопасность и необходимость снижения АД при мягкой и умеренной АГ у пожилых. Изначально планируемое как плацебо-контролируемое, это исследование по этическим причинам было трансформировано в рандомизированное исследование со сравнением эффективности терапии кандесартаном и обычного терапевтического подхода. В результате в исследовании SCOPE (n = 4964) показано, что применение кандесартана у пожилых пациентов с АГ связано со снижением риска развития фатального и нефатального инсульта по сравнению с другими антигипертензивными препаратами. Кандесартан снижал риск нефатального инсульта на 27,8 % и общего количества инсультов на 23,6 %, а также обеспечивал более медленные темпы снижения когнитивной функции, несмотря на то что число новых случаев деменции было очень низким для изучаемой возрастной группы [Lundkvist].
В исследовании ACCESS оценивалась безопасность использования кандесартана в остром периоде инсульта с целью умеренного снижения АД. Результаты исследования показали, что назначение кандесартана в остром периоде ишемического инсульта продемонстрировало значительное снижение суммарного показателя общей смертности и числа сердечно-сосудистых событий (на 47,5 %) по сравнению с группой пациентов, которым кандесартан был назначен спустя неделю после перенесенного инсульта. В группе плацебо смертность составила 7,2 % против 2,9 % в группе кандесартана [Schrader]. Недавно опубликованные результаты исследования Scandinavian Candesartan Acute Stroke Trial (SCAST), которые основаны на наблюдении 2029 больных острым инсультом, не выявили преимуществ активного лечения кандесартаном по сравнению с плацебо по первичной конечной точке (сосудистые события и результаты функциональных исследований) на этапе шести месяцев наблюдения. Аналогичные данные получены по другим исходно определенным конечным точкам. Кроме того, функциональный исход через 6 месяцев по оценке модифицированной шкалы Рэнкина достоверно не различался между группами, хотя была отмечена незначительная тенденция к ухудшению результатов при использовании лечения. Фактически исследование показало, что нет показаний для снижения АД в острой фазе инсульта. Авторы исследования считают, что результат исследования применим к другим препаратам и отсутствие позитивного результата связано с проблемой снижения артериального давления в острой фазе инсульта [Sandset].
Нефропротекция
При хроническом заболевании почек IV–V стадии (расчетная скорость клубочковой фильтрации менее 30 мл/мин/1,73 м2) кандесартан обладал способностью уменьшать протеинурию и тормозить ухудшение фильтрационной функции почек [48]. Результаты исследования SMART показали дозозависимость антипротеинурического эффекта кандесартана, достигающего максимума при применении его в дозе, превышающей рекомендуемую максимальную, но тем не менее оказывающейся сравнительно безопасной [Burgess]. В исследовании CALM у 199 больных АГ и сахарным диабетом 2-го типа кандесартан в дозе 16 мг один раз в день был столь же эффективен, как и терапия лизиноприлом в дозе 20 мг один раз в день, в плане как снижения АД, так и уменьшения микроальбуминурии. Комбинированное лечение обоими препаратами хорошо переносилось и было достоверно более эффективным как в снижении АД, так и в уменьшении соотношения альбумин/креатинин в моче [Mogensen].
Метаболические эффекты
В исследовании ALPINE (n = 392, срок наблюдения 1 год) кандесартан подтвердил не только свою эффективность в качестве антигипертензивного препарата, но и безопасность, отсутствие влияния на метаболизм (метаболическая нейтральность) и способность предотвращать развитие сахарного диабета типа 2 и сердечно-сосудистых катастроф [Lindholm]. В ходе исследования как в группе кандесартана, так и в контрольной группе (гидрохлортиазид + атенолол) были достигнуты целевые значения АД. При этом тощаковые концентрации глюкозы в сыворотке крови и уровня инсулина были достоверно выше в контрольной группе, чем в группе кандесартана. СД типа 2 был диагностирован у 4,1 % пациентов контрольной группы, в группе кандесартана — всего 0,5 %. Также неоднородные результаты были получены при исследовании липидного спектра у включенных в исследование пациентов. Отношение холестерина (ХС) липопротеинов высокой плотности к ХС липопротеинов низкой плотности снижалось в группе кандесартана и увеличивалось в группе гидрохлортиазида. Влияние на уровень триглицеридов также различалось между группами: концентрация ТГ незначительно увеличивалась в группе кандесартана и достоверно возрастала в группе гидрохлортиазида. Кроме того, у значительно меньшего количества пациентов, принимавших кандесартан, отмечалось развитие нежелательных эффектов на фоне терапии. В исследовании HIJ-Create кандесартан продемонстрировал снижение риска развития СД типа 2 на 63 % по сравнению со стандартной терапией — 71 % пациентов принимали ингибиторы АПФ [Kasanuki]. Несмотря на то что кандесартан оказывает весьма незначительное положительное влияние на метаболизм липидов и углеводов, в ряде исследований отмечались его положительные эффекты на инсулиночувствительность периферических тканей при ожирении. В работе G. Grassi и соавт. продемонстрировано, что при приеме кандесартана повышается чувствительность периферических тканей к инсулину, а также снижается симпатическая активность мышечных нервов у пациентов с АГ и сопутствующим ожирением [15].
Фибрилляция предсердий
В упомянутом выше исследовании CHARM у больных с симптомной СН, получавших современную терапию, назначение кандесартана приводило к снижению относительного риска развития фибрилляции предсердий на 19 % по сравнению с плацебо (ОР 0,812; 95% ДИ 0,662–0,998; p = 0,048) [Ducharme]. В подгруппе пациентов со сниженной фракцией выброса также наблюдалось достоверное снижение риска возникновения фибрилляции предсердий на 22 %.
Безопасность
Безопасность кандесартана была оценена в специальных исследованиях, включавших более чем 3600 пациентов, в том числе более 3200 больных АГ. У 600 из этих пациентов безопасность препарата была изучена в течение по крайней мере 6 месяцев, у более 200 больных — в течение не менее одного года. В целом лечение кандесартаном переносилось хорошо. Общая частота побочных эффектов при приеме кандесартана была сходна с плацебо. Частота отмены препарата из-за побочных эффектов во всех исследованиях у больных АГ (всего 7510) составила 3,3 % (т.е. 108 из 3260) пациентов, получавших кандесартан в качестве монотерапии, и 3,5 % (т.е. 39 из 1106) пациентов, получавших плацебо. В плацебо-контролируемых исследованиях прекращение терапии из-за неблагоприятных клинических событий произошло у 2,4 % (т.е. 57 из 2350) пациентов, получавших кандесартан, и у 3,4 % (т.е. 35 из 1027) пациентов, получавших плацебо. Наиболее распространенными причинами прекращения терапии кандесартаном были головная боль (0,6 %) и головокружение (0,3 %). Побочные эффекты, которые наблюдались в плацебо-контролируемых клинических исследованиях по крайней мере у 1 % пациентов, получавших кандесартан (при большей частоте случаев (n = 2350), чем в группе плацебо (n = 1027)): боли в спине (3 % против 2 %), головокружение (4 % против 3 %), инфекции верхних дыхательных путей (6 % против 4 %), фарингит (2 % против 1 %) и ринит (2 % против 1 %). Побочные эффекты, которые наблюдались в плацебо-контролируемых клинических испытаниях менее чем у 1 % пациентов, получавших кандесартан, но встречались приблизительно с той же частотой, что и в группе плацебо: повышенная утомляемость, периферические отеки, боль в груди, головные боли, бронхит, кашель, синусит, тошнота, боль в животе, диарея, рвота, боли в суставах, альбуминурия.
В опубликованных данных контролируемых исследований клинически значимых изменений в величине стандартных лабораторных показателей, связанных с приемом кандесартана, практически не наблюдалось. Так, крайне редко отмечалось незначительное увеличение уровня азота мочевины крови и креатинина в сыворотке крови. Гиперурикемия наблюдалась редко: у 19 (0,6 %) из 3260 пациентов, получавших кандесартан, и у 5 (0,5 %) из 1106 пациентов, получавших плацебо. Крайне редко происходило незначительное снижение уровня гемоглобина и гематокрита (среднее снижение примерно на 0,2 г/л и 0,5 объемных процентов соответственно) у пациентов, получавших кандесартан в качестве монотерапии, более того, оно практически не имело клинического значения. Развитие анемии, лейкопении, тромбоцитопении с последующей отменой наблюдалось только у одного пациента среди всех клинических исследований препарата. Отмечено небольшое увеличение уровня калия в сыворотке крови (в среднем на 0,1 ммоль/л) у пациентов, получавших кандесартан в виде монотерапии, однако оно редко имело клиническое значение. У одного пациента с застойной СН наблюдалась выраженная гиперкалиемия (калий сыворотки = 7,5 ммоль/л), потребовавшая отмены препарата, однако этот больной параллельно получал спиронолактон. Повышение уровня печеночных ферментов и/или билирубина в сыворотке крови также наблюдалось нечасто. Всего 5 пациентов, получавших кандесартан в клинических исследованиях, были исключены из-за изменений показателей биохимии печени. У них наблюдалось повышение активности трансаминаз, в двух случаях — незначительное повышение общего билирубина, но у одного из этих пациентов параллельно был выявлен гепатит А.
Важным моментом является обсуждение возможного отрицательного влияния комбинации БРА с ингибитором АПФ на почки, показанного в исследовании ONTARGET при комбинировании телмисартана и рамиприла. До публикации результатов такая комбинация использовалась в нефрологической практике очень широко и имела определенную позитивную доказательную базу: исследование CALM (кандесартан и лизиноприл) у больных СД 1-го типа и исследование COOPERATE (лазартан и трандолаприл) у больных с недиабетическим поражением почек. После публикации данных ONTARGET отношение к такой комбинации стало полярным: от полнейшего непринятия до умеренной позиции — если комбинация эффективна, то такую терапию нужно продолжать. Не менее важным моментом является обсуждение возможности трансляции результатов на другие препараты — представители класса БРА. Справедливо высказываются мнения, что проблемы этого исследования — это проблемы молекулы телмисартана, а не всего класса БРА. В доказательной базе кандесартана имеются два исследования, в которых его комбинация с ингибитором АПФ улучшала клиническое течение и прогноз: CALM (кандесартан и лизиноприл) у больных СД 2-го типа и CHARM-Added (кандесартан и другие ингибиторы АПФ) при хронической СН. Возможно, что это также связано с особенностями молекулы кандесартана.
Сравнение с другими сартанами
Как указывалось ранее, различные препараты БРА имеют различное сродство к АТ1-рецепторам, что может приводить к различиям в их конечных клинических эффектах. Это положение было изучено в недавно опубликованных анализах сравнительной эффективности кандесартана и лозартана при АГ и СН.
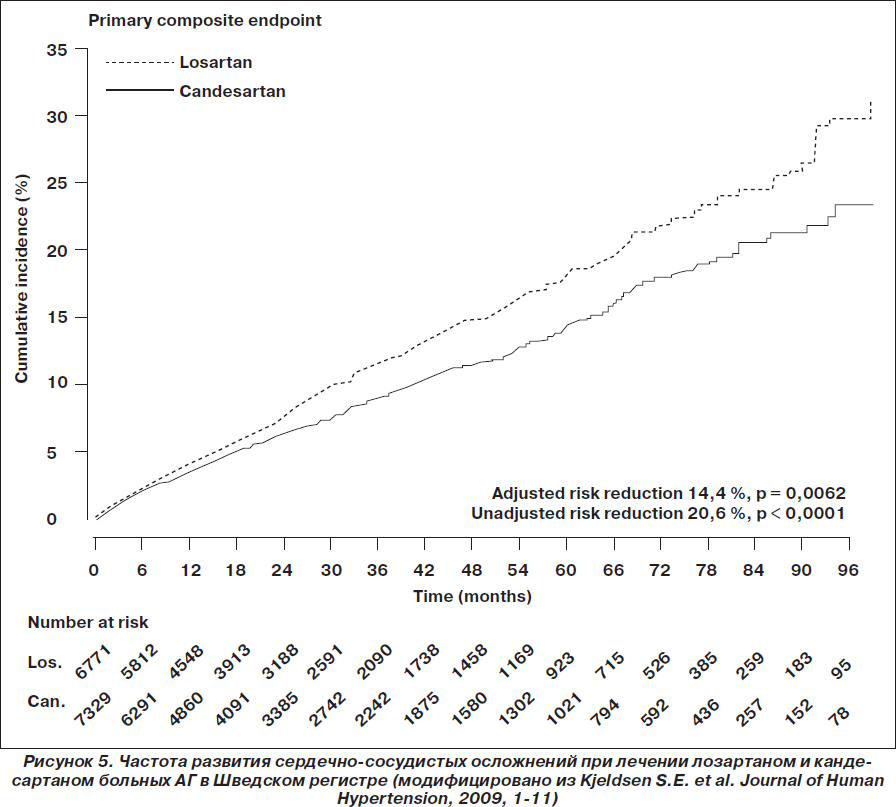
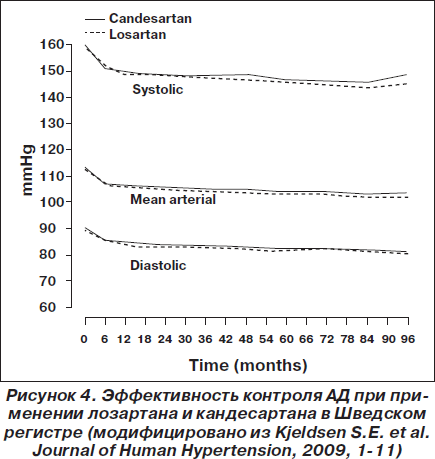
Артериальная гипертензия. В 2009 году был опубликован сравнительный анализ эффективности кандесартана и лозартана по данным Шведского регистра [Kjeldsen]. В анализ пациентов были включены данные 72 центров первичной медицинской помощи в Швеции в период с 1999 по 2007 год. Среди 24 943 отобранных пациентов 14 100 пациентов с диагнозом АГ получали лозартан (n = 6771) или кандесартан (n = 7329). Оценка исходов производилась по данным Шведского национального регистра госпитализаций и летальных исходов. В ходе наблюдения не было выявлено никакой разницы в эффективности снижения АД при сравнении групп лозартана и кандесартана. Данные об эффективности контроля АД представлены на рис. 4. По сравнению с группой лозартана в группе кандесартана отмечено достоверно более низкое скорректированное отношение риска для всех сердечно-сосудистых осложнений (0,86; 95% ДИ 0,77–0,96; р < 0,0062), СН (0,64; 95% ДИ 0,50–0,82; р < 0,0004), нарушений ритма сердца (0,80; 95% ДИ 0,65–0,92; p = 0,0330) и заболеваний периферических артерий (0,61; 95% ДИ 0,41–0,91; р < 0,0140). Авторы исследования считают, что поскольку не было различий в эффективности контроля АД, то объяснить различные клинические исходы могут механизмы, связанные с различными фармакологическими свойствами препаратов.
Недавно были опубликованы данные метаанализа Z. Zheng с соавт. (2011), в котором сравнивали антигипертензивную эффективность кандесартана и лозартана по данным доступных исследований [Zheng]. В анализ было включено 12 рандомизированных клинических исследований с участием 3644 пациентов. При сравнении эффективности кандесартана и лозартана в снижении систолического и диастолического АД в конце периода наблюдения эффективность кандесартана превосходила лозартан в среднем на 2,97 (95% ДИ –4,18 ... –1,77; р < 0,001) и 1,76 (95% ДИ –2,57 ... –0,96; р < 0,001) мм рт.ст. соответственно. Частота позитивного ответа на лечение и достижение эффективного контроля при лечении кандесартаном была больше в сравнении с лозартаном: коэффициент относительного риска — 1,12 (95% ДИ 1,06–1,18; р < 0,01) и 1,26 (95% ДИ 1,06–1,50; р = 0,008) соответственно. Общая частота побочных эффектов для обоих препаратов не различалась. В то же время частота серьезных нежелательных явлений при лечении кандесартаном была ниже, чем при терапии лозартаном: коэффициент относительного риска — 0,48 (95% ДИ 0,25–0,92; р = 0,03). Авторы анализа сделали вывод о том, что кандесартан превосходит лозартан в снижении АД, кроме того, кандесартан вызывает меньше серьезных побочных эффектов, чем лозартан.
Сердечная недостаточность. В 2011 году были также опубликованы данные Шведского регистра больных с систолической СН. Целью этого исследования была оценка влияния кандесартана по сравнению с лозартаном на показатель общей смертности у больных с СН. Для этого были проанализированы данные 30 254 больных, зарегистрированных в базе 62 больниц и 60 поликлиник в период между 2000 и 2009 годами. В анализ включено в общей сложности 5139 пациентов (средний возраст 74 года, 39 % женщин), которые получали кандесартан (n = 2639) или лозартан (n = 2500). Выживание больных по состоянию на 14 декабря 2009 года было проанализировано методом Каплана — Мейера и предикторы выживания были определены по данным одно- и многовариантной пропорциональной регрессии, со стандартизацией и без. Также были проведены стратификационный анализ и количественное определение остаточного смешения данных. Основным критерием оценки была смертность от всех причин через 1 год и 5 лет. Результаты показали, что однолетняя выживаемость составила 90 % (95% ДИ 89–91 %) у пациентов, получавших кандесартан, и 83 % (95% ДИ 81–84 %) у пациентов, получавших лозартан, а 5-летняя выживаемость составила 61 % (95% ДИ 54–68 %) и 44 % (95% ДИ 41–48 %) соответственно (p < 0,001). При многофакторном анализе с поправкой на склонность баллов соотношение риска смертности для лозартана по сравнению с кандесартаном было 1,43 (95% ДИ 1,23–1,65; р < 0,001). Результаты были сходными при использовании всех типов анализа. Авторы сделали заключение, что по данным этого реестра больных с СН применение кандесартана по сравнению с лозартаном был связано с более низким риском смерти [Eklind-Cervenka].
Заключение
Длительное время препараты БРА рассматривались врачами как резервные средства, назначаемые только в случае плохой переносимости ингибиторов АПФ. Существовало еще два важных препятствия для более широкого применения БРА в клинической практике: меньшая доказательная база БРА по сравнению с ингибиторами АПФ, а также более высокая стоимость лечения БРА по сравнению с ингибиторами АПФ, особенно генерическими. Нам хотелось бы, чтобы после ознакомления с приведенной выше доказательной базой каждый практикующий врач смог объективно оценить ее глубину и понять, что на сегодняшний день доказательная база для некоторых БРА, в т.ч. кандесартана, не менее полная, чем для большинства препаратов ингибиторов АПФ. С другой стороны, на сегодняшний день на рынке появились генерические БРА, в т.ч. отечественного производства, являющиеся более доступными, нежели оригинальные. Имея собственный позитивный опыт применения генерического кандесартана отечественного производства (препарат Касарк корпорации «Артериум»), мы можем рекомендовать препарат для более широкого клинического использования.
Выводы
1. Блокатор рецепторов ангиотензина II кандесартан имеет особенности фармакокинетики и фармакодинамики, которые могут определять его отличную от других препаратов этой группы эффективность.
2. Кандесартан обладает хорошим дозозависимым антигипертензивным эффектом у всех категорий больных АГ.
3. Доказательная база для кандесартана включает предгипертензию, АГ, сочетание АГ и сахарного диабета, хроническое заболевание почек, сочетание АГ и ишемической болезни сердца, сердечную недостаточность как с сохраненной, так и со сниженной функцией левого желудочка.
1. Кобалава Ж.Д., Склизкова Л.А., Тарапата Н.П. Обоснование, опыт и перспективы применения кандесартана цилексетила // Клин. фармакол. тер. — 2001. — 1. — C. 92-96.
2. Сіренко Ю.М., Радченко Г.Д., Поліщук С.А., Сидоренко П.І., Рейко М.М., Нестерак Р.В. Досвід застосування кандесартану (Касарк) порівняно з еналаприлом у пацієнтів із м’якою та помірною артеріальною гіпертензією (результати одномісячного спостереження) // Артериальная гипертензия. — 2009. — № 1. — С. 30-36.
3. Abrahamsson Т., Karp L., Brabdl-Eliasson II. el al. Candesartan causes long-last antagonism of angiotensin II receptor-mediated contractile effects in isolated vascular preparations: a comparison with irbesartan, losartan and its active metabolite (EXP-3174) // Blood Pressure. — 2000. — 9. — Abstr. Suppl. — P. 1-52.
4. Avila-Funes J.A., Amieva H., Barberger-Gateau P. et al. Cognitive impairment improves the predictive validity of the phenotype of frailty for adverse health outcomes: the three-city study // J. Am. Geriatr. Soc. — 2009. — 57. — Р. 453-461.
5. Burgess E., Muirhead N., Rene de Cotret P. et al. SMART (Supra Maximal Atacand Renal Trial) Investigators. Supramaximal dose of candesartan in proteinuric renal disease // J. Am. Soc. Nephrol. — 2009. — 20. — Р. 893-900.
6. Cuspidi C., Muiesan M.L., Valagussa L. еt al. Comparative effects of candesartan and enalapril on left ventricular hypertrophy in patients with essential hypertension: the candesartan assessment in the treatment of cardiac hypertrophy (CATCH) study // J. Hypertens. — 2002. — 20. — P. 2293-2300.
7. Ducharme A., Swedberg K., Pfeffer M.A. et al. CHARM Investigators. Prevention of atrial fibrillation in patients with symptomatic chronic heart failure by candesartan in the Candesartan in Heart failure: Assessment of Reduction in Mortality and morbidity (CHARM) program // Am. Heart J. — 2006. — 152. — Р. 86-92.
8. Eklind-Cervenka M., Benson L., Dahlstrцm U. еt al. Association of Candesartan vs Losartan With All-Cause Mortality in Patients With Heart Failure // JAMA. — 2011. — 305. — P. 175-182.
9. Escobar C., Barrios V., CalderoЂn A. et al. Electrocardiographic left ventricular hypertrophy regression induced by an angiotensin receptor blocker-based regimen in hypertensive patients with the metabolic syndrome: data from the SARA Study // J. Clin. Hypertens (Greenwich). — 2008. — 10. — P. 208-214.
10. Easthope S.E., Jarvis B. Candesartan cilexetil: an update of its use in essential hypertension // Drugs. — 2002. — 62. — P. 1253-1287.
11. Granger C.B., McMurray J.J.V., Yusuf S. et al. For the CHARM Investigators and Committees. Effects of candesartan in patients with chronic heart failure and reduced leftventricular systolic function intolerant to angiotensinconvertingenzyme inhibitors: the CHARM-Alternative trial // Lancet. — 2003. — Vol. 362. — P. 772-776.
12. Grassi G., Seravalle G., Dell’Oro R. еt al. For CROSS Study. Comparative effects of candesartan and hydrochlortiazide on blood pressure, insulin sensitivity and sympathetic drive in obese hypertensive individuals: results of the CROSS study // J. Hypertens. — 2003. — 21. — P. 1761-1769.
13. Hubner R., Hogemann A.M., Sunzel M., Riddell J.C. Pharmacokinetics of candesartan after single and repeated doses of candesartan cilexetil in young and elderly healthy volunteers // J. Hum. Hypertens. — 1997. — 11 (Suppl. 2). — P. S19-S25.
14. Inada Y., Ojima M., Kanagawa R. et al. Pharmacologic properties of candesartan cilexetil — possible mechanisms of long-term antihypertensive action // J. Hum. Hypertens. — 1999. — 13 (Suppl. 1). — P. S75-S80.
15. Julius S., Nesbitt S.D., Egan B.M. et al. Trial of Preventing Hypertension (TROPHY) Study Investigators. Feasibility of treating prehypertension with an angiotensin-receptor blocker // N. Engl. J. Med. — 2006. — 354. — Р. 1685-1697.
16. Kasanuki H., Hagiwara N., Hosoda S., Sumiyoshi T., Honda T., Haze K., Nagashima M., Yamaguchi J., Origasa H., Urashima M., Ogawa H.; HIJCREATE Investigators. Angiotensin II receptor blockerbased vs. nonangiotensin II receptor blockerbased therapy in patients with angiographically documented coronary artery disease and hypertension: the Heart Institute of Japan Candesartan Randomized Trial for Evaluation in Coronary Artery Disease (HIJ-CREATE) // Eur. Heart J. — 2009. — 30. — Р. 1203-1212.
17. Kjeldsen S.E., Stalhammar J., Hasvold P. et al. Effects of losartan vs candesartan in reducing cardiovascular events in the primary treatment of hypertension // Journal of Human Hypertension. — 2010. — 24. — P. 263-273.
18. Kurella Tamura M., Wadley V., Yaffe K. et al. Kidney function and cognitive impairment in US adults: the Reasons for Geographic and Racial Differences in Stroke (REGARDS) Study // Am. J. Kidney Dis. — 2008. — 52. — Р. 227-234.
19. Lindholm L.H., Persson M., Alaupovic P. et al. Metabolic outcome during 1 year in newly detected hypertensives: results of the Antihypertensive Treatment and Lipid Profile in a North of Sweden Efficacy Evaluation (ALPINE Study) // J. Hypertens. — 2003. — 21. — P. 1563-1574.
20. Linger T. Differences among angiotensin II type 1 receptor blockers: characterization of candesartan cilexetil // Blood Pressure. — 2000. — 9 (Suppl. 1). — P. 14-18.
21. Lithell H., Hansson L., Skoog I., Elmfeldt D., Hofman A., Olofsson B., Trenkwalder P., Zanchetti A. SCOPE Study Group. The Study on Cognition and Prognosis in the Elderly (SCOPE): principal results of a randomized double-blind intervention trial // J. Hypertens. — 2003. — 21. — P. 875-886.
22. Lundkvist J., Ekman M., Kartman B. et al. The cost-effectiveness of candesartan-based antihypertensive treatment for the prevention of nonfatal stroke: results from the Study on COgnition and Prognosis in the Elderly // J. Hum. Hypertens. — 2005. — 19. — Р. 569-57.
23. McClellan K.J., Goa K.L. Candesartan cilexetil. A review of its use in essential hypertension // Drugs. — 1998. — 56. — P. 847-869.
24. McMurray J.J.V., Цstergren J., Swedberg K. et al. For the CHARM Investigators and Committees. Effects of candesartan in patients with chronic heart failure and reduced leftventricular systolic function taking angiotensinconvertingenzyme inhibitors: the CHARM-Added trial // Lancet. — 2003. — Vol. 362. — P. 767-771.
25. Mogensen C.E., Neldam S., Tikkanen I., Oren S., Viskoper R., Watts R.W., Cooper M.E. For the CALM study group. Randomised controlled trial of dual blockade of renin-angiotensin system in patients with hypertension, microalbuminuria, and non-insulin dependent diabetes: the candesartan and lisinopril microalbuminuria (CALM) study // BMJ. — 2000. — 321. — Р. 1440-1444.
26. Norris S., Weinstein J., Peterson K., Thakurta S. Drug Class Review. Direct Renin Inhibitors, Angiotensin Converting Enzyme Inhibitors, and Angiotensin II Receptor Blockers. Drug Effectiveness Review Project // Oregon Health & Science University, 2009. — 144 р.
27. Ogihara T., Fujimoto A., Nakao K., Saruta T. CASE-J Trial Group. ARB candesartan and CCB amlodipine in hypertensive patients: the CASE-J trial // Expert Rev. Cardiovasc. Ther. — 2008. — P. 1195-1201.
28. Penicka M., Gregor P., Kerekes R. et al. Candesartan use in Hypertrophic And Non-obstructive Cardiomyopathy Estate (CHANCE) Study. The effects of candesartan on left ventricular hypertrophy and function in nonobstructive hypertrophic cardiomyopathy: a pilot, randomized study // J. Mol. Diagn. — 2009. — 11. — P. 35-41.
29. Pfeffer M.A., Swedberg K., Granger C.B., Held P., McMurray J.J.V., Michelson E.L., Olofsson B., Цstergren J., Yusuf S. For the CHARM Investigators and Committees. Effects of candesartan on mortality and morbidity in patients with chronic heart failure: the CHARM-Overall programme // Lancet. — 2003. — Vol. 362. — Р. 759-766.
30. Sandset E.C., Bath P., Boysen G. et al. Оn behalf of the SCAST Study Group. The angiotensin-receptor blocker candesartan for treatment of acute stroke (SCAST): a randomised, placebo-controlled, double-blind trial // Lancet. — 2011. — 377. — P. 741-750.
31. Schrader J., Lьders S., Kulschewski A. et al. Acute Candesartan Cilexetil Therapy in Stroke Survivors Study Group. The ACCESS Study: evaluation of Acute Candesartan Cilexetil Therapy in Stroke Survivors // Stroke. — 2003. — 34. — Р. 1699-1703.
32. Sever P., Holzgreve H. Long-term efficacy and tolerability of candesartan cilexetil and losartan in patients with mild to moderate hypertension // J. Hum. Hypertens. — 1999. — 13 (Suppl. 1). — P. S69-S73.
33. Suzuki T., Nozawa T., Fujii N., Sobajima M., Ohori T., Shida T., Matsuki A., Kameyama T., Inoue H. Combination therapy of candesartan with statin inhibits progression of atherosclerosis more than statin alone in patients with coronary artery disease // Coron. Artery Dis. — 2011 — 22. — P. 352-35.
34. Trenkwalder P., Lehlovirta M., Dahl K. Long-term treatment with candesartan cilexetil does not affect glucose homeostasis or serum lipid profile in mild hypertensives with type 2 diabetes // J. Hum. Hypertens. — 1999. — 13 (Suppl. 1). — P. S81-S83.
35. Vanderheyden P.M.L., Fierens F.L.P., De Backer J.P., Vauquelin G. Reversible and syntopic interaction between angiotensin receptor antagonists on Chinese hamster ovary cells expressing human angiotensin II type I receptors // Biochem. Pharmacol. — 2000. — 59. — P. 927-935.
36. Van Liefde I., Vauquelin G. Sartan-AT1 receptor interactions: In vitro evidence for insurmountable antagonism and inverse agonism // Molecular and Cellular Endocrinology. — 2009. — 302. — P. 237-243.
37. Williams S.A., Michelson E.L., Cain V.A. et al. TROPHY Study Investigators. An evaluation of the effects of an angiotensin receptor blocker on health-related quality of life in patients with high-normal blood pressure (prehypertension) in the Trial of Preventing Hypertension (TROPHY) // J. Clin. Hypertens (Greenwich). — 2008. — 10. — Р. 436-442.
38. Yusuf S., Pfeffer M.A., Swedberg K. et al. for the CHARM Investigators and Committees. Effects of candesartan in patients with chronic heart failure and preserved leftventricular ejection fraction: the CHARM-Preserved Trial // Lancet. — 2003. — Vol. 362. — P. 777-781.
39. Zheng Z., Shi H., Jia J., Li D., Lin S. A systematic review and meta-analysis of candesartan and losartan in the management of essential hypertension // Journal of the Renin-Angiotensin-Aldosterone System. — 2011. — Published online March 18, 1470320310391503