Журнал «Здоровье ребенка» 2 (29) 2011
Вернуться к номеру
Ефективність лікування дітей, хворих на бронхіальну астму, залежно від активності запалення дихальних шляхів
Авторы: Воротняк Т.М., Кафедра педіатрії та дитячих інфекційних хвороб Буковинського державного медичного університету, м. Чернівці
Рубрики: Педиатрия/Неонатология
Версия для печати
Вивчали ефективність базисної терапії у 57 хворих на бронхіальну астму залежно від активності запального процесу дихальних шляхів. Показано, що в цілому контролююча терапія виявилася дещо ефективнішою у дітей із «помірним» запаленням дихальних шляхів, однак цей незначний ефект визначається тільки за умови великої кількості пролікованих хворих. Водночас у цих дітей виявлене значне зниження ризику виникнення денних і нічних симптомів захворювання, необхідності позапланових візитів до алерголога. Разом із тим у хворих із вираженим запаленням відмічено зниження ризику частого застосування швидкодіючих b2-агоністів, частоти загострень на рік та частоти госпіталізацій.
Діти, бронхіальна астма, активність запалення бронхів, лікування.
Вступ
Сучасні рекомендації лікування та моніторингу хворих на бронхіальну астму (БА) базуються на оцінці тяжкості хвороби чи її контролю [2]. Для вибору об’єму контролюючої терапії та оцінки її ефективності зазвичай застосовуються схеми, що відображають частоту виникнення клінічних ознак хвороби, ступінь зниження толерантності до фізичної активності, частоту загострень захворювання та необхідність позапланових візитів до алерголога, а також частоту застосування швидкодіючих b2-агоністів [3]. Недоліком цих схем оцінки рівня контролю бронхіальної астми можна вважати превалювання суб’єктивних критеріїв над об’єктивними показниками, які нерідко є більш чутливими і мають більшу прогностичну цінність. До таких критеріїв оцінки рівня контролю захворювання, мабуть, можна зарахувати активність запалення бронхів, зниження якої є метою базисної терапії [7]. З огляду на це є доцільним оцінити ефективність базисної терапії у дітей залежно від вираженості запалення дихальних шляхів за результатами дослідження конденсату видихуваного повітря.
Мета роботи — оцінити ефективність базисної терапії в обстежених дітей залежно від вираженості запалення дихальних шляхів за результатами дослідження конденсату видихуваного повітря.
Матеріал і методи
Для досягнення мети роботи обстежено 57 дітей шкільного віку, хворих на бронхіальну астму, які проходили стаціонарне лікування в Обласній дитячій клінічній лікарні № 1 м. Чернівці. Беручи до уваги, що тяжкість бронхіальної астми визначається фенотипічними ознаками, і зокрема, інтенсивністю запального процесу в дихальних шляхах [1, 4], із обстежених нами дітей, хворих на бронхіальну астму, сформовано 2 клінічні групи за показниками активності запалення бронхів. З огляду на те, що за даними літератури оксид азоту є «маркером запалення» при бронхіальній астмі [5, 6], за критерій активності взято рівень метаболітів оксиду азоту в конденсаті видихуваного повітря. Оскільки при окисному стресі (що наявний за загострення бронхіальної астми) відбувається руйнування білкових сполук, як другий критерій активності запалення обрано вміст азоказеїну (показник лізису високомолекулярних білків) у конденсаті видихуваного повітря. Таким чином, ми сформували 2 клінічні групи за показниками конденсату видихуваного повітря: за одночасним умістом метаболітів оксиду азоту більше 40 мкмоль/л та протеолітичною активністю за лізисом азоказеїну більше 1,3 мл/год. Так, при досягненні цих показників діагностували сильне (виражене) запалення в дихальних шляхах (30 дітей), при меншому їх умісті — помірну активність запального процесу в дихальних шляхах (27 дітей). Середній вік дітей І групи (із сильним запальним процесом бронхів) становив 11,10 ± 0,49 року (71,10 ± 6,34 % хлопчиків), ІІ групи — 12,30 ± 0,46 року (76,70 ± 5,51 % хлопчиків), тобто групи порівняння порівнянні за основними клінічними характеристиками.
Дітей обстежували у процесі актуального спостереження в середньому впродовж 6 місяців. Ефективність контролюючої терапії бронхіальної астми у дітей клінічних груп порівняння оцінювалася в балах, при цьому зменшення суми балів свідчило про ефективність контролюючої терапії, а збільшення — про зниження рівня контролю бронхіальної астми. Ефективність лікування оцінювали за зниженням абсолютного (ЗАР) та відносного ризиків (ЗВР) з урахуванням мінімальної кількості хворих, яких необхідно пролікувати для отримання одного позитивного результату (МКХ).
Отримані результати дослідження аналізувалися за допомогою пакета програм Statistica 7.0 StatSoft Inc. з використанням параметричних і непараметричних методів обчислення, а також методами біостатистики та клінічної епідеміології.
Результати дослідження та їх обговорення
Відмічено, що контролююча терапія, яку отримували діти до та в процесі актуального спостереження, у більшості дітей знаходилася на 3–4-й «сходинці» і тільки в третини хворих вона відповідала 2-й «сходинці» терапії за рекомендаціями GINA-2008. Так, лише інгаляційні ГКС застосовували діти І групи у 39,2 % спостережень, пацієнти ІІ групи — у 31,7% випадків. Інгаляційні ГКС у поєднанні з інгаляційними тривало діючими b2-агоністами у І групі використовували у 10,7 % випадків та у ІІ групі — 16,7 % пацієнтів. Базисна терапія у вигляді інгаляційних ГКС у поєднанні з інгаляційними тривалодіючими b2-агоністами та теофіліном у І групі дітей відмічалася у 50,1 % спостережень та у ІІ групі — у 51,6 % випадків. Відсутність вірогідних розбіжностей за частотою застосування поданих варіантів базисної терапії у дітей груп порівняння дозволила у подальшому об’єктивно оцінити ефективність контролюючої терапії в цілому.
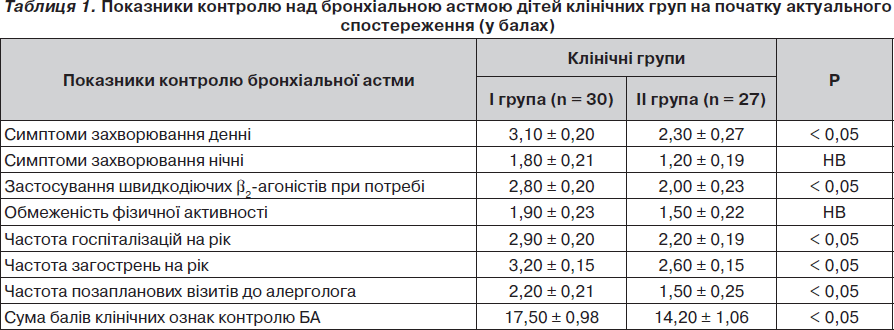
У табл. 1 наведені показники рівня контролю бронхіальної астми на початку актуального спостереження за дітьми клінічних груп порівняння.
Відмічено, що діти з вираженим запаленням дихальних шляхів вірогідно частіше скаржилися на наявність денних симптомів бронхіальної астми та необхідність застосування швидкодіючих b2-агоністів, частіше відзначали загострення бронхіальної астми, що приводили до позапланових візитів до алерголога та госпіталізації у стаціонар.
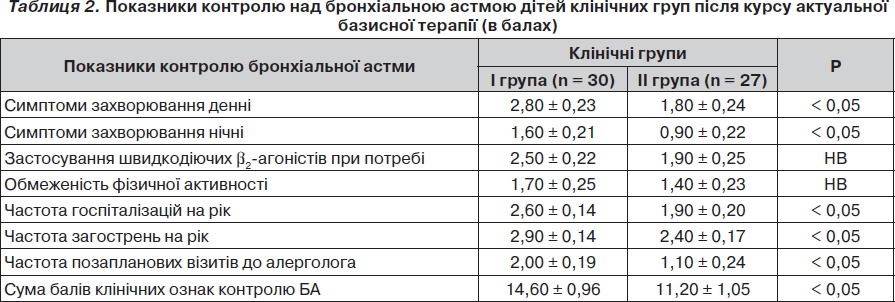
Ефективність контролюючої терапії у дітей клінічних груп після завершення актуального спостереження наведена у табл. 2.
Виявлено, що діти з вираженим запаленням дихальних шляхів у кінці актуального спостереження порівняно з пацієнтами ІІ групи вірогідно частіше скаржилися на наявність денних і нічних симптомів бронхіальної астми, частіше позапланово зверталися до алерголога та частіше госпіталізувалися у стаціонар із нападом бронхіальної астми.
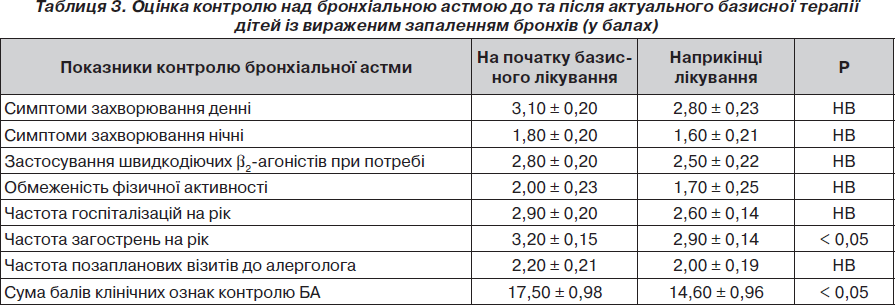
У табл. 3 наведені показники контролю над БА у дітей із вираженим запаленням бронхів до та після закінчення актуальної базисної терапії.
Отримані дані дають підстави вважати, що наприкінці актуального спостереження у пацієнтів із вираженим запаленням дихальних шляхів вірогідно зменшувалася частота загострень бронхіальної астми та сума балів клінічних критеріїв контролю бронхіальної астми.
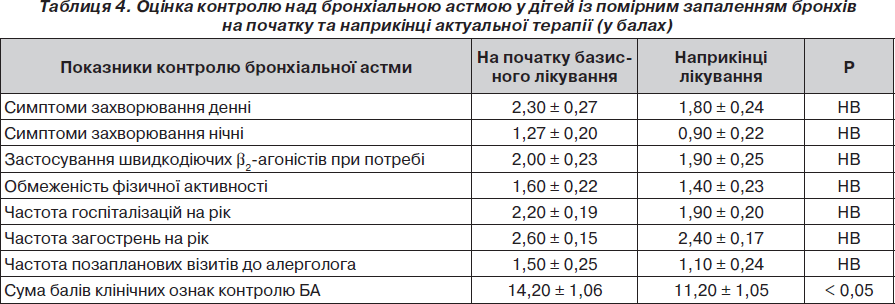
У табл. 4 наведена ефективність контролюючої терапії у дітей із «помірним» запаленням бронхів шляхом порівняння клінічних показників до та після актуального лікування.
Відмічено, що наприкінці актуального контролюючого лікування у дітей із помірним запальним процесом дихальних шляхів вірогідно зменшувалася сума балів клінічних ознак ефективності базисної терапії. Це дає підстави вважати, що проведене актуальне контролююче лікування у цих дітей виявилося ефективним, однак недостатнім для повного контролю над захворюванням.
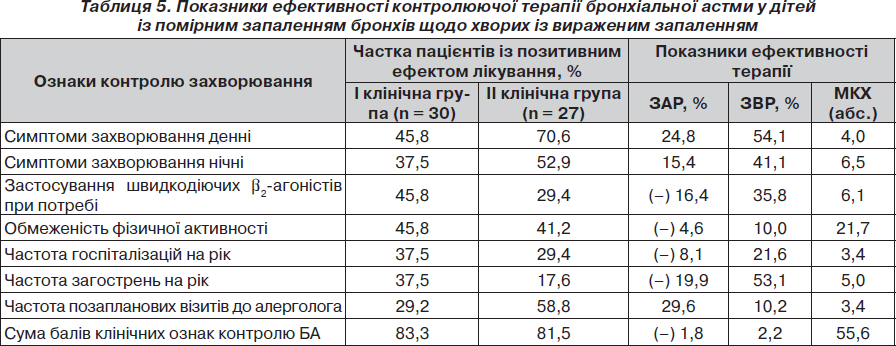
У табл. 5 наведені показники ефективності актуальної контролюючої терапії у дітей із помірним запаленням дихальних шляхів щодо хворих із вираженим запальним процесом.
У цілому контролююча терапія виявилася дещо ефективнішою у дітей з помірним запаленням дихальних шляхів, однак цей незначний ефект визначається тільки за умов великої кількості пролікованих хворих. Водночас у цих дітей виявлене значне зниження ризику виникнення денних і нічних симптомів захворювання, необхідності позапланових візитів до алерголога. Разом з тим у хворих із «вираженим» запаленням відмічено зниження ризику частого застосування швидкодіючих b2-агоністів, частоти загострень на рік та частоти госпіталізацій.
Отже, можна зробити висновок, що визначення активності запального процесу бронхів дозволить обґрунтувати індивідуалізовану базисну терапію, особливо на етапі моніторингу БА, з метою підтримки контролю. У цей період лікування бронхіальної астми, коли зникають або регресують клінічні прояви захворювання, великого значення набувають сурогатні критерії ефективності терапії. З огляду на наведені вище дані, можна вважати, що як такий показник доцільно застосовувати ступінь запалення дихальних шляхів, визначеного на основі аналізу конденсату видихуваного повітря.
Висновки
1. Після курсу базисної терапії у хворих із вираженим запаленням відмічено зниження ризику частого застосування швидкодіючих b2-агоністів, частоти загострень і госпіталізацій на рік. У дітей із помірним запаленням дихальних шляхів наприкінці курсу базисної контролюючої терапії виявлене значне зниження ризику виникнення денних і нічних симптомів захворювання та необхідності позапланових візитів до алерголога.
2. Визначення активності запального процесу бронхів за показниками конденсату видихуваного повітря дозволить обґрунтувати індивідуалізовану базисну терапію, особливо на етапі моніторингу БА з метою підтримки контролю.
Перспективи подальших досліджень полягають у вивченні спірографічних маркерів як показників контролю бронхіальної астми у дітей шкільного віку.
1. Ячник А.И., Победенная Г.П. Механизмы реализации хронического воспаления при бронхиальной астме и возможные подходы к лечению // Укр. пульмонологічний журнал. — 2005. — № 1. — С. 60-63.
2. Bateman E.D., Hurd S.S., Barnes P.J. et al. Global strategy for asthma management and prevention: GINA executive summary // Eur. Respir. J. — 2008. — Vol. 31. — P. 143–178.
3. British Guideline on the Management of Asthma // Thorax. — 2008. — Vol. 63. — P. 1-121.
4. Horvбth I., Hunt J., Barnes P.J.Exhaled breath condensate: methodological recommendations and unresolved questions // Eur. Respir. J. — 2005. — Vol. 26. — P. 523-548.
5. Kharitonov S.A. Influence of different therapeutic strategies on exhaled NO and lung inflammation in asthma and COPD // Vascul. Pharmacol. — 2005. — Vol. 43(6). — P. 371-378.
6. Rosias P.P., Jцbsis Q., van de Kant K. et al.Global condensation: a «climate change» towards better standardisation of exhaled breath condensate measurements // Eur. Respir. J. — 2008. — Vol. 31. — P. 684-685.
7. Taylor A.J.N., Cullinan P., Burge P.S. et al.BOHRF guidelines for occupational asthma // Thorax. — 2005. — Vol. 60. — P. 364-366.