Журнал «Травма» Том 9, №1, 2008
Вернуться к номеру
Мікробіологічна діагностика ранової інфекції у постраждалих з відкритими переломами кісток гомілки
Авторы: В.Т. Шевченко, А.К. Рушай, В.Ю. Борисов, В.Г. Пернакова, Л.Л. Поповіченко, О.М. Піддубна - НДІ травматології та ортопедії Донецького національного медичного університету ім. М. Горького, Донецьк, Україна
Рубрики: Травматология и ортопедия, Методы исследования
Разделы: Справочник специалиста
Версия для печати
Визначені провідні збудники раневої інфекції, високі рівні щільності колонізації ран S. aureus, P. aeruginosa, Enterobacteriaceae spp. При лікуванні відзначено швидку елімінацію ран Enterobacteriaceae spp, P. aeruginosa і повільну - S. aureus. P. aeruginosa, E. faecalis, Proteus spp в більшості випадків чутливі до 1–3 антибіотиків. 19,0% штамів E. faecalis, 16,7% штамів Proteus spp полірезистентні до антибіотиків.
Определены ведущие возбудители раневой инфекции, высокие уровни плотности колонизации ран S. aureus, P. aeruginosa, Enterobacteriaceae spp. При лечении отмечена быстрая элиминация ран Enterobacteriaceae spp, P. aeruginosa и медленная - S. aureus. P. aeruginosa, E. faecalis, Proteus spp в большинстве случаев чувствительны к 1–3 антибиотикам. 19,0% штаммов E. faecalis, 16,7% штаммов Proteus spp полирезистентны к антибиотикам.
It is had been determined main orogins of wound infection and high levels of wounds’ colonisation by S. aureus, P. aeruginosa, Enterobacteriaceae spp. There are fast wound’s elimination by Enterobacteriaceae spp, P. aeruginosa and slow by S. aureus during special treatment. P. aeruginosa, E. faecalis, Proteus spp are high sensitive to 1-3 antibiotics. 19,0% of E. faecalis and 16,7% of Proteus spp has multi-resistance for antibiotics.
бактерії (аналіз і діагноз), антибіотики, кістки, рани
бактерии (анализ и диагноз), антибиотики, кости, раны
bacteria (analysis and diagnosis), antibiotics, bone, wound
Топографічна наближеність відкритих переломів кісток гомілки (ВПКГ) зумовлює можливість інфікування ран грунтовими та іншими мікроорганізмами з довкілля. Крім того, важкість травми сприяє зниженню імунітету і транслокації аутофлори з кишечника та інших локальних джерел до місця травми. Створюються сприятливі умови для розвитку ранової інфекції (РІ). Отримання даних про мікрофлору рани до лікування і моніторинг її в процесі лікування надає незаперечну допомогу в призначенні та корекції етіотропної антибіотикотерапії, а також дозволяє оцінити ефективність лікування.
Мета роботи полягала в проведенні мікробіологічної діагностики РІ у постраждалих з ВПКГ шляхом визначення видового складу мікрофлори ран та її чутливості до антибіотиків (АБ) у процесі лікування травми.
Матеріали і методи
Загальновизначеними мікробіологічними методами [4] визначали видовий склад мікрофлори виділень ран (ВР) та щільність її колонізації (ЩК) мікроорганізмами. Чутливість виділених культур до хіміотерапевтичних препаратів визначали методом дифузії в агар з використанням дисків в запропонованій модифікації [1]. Вивчали чутливість мікрофлори ран до АБ різних груп: пеніцилінів, цефалоспоринів, аміноглікозидів, тетрациклінів, макролідів, фузідину, карбапенемів, фторхінолонів, вважаючи на особливості їх тропності до грамнегативних і грампозитивних мікроорганізмів [1,6]. Дослідження проводили до початку лікування і в процесі лікування з інтервалами 7–10 днів. Проаналізовано мікробіоценози ран у 77 постраждалих.
Результати та обговорення
До початку антибіотикотерапії з 77 проб ВР прорости дали 56 (72,7%), а в 27,3% випадків проби були стерильними. В подальшому за клінічними показаннями досліджені поступово 30, 11, 8, 4 і 3 постраждалих. На 2-му етапі прорости складали 83,3%, а потім їх кількість коливалась в інтервалах 72,7-50,0% від кількості досліджень. Різниця в процентах проростів і стерильних проб було суттєвою (р< 0,05) на 1-3-му етапах дослідження. Таким чином, ми встановили високі початкові проценти інфікування ран при ВПКГ, які знижувались в процесі лікування.
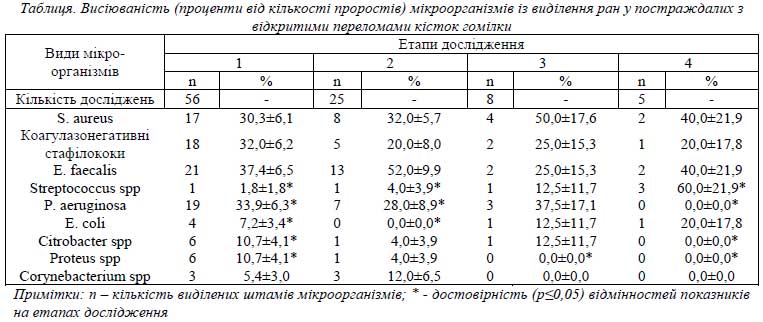
Видовой склад мікробіоценозів ран представлено в таблиці. Її дані свідчать, що на поверхні ран постраждалих знаходились найбільш розповсюджені збудники РІ – Staphylococcus aureus, коагулазонегативні стафілококи (КНС), Enterococcus faecalis, Pseudomonas aeruginosa. В меньшій (р<0,05) кількості (7,2-10,7 %) виявляли представників сімейства Enterobacteriaceae, родів Streptococcus і Corynebacterium. В процесі лікування висіюваність S.aureus змінювалась несуттєво і поєднувалась з тривалою (до 6-го етапу включно) персистенцією. Інші коки і Escherichia coli знаходились в ранах до 4-го етапа, P. aeruginosa і Citrobacter spp - до 3-го, а Proteus spp і Corynebacterium spp – до 2-го. Відмічено деякі збільшення висіюваності Streptococcus spp і E. coli на етапах дослідження. В іншої мікрофлори проценти висіюваності в процесі лікування різнились несуттєво. Дослідженнями показана більш швидка (7-10 днів) елімінація з мікробіоценозів Corynebacterium spp, Proteus spp, а протягом 2-3 тижнів - Citrobacter spp, P. aeruginosa.
ЩК ВР в основному складала (105–106) або (107–109) КУО/г. До лікування у більшості штамів S. aureus, P. aeruginosa ЩК дорівнювала (107–109) КУО/г (64,7% і 63,2% відповідно). На 2-му етапі така ЩК відмічалась у 25,0% і 28,6% з відповідним збільшенням процентів ЩК (105–106) КУО/г до 75,0% і 71,4%. Надалі максимальні ЩК у S.aureus досягали 75,0-50,0%, у P.aeruginosa – 0,0%. Аналогічною була динаміки ЩК у E. coli, Citrobacter spp, Corynebacterium spp. У КНС і Proteus spp до лікування і в його процесі переважала ЩК (105 – 106) КУО/г. У E. faecalis протягом досліджень зберігались співвідношення 1:1 популяцій з ЩК (105 – 106) КУО/г і (107 – 109) КУО/г.
Таким чином, більш вірулентні види мікрофлори на початку РІ мали вищі ЩК, ніж сапрофіти та інші меншвірулентні умовно-патогенні мікроорганізми. На 2-му етапі дослідження кількість максимальних ЩК знижувалась (крім E. faecalis), а потім коливалась без суттєвої різниці.
Досліджено динаміку чутливості до АБ мікроорганізмів, виділених із ВР. Насамперед треба визначити динаміку висіюваності мікрофлори. Якщо показники її на 1-му етапі дослідження прийняти за 100%, то на 2-му етапі вони знижувались в 1,6–2,1 (E. faecalis, S. aureus), в 2,7–3,5 (P. aeruginosa, КНС) і в 6,0 (Citrobacter spp, Proteus spp) раза. На наступних етапах зниження висіюваності мікрофлори було ще більш нагляднішим: її показники коливались від 25,0 до 5,6%. Напевно, це відображає динаміку загибелі чутливих до АБ штамів і виживання резистентних.
Половина виділених штамів S. aureus була чутливою до великої кількості АБ - 4–9, а 41,2% - до більш ніж 10 АБ, і лише 5,9% - до 1–3 АБ (р<0,05). На 2-му етапі залишалось по 37,5% штамів, чутливих до 4–9 і більше10 АБ. За рахунок загибелі чутливих штамів відбулося відносне збільшення кількості резистентних і чутливих до 1-3 АБ штамів (по 12,5%). Далі висівались поодиночні штами S. aureus з рівним перерозподілом чутливості до 4–9 і більше 10 АБ. Штами КНС також мали чутливість до багатьох АБ (до 4–9 і більше 10). Але кількість чутливих до 1–3 АБ була вище, ніж серед S. aureus. До більшості досліджених АБ були чутливі також виділені з ВР штами E. coli і Citrobacter spp. Серед виділених штамів E. faecalis було багато полірезистентних (19,0%) та чутливих до малої кількості (1–3) АБ. В сумі вони складали 57,1%. Решта порівну розподілялась на чутливі до 4–9 і більше 10 АБ. На 2-му етапі сума резистентних до АБ штамів E. faecalis залишалась високою (38,4%). На 3–4-му етапах дослідження кількість чутливих до малого (1–3) та великого (4–9) числа АБ була однаковою. До малого числа АБ були чутливі 52,6% штамів P. aeruginosa, а більшість решти – до 4–9 АБ. На 2-му етапі ці співвідношення зберігались, а на 3-му залишались поодиночні штами, лише полірезистентні та чутливі до 1–3 АБ. Резистентністю та слабкою чутливістю до АБ характеризувались штами Proteus spp. Багато з виділених штамів Corynebacterium spp були чутливі до малого числа АБ (66,7%), а в процесі лікування з’явився навіть полірезистентний штам.
Таким чином, чутливістю до більшості досліджених АБ, відсутністю полірезистентних штамів характеризуються S. aureus, КНС, E. coli, Citrobacter spp, що виділялись з ран при ВПКГ. Чутливі до малого (1 – 3) числа АБ здебільшого P. aeruginosa, E. faecalis, Proteus spp, Corynebacterium spp. Серед виділених штамів E. faecalis, P. aeruginosa, Proteus spp визначаються полірезистентні (19,0-33,3%). На етапах дослідження переважає елімінація штамів мікроорганізмів, що мають чутливість до більшості АБ разом зі збільшенням решти резистентних.
Дослідженнями доведено, що при ВПКГ спостерігаються високі проценти (72,7%) інфікування ран, що є природним явищем з урахуванням топографії та важкості ран [5]. Серед збудників РІ переважають S. aureus, КНС, E. faecalis, P. aeruginosa, в меншій кількості зустрічаються Enterobacteriaceae spp, Corynebacterium spp. Спектр збудників РІ аналогічний даним літератури [2, 5, 6]. В процесі лікування стійко персистирують S. aureus, E. faecalis, E. coli. Раніш за інших елімінуються Corynebacterium spp, Proteus spp, P. aeruginosa, не зважаючи на те, що у них великі проценти чутливих до малого числа АБ штамів і є полірезистентні штами.
Виявлено, що в більшій мірі вірулентні збудники РІ (S. aureus, P. aeruginosa) мають ЩК вище, ніж сапрофіти та інші умовно-патогенні види (КНС, Enterobacteriaceae spp), а E. faecalis - однакові проценти ЩК в рамках (105 – 106) КУО/г і (107 – 109) КУО/г. Дані вказують на їх більш високі персистентні властивості, потенційну можливість розширення екологічної ніши [5], а також на гостроту процесу запалення як прояв синдрому системної запальної відповіді з урахуванням ролі в цьому процесі ендотоксинів грамнегативних (P. aeruginosa, Enterobacteriaceae spp) та екзотоксинів грампозитивних (стафілококи, ентерококи) мікроорганізмів [3].
Якщо зменшення ЩК оцінювати як показник ефективності лікування, очевидно, що вона була низькою відносно E. faecalis, помітна на перших етапах відносно S. aureus і P. aeruginosa. Пояснюється це різним відношенням мікрофлори до АБ (низькою чутливістю E. faecalis [2, 6], селекцією резистентних штамів серед S. aureus і P. aeruginosa [2]). Відношення до АБ виділених збудників РІ при ВПКГ вкладається в рамки закономірності природної чутливості та резистентності, селекції резистентних штамів в процесі лікування травми, а також появою резистентності внаслідок впливу інших факторів [2, 7].
Висновки
1. Переважними компонентами мікробіоценозів ран при відкритих переломах кісток гомілки є S. aureus, коагулазонегативні стафілококи, E. faecalis, P. aeruginosa.
2. На початку інфекційного процесу найвищі показники щільності колонізації одержано у S. aureus, P. aeruginosa, представників сімейства Enterobacteriaceae.
3. В процесі лікування ран спостерігається швидка елімінація бактерій роду Corynebacterium, сімейства Enterobacteriaceae, P. aeruginosa. Максимальні терміни персистенції в ранах помічені у S. aureus.
4. Виділені з ран штами S. aureus, коагулазонегативних стафілококів, E. coli, Citrobacter spp характеризуються переважанням чутливості до 4 – 9 і більше антибіотиків і відсутністю полірезистентних штамів.
5. Чутливі до малого (1 – 3) числа антибіотиків переважно P. aeruginosa, E. faecalis, Proteus spp, Corynebacterium spp. 19,0% виделених із ран штамів E. faecalis, 16,7% Proteus spp є полірезистентними до антибіотиків. В процесі лікування з’являються полірезистентні штами P. aeruginosa.
6. Результати роботи можливо використовувати для призначення і корекції етіотропної антибіотикотерапії та оцінки ефективності лікування.
- Авдеева Л.В., Полищук Е.И., Покас Е.В. Методические подходы к определению чувствительности микроорганизмов к антибиотикам // Лаб. диагностика.. – 2005. - №3 (33). – С. 35 – 40.
- Березняков И.Г. Резистентность микробов к антибиотикам: механизмы возникновения и пути преодоления // Біль, знеболювання і інтенсивна терапія. – 1999. - №3 (8). – С. 28 – 31.
- Кузин М.И. Синдром системного ответа на воспаление // Хирургия. – 2000. - №2. – С. 54 – 59.
- Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений / Приказ №535 МЗ СССР. – М., 1985. – 126 с.
- Фадеев С.Б., Чернова О.Л., Киргизова С.Б., Бухарин О.В. Особенности хирургической инфекции мягких тканей // Хирургия. – 2001. - №7. – С. 42 – 44.
- Черний В.И., Колесников А.Н., Кузнецова И.В., Лунёва А.Г., Бойцун И.Н., Каспарова О.В., Колесникова А.Г. Роль системы бактериального мониторинга в оптимизации антибактериальной терапии в медицине критических состояний // Лаб. диагностика.. – 2005. - №3 (33). – С. 40 – 46.
- Levy S.B. The challende of antibiotic resistance // Scientific American. – 1998. – V. 278. – P. 32 – 39.