Журнал «Травма» Том 10, №2, 2009
Вернуться к номеру
Микротвердость губчатого вещества проксимального эпифиза большеберцовой кости при имплантации в нее керамического гидроксилапатита и деминерализованного костного матрикса
Авторы: Е.П.Бережной - Государственный медицинский университет, Луганск, Украина
Рубрики: Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
Установлено, что при нанесении сквозного дырчатого дефекта в проксимальных отделах диафиза большеберцовой кости микротвердость трабекул губчатого вещества проксимального эпифиза снижается прямо пропорционально стадийной активности процессов репаративной регенерации. Имплантация в область нанесенного дефекта керамического гидроксилапатита и деминерализованного костного матрикса в значительной степени сглаживает изменения микротвердости.
Встановлено, що при нанесенні наскрізного дирчастого дефекту в проксимальних відділах діафіза великогомілкової кістки мікротвердість трабекул губчастої речовини проксимального епіфіза знижується прямо пропорційно стадійній активності процесів репаративної регенерації. Імплантація в ділянку дефекта керамчного гідроксилапатиту та демінералізованого кісткового матриксу значною мірою згладжує зміни мікротвердості.
In the work we showed that through defect in proximal portion of diaphysis leads to decrease of microhardness in trabecules, which is directly proportional to stage related activity of bone regeneration. Implantation of ceramic hydroxyapatite and demineralized bone matrix returns the microhardness values to baseline.
костный минерал, гидроксилапатит, деминерализованный костный матрикс, губчатое костное вещество, микротвердость
кістковий мінерал, гідроксилапатит, демінералізований кістковий матрикс, губчаста кісткова речовина, мікротвердість
bone mineral, hydroxyapatite, demineralized bone matrix, cancellous bone, microhardness
современной травматологии и ортопедии достаточно широко используется пластика костных дефектов различными материалами. Как правило, эти материалы должны обладать и остеокондуктивными и остеоиндуктивными свойствами. Одним из вариантов используемого материала является комбинация керамического гидроксилапатита (КГОА) и деминерализованного костного матрикса (ДКМ). Особый интерес при этом вызывает, помимо оптимизации процессов репаративного остеогенеза, реакция на имплантацию костного органа в целом. В предшествующих исследованиях нами были изучены процессы роста и формообразования, химический состав костного вещества, ультраструктура кристаллической решетки костного минерала при имплантации в большеберцовую кость комбинации КГОА и ДКМ [1-2]. Цель данной работы – изучить в эксперименте микротвердость губчатого вещества проксимального эпифиза большеберцовой кости при имплантации в проксимальный отдел диафиза комбинации КГОА и ДКМ. Работа является фрагментом межкафедральной НИР Луганского государственного медицинского университета “Особенности роста, строения и регенерации трубчатых костей при пластике костных дефектов материалами на основе гидроксилапатита” (государственный регистрационный номер - 0103U006651).
Материал и методы
Исследования были проведены на 210 белых крысах-самцах с исходной массой тела 130-150 г, распределенных на пять групп: 1-я (К) – это группа интактных животных, 2-я (Д) – животные, которым формировали сквозные костные дефекты на границе проксимального метафиза и диафиза большеберцовой кости (ББК) диаметром 2,2 мм [3], в 3-й группе (А) дефект заполняли порошкообразным КГОА с размером частиц менее 63 мкм (производства НПП КЕРГАП, Украина), в 4-й (В) – измельченным ДКМ и в 5-й (С) – комбинацией КГОА с измельченным ДКМ в соотношении 2:1. Манипуляции на животных выполняли в соответствии с правилами европейской конвенции защиты позвоночных животных, использующихся в экспериментальных и других научных целях [4].
По истечении сроков эксперимента крыс забивали декапитацией под эфирным наркозом. У животных выделяли и освобождали от мягких тканей скелета большеберцовые кости. Для определения микротвердости фрагмент проксимального эпифиза большеберцовой кости заливали в акрилоксид и изготавливали полированные шлифы. Исследование шлифов проводили на микротвердомере ПМТ-3, алмазная пирамидка вдавливалась при нагрузке 50 г [5].
Микротвердость вычисляли по формуле:
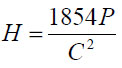
, где Н – число твердости в кг/мм2, Р – нагрузка в граммах, С – диагональ отпечатка в микрометрах.
Все использованные измерения и параметры приведены в соответствие с международной системой единиц. Полученные цифровые данные обрабатывали методами вариационной статистики с использованием прикладного пакета STATISTICA 5.11 for Windows.
Результаты и обсуждение
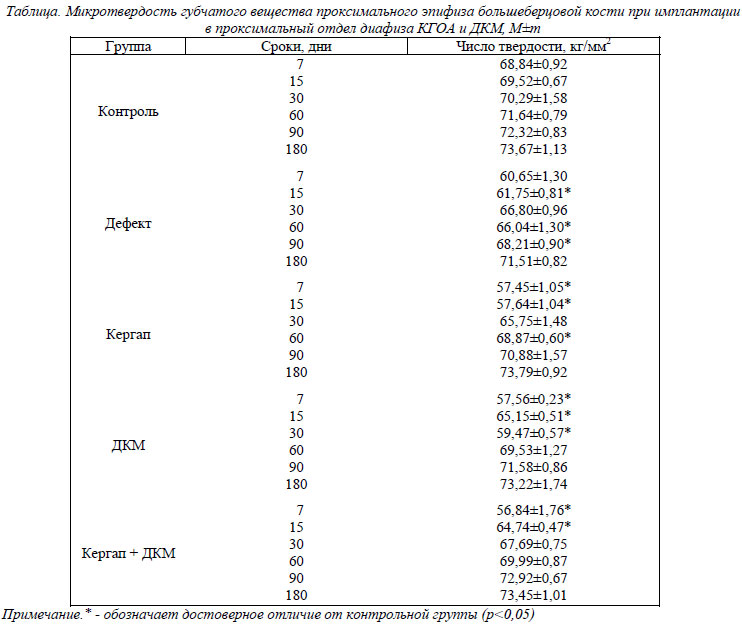
У интактных животных в ходе наблюдения с 7 по 180 день микротвердость трабекул губчатого вещества проксимального эпифиза большеберцовой кости увеличивалось с 68,84±0,92 кг/мм2 до 73,67±1,13 кг/мм2, что соответствует описанной в литературе возрастной динамике прочности костей скелета у крыс репродуктивного возраста (табл.).
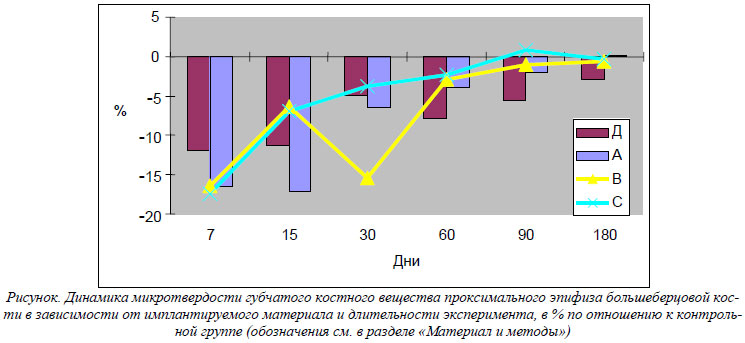
При нанесении сквозного дырчатого дефекта на границе проксимального метафиза и диафиза большеберцовой кости микротвердость губчатого вещества проксимального эпифиза уменьшалась. Ее значение было меньше контрольных показателей в течение всего периода наблюдения на 11,89%, 11,18%, 4,98% (р>0,05), 7,82%, 5,69% и 2,94% (р>0,05) соответственно установленным срокам эксперимента. Обращает на себя внимание тот факт, что минимальными значения микротвердости были к 7-му, 15-му и 60-му дню эксперимента (рис.). Эти сроки соответствуют наибольшей активности следующих процессов – формирования первичного регенерата, дифференцировки грубоволокнистой костной ткани и замещения ее пластинчатой костной тканью [2].
Таким образом, можно сделать предположение, что микротвердость губчатого вещества проксимальных эпифизов большеберцовой кости в значительной степени зависит от интенсивности процессов репаративной регенерации в ообласти нанесенного дефекта.
Имплантация в сформированнный дефект КГОА с размерами частиц менее 63 мкм (группа А), так же как и в группе Д, сопровождалась снижением микротвердости губчатого вещества проксимального эпифиза большеберцовой кости, однако достоверными отличия были лишь в период до 60-го дня эксперимента. В этот период значение микротвердости было ниже контрольных показателей соответственно на 16,55%, 17,09%, 6,47% (р>0,05) и 3,84%. Сравнение с группой Д показывает, что в период с 7-го по 30-й день снижение показателей микротвердости было более значимым. Это связано с тем, что помимо формирования костного регенерата в этот период протекают процессы биорезорбции имплантированного КГОА, а значит более высока интенсивность репаративных процессов в зоне нанесенного дефекта. С 60-го дня наблюдается обратная динамика: показатели микротвердости в группе А отстают от контрольных значений меньше, чем в группе Д. По-видимому, это объясняется тем, что при биологической деградации имплантированного КГОА образуются ионы кальция и фосфора, которые несколько ускоряют апоптоз хондро- и остеобластов, а, следовательно, ускоряют созревание губчатого костного вещества эпифизов [6].
При имплантации в костный дефект измельченного ДКМ микротвердость костного вещества эпифизов была меньше контрольных показателей во временной период с 7-го по 30-й день наблюдения – соответственно на 16,39%, 6,29% и 15,40%. Амплитуда отклонений к 7-му и 30-му дню значительно выше, чем в группе Д. Вероятно, это связано с присутствием в составе ДКМ костного морфогенетического протеина, который ускоряет процессы созревания костной ткани [7]. В ранние сроки после имплантации это приводит к активизации репаративных процессов, а позже – к ускорению созревания губчатого костного вещества эпифизов. Менее всего изменялась микротвердость губчатого костного вещества эпифизов в группе С – при имплантации смеси КГОА и ДКМ. Ее значения были меньше контрольных показателей лишь к 7-му и 15-му дням эксперимента – на 17,43% и 6,88% соответственно. Вероятно, это факт можно объяснить тем, что влияние ионов кальция и фосфора, а также костного морфогенетического протеина потенцируется.
Выводы
Полученные результаты позволяют сделать вывод о том, что нанесение сквозного дырчатого дефекта на границе проксимального метафиза и диафиза большеберцовой кости сопровождается снижением микротвердости трабекул губчатого вещества проксимального эпифиза. Степень снижения микротвердости зависит от интенсивности процессов репаративной регенерации в области нанесенного дефекта. Заполнение дефекта керамическим гидроксилапатитом и деминерализованным костным матриксом также сопровождается снижением микротвердости губчатого вещества проксимального эпифиза, которое больше выражено в ранние сроки эксперимента, а в поздние - нивелируется в большей степени. Вероятно, это связано с тем, что в ранние сроки интенсивность процессов репаративной регенерации увеличивается за счет биологической резорбции имплантированного материала. В поздние сроки отклонения сглаживаются в большей степени за счет влияния на созревание костной ткани либо ионов кальция и фосфора, либо костного морфогенетического белка, либо их комбинации. Для подтверждения выдвинутых предположений будет проведено гистологическое исследование губчатого костного вещества проксимального эпифиза большеберцовой кости.
- Luzin V.I., Berezhnoy E.P., Kucherenko S.L., Golovchenko V.V. Growth and formation of rat tibiae after metadiaphysis bone defect plastics // Сalcified Tissue International. – 2004. – Vol. 74, Suppl. 1. - S.78.
- Лузин В.И., Головченко В.В., Бережной Е.П. Гистоморфометрическое исследование регенерации костной ткани при имплантации порошкообразной гидроксилапатитной керамики в сочетании с деминерализованным костным матриксом // Український медичний альманах. – 2001. – Т.4, №5. – С.81-84.
- Лузин В.И., Ивченко Д.В., Панкратьев А.А., Скоробогатов А.Н., Самойленко А.А. Методика моделирования костного дефекта у лабораторных животных // Український медичний альманах. – 2005. – Том 8, №2 (додаток). – С. 162.
- European convention for the protection of vertebrate animals used for experimental and other scientific purpose: Council of Europe 18.03.1986. - Strasbourg, 1986. - 52 p.
- Лузин В.И., Астраханцев Д.А. Методика определения микротвердости минерализованных тканей зубочелюстного сегмента нижней челюсти в эксперименте // Український морфологічний альманах. – 2005. - Том 3, №3. – С.42-44.
- Adams Ch.S., Mansfield K., Perlot R.L., and Shapiro I.M. Matrix Regulation of Skeletal Cell Apoptosis. Role of calcium and phosphate ions // J. Biol. Chem. – 2001. - Vol. 276, Issue 23. – P. 20316-20322.
- Rabie A.B. Vascular endothelial growth pattern during demineralized bone matrix induced osteogenesis // Connect Tissue Res. – 1997. – Vol. 36, № 4. – P. 337-345.