Международный эндокринологический журнал 4 (36) 2011
Вернуться к номеру
Взаимосвязь лептина и метаболических показателей при пубертатно-юношеском диспитуитаризме
Авторы: Фомина И.А., ГОУ ВПО «Cамарский государственный медицинский университет» Росздрава
Рубрики: Эндокринология
Версия для печати
Введение
Ожирение является одним из наиболее распространенных хронических заболеваний. В настоящее время в мире насчитывается около 250 млн больных, страдающих ожирением, что составляет 7 % от всего взрослого населения. Известно, что у трети взрослых ожирение начинается в детском или подростковом возрасте и сопровождается более выраженной прибавкой массы тела и увеличением частоты развития сопутствующих заболеваний. В экономически развитых странах до 25 % подростков имеют избыточную массу тела, а 15 % — страдают ожирением [1]. Подростковый возраст является переходным между детством и половой зрелостью. Именно в этот период происходит ряд изменений, приводящих к физической, психологической и репродуктивной зрелости организма. Биологические изменения в период пубертата регулируются нейросекреторными факторами и гормонами, которые ускоряют соматический рост, развитие половых желез, их эндокринную и экзокринную функции [2].
Одной из наиболее распространенных форм ожирения этого возрастного периода является пубертатно-юношеский диспитуитаризм (ПЮД). По данным Р.Ф. Рудаковой-Суворовой с соавт. (1980), ПЮД составил 3,3 % среди всех лечившихся эндокринных больных и 19 % среди всех больных с патологией гипоталамуса. А по данным Г.В. Лундиной с соавт. (2003), эта патология составляет 61,4 % среди всех эндокринных заболеваний подросткового периода.
На сегодняшний день не ясны первичные причины накопления и топографии жира в организме при ПЮД. При ожирении у подростков, особенно в период полового созревания, в нарушении липидного и углеводного обменов помимо центральных механизмов, приводящих к первичной гиперфагии и ожирению, не меньшее значение имеет состояние периферических тканей и органов. Жировая ткань является источником целого ряда факторов, обладающих эндокринным, паракринным и аутокринным действием [3]. В жировой ткани синтезируется лептин, фактор некроза опухолей a, интерлейкин-6 и другие биологически активные вещества, метаболизируются половые гормоны. Открытие в 1994 году лептина — гормона пептидной природы, подавляющего аппетит, участвующего в системе энергетического баланса организма, — определило интерес к нему исследователей, занимающихся проблемами ожирения. Увеличение продукции лептина предшествует увеличению в период пубертата содержания всех гормонов, ответственных за становление репродуктивной функции. Вероятно, при достижении оптимального количества жировой ткани лептин посылает сигналы в гипоталамус и система «гипоталамус — гипофиз — гонады», контролирующая процесс пубертации, запускается. По мере полового развития увеличивается уровень тестостерона в крови, а секреция лептина снижается [4]. В связи с этим особую актуальность приобретает изучение роли лептина при ПЮД, его взаимоотношения с уровнем инсулина, половых гормонов, инсулинорезистентностью, показателями жирового и углеводного обменов.
Цель исследования: установить взаимосвязь лептина с метаболическими и гормональными показателями при ПЮД у юношей для определения роли лептина в патогенезе заболевания.
Материалы и методы исследования
Обследовано 86 больных пубертатно-юношеским диспитуитаризмом, средний возраст которых составил 19,40 ± 0,14 года. В контрольную группу вошли 20 практически здоровых юношей идентичного возраста — 20,10 ± 0,12 года (р > 0,05).
Диагноз ПЮД ставился на основании жалоб: на головные боли, повышенный аппетит, значительную прибавку в весе в период пубертата, потливость, сонливость, повышенную утомляемость, боли в сердце различной интенсивности, а также характерной клинической картины: наличие ожирения с висцеральным или глютеофеморальным типом распределения подкожно-жировой клетчатки, высокорослости, мелких розовых или белых перламутровых полос растяжения на коже плеч, груди, живота, бедер, ягодиц, истинной, ложной или смешанной гинекомастии.
Учитывались также данные анамнеза: родовые травмы, вес при рождении, наличие инфекционных заболеваний и травм в детском и подростковом возрасте, возникновение или прогрессирование заболевания в период пубертата, наследственная отягощенность. У 2 % больных в анамнезе было сотрясение головного мозга, у 31 % выявлен хронический тонзиллит, у 46 % прослеживалась связь начала заболевания с проведенной тонзилл- эктомией, 21 % перенесли нейроинфекцию. Большинство больных ПЮБ больными себя не считали и жалоб не предъявляли (72,4 %). Жалобы выявлялись лишь при активном опросе и отличались большим полиморфизмом. Чаще всего больные отмечали головную боль (50,8 %), одышку и боли в области сердца различной интенсивности, усиливающиеся при физической нагрузке (43,1 %), быструю утомляемость (21,3 %), потливость (13,4 %), головокружение (7,8 %), повышенный аппетит (6,3 %). Артериальная гипертензия (АГ) выявлена у 79,2 % больных ПЮД.
У 53 % пациентов с ПЮД были обнаружены изменения со стороны сердечно-сосудистой системы: увеличение размеров сердца влево, наличие синусовой тахикардии, приглушенность тонов сердца.
Исследования глазного дна выявили сужение артерий и полнокровие вен у 63 % больных ПЮД с АГ. Подобные проявления считаются наиболее характерными для пубертатно-юношеского базофилизма (ПЮБ) [5]. Наследственная отягощенность по сахарному диабету выявлена у 23,1 % больных, по ожирению — у 40,6 %, по АГ — у 36,3 %.
У 18,3 % больных избыточный вес наблюдался с раннего детского возраста и нарастал постепенно; 34,1 % пациентов отмечали новую прибавку в весе в течение первых лет пубертатного периода на фоне уже имеющегося избыточного веса с раннего возраста. 47,6 % юношей с ПЮБ отмечали постепенное увеличение массы тела в течение последних 1–3 лет.
В группе больных ПЮД средний индекс массы тела (ИМТ) составил 33,90 ± 0,54 кг/м2. Оценка степени ожирения проводилась по индексу массы тела.
С І степенью ожирения (ИМТ = 30,0–34,9 кг/м2) было 44 человека, со ІІ степенью ожирения (ИМТ = 35,0–39,9 кг/м2) — 30 человек, с ІІІ степенью ожирения (ИМТ = > 40,0 кг/м2) было 12 человек.
Обследование всех пациентов проводилось по общепринятой для данного заболевания схеме. Кроме этого, у всех больных исследовалось содержание лептина, тестостерона, секс-стероидсвязывающего глобулина (СССГ), фолликулостимулирующего гормона (ФСГ), лютеинизирующего гормона (ЛГ), иммунореактивного инсулина (ИРИ) в сыворотке крови. Исследование проводилось иммуноферментным методом на приборе Axym (Abbott, Германия) и Asys Export Plus (Австрия). Для определения свободного тестостерона использовалась расчетная формула, вычислялся индекс андрогенной активности: ИАА = (общий тестостерон/СССГ) 100 %.
Концентрация глюкозы крови измерялась глюкозооксидазным методом на биохимическом анализаторе Sсreen Master plus компании Hospitex diagnostic (Швейцария). Определяли индекс инсулинорезистентности по методике Carо: глюкоза (ммоль/л)/инсулин (мкЕд/мл).
Уровень общего холестерина (ОХ), липопротеидов низкой плотности (ЛПНП), липопротеидов высокой плотности (ЛПВП), триглицеридов (ТГ) определяли методом спектрофотометрии на приборе Screen Master Plus (Hospitex Diagnostics, Швейцария).
Результаты исследования анализировались с применением различных методов параметрической и непараметрической статистики. Закон распределения определялся при помощи критериев нормальности Колмогорова — Смирнова, одновыборочного теста нормальности Шапиро — Уилка. Переменные, подчиняющиеся нормальному закону распределения, подвергались анализу с использованием дескриптивного, корреляционного (Пирсона), дисперсионного, факторного и дискриминантного анализов. Нелинейные связи признаков оценивались при помощи логической регрессии. Статистические гипотезы проверялись при помощи дисперсионного анализа, t-теста, U-критерия Манна — Уитни, F-критерия. Перед выполнением дисперсионного анализа проводился тест Левена для проверки гипотезы о равенстве (однородности) дисперсий в двух группах. Переменные, не подчиняющиеся нормальному закону распределения или закон распределения которых не определялся, анализировались при помощи непараметрических методов статистики: рангового корреляционного анализа Спирмена, Кендалла. Математическая обработка результатов проводилась с использованием пакета программ Statistica фирмы StatSoft (Огайо, США).
Результаты исследования и их обсуждение
Уровень лептина в группе юношей с ПЮД составил 21,58 ± 2,50 нг/мл и практически не отличался (р > 0,05) от уровня лептина у здоровых юношей. При изучении содержания лептина в зависимости от степени ожирения нами было обнаружено, что с нарастанием массы тела уже при ІІІ степени ожирения наблюдается достоверное (р < 0,05) увеличение уровня гормона.
Обнаруженная нами положительная корреляция лептина и ИМТ (r = 0,38; p = 0,001) подтверждает взаимосвязь степени ожирения и уровня лептина у юношей с ПЮД.
Закономерно, что чем больше масса жировой ткани, тем она больше секретирует в кровь лептина, как это имело место в наших исследованиях. При III cтепени ожирения лептин был значительно выше, чем при I степени. Однако эффективность действия лептина при этом была снижена. Вместе с тем нельзя исключить и нарушение функционирования рецептора лептина или торможения пострецепторных механизмов проведения гормонального сигнала [2].
Таким образом, при III степени ожирения у больных ПЮД гиперлептинемия сочетается с лептинорезистентностью. У юношей гиперлептинемия может рассматриваться в качестве компонента метаболического синдрома.
Для выяснения роли лептина в формировании типа ожирения все пациенты с ПЮД были поделены на 2 группы. В 1-ю группу вошли больные ПЮД с висцеральным типом ожирения — 12 пациентов, во 2-ю группу с глютеофеморальным — 74 пациента. Уровень лептина у больных ПЮД с висцеральным типом ожирения составил 32,56 ± 8,9 нг/мл, при глютеофеморальном типе ожирения — 19,37 ± 2,38 нг/мл. По результатам корреляционного анализа уровень лептина крови в большей степени зависит от общего содержания жира в организме и в меньшей мере — от характера его распределения. Лептин примерно в равной степени коррелировал с объемом талии (ОТ) и бедер (ОБ) и практически не зависел от индекса ОТ/ОБ в группе больных ПЮД. Положительная корреляция уровня лептина с ОТ и ОБ (r = 0,49; p = 0,000 и r = 0,47; p = 0,000 соответственно) сохранялась в обеих подгруппах. Однако его уровень достоверно не отличался (р > 0,05) при различных типах ожирения. Следовательно, лептин участвует в формировании как висцерального, так и глютеофеморального типов ожирения.
Нами выявлена достоверная корреляция лептина в общей группе больных ПЮД с систолическим (САД) и диастолическим артериальным давлением (ДАД) (r = 0,4; p = 0,000 и r = 0,48; p = 0,000 cоответственно), что предполагает участие лептина в формировании АГ при ПЮД. Выявлена достоверная положительная корреляция лептина и с САД, и с ДАД при глютеофеморальном типе ожирения. При висцеральном типе ожирения лептин коррелировал только с ДАД.
При АГ и избыточной массе тела значимо снижена чувствительность тканей к инсулину по сравнению с больными ожирением, имеющими нормальное АД. При этом наблюдается прямая корреляция между величиной инсулинорезистентности и артериальным давлением. При глютеофеморальном типе ожирения у юношей с ПЮД лептин достоверно коррелировал с инсулином, индексом Cаrо, триглицеридами (p < 0,05), что говорит об участии лептина в формировании инсулинорезистентности. Корреляции лептина при висцеральном типе ожирения с инсулином и индексом Cаrо отсутствуют (не исключено, что это связано с небольшим числом наблюдений). У больных ПЮД с висцеральным типом ожирения установлена достоверная корреляция лептина с ЛПВП и триглицеридами (r = –0,96; p = 0,000 и r = 0,79; p = 0,036 соответственно), что говорит об участии лептина в патогенезе дислипидемий при этом типе ожирения. Лица с висцеральным типом распределения жировой клетчатки подвержены большему риску развития сердечно-сосудистых заболеваний (в связи с ранним развитием атеросклероза), остеопороза, сахарного диабета типа 2, преждевременному старению.
У подростков слой подкожно-жировой ткани и ее топография являются определяющими факторами обменных нарушений в организме. В настоящее время тестостерон рассматривают как регулятор синтеза лептина, при этом он оказывает, очевидно, прямое ингибирующее действие на этот процесс.
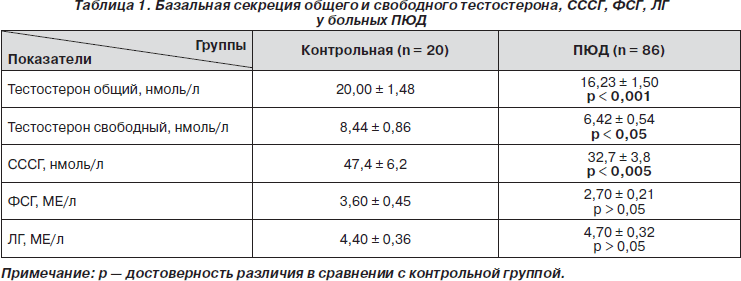
В нашем исследовании у больных ПЮД было выявлено нарушение секреции общего и свободного тестостерона. Оно проявлялось снижением базального уровня гормона (табл. 1) и мало менялось при увеличении массы тела.
Содержание ФСГ, ЛГ у больных ПЮД в сыворотке крови значимо (р > 0,05) не отличалось от аналогичных показателей контрольной группы.
Мы обнаружили достоверную отрицательную взаимосвязь между общим тестостероном и ИРИ (r = –0,39; р = 0,001), отрицательную — между общим тестостероном и коэффициентом инсулинорезистентности (r = –0,32; р = 0,006). По данным линейного корреляционного анализа Пирсона, уровень общего тестостерона достоверно коррелировал с показателями ОБ (r = –0,26; p = 0,02). Выявлена отрицательная взаимосвязь между тестостероном и отношением ОТ/ОБ (r = –0,32; p = 0,007).
Концентрация в плазме СССГ у пациентов с ПЮД по сравнению со здоровыми юношами была сниженной (р < 0,05), минимальные значения были при III степени ожирения, что, по-видимому, является компенсаторным механизмом, сохраняющим на должном уровне свободный тестостерон. Вместе с тем факторами, способствующими снижению секреции СССГ, являются ожирение и гиперинсулинемия, которые имели место у наших больных.
Многие исследования свидетельствуют о том, что инсулин повышает уровень свободных (биологически активных) фракций половых гормонов путем снижения уровня СССГ. Если содержание СССГ снижается, фракция свободного тестостерона должна увеличиваться. Однако содержание свободного тестостерона у наших больных также оказалось сниженным по сравнению со здоровыми, но ни степень, ни тип ожирения сколько-нибудь существенно не меняли его уровень. Вместе с тем снижение общего тестостерона не доходило до критического уровня ниже 12,0 ммоль/л, при котором могут появляться клинические признаки гипогонадизма. Ни у одного обследованного таких признаков обнаружено не было. Однако остается дискуссионным, является ли нарушение секреции тестостерона первичным или вторичным по отношению к ожирению. По этому поводу имеются противоречивые мнения.
Одни авторы считают гормональные нарушения вторичными, так как снижение веса приводит к нормализации показателей тестостерона (R. Pasquali, F. Casimirri, 1995). По мнению других, первичность гормональных изменений подтверждает коррекция андрогенного дефицита с помощью препаратов тестостерона, что приводит к достоверному снижению висцерального ожирения (снижение ИМТ, уменьшение окружности талии, соотношения ОТ/ОБ), уменьшению клинических симптомов гипогонадизма (С.Ю. Калинченко и соавт., 2002). Позитивный эффект андрогенотерапии обусловлен как прямым уменьшением инсулинорезистентности в мышечной ткани под действием тестостерона, так и опосредованным влиянием тестостерона — через уменьшение количества висцеральной жировой ткани посредством снижения активности висцеральной липопротеинлипазы.
Доказано, что гипотестостеронемия является мощным стимулирующим фактором роста висцеральных адипоцитов. Большое влияние на увеличение висцеральных адипоцитов оказывает сниженная андрогенная активность плазмы у мужчин. Выявленная нами обратная взаимосвязь тестостерона с инсулином (r = –0,39; p = 0,001), ОБ (r = –0,26; p = 0,02) совпадает с результатами исследований A.N. Peiris et al. (1987), D. Simon et al. (1997). Авторы, как и мы, выявили четкую отрицательную взаимосвязь между уровнем тестостерона и инсулина.
Гипотестостеронемия у мужчин с ожирением является важным фактором поддержания и прогрессирования ожирения. Низкий уровень тестостерона и СССГ является предиктором развития инсулинорезистентности и, следовательно, сахарного диабета типа 2.
Корреляционный анализ Спирмена показал усиление отрицательной взаимосвязи между свободным тестостероном и СССГ при возрастании степени ожирения: при І степени r = –0,36; p = 0,03; при ІІІ степени r = –0,76; p = 0,006. Выявлена отрицательная взаимосвязь свободного тестостерона с возрастом и ЛПНП (r = –0,55; p = 0,04 и r = –0,46; p = 0,03 соответственно).
При ранговом корреляционном анализе Спирмена нами найдена достоверная отрицательная взаимосвязь общего тестостерона и инсулина (r = –0,39; р = 0,001), общего тестостерона и коэффициента инсулинорезистентности (r = –0,32; р = 0,006).
При увеличении массы тела корреляционный анализ Спирмена и Кендалла показал отрицательную взаимосвязь свободного тестостерона с возрастом и ЛПНП.
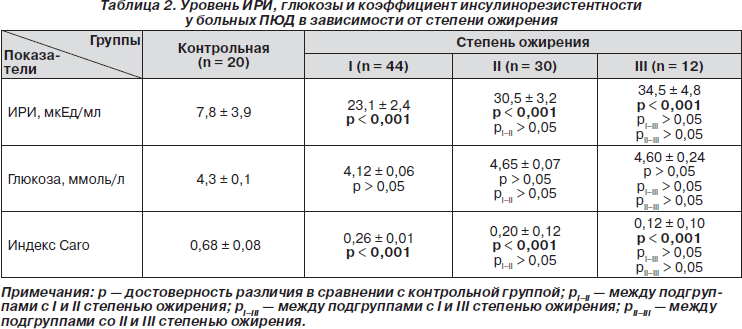
ИРИ при ПЮД был достоверно (р < 0,05) увеличен при нормальном содержании глюкозы крови. Уровень иммунореактивного инсулина имел тенденцию к возрастанию при увеличении степени ожирения (табл. 2).
Вероятно, что низкие значения тестостерона обусловливают высокий уровень инсулина, выявленного у юношей с ПЮД, что, в свою очередь, приводит к усилению инсулинорезистентности. Глюкоза крови натощак и при I, и при II, и при III степени ожирения у больных ПЮД не превышает значений здоровых юношей и значимо не различается в зависимости от степени ожирения (p > 0,05).
Индекс Cаrо снижался при возрастании степени ожирения у больных ПЮД, достигая самых низких значений (р < 0,001) при III степени ожирения.
Это свидетельствует об усилении инсулинорезистентности по мере прогрессирования ожирения.
Увеличение секреторной активности инсулярного аппарата может носить приспособительный характер в ответ на увеличение массы тела и, следовательно, для обеспечения тех тканей, присутствие инсулина в которых является обязательным для нормального метаболизма. Данной секреции инсулина у больных ПЮД достаточно для преодоления инсулинорезистентности и поддержания нормального уровня глюкозы.
Мы не установили сколько-нибудь значимого повышения уровня ИРИ у пациентов с висцеральным типом ожирения по сравнению с больными с глютеофеморальным типом ожирения.
Высокое содержание ИРИ при практически нормальном показателе глюкозы у больных с висцеральным типом распределения подкожно-жировой клетчатки говорит о более высокой степени инсулинорезистентности у больных ПЮД с висцеральным типом ожирения, нежели с глютеофеморальным. О более высокой инсулинорезистентности при висцеральном типе ожирения также свидетельствуют корреляции коэффициента инсулинорезистентности с ОТ (r = 0,35; p = 0,003), с ОБ (r = 0,24; p = 0,003).
Показатели липидного спектра у больных ПЮД по группе в целом изменялись незначительно. Исключение составляют липопротеиды высокой плотности, достоверно (p < 0,05) сниженные по сравнению с контролем. Когда же мы проанализировали эти показатели в зависимости от степени ожирения, оказалось, что прослеживается четкая тенденция к увеличению общего холестерина к III степени ожирения, снижению липопротеидов высокой плотности (р < 0,05), повышению липопротеидов низкой плотности при неизменных триглицеридах.
Проведенный нами корреляционный анализ выявил связь ЛПВП со степенью ожирения (r = –0,24; p = 0,05) и ЛПНП с ИМТ (r = 0,24; p = 0,05).
Уровни ОХ, ЛПНП, КА имеют достоверное повышение, и мы видим максимальное значение этих показателей при висцеральном типе ожирения. Кроме того, при корреляционном анализе выявлена отрицательная взаимосвязь между свободным тестостероном и ЛПНП ( r = –0,46; p = 0,03).
Следовательно, в формировании дислипидемии при ПЮД определенное значение имеет и гипотестостеронемия.
Мы провели стандартный глюкозотолерантный тест с 75 г глюкозы у юношей с ПЮД, определив у них содержание глюкозы, инсулина и лептина натощак, через 1 и 2 часа в ходе теста, чтобы выявить возможные нарушения взаимодействия нейрогуморальных регуляторных механизмов.
Уровень глюкозы крови натощак составил 5,11 ± ± 0,19 ммоль/л. Через 1 час после нагрузки концентрация глюкозы достоверно (р < 0,05) повысилась по сравнению с исходной, но оставалась в пределах нормальных значений.
Через 2 часа показатели глюкозы практически пришли к исходному уровню.
Следовательно, изменение содержания глюкозы при выполнении перорального глюкозотолерантного теста (ПГТТ) носило физиологический характер через 1 и 2 часа пробы.
Содержание инсулина через 1 час после нагрузки достоверно (р < 0,05) и значительно повысилось по отношению к исходному уровню. Через 2 часа сохранялась гиперинсулинемия, но она уже достоверно не отличалась от исходной.
Уровень лептина натощак был 27,41 ± 5,03 нг/мл. Через 1 час он увеличился на 2,21 ± 3,60 нг/мл, через 2 часа — на 1,27 ± 3,60 нг/мл. Различия были не достоверны (p > 0,05). Таким образом, достоверное повышение глюкозы и ИРИ не вызвало ожидаемого снижения лептина при ПЮД. ПГТТ показал нарушение физиологической роли лептина в ответ на введение глюкозы и развившуюся гиперинсулинемию у юношей с ПЮД.
Исходя из вышеизложенного, можно предположить, что лептин прямо и опосредованно участвует в сложных гипоталамо-гипофизарных изменениях у больных ПЮД. Это приводит к изменению метаболизма гормонов и развитию ожирения.
Выводы
1. Базальный уровень лептина у больных ПЮД не отличается от значений контрольной группы. При увеличении степени ожирения отмечается тенденция к повышению лептина, причем уровень гормона достоверно выше при ІІІ степени ожирения по сравнению с І степенью. Гиперлептинемия при ІІІ степени ожирения сочетается с лептинорезистентностью. Обнаружена достоверная положительная взаимосвязь уровня лептина крови с ИМТ, ОТ, ОБ, систолическим и диастолическим артериальным давлением.
2. Снижение общего и свободного тестостерона является одним из механизмов развития ожирения у больных ПЮД. Установлена достоверная отрицательная взаимосвязь общего тестостерона с инсулином и коэффициентом инсулинорезистентности. Снижение СССГ в постпубертатный период имеет, вероятно, компенсаторный характер.
3. У больных ПЮД имеется гиперинсулинемия и инсулинорезистентность, увеличивающаяся с нарастанием степени ожирения. Проведенный пероральный глюкозотолерантный тест выявил нарушение физиологической роли лептина.
4. Содержание холестерина высокой плотности снижено у всех больных ПЮД. С увеличением степени ожирения это снижение становится более значимым. Наиболее выраженные изменения атерогенной направленности жирового обмена выявлены при висцеральном типе ожирения у больных ПЮД, проявляющиеся гиперхолестеринемией, снижением холестерина высокой плотности, повышением коэффициента атерогенности.
1. Гурова О.Ю, Бобров А.Е., Романцова Т.И., Роик О.В Метаболические и психопатологические особенности у больных морбидным ожирением // Ожирение и метаболизм. — 2007. — № 3(12). — C. 28-33.
2. Hildrum B., Mykletun A., Dahl A.A., Midthjell K. Metabolic syndrome and risk of mortality in middle-aged versus elderly individuals: the Nord-Trondelag Health Study (HUNT) // Diabetologia. — 2009. — Vol. 52, № 1. — P. 583-590.
3. Ford E.S. Risks for all-cause mortality, cardiovascular disease, and diabetes associated with the metabolic syndrome: a summary of the evidence // Diabetes Care. — 2005. — Vol. 28. — P. 1769-1778.
4. Гурова О.Ю., Бобров А.Е., Романцова Т.И., Роик О.В. Метаболические нарушения и особенности поведения больных ожирением: статика и динамика на фоне терапии Ксеникалом // Ожирение и метаболизм. — 2009. — Т. 20, № 3. — С. 27-38.
5. Мамырбаева К.М., Мычка В.Б., Чазова И.Е. Артериальная гипертензия и метаболический синдром // Сonsilium Medicum. — 2004. — T. 6, № 5. — С. 320-324.