Международный неврологический журнал 4 (42) 2011
Вернуться к номеру
Клинические исходы у пациентов, получавших нейропротективное и нейрореабилитационное лечение плейотропным препаратом Церебролизин
Авторы: Onose G.1, 2, Mureşanu D.F.3, Ciurea A.V.2, 4, Daia Chendreanu C.1, 2, Mihaescu A.S.1, Mardare D.C.1, Andone I.1, Spanu A.1, Popescu C.1, Dumitrescu A.1, Popescu M.5, Grigorean V.1, 2, Ungur B.1, Marinescu F.1, Colibăşeanu I.1, Onose L.6, Haras M.1, 2, Sandu A.1, Spircu T.2
1 Bagdasar-Arseni Teaching Emergency Hospital, Bucharest, Romania
2 Carol Davila (State) University of Medicine and Pharmacy, Bucharest, Romania
3 The Neurological Clinic of Iuliu Hatieganu (State) University of Medicine and Pharmacy, Cluj-Napoca, Romania
4 The Ist Clinic Division of Neurosurgery, Bagdasar-Arseni Teaching Emergency Hospital, Bucharest, Romania
5 The Neurosurgery Division of the County Hospital, Pitesti, Romania
6 The Medical Service of Metrorex, Bucharest, Romania
Рубрики: Неврология
Версия для печати
Резюме. Предпосылки исследования. Открытие нейротрофических факторов дало возможность более эффективно бороться с повреждениями центральной нервной системы (ЦНС). Вскоре было обнаружено еще одно ключевое свойство этих веществ — уникальный плейотропный характер действия. Препарат Церебролизин представляет собой пептидную смесь, которая в больших количествах проникает через гематоэнцефалический барьер и имитирует эффекты NGF.
Методы. В ходе исследования сравнили две группы пациентов, поступивших в отделение физической реабилитации в период с 2007 по 2009 г. Одна из групп получала терапию Церебролизином 10 мл 2 раза/день внутривенно в течение 3 недель (69 пациентов — 22 женщины, 47 мужчин; средний возраст 61,0 года, стандартное отклонение 16,583), в то время как другая группа не получала данный препарат (70 пациентов — 41 женщина, 29 мужчин; средний возраст 70,5 года, стандартное отклонение 6,270). Остальные средства фармакотерапии и физическая терапия были одинаковы в обеих группах. В ходе исследования были изучены 12 показателей, из которых выраженное влияние на значение по Шкале меры функциональной независимости на момент выписки оказывали лишь 5: значение по Шкале меры функциональной независимости на момент госпитализации; количество дней, в течение которых осуществлялась физическая терапия; длительность госпитализации; возраст и количество дней, прошедших до первого функционального разгибания колена. Одновременно была оценена и скорость восстановления ряда других функциональных параметров.
Результаты. Между обеими группами пациентов не было обнаружено достоверных различий значений по Шкале меры функциональной независимости на момент выписки (p = 0,2453). Однако в группе, получавшей Церебролизин, проходило достоверно меньше дней до первого функционального разгибания колена паретической ноги (p = 0,0007) и достоверно меньше дней до первой прогулки между двумя параллельными брусьями (p = 0,0000) по сравнению со второй группой пациентов.
Выводы. Прием Церебролизина приводил к достоверно более быстрому восстановлению ряда функциональных параметров, связанных со стоянием и ходьбой. В связи с этим мы инициировали крупное национальное 5-летнее ретроспективное многоцентровое исследование, направленное на оценку эффективности применения Церебролизина у пациентов с травматическим повреждением головного мозга.
Нейротрофические факторы, Церебролизин, ЦНС, пациенты.
Введение
В 1986 г. Rita Levi-Moncalcini (Институт клеточной биологии, Рим, Италия) и Stanley Cohen (Медицинская школа Университета Вандербилта, Нашвилл, США) получили Нобелевскую премию за открытие нейротрофических факторов — фактора роста нервов (NGF) и фактора роста эпидермиса (EGF).
С тех пор было идентифицировано много других нейротрофических факторов: все они являются полипептидами, синтезируемыми во всех типах клеток ЦНС, а также в других тканях. Активность этих факторов важна для развития нервной системы (они стимулируют клеточную пролиферацию и дифференцировку, включая рост аксонов и дендритов), для выживания нервных клеток как при отсутствии повреждающих факторов, так и при их наличии и для поддержания их фенотипа в течение жизни.
Нейротрофические факторы стимулируют нейрональную пластичность и синаптическую активность, благодаря чему играют важную роль в процессах обучения и в удивительной способности нервной системы к спонтанной реорганизации, что, в свою очередь, важно для клинической адаптации/частичного самовосстановления после различных повреждений.
Открытие нейротрофических факторов дало возможность более эффективно бороться с повреждениями центральной нервной системы (ЦНС). Сравнительно недавно было установлено еще одно ключевое свойство нейротрофических факторов — их уникальный плейотропный эффект [1], т.е. комбинированное нейропротективное и нейротрофическое (включая стимуляцию нейронной пластичности) действие.
Повреждения ЦНС делят на две основных категории: первичные, которые наблюдаются главным образом в момент травмы, и вторичные, которые развиваются после начального повреждения как следствие сложного и специфичного для ЦНС патофизиологического каскада; они вызывают эффекты, которые могут продолжаться длительное время. Вторичные повреждения (включают избыточный синтез оксида азота и окислительный стресс, активацию микроглии, местное воспаление, нарушение микроциркуляции, дисфункцию гематоэнцефалического барьера и совсем недавно обнаруженные «отсроченные механизмы клеточной гибели») [2–5] приводят к формированию порочных кругов патогенеза с неблагоприятными последствиями:
— некрозом нейронов;
— апоптозом нейронов;
— образованием рубца и/или кисты/гигромы с дальнейшими патологическими эффектами в ткани ЦНС;
— демиелинизацией;
— разрушением морфофункциональных нервных путей (прерывание) и/или функциональным разъединением, таким как диасхиз.
Из вышесказанного следует, что минимизация каскада вторичных повреждений может привести к максимизации благоприятного разрешения/восстановления после повреждений, включая более быстрое развитие приемлемых нейрореабилитационных исходов.
Следовательно, именно механизмы вторичного повреждения ЦНС являются в настоящее время основной мишенью для современных видов терапии (включая плейотропные подходы).
К основным путям вторичного повреждения ЦНС (развивается как в пораженной, так и в соседних областях) относят:
1. Разрушение клеток в первично травмированных областях.
2. Разрушение миелиновых оболочек.
3. Высвобождение из разрушенных клеток ЦНС активных форм кислорода (АФК) (их основным источником являются митохондрии).
4. Активацию микроглии, в том числе провоспалительной, что ведет к увеличению высвобождения цитокинов из мест повреждения, а также дополнительному образованию АФК в результате перекисного окисления мембранных фосфолипидов (в условиях метаболической, митохондриальной/клеточной гиперактивности (после повреждения тканей, в том числе и нервной)).
5. Окислительный стресс — избыточное повышение местного метаболического образования АФК в условиях истощения запасов физиологических антиоксидантов. Его развитие приводит к изменению экспрессии ряда генов (особенно связанных с факторами транскрипции, такими как NF-kB, PPAR, AP-1) и, как следствие, синтезу веществ, которые стимулируют продукцию провоспалительных цитокинов (особенно интерлейкинов IL-1, IL-6 и фактора некроза опухоли a (TNF-a)) и снижают продукцию противовоспалительных цитокинов (например, IL-2).
6. Иммунный дисбаланс/воспаление.
7. Нарушение местной микроциркуляции и целостности гематоэнцефалического барьера (с последующей регионарной ишемией и регионарным отеком).
8. Электролитные нарушения, включая массивный отек (отек тканей ЦНС), вызванный внезапно начавшимся осмолизисом (часто он является также прямым следствием первичного повреждения). В этих условиях выраженный осмолизис является одновременно и основным механизмом некроза, поскольку некроз — это клеточный отек, который приводит к осмолизису, с пассивной гибелью клеток.
9. Увеличение метаболизма нервной ткани, включая рост потребления кислорода, что приводит к повышению ее чувствительности к гипоксии и усугублению ишемии (порочный круг).
10. Большое количество малых молекул (катионный канал транзиторного рецепторного потенциала, подсемейство М, член 7 (TRPM7)) встраивается в расположенные рядом нормальные мембраны нейронов и, по-видимому, путем активации аденилатциклазы значительно увеличивает их окислительную метаболическую активность. Это приводит к повышению образования АФК, что способствует апоптическому и некротическому повреждению большого количества клеток, включая также расположенные рядом нормальные клетки.
11. Это приводит к относительному избытку возбуждающих медиаторов и массивному поступлению ионов кальция внутрь клеток (обладают токсическим, метаболически-деструктивным действием; см. ниже).
12. Последующая активация ключевых генов, включая те, которые ответственны за апоптоз (что особенно опасно для нерегенерирующих тканей, подобных ЦНС, поскольку нейроны лишены центросом), запускает механизмы отсроченной клеточной гибели — запрограммированного самоуничтожения клеток и апоптозоподобных процессов. Эти механизмы протекают медленно и вызваны перестройками на очень глубоком уровне, которые сводятся главным образом к нарушению метаболизма агрегированных белков, вовлеченных в механизмы репродуктивного цикла/поддержания жизнеспособности и выживания клеток.
Учитывая плейотропность рассматриваемых повреждений, будет весьма полезно кратко остановиться на некоторых основных положительных эффектах и ограничениях в применении/побочных эффектах одного из наиболее хорошо изученных препаратов с выраженной противовоспалительной активностью — метилпреднизолона (хотя необходимость его применения при острых повреждениях ЦНС продолжает обсуждаться). Наиболее важным эффектом метилпреднизолона в острой стадии повреждения является его способность ингибировать перекисное окисление липидов, индуцированное АФК, что приводит к ограничению вторичного повреждения. Антиоксидантные свойства метилпреднизолона не опосредованы глюкокортикоидными рецепторами; другие стероидные противовоспалительные средства не проявляют подобную антиоксидантную активность [8].
Метилпреднизолон оказывает влияние и на другие патологические пути в нервной ткани:
— снижает высвобождение арахидоновой кислоты;
— снижает поступление ионов кальция в клетки и, как следствие, выраженность апоптоза;
— снижает выраженность анаэробного метаболизма и предотвращает токсическое накопление лактата/ацидоз;
— минимизирует дегенерацию нейрофиламентов;
— уменьшает посттравматический отек нервной ткани и его компрессионные последствия;
— помогает поддерживать мембранный потенциал в нейронах и синаптическую передачу.
Побочные эффекты: в последние годы использование высоких доз метилпреднизолона было поставлено под сомнение, главным образом вследствие высокого риска развития серьезных побочных эффектов при умеренно положительном неврологическом действии. Побочные эффекты этого препарата проявляются в том случае, если лечение продолжается более 24 ч: пневмонии, септический шок, инфицирование ран, плохое заживление ран, пролежни, гипергликемия, тромбоз глубоких вен, желудочно-кишечные кровотечения [9–12].
Другие ограничения, связанные с применением высоких доз метилпреднизолона: нейропротективные свойства метилпреднизолона можно представить в форме U-образной кривой (зависимость между дозой и эффектом), что требует тщательного расчета дозы. Начало терапии после 8-часового окна (когда это можно было сделать) может усугубить повреждение — вызвать торможение отрастания аксонов и синапсогенеза. Если говорить об отдаленных неврологических исходах, то потенциальная возможность метилпреднизолона ослаблять нейронную пластичность после повреждения является, по-видимому, наиболее серьезным побочным эффектом, развития которого опасаются при введении больших доз этого препарата.
13. Ионы кальция, вышедшие через повреждения мембран нервных клеток наружу, создают здесь высокую концентрацию во внеклеточном пространстве и как следствие — устремляются внутрь других поврежденных и неповрежденных нейронов [13]. Вследствие подобной попытки восстановить баланс давления, зависящий от концентрации ионов, кальций запускает серию самодеструктивных клеточных процессов, среди которых важное значение имеет его вмешательство в работу электрон-транспортной/акцепторной цепи митохондрий, что ведет к увеличению образования АФК (рис. 1).
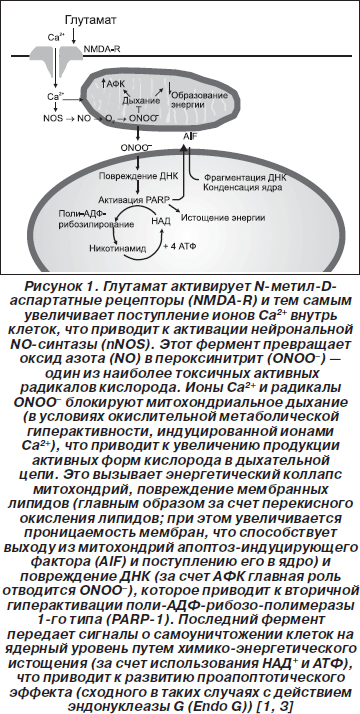
14. Из мест повреждения высвобождается большое количество различных нейромедиаторов (в количестве большем, чем обычно): катехоламины, эндорфины, серотонин и глутамат (последний является наиболее «опасным», особенно в ранние сроки после повреждения) — это основные возбуждающие нейромедиаторы; в патологически больших количествах, превышающих количество способных к ответу нейронов, глутамат становится токсичным, перегружая остающиеся интактными нейрональные сети.
15. Кальций, АФК и эндогенные тканевые ферменты (протеазы, фосфолипазы, липоксигеназы) «работают» совместно над тем, чтобы разрушить погибшие или умирающие клетки.
16. Простагландины вызывают хемотаксис и в дополнение к этому местную/регионарную вазоконстрикцию/ишемию.
17. Разрушение эссенциальных клеточных липидов с помощью АФК (перекисное окисление липидов) и другие обсуждавшиеся выше пути приводят (по механизму порочного круга) к развитию более выраженного отека за счет поступления жидкости в ЦНС (особенно в ткани головного мозга) из кровотока и цереброспинальной жидкости. Это приводит к разрушению большего количества клеток и более выраженному вторичному высвобождению токсических веществ, что опять же ведет к нарушению кровотока.
18. Побочные продукты многих из этих реакций и каскадных путей стимулируют глиальные клетки (прежде всего астроциты, выполняющие сложную функцию жизнеобеспечения нервной системы), которые пролиферируют в попытке заменить/восстановить разрушенную нейроаксиальную ткань. Это приводит главным образом к глиозу и, к сожалению, к образованию рубцов (основное препятствие для последующего восстановления ЦНС).
Кроме дефицита способности к самовосстановлению и наличия множества путей вторичного повреждения ЦНС, по неясным причинам наблюдается также выраженное угнетение повторного отрастания аксонов. Среди основных (отмечены выше) ограничений самовосстановления нейроаксиальной ткани после повреждений существует также ряд внутренних барьеров, которые препятствуют регенерации клеток ЦНС. В нейронах их обычно называют стопорной системой; к ним относят белок, ингибирующий отрастание аксонов (NOGO), и его рецепторы (Schwab и соавт., начиная с середины 80-х гг.) [14, 15], а также рецепторы семейства Rho [17]. Последнее семейство рецепторов переключается на белок, называемый TAJ или TROY, а также на белок р75 — оба белка относятся к семейству TNF-рецепторов, расположены на нейронах и чувствительны к воздействию рост-ингибирующих молекул миелина, тем самым предотвращая отрастание аксонов от поврежденных нейронов ЦНС. Чувствительность к рост-ингибиторным молекулам приводит к формированию ингибиторных сигналов внутри нейронов [18].
Сегодня известно более 500 веществ, обладающих нейропротективным действием.
Травматические и ишемические повреждения в головном и спинном мозге влекут за собой сходные патогенетические механизмы, приводящие к развитию вторичных повреждений. В связи с этим есть и хорошая новость: среди доступных веществ имеются те, которые обладают полным спектром нейропротективной активности [19].
Церебролизин является пептидной смесью, полученной с помощью стандартизированного ферментного протеолиза очищенных белков из мозга свиней. Он содержит примерно 25 % биологически активных низкомолекулярных пептидов и аминокислот, которые в большом количестве проникают через гематоэнцефалический барьер и имитируют эффекты NGF. Так, 1 мл Церебролизина содержит 215,2 мг белкового лизата и вспомогательные вещества (натрия хлорид, вода). Инъецируемый раствор не содержит белков, липидов и других антигенных молекул.
Как мы увидим далее, Церебролизин препятствует развитию многих путей вторичного каскада повреждений ЦНС и одновременно стимулирует/облегчает механизмы реадаптации и (ограниченно) самовосстановления при повреждениях ЦНС. Следовательно, Церебролизин — редкий препарат, который проявляет столь необходимое плейотропное действие (рис. 2, 3).
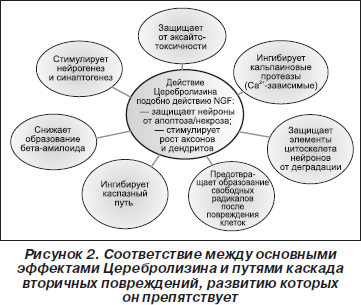
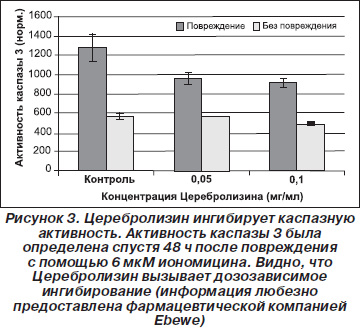
Особо следует отметить:
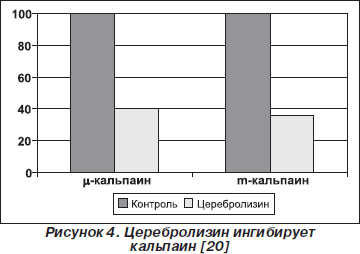
— Церебролизин дозозависимо ингибирует μ- и m-кальпаин. Ингибирование этой протеазы происходит неконкурентно и обратимо (рис. 4);
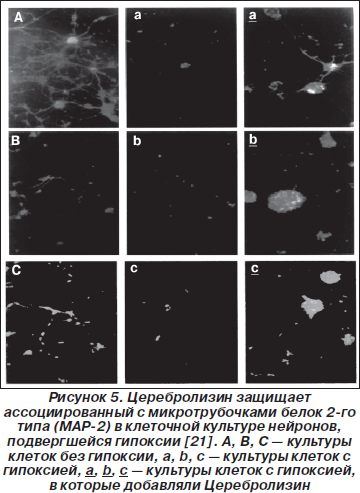
— следовательно, Церебролизин защищает те элементы цитоскелета, которые деградируют под влиянием кальпаина. В культурах нервных клеток он предотвращает потерю ассоциированного с микротрубочками белка 2-го типа (MAP-2; этот белок имеет важное морфофункциональное значение) после повреждения клеток (рис. 5).
Показания к применению Церебролизина. Как уже отмечалось, для Церебролизина характерно сложное нейропротективное и нейротрофическое (в целом плейотропное) действие. Все эти эффекты были выявлены и подтверждены при моделировании нейродегенеративных и ишемических повреждений на клеточных культурах и у животных, а также при проведении клинических исследований.
Считается, что для получения хорошего терапевтического эффекта при остром инсульте Церебролизин должен быть назначен в течение 24 ч после его развития. В клинических исследованиях было продемонстрировано выраженное двигательное и когнитивное улучшение у пациентов с инсультом и деменцией, что одновременно приводило к улучшению качества жизни этих пациентов.
Взаимодействия. Церебролизин не должен смешиваться с нейтральными растворами аминокислот. При одновременном назначении с Церебролизином антидепрессивных средств (особенно ингибиторов моноаминоксидазы) доза последних должна быть снижена.
Побочные эффекты при приеме Церебролизина развиваются редко и обычно носят легкий и транзиторный характер: возбуждение (агрессивность, инсомния, редко галлюцинации), спутанность сознания, тремор, аллергические реакции (по нашим данным, очень редко: лихорадка, кожные реакции, зуд, местные сосудистые реакции, головная боль, боль в шее, боли в руках и ногах, боль в нижней части спины, диспноэ, озноб, шокоподобные состояния), головокружение, гипертензия или гипотензия, гипервентиляция, утомляемость, депрессия, апатия, гриппоподобные симптомы, расстройства желудочно-кишечного тракта (потеря аппетита, диспепсия, диарея, запоры, тошнота, рвота). Быстрая инъекция препарата может вызвать ощущение жара, потливость, головокружение, изредка сердцебиение или сердечные аритмии, реакции в месте инъекции (раздражение, зуд, ощущение жжения).
Противопоказания к приему Церебролизина: гиперчувствительность к белковому лизату или к вспомогательным веществам; эпилепсия (особенно большие судорожные формы — grand mal), поскольку лечение Церебролизином может увеличивать частоту приступов; тяжелая или острая почечная недостаточность. На сегодня собрано мало информации о безопасности применения препарата во время беременности и лактации у людей, однако в исследованиях у животных какие-либо токсические эффекты обнаружены не были. В ряде исследований было показано, что Церебролизин безопасен при назначении пациентам с острым геморрагическим инсультом.
Цель настоящего исследования сводилась к тому, чтобы оценить результаты терапии у пациентов, получавших Церебролизин, по сравнению с пациентами, не получавшими данный препарат, во время лечения в нашем отделении физической реабилитации.
Методы исследования
В исследование были включены две группы пациентов, поступивших в отделение в период с 2007 по 2009 г. Первую группу составили 69 пациентов, получавших Церебролизин (22 женщины, 47 мужчин; средний возраст 61,0 года, стандартное отклонение 16,583). Вторую (контрольную) группу составили 70 пациентов, не получавших данный препарат (41 женщина, 29 мужчин; средний возраст 70,5 года, стандартное отклонение 6,270).
Дизайн исследования
В ходе исследования был выполнен сравнительный анализ пациентов, получавших Церебролизин (10 мл 2 раза в день внутривенно в течение 3 недель), и пациентов, не получавших данный препарат. За исключением приема Церебролизина, других различий по проводимой фармако- и физической терапии между группами пациентов не было.
Группа, получавшая Церебролизин, была сформирована на случайной основе, в зависимости от того, в какие периоды времени в больнице был назначен (и, соответственно, мог быть назначен) Церебролизин.
Все пациенты:
— поступали в наше отделение в основном в ранней подострой стадии (спустя 10–14 дней после повреждения) из нейрохирургических и неврологических отделений Бухареста и прилежащих территорий (70,65 %), а также со всей страны, поскольку наша клиника является Национальным центром нейрореабилитации;
— либо госпитализировались повторно в течение 1 года после повреждения.
В общей сложности мы оценили у пациентов 12 показателей, из которых наиболее значимыми (определяли значение по Шкале меры функциональной независимости на момент выписки) были первые пять:
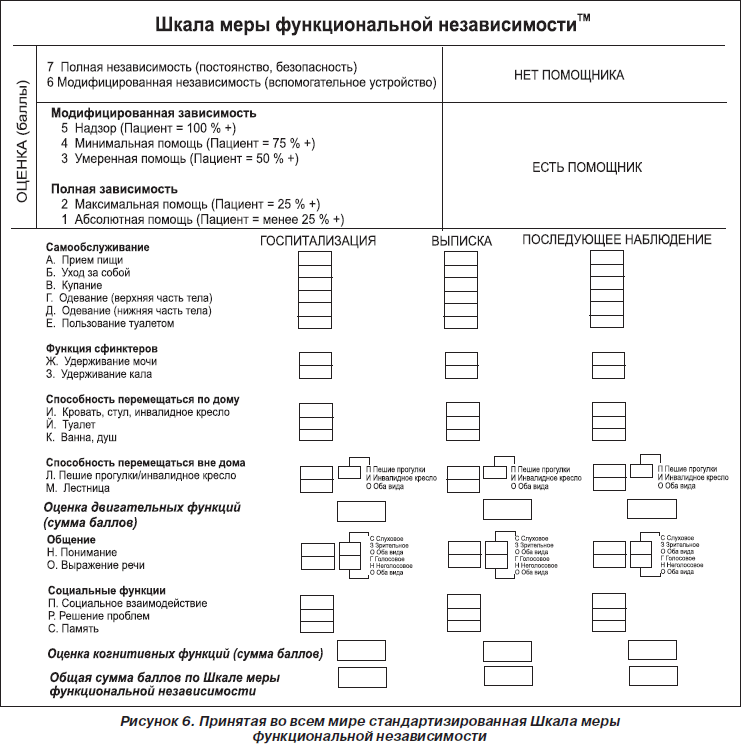
— значение по Шкале меры функциональной независимости на момент госпитализации/выписки (рис. 6);
— количество дней, в течение которых осуществлялась физическая терапия;
— длительность госпитализации (дни);
— возраст;
— количество дней, прошедших до первого функционального разгибания колена;
— количество дней, прошедших до первой прогулки между двумя параллельными брусьями;
— количество дней, прошедших до первой самостоятельной прогулки;
— количество дней, прошедших до первой прогулки с помощью трости;
— количество дней, прошедших до первого подъема/спуска по лестнице;
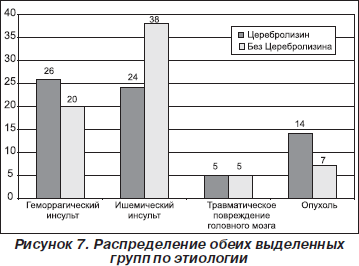
— этиология (рис. 7);
— пол;
— изменение состояния к моменту выписки.
Статистический анализ
При сравнении двух выделенных групп мы стремились использовать t-критерий Стьюдента. Однако его использование возможно лишь в том случае, если данные распределены нормально. Учитывая это, мы оценивали распределение наших данных с помощью гистограммы частот и ряда других параметров (минимальное, максимальное и среднее значение, стандартное отклонение среднего значения). Если распределение было нормальным, мы применяли t-критерий Стьюдента. Если распределение отличалось от нормального — а большинство показателей в нашем исследовании было распределено именно так, — мы применяли критерий хи-квадрат (это значительно расширяло количество данных, которое мы могли оценить).
В ходе нашего исследования был выполнен также корреляционный анализ, что позволяло оценить зависимость между показателями, количественно выраженную с помощью коэффициентов корреляции (положительных или отрицательных) (пакет прикладных статистических программ EPI INFO). При обнаружении зависимостей между показателями должен быть выполнен регрессионный анализ. Хорошо известно, что регрессия может быть простой (ее формула: Y = a + bX, где Y — зависимая переменная; X — независимая переменная; a и b — коэффициенты регрессии; коэффициент b отражает также наклон линии регрессии и показывает, на какую величину меняется значение Y при изменении значения X на одну единицу) или множественной (в которую включают множество независимых переменных). Последняя была применена в настоящем исследовании: мы построили регрессионную модель, в которой в качестве зависимой переменной Y выступало значение по Шкале меры функциональной независимости на момент выписки, а остальные вышеупомянутые показатели выступали в роли независимых переменных (результирующее уравнение множественной регрессии имеет вид Y = B0 + B1X1 + B2X2 + … + BnXn, где Y — зависимая переменная (значение по Шкале меры функциональной независимости на момент выписки); X1, X2, …, Xn — независимые переменные (остальные изученные показатели); B0, B1, B2, …, Bn — коэффициенты регрессии для соответствующих показателей) (рис. 8).

Результаты и их обсуждение
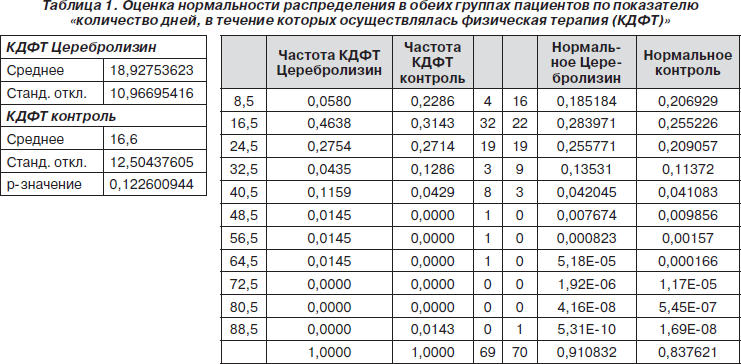
Прежде всего была оценена нормальность распределения каждого из основных показателей в обеих группах пациентов. Первым показателем, для которого была оценена нормальность распределения, стало количество дней, в течение которых осуществлялась физическая терапия (рис. 9, 10, табл. 1).
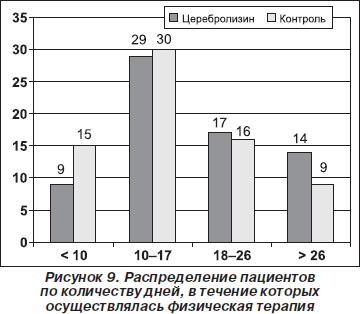
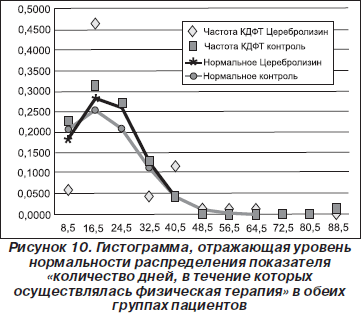
Из гистограммы, представленной на рис. 10, видно, что в обеих группах пациентов не было статистически достоверного нормального распределения показателя «количество дней, в течение которых осуществлялась физическая терапия».
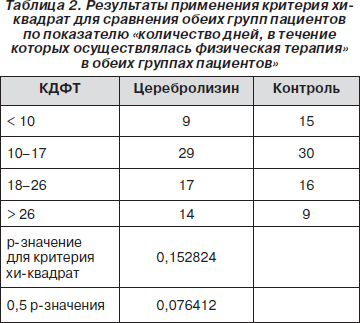
Соответственно, для сравнения обеих групп пациентов по показателю «количество дней, в течение которых осуществлялась физическая терапия» в обеих группах пациентов» был применен критерий хи-квадрат. В результате было установлено, что р = 0,152824. Это свидетельствует об отсутствии статистически достоверных различий между обеими группами пациентов по изученному показателю (табл. 2).
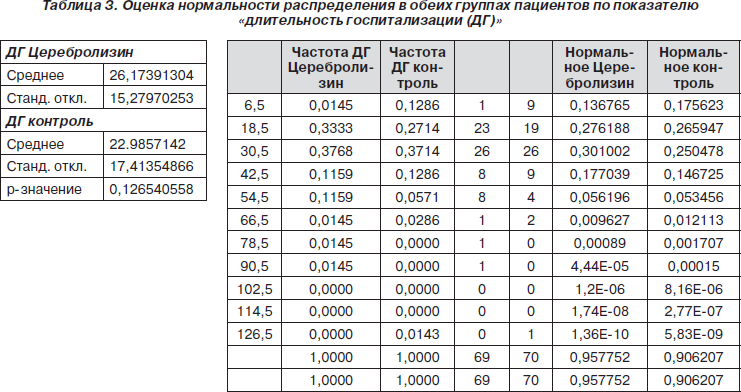
Следующим показателем, для которого была оценена нормальность распределения, стала длительность госпитализации (табл. 3, рис. 11).
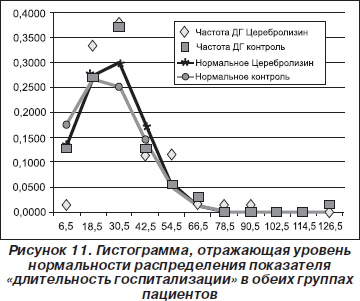
Из гистограммы, представленной на рис. 11, видно, что в обеих группах пациентов не было статистически достоверного нормального распределения показателя «длительность госпитализации».
Поскольку распределение отличалось от нормального, мы применили критерий хи-квадрат. В результате между обеими группами пациентов были обнаружены достоверные различия (p = 0,013259) по показателю «длительность госпитализации»: в группе с Церебролизином этот показатель был немного больше, чем в контрольной группе (табл. 4).
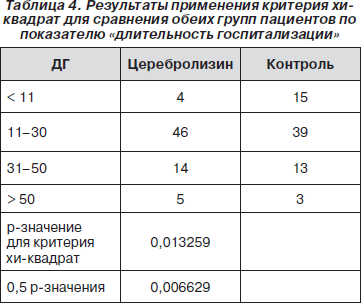
Интерпретация этого результата должна быть дана в более широком контексте, поскольку средняя длительность госпитализации ограничивается экономическими причинами, что вносит коррективы в работу врача. Однако один из основных критериев для выписки пациента из стационара — это когда он/она достигнет плато в процессе реабилитации (на что обычно требуется много времени). Следовательно, большая длительность госпитализации означает, что у соответствующего пациента более длительное время наблюдалась положительная динамика.
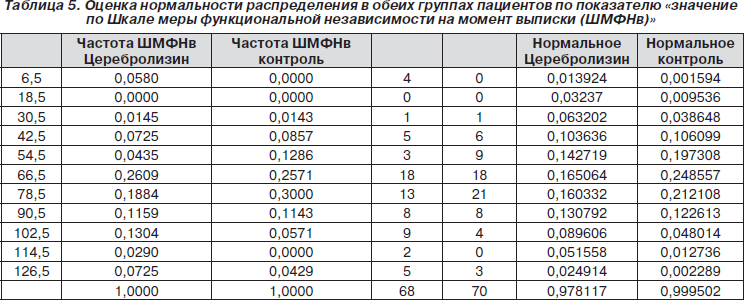
Следующим показателем, для которого была оценена нормальность распределения, стало значение по Шкале меры функциональной независимости на момент выписки.
Из гистограммы, представленной на рис. 12, видно, что в обеих группах пациентов наблюдалось статистически достоверное нормальное распределение по показателю «значение по Шкале меры функциональной независимости на момент выписки».
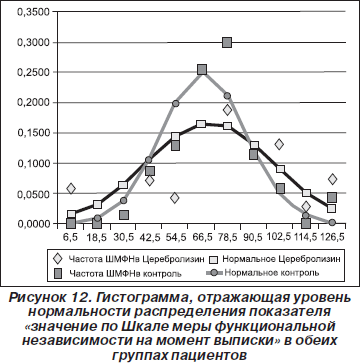
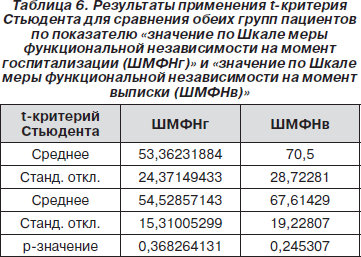
Поскольку распределение было нормальным, мы применили t-критерий Стьюдента. В результате было обнаружено, что между обеими группами пациентов нет достоверных различий как по значению Шкалы меры функциональной независимости на момент госпитализации (р = 0,3682), так и по значению Шкалы меры функциональной независимости на момент выписки (р = 0,2453).
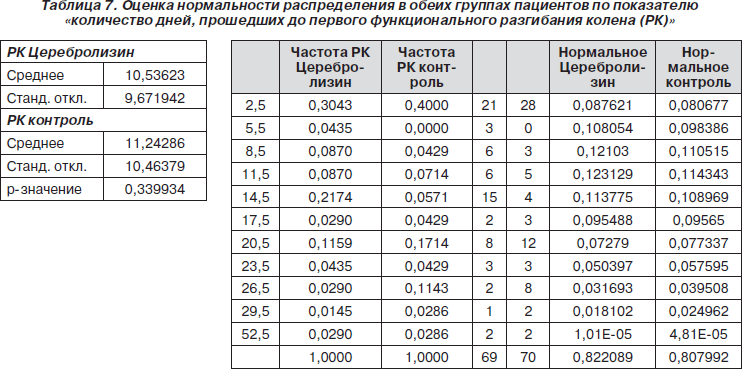
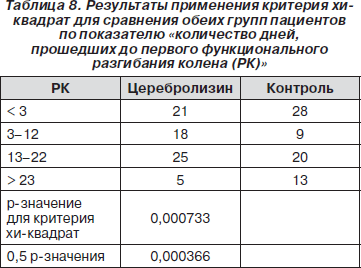
Следующим показателем, по котрому была оценена нормальность распределения, стало количество дней, прошедших до первого функционального разгибания колена (табл. 7).
Поскольку распределение отличалось от нормального, был применен критерий хи-квадрат. В результате было обнаружено, что в группе с Церебролизином проходило достоверно меньшее количество дней до первого функционального разгибания колена паретической ноги (p = 0,000733) (табл. 8).
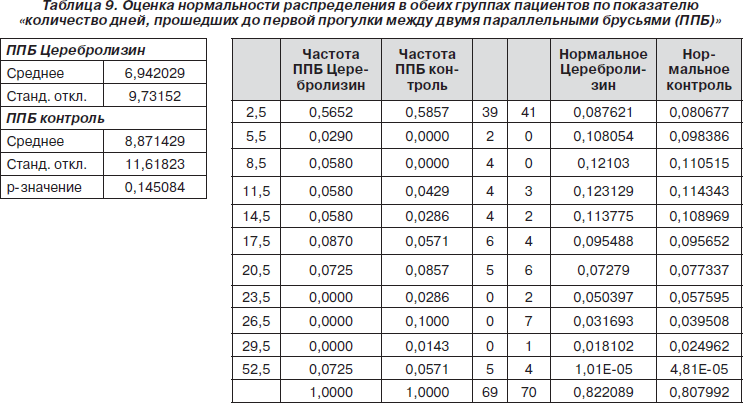
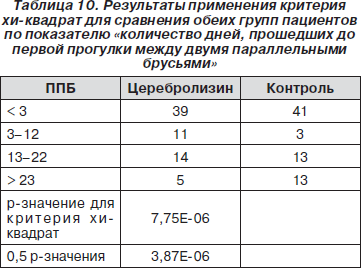
Следующим показателем, для которого была оценена нормальность распределения, стало количество дней, прошедших до первой прогулки между двумя параллельными брусьями (табл. 9).
Поскольку распределение отличалось от нормального, был применен критерий хи-квадрат. В результате было обнаружено, что в группе с Церебролизином проходило достоверно меньшее количество дней до первой прогулки между двумя параллельными брусьями (p = 0,000000) (табл. 10).
Таким образом, в ходе исследования был тщательно проанализирован ряд нефункциональных (количество дней, в течение которых осуществлялась физическая терапия; длительность госпитализации), композитных (значение по Шкале меры функциональной независимости на момент выписки) и функциональных (количество дней, прошедших до первого функционального разгибания колена; количество дней, прошедших до первой прогулки между двумя параллельными брусьями) показателей.
Что касается остальных показателей, то количество пациентов, которые могли быть включены в гистограммы, было слишком мало, чтобы сделать какие-либо выводы.
Множественный регрессионный анализ, выполненный в ходе нашего исследования, был нацелен в основном на оценку прогностической значимости изученных показателей. Поэтому при его проведении обе группы пациентов были объединены в одну, что позволило получить наиболее оптимальную формулу множественной регрессии (рис. 13).
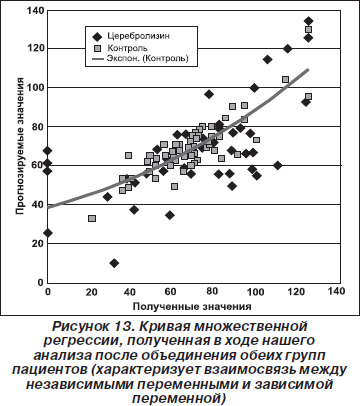
Результаты множественного регрессионного анализа свидетельствуют о наличии выраженной связи между зависимой переменной «значение по Шкале меры функциональной независимости на момент выписки» и независимой переменной «значение по Шкале меры функциональной независимости на момент госпитализации» (r = 0,8660, p = 0,0000) в общей популяции пациентов. Это свидетельствует о важности правильного исходного оценивания пациентов, поскольку его результаты важны для прогноза эффективности проводимого лечения.
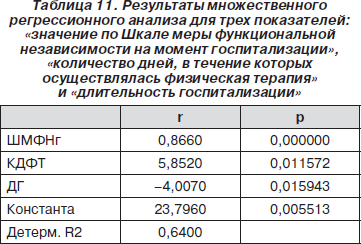
Кроме того, в ходе множественного регрессионного анализа было показано, что прогностически значимы еще два показателя: «количество дней, в течение которых осуществлялась физическая терапия» (r = 5,8520, p = 0,0115) и «длительность госпитализации» (r = –4,0070, p = 0,0159) (табл. 11).
Все остальные показатели были оценены у малого количества пациентов, поэтому не могли статистически значимо влиять на построенную прогностическую модель.
Статистически значимые результаты, полученные с помощью критериев достоверности и свидетельствующие о том, что Церебролизин ускоряет нейрореабилитацию (см. выше), побуждают нас к дальнейшему проведению исследования с укрупнением изучаемых групп.
Выводы
Прием Церебролизина приводил к достоверному улучшению по крайней мере двух ключевых функциональных параметров: уменьшалось количество дней до первого функционального разгибания колена и количество дней до первой прогулки между двумя параллельными брусьями. Это согласуется с имеющимися на сегодняшний день научными данными: применение современных плейотропных средств (Церебролизин) не позволяет полностью восстановить утраченные функции при повреждении ЦНС, однако эти препараты ускоряют и улучшают процессы восстановления в организме.
Учитывая необходимость увеличить количество пациентов, участвовавших в настоящем исследовании, мы инициировали крупное национальное 5-летнее ретроспективное многоцентровое исследование, направленное на оценку эффективности применения Церебролизина у пациентов с травматическим повреждением головного мозга (табл. 12 представляет образец для унифицированного сбора данных о пациентах в рамках этого исследования).
Перевод к.м.н. А.В. Савустьяненко
Оригинал статьи опубликован в Journal of Medicine and Life, Vol. 2, № 4, 2009
1. Muresanu D. Neuroprotection and Neuroplasticity — two aspects of continuous process, genetically regulated and powered by neurotrophic factors // Communication at the 6th AMN Congress, April 2008, Cluj-Napoca, Romania.
2. Fehlings M.G., Baptiste D.C. Current status of clinical trials for acute spinal cord injury // Injury. — 2005. — 36 (Suppl. 2). — B113-B122.
3. Hall E.D., Springer J.E. Neuroprotection and acute spinal cord injury: a reappraisal // NeuroRx. — 2004. — 1. — 80-100.
4. Skvortsova V.I., Stakhovskya L.V., Gubsky L.V., Shamalov N.A., Tikhonova I.V., Smychkov A.S. Randomized, double-blind, placebocontrolled study of Cerebrolysin safety and efficacy in treatment of acute ischemic stroke // Zh. Nevrol. Psikhiatr. im. S.S. Korsakova. — 2004. — 11.
5. Windisch M., Gschanes A., Hutter-Paier B. Neurotrophic activities and therapeutic experience with a brainderived peptide preparation, ageing and dementia // J. Neural. Transm. — 1998. — Suppl. 53.
6. Onose G. et al. Stem cells and Tissue engineering, basics for Regenerative Medicine. A synthetic overview // Romanian Neurosurgery. — 2007. — 14(1). — 4-18.
7. Rowland J.W. et al. Current status of acute spinal cord injury pathophysiology and emerging therapies: promise on the horizon // Neurosurg. Focus. — 2008. — 25(5). — E2.
8. Hall E.D., Springer J.E. Neuroprotection and acute spinal cord injury: a reappraisal // NeuroRx. — 2004. — 1. — 80-100.
9. Bracken M.B., Shepard M.J., Collins W.F. et al. A randomized, controlled trial of methylprednisolone or naloxone in the treatment of acute spinal-cord injury. Results of the Second National Acute Spinal Cord Injury Study // N. Engl. J. Med. — 1990. — 322. — 1405-11.
10. Bracken M.B., Shepard M.J., Holford T.R. et al. Administration of methylprednisolone for 24 or 48 hours or tirilazad mesylate for 48 hours in the treatment of acute spinal cord injury. Results of the Third National Acute Spinal Cord Injury Randomized Controlled Trial. National Acute Spinal Cord Injury Study // JAMA. — 1997. — 277. — 1597-604.
11. Hurlbert R.J. Methylprednisolone for acute spinal cord injury: an inappropriate standard of care // J. Neurosurg. — 2000. — 93. — 1-7.
12. Sayer F.T., Kronvall E., Nilsson O.G. Methylprednisolone treatment in acute spinal cord injury: the mythchallenged through a structured analysis of published literature // Spine J. — 2006. — 6. — 335-43.
13. Blackman S. A matter of life and celll death // The Scientist. — 2005. — 19(4). — 22.
14. Kartje G.L., Schulz M.K., Lopez-Yunez A., Schnell L., Schwab M.E. Corticostriatal plasticity is restricted by myelin-associated neurite growth inhibitors in the adult rat // Ann. Neurol. — 1999. — 45. — 778-786.
15. Buchli A.D., Schwab M.E. Inhibition of Nogo: a key strategy to increase regeneration, plasticity and functional recovery of the lesioned central nervous system // Ann. Med. — 2005. — 37. — 556-567.
16. Schwab M.E. Nogo inhibition to enhance regeneration and functional recovery in SCI. Summer School for the Biological Treatment of Chronic Spinal Cord Injury. Vienna, Austria, Oct 2008.
17. McKerracher L. et al. Targeting Rhoto stimulate repair after spinal cord injury // Top Spinal Cord Inj. Rehabil. — 2003. — 8. — 69-75.
18. Shao Z. et al. TAJ/TROY an orphan FNT receptor family member, bind Nogo-66 receptor 1 and regulates axonal regeneration // Neuron. — 45(3). — 353. — 2005.
19. Abdelaziz O. A potentially new pharmacological therapy for acute spinal cord injury (ASCI) effects of Cerebrolysin administration on experimental ASCI // Communication at the 6th AMN Congress, April 2008, Cluj-Napoca, Romania.
20. Wronski R., Kronawetter S., Hutter-Paier B., Crailsheim K., Windisch M. A brain derived peptide preparation reduces the translation dependent loss of a cytoskeletal protein in primary cultured chicken neurons // J. Neural. Transm. — 2000. — Suppl. 59. — 263.
21. Gutmann B., Hutter-Paier B., Skofitsch G., Windisch M., Gmeinbauer R. In vitro models of brain ischemia: the peptidergic drug cerebrolysin protects cultured chick cortical neurons from cell death // Neurotox. Res. — 2002. — 4. — 59.