Международный неврологический журнал 3 (41) 2011
Вернуться к номеру
Клініко-діагностичні особливості перебігу діабетичної енцефалопатії залежно від типу основного захворювання
Авторы: Пашковська Н.В., Пашковський В.М., Буковинський державний медичний університет, м. Чернівці
Рубрики: Неврология
Версия для печати
У статті висвітлено дані щодо клінічного перебігу діабетичної енцефалопатії залежно від типу основного захворювання. Наведені відмінності у клінічному перебігу та діагностичній картині діабетичних енцефалопатій при цукровому діабеті 1-го та 2-го типів, що вимагають диференційованого підходу до діагностики та лікування цього захворювання.
Цукровий діабет, енцефалопатія, клінічні особливості.
Енцефалопатії різного генезу становлять одну з найбільш важливих проблем сучасної медицини внаслідок неухильного зростання захворюваності, негативного впливу на якість життя, ранньої інвалідизації пацієнтів [2].
В Україні зареєстровано понад 3 мільйони осіб із цереброваскулярними захворюваннями. Щорічно близько 20 тисяч громадян нашої держави стають інвалідами внаслідок цієї патології, що зумовлює медико-соціальну значущість проблеми. У структурі судинних захворювань головного мозку переважають хронічні форми недостатності церебрального кровообігу, що іменуються дисциркуляторною енцефалопатією, питома вага якої становить понад 90 % [1, 2, 6]. За останні 10 років темпи зростання цієї нозології збільшилися удвічі. Аналогічна тенденція відмічається і в інших країнах, що пов’язано із поширенням у популяції таких чинників ризику цереброваскулярних захворювань, як артеріальна гіпертензія, цукровий діабет (ЦД), ожиріння, зловживання алкоголем, паління, стреси тощо [9, 12].
ЦД, що останнім часом набув ознак неінфекційної епідемії, яка охопила близько чверті мільярда жителів нашої планети, визнаний незалежним чинником ризику цереброваскулярної патології. В Україні за останні 15 років захворюваність на цю ендокринно-обмінну патологію збільшилася удвічі. Кількість пацієнтів із ЦД ще у 2006 році подолала мільйонну позначку, водночас, за даними епідеміологічних досліджень, реальний показник є принаймні утричі вищим [8].
Хронічні ураження головного мозку при ЦД називають діабетичною енцефалопатією (ДБЕ). Центральна діабетична нейропатія є найменш вивченою і розробленою частиною нейродіабетології, що нерідко залишається поза межами існуючих клінічних класифікацій. Незважаючи на сучасні діагностичні можливості, більшість авторів указують на несвоєчасне виявлення ДБЕ через стерту суб’єктивну симптоматику, субклінічний перебіг та маскування [4, 5].
Питання залежності перебігу ДБЕ від типу основного захворювання, незважаючи на відмінності у патогенезі виникнення захворювання у хворих на ЦД 1-го типу (переважання метаболічних порушень) та 2-го типу (домінування судинного компонента) [7, 10], залишаються поза увагою дослідників. Не розроблені чіткі діагностичні критерії та лікувальні підходи, які б ураховували специфіку церебральних уражень при ЦД обох типів. Усе це вказує на необхідність створення диференційованого підходу до діагностики ДБЕ з урахуванням механізмів розвитку та клініко-діагностичних особливостей залежно від типу основного захворювання.
Мета дослідження — з’ясування клініко-діагностичних особливостей перебігу діабетичної енцефалопатії залежно від типу основного захворювання.
Матеріали та методи дослідження
Обстежено 193 хворих на діабетичну енцефалопатію (ДБЕ, середній вік — 52,40 ± 10,74 року, 46,2 % чоловіків і 53,8 % жінок) та 48 практично здорових осіб (середній вік — 52,20 ± 12,15 року, 45,8 % чоловіків та 54,2 % жінок), які становили контрольну групу. ДБЕ у 76 осіб мала перебіг на тлі ЦД 1-го типу (у 30 діагностовано ДБЕ І стадії, 32 — ІІ стадії, 14 — ІІІ стадії, середній вік — 48,00 ± 12,18 року, середня тривалість ЦД — 12,00 ± 7,33 року), у 117 — на тлі ЦД 2-го типу (43 — з ДБЕ І стадії, 53 — ІІ стадії, 21 — ІІІ стадії, середній вік — 55,30 ± 8,59 року, середня тривалість ЦД — 8,20 ± 4,29 року).
Для об’єктивної оцінки клінічного стану хворих застосовували бальну оцінку скарг та неврологічного статусу [1]. З метою встановлення особливостей когнітивних функцій використовували тест MMSE (Mini Mental State Examination — міні-тест оцінки психічного статусу) [3] та метод слухових когнітивних викликаних потенціалів Р 300 з використанням багатофункціонального комп’ютерного комплексу «Нейро-МВП» (Росія).
Рівень глікемії досліджували глюкозооксидазним методом із використанням наборів НПП «Филісит діагностика» (Україна), глікозильованого гемоглобіну (HbA1с) — на автоматичному аналізаторі глікозильованого гемоглобіну D10 Bio-Rad Laboratories Inc. (Франція). Імунореактивний інсулін (ІРІ) досліджували імуноферментним методом із використанням реактивів фірми DRG International Inc. (США). Ступінь інсулінорезистентності встановлювали за індексом маси тіла (ІМТ), індексами Caro, HOMA-IR [11].
Вивчення макроструктурних змін головного мозку проводили за допомогою магнітно-резонансного томографа Siemens Magnetom Impact та комп’ютерного томографа Siemens Somatom-crx. Внутрішню і зовнішню гідроцефалію оцінювали шляхом виміру шлуночкової системи і субарахноїдальних просторів. Екстра- та транскраніальне дуплексне сканування судин головного мозку (загальних (ЗСА), внутрішніх (ВСА), зовнішніх (ЗовСА) сонних, середніх (СМА), передніх (ПМА), задніх (ЗМА) мозкових, хребцевих (ХА) артерій) здійснювали шляхом використання системи EnVisor HD (Philips) з оцінкою анатомічних та гемодинамічних характеристик.
Статистичний аналіз результатів дослідження здійснювали за спеціальними програмами із застосуванням параметричних (t-критерій Стьюдента) та непараметричних (ранговий критерій Манна — Уїтні, парний Т-критерій Вілкоксона) методів варіаційної статистики, що порівнювали з адекватними групами контролю. Математичну обробку отриманих даних проводили за допомогою програм Primer of Biostatistics. Version 4.03 (Glantz S., США), SPSS 16.0, Excel.
Результати дослідження та їх обговорення
Як показали результати дослідження, ДБЕ, що мала перебіг на тлі ЦД 1-го типу, частіше розвивалася на тлі лабільного перебігу ЦД, з епізодами кетоацидозу та/або гіпоглікемій в анамнезі, частота яких становила 60,5 та 52,6 % відповідно. Гострі порушення мозкового кровообігу в анамнезі зафіксовані удвічі частіше при ЦД 2-го типу: у 21,4 % обстежених проти 10,5 % при ЦД 1-го типу. У більшості пацієнтів обох груп відсутня достатня компенсація ЦД. Рівень глікемії натще виявився вищим за контрольний при ЦД 1-го типу у 2,2 раза (P < 0,001), 2-го типу — у 2 рази (P < 0,001). Концентрація HbA1c у хворих на ЦД 1-го типу на 28,9 % (P < 0,001) вища щодо групи порівняння. У більшості хворих на ЦД 2-го типу встановлено ознаки метаболічного синдрому: надмірна маса тіла (у 76,1 % обстежених) із вірогідним (Р < 0,001) зростанням ІМТ (на 18,2 %), артеріальна гіпертензія (у 67,5 % пацієнтів) тощо. Рівень сироваткового інсуліну та індекс HOMA-IR при ЦД 2-го типу вірогідно (Р < 0,001) перевищували контрольні показники у 3,2 та 6,2 раза відповідно.
Неврологічне обстеження показало, що клінічна симптоматика ДБЕ є поліморфною, залежить від типу ЦД та змінюється впродовж стадій її розвитку: у І стадії ДБЕ відмічалося переважання суб’єктивних проявів з подальшим поглибленням об’єктивних даних у ІІ стадії й тяжкими порушеннями у ІІІ стадії захворювання. У клінічній картині ДБЕ, що ускладнила перебіг ЦД 1-го типу, домінували прояви мозочкової недостатності (47,4 %), пірамідний синдром (72,4 %), вегетативні (52,7 %) та неврозоподібні (68,5 %) порушення, при ЦД 2-го типу — окрім явищ мозочкової атаксії (57,3 ) та пірамідної недостатності (78,6 %), частіше діагностувалися та мали більший ступінь прояву (P < 0,05–0,01) екстрапірамідні розлади (35,9 %) й психоорганічний синдром (12,8 %).
У пацієнтів обох груп встановлений когнітивний дефіцит, що поглиблювався з прогресуванням захворювання. Середній бал MMSE-тесту виявився меншим за відповідний у контролі (29,1 бала) як при ЦД 1-го типу (25,5 бала), так і 2-го типу (24,7 бала) з високим ступенем вірогідності (Р < 0,001), водночас без статистично значущих змін при міжгруповому порівнянні. У переважної більшості хворих зареєстровані помірні когнітивні порушення (77,6 % при ЦД 1-го типу та 72,7 % — при ЦД 2-го типу). Деменція легкого ступеня діагностувалася удвічі частіше при ЦД 2-го типу: у 23,9 % проти 11,9 % при ЦД 1-го типу. Встановлені статистично значущі зміни у когнітивній сфері хворих вже з І стадією захворювання вказують на достатню чутливість та високу інформативність тесту MMSE у діагностиці ДБЕ. Дослідження когнітивних викликаних потенціалів встановило статистично значуще подовження латентного періоду компонента Р 300 як при ДЕ (на 10,2 %), так і при ДБЕ (на 15,3 %) з вірогідною міжгруповою різницею (Р < 0,05). При ДБЕ, що мала перебіг на тлі ЦД 1-го типу, латентний період вірогідно збільшувався на 14,0 % щодо контрольної групи, 2-го типу — на 16,5 % (P < 0,001).
У хворих на ДБЕ нейровізуалізаційна картина змін головного мозку супроводжувалася явищами внутрішньої гідроцефалії з розширенням лінійних параметрів та індексів шлуночків (рис. 1). Так, встановлено вірогідне (Р < 0,05–0,001) зростання індексів передніх рогів бічних шлуночків (на 21,8 %), їх центральних відділів (на 17,5 %) та задніх рогів (на 18,9 %). Індекс ІІІ шлуночка статистично значуще (Р < 0,001) збільшувався на 69,0 %.
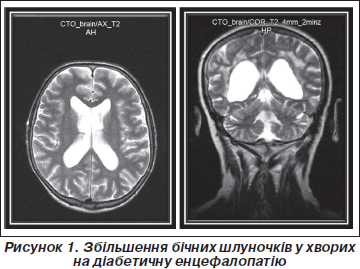
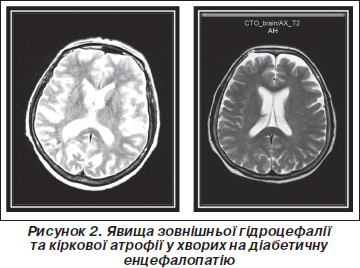
В обох групах встановлені ознаки кіркової атрофії зі зростанням параметрів субарахноїдальних просторів (рис. 2). Відмічалося вірогідне (Р < 0,001) зростання максимальної ширини сільвієвої щілини в задніх відділах (зліва — на 62,8 %, справа — на 65,9 %) та передніх відділів міжпівкульової щілини (на 43,0 % при ДЕ та на 51,3 % при ДБЕ). При ЦД 2-го типу параметри шлуночків мозку збільшувалися помітніше (P < 0,05), ніж у пацієнтів з ЦД 1-го типу, у той час як показники субарахноїдальних просторів не відрізнялися між групами спостереження.
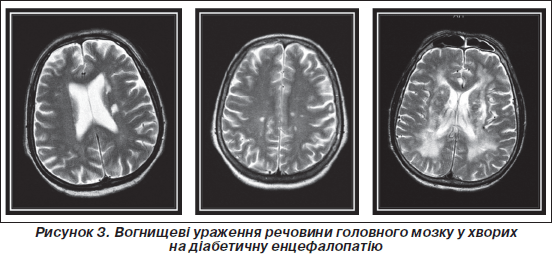
Вогнищеві зміни виявлялися у 80 % хворих на ДБЕ. У пацієнтів із ЦД 1-го типу частіше реєструвалися множинні дрібні вогнища, що локалізувалися переважно глибоко в білій речовині обох півкуль мозку (у 29 %), 2-го типу — одиничні дрібні вогнища, розташовані ближче до кори (у 32 %). Ці дрібні точкові огнища, вочевидь, пов’язані з розширенням периваскулярних просторів і можуть бути проявом діабетичних мікроангіопатій головного мозку. Частота лейкоареозу була однакова в обох групах (у близько 70 % пацієнтів).
Результати кореляційного аналізу вказують на залежність параметрів шлуночків та субарахноїдальних просторів головного мозку хворих на ДБЕ від стану вуглеводного обміну, причому при ЦД 2-го типу найпотужніші зв’язки встановлено з показниками, що відображають інсулінорезистентність організму, зокрема сильний прямий кореляційний зв’язок (R = 0,625; P < 0,05) між індексом задніх рогів бічних шлуночків та HOMA-IR.
Проведення дуплексної допплерографії екстра- та інтракраніальних артерій каротидного та вертебробазилярного басейнів не встановило помітних змін лінійних параметрів кровотоку при ДБЕ, проте коефіцієнт асиметрії середньої швидкості кровотоку вірогідно (P < 0,05–0,001) зростав практично у всіх досліджуваних судинах. Об’ємна швидкість кровотоку при ЦД 1-го типу зазнавала тільки невірогідної тенденції до зменшення, у той час як при ЦД 2-го типу статистично значуще знижувалася на 33,2 % (P < 0,01). При ЦД обох типів встановлено вірогідне (P < 0,05) зростання індексу резистивності артерій як каротидного (ЗСА, ВСА, ЗовСА, ПМА, СМА), так і вертебробазилярного басейну (ХА, БА). В обох групах відмічалося потовщення КІМ, причому помітніше при ЦД 2-го типу. Так, у хворих на ЦД 1-го типу зареєстровано вірогідне (P < 0,05–0,001) збільшення досліджуваного показника у ЗСА на 41,2 % зліва та на 38,2 % справа, ВСА — відповідно на 32,1 % та на 29,9 %, ЗовСА — на 20,9 та 26,1 %.
При ЦД 2-го типу товщина КІМ у ЗСА вірогідно (P < 0,001) збільшувалася на 77,1 % зліва та на 91,2 % справа, ВСА — відповідно на 67,9 % та на 63,2 %, ЗовСА — на 53,5 % та на 45,7 % із встановленням вірогідності (P < 0,01–0,001) змін при міжгруповому порівнянні у всіх досліджуваних судинах. Потовщення КІМ супроводжувалося порушенням його диференціації на шари, нерівністю та неоднорідністю поверхні інтими. У хворих на ДБЕ, у першу чергу з ЦД 2-го типу, частіше реєструвалися атеросклеротичні бляшки, нерідко неоднорідної структури, нестабільні, а питома вага стенозів (усі — гемодинамічно незначущі) суттєво перевищувала відповідний показник у пацієнтів з ЦД 1-го типу.
Отримані результати вказують на більший ступінь прояву церебральних макроангіопатій у хворих на ЦД 2-го типу. Водночас вірогідне зростання індексу резистивності артерій при ЦД обох типів може бути відображенням наявності у них мікроангіопатій головного мозку. З огляду на отримані результати дуплексне обстеження судин головного мозку доцільно призначати хворим на ЦД 2-го типу, у той час як при ЦД 1-го типу інформативність цього методу низька.
У пацієнтів із ДБЕ, що ускладнила перебіг ЦД 2-го типу, показник сумарного мозкового кровотоку виявив більшу залежність від вуглеводного обміну, у першу чергу від показника інсулінорезистентності HOMA-IR (R = –0,504; P < 0,05), у той час як при ЦД 1-го типу цей параметр залежав переважно від компенсації ЦД, відображенням якої є концентрація HbA1c (R = –0,352; P < 0,05).
Відмінності у клінічно-діагностичній картині ДБЕ залежно від типу основного захворювання, на нашу думку, зумовлені різницею у механізмах розвитку церебральних змін при ЦД 1-го та 2-го типів, а саме наявністю чинників розвитку та прогресування макросудинних змін в останніх. Гіперглікемія, активуючи процеси вільнорадикального окиснення та неферментативного глікозилювання білків, поліоловий шлях метаболізму глюкози, веде до ендотеліальної дисфункції, гемореологічних порушень із розвитком діабетичних мікроангіопатій. Водночас наявність інсулінорезистентності та гіперінсулінемії при ЦД 2-го типу додатково сприяють розвитку дисліпідемії, артеріальної гіпертензії та церебрального атеросклерозу. Все це вказує на необхідність диференційованого підходу до діагностики та лікування цього захворювання.
Висновки
1. Клінічна симптоматика діабетичної енцефалопатії є поліморфною та залежить від типу основного захворювання: у хворих на цукровий діабет 1-го типу домінують, окрім когнітивних порушень, неврозоподібні й вегетативні розлади, вестибулярний, мозочковий синдром та прояви пірамідної недостатності, у той час як у пацієнтів із цукровим діабетом 2-го типу часто діагностуються та мають більший ступінь прояву екстрапірамідні розлади, пірамідні порушення та психоорганічний синдром.
2. Діабетична енцефалопатія супроводжується когнітивним дефіцитом із вірогідним зниженням показника міні-тесту оцінки психічного статусу до рівня помірних когнітивних порушень, подовженням латентного періоду когнітивних викликаних потенціалів. Інтелектуально-мнестичні порушення мають більший ступінь прояву при цукровому діабеті 2-го типу, поглиблюються з прогресуванням енцефалопатії, залежать від компенсації основного захворювання та ступеня інсулінорезистентності.
3. Нейровізуалізаційна картина змін головного мозку при діабетичній енцефалопатії супроводжується явищами церебральної атрофії із розширенням лікворовмісних просторів, ступінь яких залежить від компенсації вуглеводного обміну та пов’язаний з когнітивним забезпеченням. У хворих на цукровий діабет 2-го типу відбувається суттєвіше зростання лінійних розмірів та індексів шлуночків мозку, у той час як ступінь кіркової атрофії зі збільшенням параметрів субарахноїдальних просторів не залежить від типу основного захворювання. Вогнищеві зміни головного мозку трапляються у 80 % пацієнтів. У хворих на цукровий діабет 1-го типу частіше реєструються множинні дрібні вогнища, що локалізуються переважно глибоко в білій речовині обох півкуль мозку, 2-го типу — одиничні дрібні вогнища, розташовані ближче до кори. Частота лейкоареозу однакова в обох групах.
4. У хворих на діабетичну енцефалопатію, що ускладнила перебіг цукрового діабету 2-го типу, відбуваються більш значущі, ніж при цукровому діабеті 1-го типу, гемодинамічні зміни як у каротидному, так і у вертебробазилярному басейнах у вигляді вірогідного зменшення об’ємних параметрів кровотоку, порушення пружно-еластичних властивостей артерій, потовщення комплексу інтима-медіа та значно більшої частоти стенозування судин.
1. Віничук С.М. Порівняльна оцінка клінічної та гемодинамічної ефективності препаратів серміон та вінпоцетин при лікуванні хворих з дисциркуляторною енцефалопатією / С.М. Віничук, Т.І. Ілляш, І.І. Бедрій та ін. // Укр. мед. часопис. — 2000. — № 4(18). — С. 8-64.
2. Волошин П.В. Аналіз поширеності та захворюваності на нервові хвороби в Україні / П.В. Волошин, Т.С. Міщенко, Є.В. Лекомцева // Міжнар. неврол. журн. — 2006. — № 3(7). — С. 9-13.
3. Карелин А. Большая энциклопедия психологических тестов. — М.: Эксмо, 2007. — 416 с.
4. Котов С.В. Энцефалопатия у больных сахарным диабетом ІІ типа. Клиника и лечение / С.В. Котов, И.Г. Рудакова, Е.В. Исакова // Неврол. журн. — 2001. — Т. 6, № 3. — С. 35-37.
5. Мищенко Т.С. Cахарный диабет и хронические нарушения мозгового кровообращения / Т.С. Мищенко, Т.Г. Перцева // Укр. неврол. журн. — 2008. — № 3(8). — С. 4-13.
6. Мищенко Т.С. Сосудистая деменция: диагностика, лечение, профилактика / Т.С. Мищенко, Е.В. Дмитриева // Міжнар. неврол. журн. — 2006. — № 2(6). — С. 16-20.
7. Науменко В.Г. Патогенетична терапія ускладнень цукрового діабету / В.Г. Науменко // Міжнар. ендокрин. журн. — 2006. — № 1. — С. 55-60.
8. Паньків В.І. Цукровий діабет, переддіабет і серцево-судинні захворювання // Практична ангіологія. — 2007. — № 1(6). — С. 4-10.
9. Adams H.P. Secondary prevention of atherothrombotic events after ischemic stroke // Jr. Mayo Clin. Proc. — 2009. — Vol. 84, № 1. — P. 43-51.
10. Karsito N.V. Diabetes and stroke / N.V. Karsito, D.W. Soeatmadji // Acta. Med. Indones. — 2008. — Vol. 40, № 3. — P. 151-158.
11. Matthews D.R., Hosker J.P., Rudenski A.S. et al. Homeostasis model assessment: insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man // Diabetologia. — 1985. — Vol. 28, № 7. — P. 412-419.
12. Romero J.R. Stroke prevention: modifying risk factors / J.R. Romero, J. Morris, A. Pikula // Ther. Adv. Cardiovasc. Dis. — 2008. — Vol. 2, № 4. — P. 287-303.
