Журнал «Болезни и антибиотики» 1 (04) 2011
Вернуться к номеру
Диагностика и лечение осложненных интраабдоминальных инфекций у взрослых и детей: рекомендации Общества хирургических инфекций и Общества инфекционных заболеваний Америки
Рекомендации по лечению больных с интраабдоминальными инфекциями (ИАИ) подготовлены группой экспертов Общества хирургических инфекций и Общества инфекционных заболеваний Америки. Этот документ представляет собой новую версию рекомендаций, опубликованных ранее в 2002 и 2003 гг. В нем рассматриваются подходы к лечению пациентов с уже развившимися ИАИ либо с высоким риском их возникновения. В новые рекомендации включены научные данные, опубликованные за период 2003–2008 гг. Документ дополнен рекомендациями по лечению ИАИ у детей, по лечению аппендицита у больных всех возрастных групп и по лечению некротизирующего энтероколита у новорожденных.
Обновленные рекомендации одобрены американскими обществами микробиологов, фармацевтов, инфекционистов и педиатров-инфекционистов. Рекомендации по лечению ИАИ разработаны с учетом комплекса факторов — тяжести инфекции, возраста пациента, физиологических расстройств, сопутствующей патологии. Под больными группы высокого риска подразумевают пациентов, у которых имеются те или иные причины повышенной вероятности неуспеха лечения в дополнение к большей тяжести инфекции, особенно лиц с анатомически неблагоприятной инфекцией или инфекцией, связанной с оказанием медицинской помощи.
«Инфекция, связанная с оказанием медицинской помощи (СОМП)» — термин, появившийся в англоязычной литературе недавно. Под инфекциями СОМП понимают заболевания у взрослых пациентов, посещающих клиники по оказанию неотложной медицинской помощи или пребывающих в учреждениях длительного ухода. В этих условиях увеличивается риск инфицирования множественно резистентными бактериями, в том числе неферментирующими грамотрицательными микроорганизмами Pseudomonas aerugnosa, Acinetobacter spp., продуцирующими b-лактамазы расширенного спектра действия Klebsiella spp. и Escherichia coli, Enterobacter spp., Proteus spp., метициллинорезистентными Staphylococcus aureus (MRSA), энтерококками, Candida spp. Инфекции СОМП включают в себя заболевания, начавшиеся во внебольничной и в госпитальной среде. Под инфекциями СОМП с внебольничным началом понимают случаи с одним и более нижеследующими факторами риска: 1) наличием инвазивного устройства при поступлении; 2) анамнестическими указаниями на инфекцию или колонизацию MRSA; 3) анамнестическими указаниями на хирургическое вмешательство, стационарное лечение, диализ, пребывание в учреждениях длительного ухода на протяжении предшествующих 12 месяцев. Госпитальное начало инфекции СОМП включает случаи инфекций у пациентов, возникшие спустя 48 часов и более после госпитализации, у которых при микробиологическом исследовании образцов, взятых из стерильных в норме органов или тканей, получены позитивные результаты. У этих пациентов может быть 1 и более фактор риска внебольничного начала инфекции.
Клинические факторы, ограничивающие возможность установить контроль над очагом ИАИ:
— позднее начало хирургического вмешательства (> 24 ч от возникновения заболевания);
— высокая сумма баллов по шкале APACHE-II (і 15);
— пожилой и старческий возраст;
— сопутствующие заболевания и выраженная органная дисфункция;
— гипоальбуминемия;
— недостаточное питание;
— выраженность воспаления брюшины или разлитой перитонит;
— невозможность адекватного хирургического устранения или дренирования очага инфекции;
— наличие злокачественного образования.
Для оценки обоснованности рекомендаций и качества доказательной базы использовались критерии, представленные в табл. 1.
Ниже излагаются основные положения рекомендаций по антимикробной терапии больных с ИАИ. Некоторые положения документа, касающиеся собственно хирургического вмешательства, при подготовке данной статьи были опущены. Сначала, как и в оригинальной работе, представлен весь комплекс рекомендаций, затем эти положения повторяются и комментируются.
Первичная диагностика
1. Рутинный сбор анамнеза, физикальное обследование и лабораторные исследования позволяют идентифицировать большинство пациентов с подозрением на ИАИ (А-II).
2. У некоторых больных с неоднозначными данными, выявленными при осмотре (таких как пациенты со спутанным сознанием, травмами спинного мозга или с ослабленным иммунитетом в результате заболевания или лечения), следует подозревать ИАИ, если у них имеются признаки инфекции из неизвестного источника (B-ІІI).
3. У больных с явными признаками разлитого перитонита и при необходимости немедленного хирургического вмешательства не следует продолжать диагностические исследования (B-III).
4. У взрослых пациентов, которым не производится экстренная лапаротомия, визуализирующим методом выбора для выявления ИАИ и ее источника является компьютерная томография (КТ) (А-II).
Возмещение жидкости
5. У больных следует быстро восстановить внутрисосудистый объем и принять дополнительные меры для стабилизации физиологического баланса (A-II).
6. У больных с септическим шоком интенсивная терапия должна начинаться немедленно, как только выявлена гипотензия (А-II).
7. У больных без признаков уменьшения объема циркулирующей крови внутривенную инфузионную терапию следует начинать при первом подозрении на диагноз ИАИ (B-III).
Сроки начала антимикробной терапии
8. Антимикробная терапия должна начинаться при подозрении на ИАИ или постановке соответствующего диагноза. Пациентам с септическим шоком антибиотики необходимо назначить как можно быстрее (А-III).
9. Больным без явлений септического шока антимикробную терапию следует начинать в приемном покое (В-III).
10. Достаточная концентрация антимикробных препаратов должна поддерживаться во время хирургического вмешательства, что может потребовать дополнительного введения антимикробных препаратов до начала процедуры (А-I).
Элементы адекватного вмешательства
14. У гемодинамически стабильных больных без признаков острой органной недостаточности следует предпринять неотложное хирургическое вмешательство. Вмешательство можно отложить на срок до 24 ч при условии, что назначена адекватная антимикробная терапия и организовано тщательное клиническое наблюдение за больным (B-II).
16. Небольшую группу пациентов с минимальными физиологическими отклонениями и четко отграниченным очагом инфекции (например, периаппендикулярная или периколоническая флегмона) можно лечить только антимикробными средствами, не прибегая к хирургическому вмешательству, при условии тщательного клинического наблюдения за больным (B-II).
Микробиологическая оценка
17. У пациентов с внебольничной ИАИ посев крови не дает дополнительной клинически значимой информации, поэтому нет оснований для его рутинного выполнения (В-ІІI).
18. Если у пациента имеются признаки интоксикации или иммуносупрессии, выявление бактериемии может помочь в определении продолжительности антимикробной терапии (В-ІІI).
19. У больных с внебольничными инфекциями целесообразность окраски инфицированного материала по Граму не доказана (С-ІІI).
20. При инфекциях СОМП окраска по Граму может помочь в выявлении грибов (С-ІІI).
21. Рутинное культуральное исследование на наличие аэробов и анаэробов у больных с внебольничной инфекцией из группы низкого риска проводить не обязательно, однако оно может помочь в выявлении эпидемиологических изменений в резистентности возбудителей, ассоциированных с внебольничной ИАИ, и для обоснования последующей пероральной терапии (В-ІІ).
22. При значительной резистентности (порядка 10–20 % изолятов) распространенных возбудителей (например, E.coli) к режиму антимикробной терапии, традиционно используемому в данном лечебном учреждении, рутинное культуральное исследование и определение чувствительности к антибиотикам должны проводиться у больных с перфоративными аппендицитами и другими внебольничными ИАИ (В-ІІI).
23. Нет необходимости в идентификации анаэробов у пациентов с внебольничными ИАИ, если эмпирическая антимикробная терапия активна в отношении распространенных анаэробных патогенов (В-ІІI).
24. У больных группы высокого риска следует получить образец материала из очага инфекции для микробиологического исследования, особенно у лиц, ранее получавших антибиотики, поскольку у таких пациентов больше вероятность того, что в этиологии заболевания играют роль резистентные возбудители (А-ІІ).
25. Образец, взятый из очага интраабдоминальной инфекции, должен быть репрезентативным (В-ІІI).
26. Для культурального исследования направляется один образец, при условии, что он достаточного объема (по крайней мере 1 мл жидкости или ткани, желательно больше), и доставляется в лабораторию в соответствующей транспортной системе. Для оптимального обнаружения аэробных бактерий 1–10 мл жидкости инокулируют непосредственно во флакон с соответствующей средой. Помимо этого, 0,5 мл жидкости следует отправить в лабораторию для окраски по Граму и, по показаниям, для выявления грибов. Если необходимо выделить культуры анаэробов, в лабораторию следует направлять не менее 0,5 мл жидкости или 0,5 г ткани в анаэробной транспортной тубе. Как альтернатива, для обнаружения анаэробных бактерий 1–10 мл жидкости можно инокулировать прямо в пробирку со средой для анаэробной гемокультуры (А-І).
27. Следует определять антибиотикочувствительность Pseudomonas spp., Proteus spp., Acinetobacter spp., Staphylococcus aureus, большинства Enterobacteriaceae, поскольку у них по сравнению с другими микроорганизмами чаще встречается резистентность (А-ІІI).
Рекомендуемые антимикробные режимы
Антимикробные препараты, а также их комбинации, представленные в табл. 2–4, являются адекватными для эмпирического лечения внебольничных ИАИ и ИАИ СОМП.
Внебольничная инфекция легкой и средней тяжести у взрослых
28. Антибиотики, используемые для эмпирической терапии внебольничной ИАИ, должны быть активными в отношении кишечной флоры: грамотрицательных аэробных и факультативных палочек, кишечных грамположительных стрептококков (А-І).
29. При инфекциях, исходящих из дистальной части тонкого кишечника, червеобразного отростка, ободочной кишки, и при более проксимальной перфорации желудочно-кишечного тракта, когда имеет место обструкция или паралитическая кишечная непроходимость, следует применять антибиотики, активные в отношении анаэробных палочек (А-І).
30. У взрослых пациентов с нетяжелой внебольничной инфекцией предпочтительнее использовать тикарциллин/клавуланат, цефокситин, эртапенем, моксифлоксацин, тигециклин в качестве монотерапии либо комбинацию метронидазола с цефазолином, цефуроксимом, цефтриаксоном, левофлоксацином, ципрофлоксацином, нежели схемы с антибиотиками, активными в отношении Pseudomonas spp. (табл. 2) (А-І).
31. Не рекомендуется использовать ампициллин/сульбактам из-за высокой частоты резистентности к нему внебольничных штаммов E.coli (В-ІІ).
32. Не рекомендуется использовать цефотетан и клиндамицин из-за возрастающей резистентности к ним среди микроорганизмов группы Bacteroides fragilis (В-ІІ).
33. У взрослых больных с внебольничными ИАИ не рекомендуется рутинное использование аминогликозидов, поскольку доступны менее токсичные и как минимум столь же эффективные антибиотики (В-ІІ).
34. У пациентов с внебольничными ИАИ не требуется, чтобы эмпирическая терапия была активной в отношении энтерококков (А-І).
35. У взрослых и детей с внебольничными ИАИ не рекомендуется эмпирическая антифунгальная терапия против Candida spp. (В-ІІ).
36. Применение препаратов, предназначенных для лечения тяжелых внебольничных инфекций или инфекций СОМП, не рекомендуется у больных с нетяжелыми внебольничными инфекциями из-за большего риска токсичности и колонизации более резистентными микроорганизмами (В-ІІ).
37. Пациентам с нетяжелыми ИАИ, включая острый дивертикулит и различные формы аппендицита, у которых не производится хирургическое вмешательство, рекомендуются вышеперечисленные режимы терапии нетяжелых инфекций; допускается раннее назначение антибиотиков внутрь (В-ІІI).
Внебольничные инфекции высокого риска у взрослых
38. Пациентам с тяжелыми внебольничными ИАИ (> 15 баллов по шкале APACHE-II или с другими факторами) эмпирически назначаются антимикробные препараты широкого спектра действия, активные в отношении грамотрицательных микроорганизмов, в том числе меропенем, имипенем/циластатин, дорипенем, пиперациллин/тазобактам, ципрофлоксацин или левофлоксацин в комбинации с метронидазолом либо цефтазидим или цефепим с метронидазолом (табл. 2) (А-І)
39. Во многих регионах получили распространение E.coli, резистентные к хинолонам, поэтому хинолоны не должны применяться, если, по данным локальных лабораторий, чувствительность к ним среди E.coli < 90 % (А-ІІ).
40. В качестве альтернативы можно использовать азтреонам в сочетании с метронидазолом, однако рекомендуется добавление препарата, активного в отношении грамположительных кокков (В-ІІI).
41. У взрослых не рекомендуется рутинное использование аминогликозида или другого второго препарата, активного в отношении грамотрицательных факультативных или аэробных палочек, если нет доказательств наличия у пациента резистентных микроорганизмов, требующих такой терапии (А-ІІ).
42. Рекомендуется эмпирическое назначение препаратов, активных в отношении энтерококков (В-ІІ).
43. Не рекомендуется назначение препаратов, активных в отношении MRSA или грибов, если нет доказательств, что инфекция вызвана именно этими возбудителями (В-ІІI).
44. У больных группы высокого риска антимикробная терапия корректируется в соответствии с результатами микробиологического исследования и определения чувствительности к антибиотикам, чтобы гарантировать активность в отношении преобладающих в культуре изолятов (А-ІІI).
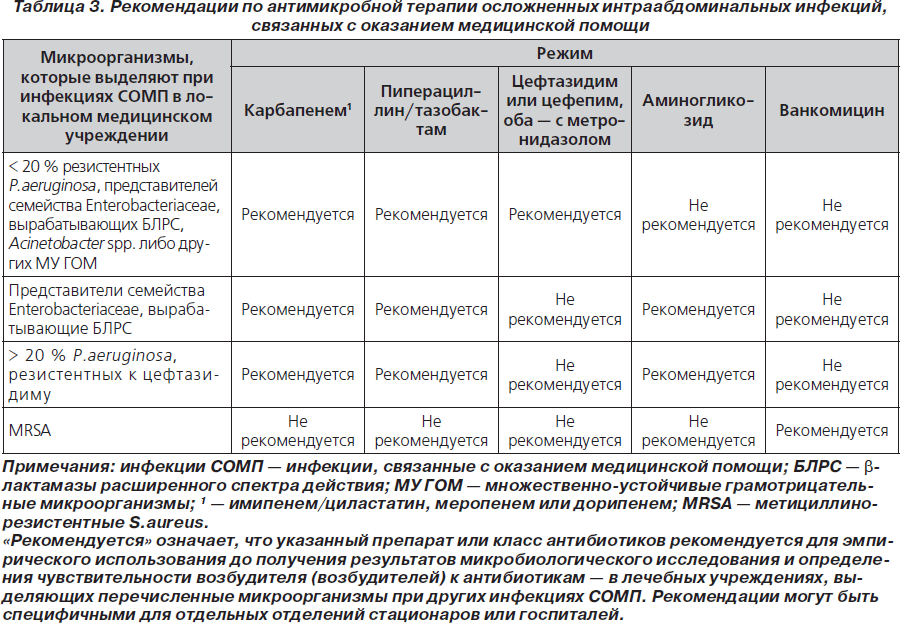
Инфекции у взрослых, связанные с оказанием медицинской помощи
45. Эмпирическая антибактериальная терапия для лечения ИАИ СОМП назначается в соответствии с локальными микробиологическими данными (А-ІІ).
46. Для эмпирического охвата вероятных возбудителей может потребоваться назначение нескольких антибиотиков, включая препараты с расширенными спектрами активности в отношении грамотрицательных аэробных и факультативных палочек. Назначаются меропенем, имипенем, дорипенем, пиперациллин/тазобактам либо цефтазидим или цефепим в комбинации с метронидазолом. Может потребоваться назначение аминогликозидов или колистина (табл. 3) (В-ІІI).
47. Антимикробная терапия корректируется после получения результатов культурального исследования и определения чувствительности к антибиотикам с целью уменьшения количества и спектра назначенных препаратов (В-ІІI).
Антифунгальная терапия
48. Антифунгальная терапия пациентам с тяжелой внебольничной инфекцией или инфекцией СОМП показана, если из образцов интраабдоминального материала высеяны грибы рода Candida (В-ІІ).
49. В случае выделения Candida albicans препаратом выбора является флуконазол (В-ІІ).
50. При выделении Candida spp., резистентных к флуконазолу, назначаются эхинокандины (каспофунгин, микафунгин либо анидулафунгин) (В-ІІI).
51. Больным, находящимся в критическом состоянии, рекомендуется начальная терапия эхинокандином вместо триазола (В-ІІ).
52. Амфотерицин В не рекомендуется для начальной терапии из-за высокой токсичности (В-ІІ).
53. У новорожденных при подозрении на инфекцию Candida spp. следует начинать эмпирическую антифунгальную терапию. При выделении Candida albicans препаратом выбора является флуконазол (В-ІІ).
Антиэнтерококковая терапия
54. Антимикробные препараты, активные в отношении энтерококков, назначают при выделении энтерококков у пациентов с инфекцией СОМП (В-ІІI).
55. Эмпирическая антиэнтерококковая терапия рекомендуется пациентам с ИАИ СОМП, в особенности лицам с послеоперационной инфекцией, больным, ранее принимавшим цефалоспорины или другие антимикробные препараты, ассоциирующиеся с селекцией Enterococcus spp., пациентам с иммунодефицитами, поражениями клапанов сердца либо с внутрисосудистыми протезами (В-ІІ).
56. Начальная эмпирическая антиэнтерококковая терапия должна быть активной в отношении Enterococcus faecalis. В зависимости от результатов определения антибиотикочувствительности выделенного изолята могут использоваться ампициллин, пиперациллин/тазобактам, ванкомицин (В-ІІI).
57. Не рекомендуется эмпирическая терапия, направленная против ванкомицинорезистентных Enterococcus faecium, если только пациент не относится к группе очень высокого риска инфекции, вызванной этим микроорганизмом, как, например, больные после трансплантации печени, у которых ИАИ исходит из гепатобилиарной системы, либо пациенты, о которых известно, что они колонизированы ванкомицинорезистентными E.faecium (В-ІІI).
Анти-MRSA терапия
58. Эмпирическая антимикробная терапия в отношении MRSA должна назначаться больным с ИАИ СОМП, о которых известно, что они колонизированы этим микроорганизмом либо же относятся к группе риска инфицирования MRSA вследствие предыдущего неэффективного лечения или длительного приема антибиотиков (В-ІІ).
59. Ванкомицин рекомендуется для лечения предполагаемой или подтвержденной ИАИ, вызванной MRSA (A-IІІ).
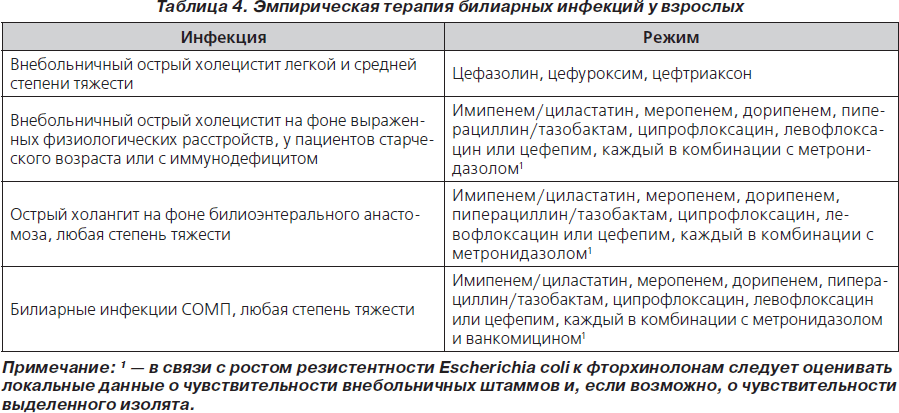
Холецистит и холангит у взрослых
60. Ультрасонография — первое визуализирующее исследование, которое должно быть сделано при подозрении на острый холецистит или холангит (А-І).
61. Пациенты с предполагаемой инфекцией и либо с острым холециститом, либо с холангитом должны получать антимикробную терапию, как представлено в табл. 4, хотя при наличии билиоэнтерального анастомоза антианаэробная терапия не показана (В-ІІ).
62. После холецистэктомии вследствие острого холецистита антимикробная терапия должна быть прекращена через 24 ч, если нет явлений инфицирования за пределами стенок желчного пузыря (В-ІІ).
63. При внебольничной билиарной инфекции не требуется, чтобы антибиотики были активными в отношении энтерококков, так как патогенность энтерококков не доказана. У отдельных пациентов с иммуносупрессивными состояниями, особенно после трансплантации печени, энтерококковая инфекция может быть значимой и потребовать лечения (В-ІІI).
Инфекции в педиатрии
64. Рутинное использование препаратов широкого спектра не показано всем детям с лихорадкой и абдоминальной болью, у которых низкая вероятность осложненного аппендицита или другой ИАИ (В-ІІI).
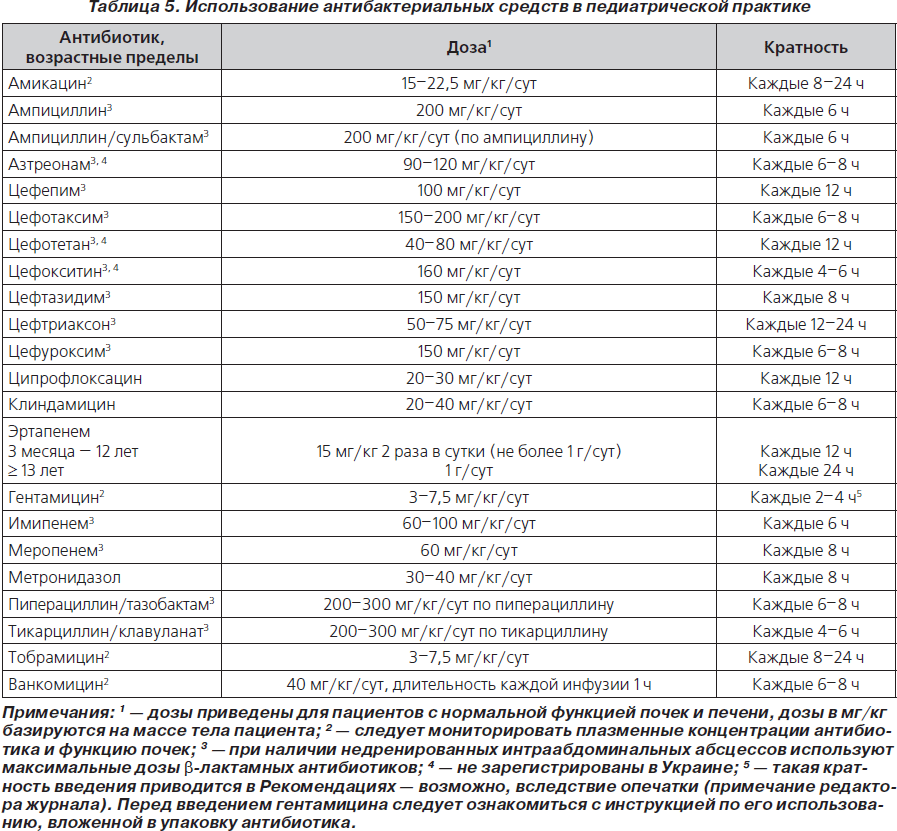
65. Выбор конкретного антимикробного препарата для детей с осложненной ИАИ должен основываться на учете происхождения инфекции (внебольничная или инфекция СОМП), тяжести заболевания, безопасности антимикробных препаратов у больных разных возрастных групп (А-ІІ).
66. Для лечения детей с осложненными ИАИ могут использоваться следующие схемы антимикробной терапии широкого спектра действия: режим, базирующийся на применении аминогликозидов, карбапенемов (имипенем, меропенем, эртапенем), b-лактама вместе с ингибитором b-лактамаз (пиперациллин/тазобактам, тикарциллин/клавуланат) либо цефалоспорина (цефотаксим, цефтриаксон, цефтазидим, цефепим) с метронидазолом (табл. 2, 5) (В-ІІ).
67. При наличии выраженных аллергических реакций на b-лактамные антибиотики рекомендуются ципрофлоксацин в комбинации с метронидазолом или режим терапии, основанный на аминогликозидах (В-ІІI).
68. Некротизирующий энтероколит у новорожденных требует проведения инфузионной терапии, назначения антибиотиков широкого спектра действия внутривенно (с возможным включением антифунгальных препаратов), кишечной декомпрессии. При наличии явлений перфорации кишечника следует предпринять неотложное или срочное оперативное вмешательство — лапаротомию или чрескожное дренирование. Интраоперативно следует произвести забор материала для окраски по Граму и культурального исследования (В-ІІI).
69. У новорожденных с некротизирующим колитом могут оказаться полезными следующие антибиотики широкого спектра: ампициллин, гентамицин и метронидазол; ампициллин, цефотаксим и метронидазол; меропенем. Ванкомицин можно использовать вместо ампициллина при подозрении на инфекцию MRSA или энтерококками, резистентными к ампициллину. Если результаты окраски по Граму либо культурального исследования образцов, полученных во время операции, указывают на наличие грибковой инфекции, следует назначить флуконазол или амфотерицин B (B-II).
Фармакокинетические аспекты
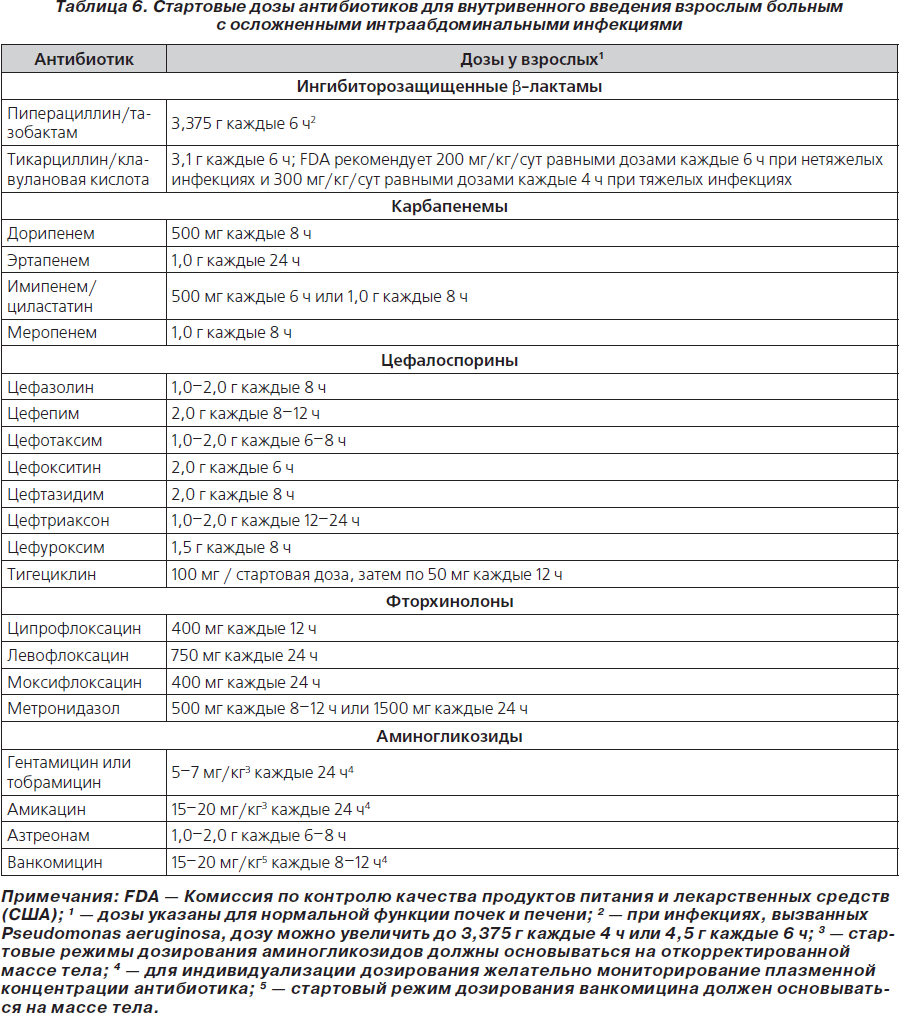
70. При эмпирической терапии пациентов с осложненными ИАИ антибиотики используются в оптимальных дозах, чтобы обеспечить максимальную эффективность и минимальную токсичность и снизить антимикробную резистентность (табл. 5, 6) (В-ІІ).
71. Индивидуальное дозирование аминогликозидов с учетом мышечной массы и объема внеклеточной жидкости предпочтительно у пациентов с ИАИ, получающих эти препараты (В-ІІI).
Использование результатов микробиологических исследований для выбора антимикробной терапии
72. Пациенты с внебольничной ИАИ группы низкого риска не требуют изменений в терапии, если в результате хирургического вмешательства и первоначальной терапии достигнут удовлетворительный клинический эффект, даже если в последующем при микробиологическом исследовании выделены неожиданные или нелеченные патогены (В-ІІI).
73. Если резистентная бактерия выделена на начальном этапе вмешательства и сохраняются признаки персистирующей инфекции, больным с нетяжелым заболеванием рекомендуется терапия, направленная на возбудителя (В-ІІI).
74. Результаты культурального исследования и определения чувствительности к антибиотикам для выбора антимикробной терапии у пациентов с тяжелой внебольничной инфекцией или ИАИ СОМП трактуют с учетом патогенности и концентрации выделенных микроорганизмов (В-ІІI).
75. Микроорганизмы, высеянные из крови, рассматриваются как значимые, если располагают ранее установленным патогенным потенциалом или выделены из і 2 образцов крови (A-I), либо содержатся в умеренных или значительных количествах в образцах материала, полученных путем дренирования (B-II).
Продолжительность терапии осложненных интраабдоминальных инфекций у взрослых
76. Антимикробная терапия документированной инфекции ограничивается 4–7 сутками, за исключением случаев, когда затруднительно достичь адекватного контроля над очагом инфекции. Более продолжительная терапия не ассоциируется с улучшением исходов (В-ІІI).
77. При перфорациях желудка и проксимальной части тощей кишки, если контроль над очагом инфекции достигнут в течение 24 ч и при этом не проводится кислотоснижающая терапия и нет малигнизации, профилактическая антимикробная терапия в течение 24 часов, направленная на аэробных грамположительных кокков, вполне адекватна (В-ІІ).
78. В случаях задержки операции по поводу перфорации желудка и проксимальной части тощей кишки, малигнизации желудка или кислотоснижающей терапии антимикробная терапия должна быть направлена на смешанную флору (как, например, при осложненных инфекциях ободочной кишки) (В-ІІI).
79. Повреждения кишечника, обусловленные пенетрацией, тупой или ятрогенной травмой, которые были устранены в течение 12 часов вместе с любой другой интраоперационной контаминацией операционного поля кишечным содержимым, должны лечиться антибиотиками Ј 24 часов (А-І).
80. Больные с острым аппендицитом без явлений перфорации, абсцесса или локального перитонита нуждаются только в профилактическом применении антибиотиков с узким спектром, активных в отношении аэробов и факультативных и облигатных анаэробов; лечение следует прекратить через 24 часа (А-І).
81. Профилактическое назначение антибиотиков пациентам с тяжелым некротизирующим панкреатитом до верификации инфекции не рекомендуется (А-І).
Использование пероральной или внутривенной антимикробной терапии в амбулаторных условиях
82. У взрослых и детей, у которых отсутствуют признаки и симптомы инфекции, продолжение антибактериальной терапии не требуется (В-ІІI).
83. У взрослых на этапе выздоровления после ИАИ допускается завершение антимикробного курса таблетированными формами моксифлоксацина, ципрофлоксацина с метронидазолом, левофлоксацина с метронидазолом, таблетированного цефалоспорина с метронидазолом либо амоксициллин/клавуланатом (В-ІІ) при условии, что пациент в состоянии принимать пищу внутрь, а также у больных, у которых при определении чувствительности к антибиотикам не были выявлены резистентные микроорганизмы.
84. Если возбудитель чувствителен только к внутривенным препаратам, такая терапия может назначаться на амбулаторном этапе (В-ІІI).
85. У детей возможно назначение антибиотиков парентерально на амбулаторном этапе, когда не требуется последующее дренирование, однако сохраняются симптомы интраабдоминального воспаления на фоне снижения температуры, контроля над болью, способности принимать жидкости внутрь и возможности передвигаться (В-ІІ).
86. Для проведения ступенчатой терапии у детей во время дренирования источника ИАИ рекомендуется проведение культурального исследования интраабдоминального образца с целью обоснования выбора препаратов для приема внутрь с наиболее узким спектром, с наилучшими переносимостью и безопасностью. Могут использоваться цефалоспорины второго или третьего поколения в комбинации с метронидазолом или амоксициллин/клавуланат — при чувствительности к ним выделенных возбудителей. Фторхинолоны ципрофлоксацин или левофлоксацин могут использоваться для лечения инфекций, вызванных чувствительными к ним Pseudomonas spp., Enterobacter spp., Serratia spp., Citrobacter spp. (В-ІІI). При назначении ципрофлоксацина или левофлоксацина к ним добавляется метронидазол.
87. Если доступны результаты определения чувствительности к антибиотикам выделенных грамотрицательных аэробных и факультативных микроорганизмов, их следует использовать для выбора антибиотиков у детей и взрослых (В-ІІI).
88. Многие пациенты, которым не проводилось хирургическое вмешательство, могут лечиться в амбулаторных условиях. В таких случаях можно также использовать режимы антибактериальной терапии для приема внутрь (см. Рекомендации 83 и 86) — либо с самого начала, либо в качестве ступенчатой терапии, следующей за внутривенной антимикробной терапией (В-ІІI).
Предполагаемая неудача лечения
89. У пациентов с персистирующими или рецидивирующими клиническими проявлениями ИАИ после 4–7 дней терапии следует провести соответствующие диагностические исследования. Они должны включать КТ или ультразвуковое исследование. Следует продолжать антимикробную терапию, активную в отношении ранее выделенных возбудителей (А-ІІI).
90. Следует исключить экстраабдоминальные источники инфекции и неинфекционные воспалительные состояния, если отсутствует удовлетворительный клинический ответ на микробиологически адекватную эмпирическую антимикробную терапию (А-ІІ).
91. У больных с сохраняющимся очагом инфекции, не ответивших на начальную терапию, следует провести культуральное исследование 1 образца на предмет выявления аэробных и анаэробных микроорганизмов, при условии, что он достаточного объема (не менее 1,0 мл жидкости или ткани) и доставлен в лабораторию в анаэробной транспортной среде (С-ІІI). Инокуляция 1–10 мл жидкости непосредственно в емкость с бульоном для выращивания анаэробных гемокультур может повысить результативность исследования.
Диагностика и лечение пациентов с подозрением на острый аппендицит
92. В каждой больнице должны быть созданы клинические стандарты диагностики, внутригоспитального лечения, выписки и амбулаторного лечения (В-ІІ).
93. Стандарты должны разрабатываться на основе сотрудничества клиницистов, участвующих в лечении этих пациентов, включая хирургов, инфекционистов, семейных врачей, врачей приемного отделения, рентгенологов, медицинских сестер, фармацевтов, и отражать местные ресурсы и стандарты оказания медицинской помощи (В-ІІ).
94. Хотя нет бесспорных клинических данных для идентификации пациентов с аппендицитом, совокупность признаков, включая характерную боль в животе, локальную абдоминальную болезненность, лабораторные данные, характерные для острого воспалительного процесса, обычно позволяют диагностировать аппендицит (А-ІІ).
95. При подозрении на аппендицит рекомендуется спиральная КТ органов брюшной полости и малого таза с внутривенным, но не ректальным или пероральным, введением контраста (В-ІІ).
96. Диагностическую визуализацию следует произвести у всех женщин. У женщин детородного возраста до диагностической визуализации выполняется тест на беременность. Если пациентка находится в первом триместре беременности, вместо КТ следует произвести ультразвуковое исследование или магнитно-резонансную томографию (В-ІІ). Если эти исследования не позволяют диагностировать имеющуюся патологию, можно прибегнуть к лапароскопии или ограниченному КТ-исследованию (В-ІІІ).
97. Визуализацию следует выполнить у всех детей, особенно в возрасте до 3 лет, в случае сомнений в диагнозе аппендицита. Предпочтительнее КТ, хотя, чтобы избежать использования у детей ионизирующего излучения, ультразвуковое исследование является разумной альтернативой (В-ІІI).
98. Если диагноз аппендицита не подтверждается с помощью визуализирующих методов исследования, рекомендуется наблюдение в течение 24 часов до исчезновения симптомов — из-за возможного риска ложноотрицательных результатов (В-ІІI).
99. За пациентами с подозрением на аппендицит, когда диагноз нельзя ни подтвердить, ни исключить с помощью диагностических исследований, рекомендуется пристальное наблюдение (А-ІІI).
100. При высокой вероятности заболевания пациенты могут госпитализироваться (А-ІІI).
101. Антимикробная терапия назначается всем больным с диагнозом аппендицита (А-ІІ).
102. Адекватными антибиотиками являются препараты, активные в отношении факультативных и аэробных грамотрицательных микроорганизмов и анаэробов, как представлено в табл. 4, для лечения пациентов с внебольничными ИАИ (А-І).
103. У больных с подозрением на аппендицит, у которых результаты диагностических исследований сомнительные, антимикробная терапия назначается вместе с анальгетиками и, при необходимости, с антипиретиками. Взрослым антибиотики назначаются минимум на 3 дня — до исчезновения клинических симптомов и признаков инфекции либо постановки окончательного диагноза (В-ІІI).
104. При остром аппендиците без перфорации оперативное вмешательство следует произвести как можно быстрее. Операция может быть отложена на короткое время, если такая тактика принята в лечебном учреждении (В-ІІ).
105. Приемлемыми являются и лапароскопия, и открытая аппендэктомия, использование того или иного подхода зависит от опыта хирурга (А-І).
106. У отдельных больных с острым неперфоративным аппендицитом допускается неоперативное лечение, если состояние пациента значительно улучшилось до операции (В-ІІ).
107. У мужчин допускается неоперативное лечение, при условии, что пациент госпитализирован до 48 часов и у него отмечается выраженное улучшение клинической симптоматики в течение 24 ч на фоне антимикробной терапии (А-ІІ).
108. Пациенты с перфоративным аппендицитом нуждаются в неотложном хирургическом вмешательстве для обеспечения адекватного контроля над очагом инфекции (В-ІІI).
109. Пациентам со сформировавшимся периаппендикулярным абсцессом проводят чрескожное дренирование или, при необходимости, оперативный дренаж. Аппендэктомию у таких больных обычно откладывают (А-ІІ).
110. У отдельных больных, поступивших спустя несколько дней после возникновения воспалительного заболевания и у которых диагностирована периаппендикулярная флегмона или небольшой абсцесс, не подлежащий чрескожному дренированию, можно отложить или не производить хирургическое вмешательство, чтобы предотвратить возможно более обширную операцию, чем простая аппендэктомия. Таким больным назначают антимикробную терапию и организуют тщательное наблюдение за ними в условиях стационара — по аналогии с пациентами с острым дивертикулитом (В-ІІ).
111. Целесообразность отсроченной аппендэктомии после чрескожного дренирования или неоперативного лечения перфоративного аппендицита точно не установлена, а ее выполнение может быть излишним (А-ІІ).
Введение
Осложненные ИАИ распространяются за пределы полого органа в брюшную полость и ассоциируются с формированием абсцесса или перитонитом. В данных Рекомендациях не рассматривается лечение первичного энтероколита и/или колита без перфорации или с перфорацией в результате заболеваний, которые в Северной Америке встречаются редко. Этот термин не претендует на характеристику анатомии или тяжести инфекции. Под неосложненной инфекцией понимают внутристеночное воспаление органов желудочно-кишечного тракта, которое при отсутствии адекватного лечения с большой вероятностью прогрессирует в осложненную инфекцию.
Осложненные ИАИ встречаются часто. Одним только аппендицитом в США ежегодно заболевает порядка 300 000 человек, а количество дней пребывания в стационаре превышает 1 миллион. ИАИ является второй по значимости причиной смертности от инфекций в отделениях интенсивной терапии.
Лечение этих инфекций претерпело значительные изменения благодаря достижениям в интенсивной терапии, диагностических возможностях, антимикробной терапии, внедрению минимальных инвазивных вмешательств. Эти изменения нашли отражение в новой версии Рекомендаций. Учитывая распространенность острого аппендицита, информацию, содержащуюся в этом документе, можно использовать для создания локальных рекомендаций по лечению детей и взрослых с подозрением на острый аппендицит.
I. Каковы адекватные действия при первоначальной оценке больных с подозрением на ИАИ?
1. Рутинный сбор анамнеза, физикальное обследование и лабораторные исследования позволяют идентифицировать большинство пациентов с подозрением на ИАИ (А-II).
2. У некоторых больных с неоднозначными данными, выявленными при осмотре (таких, как пациенты со спутанным сознанием, травмами спинного мозга или с ослабленным иммунитетом в результате заболевания или лечения), следует подозревать ИАИ, если у них имеются признаки инфекции из неизвестного источника (B-ІІI).
3. У больных с явными признаками разлитого перитонита и при необходимости немедленного хирургического вмешательства не следует продолжать диагностические исследования (B-III).
4. У взрослых пациентов, которым не производится экстренная лапаротомия, визуализирующим методом выбора для выявления ИАИ и ее источника является компьютерная томография (КТ) (А-II).
Краткое изложение доказательств
Пациенты с ИАИ обычно предъявляют жалобы на внезапно начавшуюся боль в животе и симптомы желудочно-кишечной дисфункции (потеря аппетита, тошнота, рвота, вздутие живота и/или запор) на фоне признаков воспаления (боль, болезненность, лихорадка, тахикардия и/или учащенное дыхание) либо без таковых. Зачастую при тщательном сборе анамнеза и объективном обследовании можно ограничить перечень заболеваний, с которыми предстоит провести дифференциальный диагноз, и оценить выраженность физиологических нарушений у больного. Полученные данные позволяют быстро принимать решения о необходимости и интенсивности реанимационных мер, восполнении дефицита жидкости, проведении диагностических процедур, необходимости и времени начала антимикробной терапии, сроках хирургического вмешательства (операции или чрескожного вмешательства). Следует помнить, что у лиц старческого возраста, пациентов, принимающих кортикостероиды или другие препараты, подавляющие иммунитет, симптомы и признаки сепсиса могут быть минимальными.
Значимость ряда жалоб, симптомов, физикальных данных в диагностике ИАИ наиболее полно изучена в отношении острого аппендицита. Главный вывод заключается в том, что никакие диагностические критерии у детей и взрослых не обладают большей чувствительностью и специфичностью, чем суждение врача.
В целом из визуализирующих методов предпочтение следует отдавать КТ, лучше — спиральному сканированию. В недавнем метаанализе показано, что чувствительность и специфичность ультразвукового метода в постановке диагноза аппендицита у детей составляла соответственно 88 и 94 %, КТ — 94 и 95 %. Чувствительность и специфичность ультразвукового исследования для постановки диагноза у взрослых составляла соответственно 83 и 93 %, КТ — 94 и 94 %. Подобные исследования при других интраабдоминальных процессах не проводились.
II. Когда следует начинать инфузионную терапию для лечения больных с подозрением на ИАИ?
5. У больных следует быстро восстановить внутрисосудистый объем и принять дополнительные меры для стабилизации физиологического баланса (A-II).
6. У больных с септическим шоком интенсивная терапия должна начинаться немедленно, как только выявлена гипотензия (А-II).
7. У больных без признаков уменьшения объема циркулирующей крови внутривенную инфузионную терапию следует начинать при первом подозрении на диагноз ИАИ (B-III).
Краткое изложение доказательств
Дефицит жидкости характерен для лихорадящих больных и усугубляется при неадекватном его возмещении из-за тошноты и/или рвоты и при наличии кишечной непроходимости, индуцированной внутрибрюшным воспалением. Существенные количества жидкости теряются при одышке.
У пациентов с перфоративным или абсцедирующим аппендицитом восполнение жидкости улучшает исходы даже в отсутствие септического шока. У больных с септическим шоком или полиорганной недостаточностью возмещение жидкости должно быть более агрессивным. Авторы документа предлагают следовать рекомендациям Surviving Sepsis Campaign по лечению септического шока.
III. Когда следует начинать антимикробную терапию у больных с диагностированной или предполагаемой ИАИ?
8. Антимикробная терапия должна начинаться при подозрении на ИАИ или постановке соответствующего диагноза. Пациентам с септическим шоком антибиотики необходимо назначить как можно быстрее (А-III).
9. Больным без явлений септического шока антимикробную терапию следует начинать в приемном покое (В-III).
10. Достаточная концентрация антимикробных препаратов должна поддерживаться во время хирургического вмешательства, что может потребовать дополнительного введения антимикробных препаратов до начала процедуры (А-I).
Краткое изложение доказательств
Промедление с началом антимикробной терапии ассоциируется с худшими исходами у пациентов с септическим шоком, включая больных с ИАИ. Впрочем, данные об исходах при ИАИ получены в исследовании недостаточно высокого качества. В руководстве по лечению сепсиса начинать вводить антибиотики рекомендуется в течение 1 часа после постановки диагноза септического шока. У пациентов без гемодинамических или органных нарушений начинать применение антибактериальных препаратов необходимо в первые 8 часов.
У больных, которым производится хирургическое вмешательство, антибиотики применяют для профилактики раневой инфекции и подавления возбудителей, способных к диссеминации во время вмешательства, в дополнение к уже проводимой терапии по поводу инфекции. Антимикробная терапия, следовательно, рассматривается и как средство профилактики раневой инфекции у всех больных, которым производится вмешательство. С профилактической целью используют препараты, активные в отношении контаминирующих микроорганизмов, и вводят их в течение 1 часа до начала операции.
IV. Какие мероприятия необходимо проводить для достижения адекватного контроля над очагом инфекции?
14. У гемодинамически стабильных больных без признаков острой органной недостаточности следует предпринять неотложное хирургическое вмешательство. Вмешательство можно отложить на срок до 24 ч при условии, что назначена адекватная антимикробная терапия и организовано тщательное клиническое наблюдение за больным (B-II).
16. Небольшую группу пациентов с минимальными физиологическими отклонениями и четко отграниченным очагом инфекции (например, периаппендикулярная или периколоническая флегмона) можно лечить только антимикробными средствами, не прибегая к хирургическому вмешательству, при условии тщательного клинического наблюдения за больным (B-II).
Краткое резюме
Под контролем над очагом инфекции понимают любое вмешательство или несколько вмешательств, которые приводят к ликвидации очага инфекции, контролю факторов, способствующих распространению инфекции, коррекции и контролю анатомических нарушений для восстановления нормальных физиологических функций.
Острый перитонит лучше лечится хирургическим путем, чем с помощью чрескожного дренирования. Принципиальное значение имеет время начала вмешательства, особенно при наличии диффузного перитонита. У больных с диффузным перитонитом рекомендуется неотложное хирургическое вмешательство.
V. Когда и как получают образцы и проводят микробиологические исследования?
17. У пациентов с внебольничной ИАИ посев крови не дает дополнительной клинически значимой информации, поэтому нет оснований для его рутинного выполнения (В-ІІI).
18. Если у пациента имеются признаки интоксикации или иммуносупрессии, выявление бактериемии может помочь в определении продолжительности антимикробной терапии (В-ІІI).
19. У больных с внебольничными инфекциями целесообразность окраски инфицированного материала по Граму не доказана (С-ІІI).
20. При инфекциях СОМП окраска по Граму может помочь в выявлении грибов (С-ІІI).
21. Рутинное культуральное исследование на наличие аэробов и анаэробов у больных с внебольничной инфекцией из группы низкого риска проводить не обязательно, однако оно может помочь в выявлении эпидемиологических изменений в резистентности возбудителей, ассоциированных с внебольничной ИАИ, и для обоснования последующей пероральной терапии (В-ІІ).
22. При значительной резистентности (порядка 10–20 % изолятов) распространенных возбудителей (например, E.coli) к режиму антимикробной терапии, традиционно используемому в данном лечебном учреждении, рутинное культуральное исследование и определение чувствительности к антибиотикам должны проводиться у больных с перфоративными аппендицитами и другими внебольничными ИАИ (В-ІІI).
23. Нет необходимости в идентификации анаэробов у пациентов с внебольничными ИАИ, если эмпирическая антимикробная терапия активна в отношении распространенных анаэробных патогенов (В-ІІI).
24. У больных группы высокого риска следует получить образец материала из очага инфекции для микробиологического исследования, особенно у лиц, ранее получавших антибиотики, поскольку у таких пациентов большая вероятность того, что в этиологии заболевания играют роль резистентные возбудители (А-ІІ).
25. Образец, взятый из очага интраабдоминальной инфекции, должен быть репрезентативным (В-ІІI).
26. Для культурального исследования направляется один образец, при условии, что он достаточного объема (по крайней мере 1 мл жидкости или ткани, желательно больше), и доставляется в лабораторию в соответствующей транспортной системе. Для оптимального обнаружения аэробных бактерий 1–10 мл жидкости инокулируют непосредственно во флакон с соответствующей средой. Помимо этого, 0,5 мл жидкости следует отправить в лабораторию для окраски по Граму и, по показаниям, для выявления грибов. Если необходимо выделить культуры анаэробов, в лабораторию следует направлять не менее 0,5 мл жидкости или 0,5 г ткани в анаэробной транспортной тубе. Как альтернатива, для обнаружения анаэробных бактерий 1–10 мл жидкости можно инокулировать прямо в пробирку со средой для анаэробной гемокультуры (А-І).
27. Следует определять антибиотикочувствительность Pseudomonas spp., Proteus spp., Acinetobacter spp., Staphylococcus aureus, большинства Enterobacteriaceae, поскольку у них по сравнению с другими микроорганизмами чаще встречается резистентность (А-ІІI).
Краткое изложение доказательств
Посев крови редко добавляет значимую информацию для диагностики ИАИ, даже в случаях инфекции СОМП и осложненной инфекции. Частота бактериемии, когда в крови обнаруживают того же возбудителя, что и в очаге инфекции в брюшной полости, колеблется от 0 % при открытых операциях до 5 % при чрескожном дренировании. Бактериемия чаще выявляется в отделениях интенсивной терапии и ассоциируется с повышением смертности.
Микроорганизмы, которые выделяют при бактериемии, вызванной внебольничными осложненными ИАИ, редко приводят к формированию эндокардита на неизмененных клапанах или развитию метастатических абсцессов. Те же бактерии, которые могут вызвать подобные повреждения, — S.aureus, Candida spp., Streptococcus milleri — настолько редко выделяются до начала терапии ИАИ, что посев крови у этих пациентов не рекомендуется.
У больных с внебольничной осложненной ИАИ мало данных о том, что окрашивание по Граму, культуральное исследование материала из очага инфекции и определение чувствительности к антибиотикам может изменить исход заболевания. У пациентов с перфоративным или гангренозным аппендицитом многие хирурги не производят забор материала для определения возбудителя. Антимикробная терапия у больных с инфекцией СОМП, которая не охватывала возможные патогены, ассоциировалась с повышенной частотой клинических неудач и смертности. Поэтому окраска по Граму может быть ценной для обнаружения грамположительных кокков или грибов и дополнительного эмпирического применения антибиотиков еще до получения окончательных результатов культурального исследования.
Данные о локальной чувствительности S.aureus и энтерококков могут побудить к добавлению препарата, активного в отношении MRSA, до получения результатов культурального исследования и чувствительности к антибиотикам. Следует мониторировать локальную чувствительность энтерококков к пенициллину и ванкомицину. Если при окраске по Граму выявлены грибы, может потребоваться дополнительная терапия, направленная на Сandida spp.
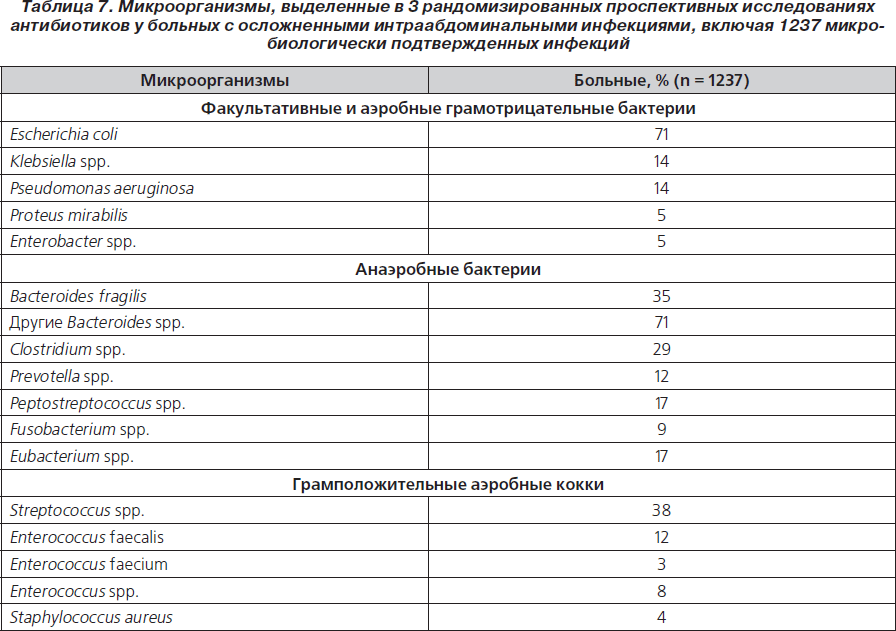
Основными возбудителями внебольничных ИАИ являются кишечная флора (представители семейства Enterobacteriaceae, в особенности E.coli) и анаэробы (особенно B.fragilis) (табл. 7). Концентрация патогенов почти всегда ≥ 1 ∙ 105 микроорганизмов в 1 г ткани или 1 ∙ 105 микроорганизмов в 1 мл экссудата. Это соответствует умеренному или значительному росту колоний бактерий на питательных средах. Поэтому в фокусе внимания должны быть преобладающие в выделенных культурах микроорганизмы.
В этиологии большинства ИАИ играют роль и анаэробные бактерии. Основной патоген — B.fragilis — демонстрирует стойкую чувствительность к метронидазолу, карбапенемам, некоторым ингибиторозащищенным b-лактамам. Результаты исследований активности хинолонов в отношении B.fragilis противоречивы, отчасти потому, что изучались микроорганизмы, выделенные из абдоминальных абсцессов, а не гемокультуры. Показаниями к определению чувствительности анаэробов могут быть стойкое их выделение, бактериемия, потребность в длительном лечении вследствие иммуносупрессии или инфекций протезов. По запросу врачей лаборатории могут выделять чистые культуры анаэробов и хранить их для дополнительного тестирования.
Во многих регионах отмечается возрастание резистентности внебольничных штаммов грамотрицательных организмов к некоторым антибиотикам. Например, повсеместное распространение штаммов E.coli, резистентных к ампициллин/сульбактаму, высокая частота резистентности к фторхинолонам штаммов E.coli в Латинской Америке и Восточной Азии и др. В некоторых популяциях и местностях сравнительно высокое распространение полирезистентных неферментирующих грамотрицательных микроорганизмов, таких как Pseudomonas aeruginosa, влияет на выбор адекватной эмпирической антибактериальной терапии. Рутинные микробиологические исследования у больных с внебольничными ИАИ могут содействовать отслеживанию местных изменений резистентности и, соответственно, оптимальному выбору антимикробных средств для этиотропого лечения и для ступенчатой терапии. Существуют заметные различия в профилях чувствительности внутри и между различными регионами и лечебными учреждениями. Ценность эпидемиологических данных при выборе адекватной антимикробной терапии у больных с ИАИ не вызывает сомнений. Неадекватная антимикробная терапия у таких пациентов ассоциируется с высокой частотой клинических неудач и в ряде случаев — с увеличением смертности.
В некоторых сообществах и возрастных группах зарегистрирована необъяснимо высокая частота выделения P.аeruginosa при внебольничном аппендиците. Даже при эмпирическом использовании препаратов более широкого спектра действия знание возбудителя может позволить клиницисту значительно сузить спектр терапии при продолжительном целенаправленном лечении.
VI. Какие антимикробные режимы назначают пациентам с внебольничными интраабдоминальными инфекциями?
28. Антибиотики, используемые для эмпирической терапии внебольничной ИАИ, должны быть активными в отношении кишечной флоры: грамотрицательных аэробных и факультативных палочек, кишечных грамположительных стрептококков (А-І).
29. При инфекциях, исходящих из дистальной части тонкого кишечника, червеобразного отростка, ободочной кишки и при более проксимальной перфорации желудочно-кишечного тракта, когда имеет место обструкция или паралитическая кишечная непроходимость, следует применять антибиотики, активные в отношении анаэробных палочек (А-І).
30. У взрослых пациентов с нетяжелой внебольничной инфекцией предпочтительнее использовать тикарциллин/клавуланат, цефокситин, эртапенем, моксифлоксацин, тигециклин в качестве монотерапии либо комбинацию метронидазола с цефазолином, цефуроксимом, цефтриаксоном, левофлоксацином, ципрофлоксацином, нежели схемы с антибиотиками, активными в отношении Pseudomonas spp. (табл. 2) (А-І).
31. Не рекомендуется использовать ампициллин/сульбактам из-за высокой частоты резистентности к нему внебольничных штаммов E.coli (В-ІІ).
32. Не рекомендуется использовать цефотетан и клиндамицин из-за возрастающей резистентности к ним среди микроорганизмов группы Bacteroides fragilis (В-ІІ).
33. У взрослых больных с внебольничными ИАИ не рекомендуется рутинное использование аминогликозидов, поскольку доступны менее токсичные и как минимум столь же эффективные антибиотики (В-ІІ).
34. У пациентов с внебольничными ИАИ не требуется, чтобы эмпирическая терапия была активной в отношении энтерококков (А-І).
35. У взрослых и детей с внебольничными ИАИ не рекомендуется эмпирическая антифунгальная терапия против Candida spp. (В-ІІ).
36. Применение препаратов, предназначенных для лечения тяжелых внебольничных инфекций или инфекций СОМП, не рекомендуется у больных с нетяжелыми внебольничными инфекциями из-за большего риска токсичности и колонизации более резистентными микроорганизмами (В-ІІ).
37. Пациентам с нетяжелыми ИАИ, включая острый дивертикулит и различные формы аппендицита, у которых не производится хирургическое вмешательство, рекомендуются вышеперечисленные режимы терапии нетяжелых инфекций; допускается раннее назначение антибиотиков внутрь (В-ІІI).
Краткое изложение доказательств
Инфекции, исходящие из желудка, двенадцатиперстной кишки, желчевыводящих путей, проксимальной части тонкого кишечника, вызываются грампозитивными и грамнегативными аэробными и факультативными микроорганизмами. Инфекции из перфорированных дистальных участков тонкого кишечника вызываются грамнегативными факультативными и аэробными микроорганизмами с различными концентрациями возбудителей. В результате таких перфораций часто формируются локализованные абсцессы; перитонит развивается только после разрыва абсцесса. Часто обнаруживают анаэробов, как, например, B.fragilis. ИАИ вследствие повреждения толстого кишечника вызываются факультативными или облигатными анаэробными микроорганизмами. Также обычно выделяются стрептококки, в особенности S.millery, и энтерококки. Среди грамотрицательных факультативных микроорганизмов чаще всего обнаруживают E.coli.
Ранее неоднократно документировались эффективность и меньшая стоимость генерических антибиотиков. Тикарциллин/клавуланат, цефокситин, моксифлоксацин, эртапенем, тигециклин могут использоваться в качестве монотерапии. С учетом очень широкого спектра действия тигециклина, который включает в себя MRSA и широкий ряд других грампозитивных и грамнегативных микроорганизмов, которые не часто обнаруживаются при инфекциях, исходящих из аппендикса, высказываются сомнения в целесообразности его использования для лечения осложненных ИАИ легкой и средней степени тяжести. Авторы рекомендаций подчеркнули также обеспокоенность тем, что широкое использование эртапенема может ускорить появление карбапенеморезистентных штаммов Enterobacteriacae, Pseudomonas spp., Acinetobacter spp. В связи с распространением в некоторых регионах хинолонорезистентных E.coli не следует использовать хинолоны, если чувствительность к ним E.coli, согласно данным локального мониторинга, не превышает 90 %.
Распространение внебольничных штаммов микроорганизмов, резистентных к обычно используемым антибиотикам, становится реальностью. Следует избегать применения таких препаратов, если резистентность к данному антибиотику среди типичных возбудителей ИАИ в конкретном регионе достигает 10–20 % и более. В связи с широким распространением резистентности E.coli к ампициллин/сульбактаму этот антибиотик более не рекомендуется использовать для рутинного эмпирического лечения осложненных ИАИ.
Обеспокоенность вызывает также возрастание резистентности к антибиотикам среди штаммов B.fragilis. Получены данные, указывающие на более высокую частоту клинических неудач, если для лечения инфекций, вызванных этими микроорганизмами, используют неактивные препараты. Поскольку в рандомизированных клинических исследованиях (РКИ) не выявлено различий в исходах вмешательств, выбор антимикробных препаратов должен основываться на локальных микробиологических данных, стоимости антибиотиков, аллергологическом анамнезе, наличии тех или иных препаратов в локальных формулярах. Следует избегать использования моксифлоксацина для лечения пациентов с ИАИ, вызванными B.fragilis, если больной получал хинолоны в течение предшествующих 3 месяцев, — в связи с повышенным риском того, что нынешнее заболевание вызвано хинолонорезистентными штаммами.
В клинических исследованиях показана эффективность ряда антибиотиков с расширенным спектром активности в отношении грамотрицательных бактерий. Однако эти препараты не имеют преимуществ при лечении больных с внебольничными инфекциями, а их необоснованное использование может способствовать развитию резистентности. С другой стороны, лечебные учреждения должны отслеживать локальные микробиологические данные, так как может потребоваться применение антимикробного режима с более широким спектром действия.
В многочисленных проспективных слепых и рандомизированных исследованиях по лечению внебольничных инфекций сравнивали режимы, активные в отношении рутинных изолятов Enterococcus spp. По крайней мере в 6 из этих исследований один из сравниваемых режимов не действовал на энтерококков. Ни в одном из этих исследований превосходство режима лечения, активного в отношении энтерококков, продемонстрировано не было.
Больные с ИАИ, включая острый дивертикулит и некоторые формы аппендицита, могут лечиться без оперативного вмешательства. Результаты микробиологических исследований у пациентов, леченных неоперативно, аналогичны таковым у лиц, которым были произведены оперативные вмешательства. Поэтому для лечения таких пациентов рекомендуются те же антибиотики, что и для лечения осложненных ИАИ.
VII. Какие режимы антимикробной терапии следует использовать у больных с тяжелыми внебольничными интраабдоминальными инфекциями?
38. Пациентам с тяжелыми внебольничными ИАИ (> 15 баллов по шкале APACHE-II или с другими факторами) эмпирически назначаются антимикробные препараты широкого спектра действия, активные в отношении грамотрицательных микроорганизмов, в том числе меропенем, имипенем/циластатин, дорипенем, пиперациллин/тазобактам, ципрофлоксацин или левофлоксацин в комбинации с метронидазолом, либо цефтазидим или цефепим с метронидазолом (табл. 2) (А-І).
39. Во многих регионах получили распространение E.coli, резистентные к хинолонам, поэтому хинолоны не должны применяться, если, по данным локальных лабораторий, чувствительность к ним среди E.coli < 90 % (А-ІІ).
40. В качестве альтернативы можно использовать азтреонам в сочетании с метронидазолом, однако рекомендуется добавление препарата, активного в отношении грамположительных кокков (В-ІІI).
41. У взрослых не рекомендуется рутинное использование аминогликозида или другого второго препарата, активного в отношении грамотрицательных факультативных или аэробных палочек, если нет доказательств наличия у пациента резистентных микроорганизмов, требующих такой терапии (А-ІІ).
42. Рекомендуется эмпирическое назначение препаратов, активных в отношении энтерококков (В-ІІ).
43. Не рекомендуется назначение препаратов, активных в отношении MRSA или грибов, если нет доказательств, что инфекция вызвана именно этими возбудителями (В-ІІI).
44. У больных группы высокого риска антимикробная терапия корректируется в соответствии с результатами микробиологического исследования и определения чувствительности к антибиотикам, чтобы гарантировать активность в отношении преобладающих в культуре изолятов (А-ІІI).
Краткое изложение доказательств
Неоднократно предпринимались попытки идентифицировать клинические признаки, которые повышают риск неблагоприятных исходов у пациентов с осложненными ИАИ. В этих исследованиях установлены параметры, являющиеся предикторами смертности, но не риска рецидивирования инфекции. К ним относятся большое число баллов по шкале APACHE-II, пониженное питание, тяжелое сердечно-сосудистое заболевание, невозможность достижения адекватного контроля над очагом инфекции. К группе высокого риска неблагоприятного исхода относятся также пациенты с иммуносупрессией вследствие медикаментозного лечения опухолей, воспалительных заболеваний и после трансплантации органов. Важными предикторами клинических неудач вследствие рецидивирующих инфекций являются длительное пребывание в стационаре перед операцией (≥ 5 дней) и продолжительная предоперационная антимикробная терапия (≥ 2 дней). Иммунитет может быть подавлен и у больных с другими острыми или хроническими заболеваниями, хотя это трудно установить. Результаты культурального исследования интраоперационных биоптатов, включая материал, полученный при чрескожном дренировании, являются ключом к назначению таким больным этиотропных терапевтических режимов и могут позволить рекомендовать деэскалацию с переходом на антибиотики с более узким спектром действия.
У больных с тяжелым течением инфекции последствия неудачного лечения могут быть более выраженными, чем у пациентов с инфекциями легкой и средней степени тяжести. Стартовая эмпирическая антимикробная терапия, которая впоследствии оказывается неактивной in vitro в отношении возбудителей, выделенных при ИАИ, ассоциируется с необходимостью дополнительных хирургических вмешательств и проведения более агрессивной антимикробной терапии, увеличением длительности пребывания в стационаре, стоимости лечения, возрастанием смертности. Поэтому применение антибиотиков широкого спектра действия, активных в отношении ряда грамотрицательных факультативных и аэробных микроорганизмов, которые редко выделяются у таких пациентов, способно улучшать исходы, однако эта гипотеза не была тщательно изучена в клинических исследованиях.
В подобных случаях выделение возбудителей и определение их чувствительности к антибиотикам являются особенно важными. Аргументом в пользу расширения спектра активности за счет более редких микроорганизмов является то, что риск клинических неудач у таких пациентов выше, а последствия могут быть хуже.
Аминогликозиды обладают сравнительно узким спектром активности и ассоциируются с такими проблемами, как ототоксичность и нефротоксичность. Они резервируются для лечения пациентов с аллергическими реакциями на b-лактамы и даже в этом случае остаются препаратами второго ряда по отношению к хинолонам. Аминогликозиды могут быть разумным выбором для эмпирической терапии отдельных пациентов с ИАИ СОМП в зависимости от локальных данных чувствительности нозокомиальных грамотрицательных палочек. В соответствии с данными метаанализа проспективных РКИ режимы терапии, основанные на аминогликозидах, уступают многим другим режимам при лечении пациентов с ИАИ.
Нет доказательств, что рутинное применение средств, активных в отношении энтерококков, улучшает прогноз, однако инфекции, вызванные этими микроорганизмами, ассоциируются с худшим прогнозом. Почти все энтерококки, выделяемые при внебольничных инфекциях, относятся к виду E.faecalis и обычно чувствительны к ампициллину, пиперациллину и ванкомицину. Если выбранный режим не активен в отношении энтерококков, допускается дополнительное назначение средства, обеспечивающего такую активность. Стафилококки и грибы крайне редко выделяются у пациентов с внебольничными ИАИ, поэтому использование средств, активных в отношении MRSA и грибов, не рекомендуется при отсутствии доказательств этиологической роли указанных микроорганизмов.
VIII. Какие режимы антимикробной терапии должны использоваться у пациентов с интраабдоминальными инфекциями, связанными с оказанием медицинской помощи, в особенности при подозрении на этиологическую значимость Candida spp., Enterococcus spp., MRSA?
45. Эмпирическая антибактериальная терапия для лечения ИАИ СОМП назначается в соответствии с локальными микробиологическими данными (А-ІІ).
46. Для эмпирического охвата вероятных возбудителей может потребоваться назначение нескольких антибиотиков, включая препараты с расширенными спектрами активности в отношении грамотрицательных аэробных и факультативных палочек. Назначаются меропенем, имипенем, дорипенем, пиперациллин/тазобактам, либо цефтазидим или цефепим в комбинации с метронидазолом. Может потребоваться назначение аминогликозидов или колистина (табл. 3) (В-ІІI).
47. Антимикробная терапия корректируется после получения результатов культурального исследования и определения чувствительности к антибиотикам с целью уменьшения количества и спектра назначенных препаратов (В-ІІI).
Антифунгальная терапия
48. Антифунгальная терапия пациентам с тяжелой внебольничной инфекцией или инфекцией СОМП показана, если из образцов интраабдоминального материала высеяны грибы рода Candida (В-ІІ).
49. В случае выделения Candida albicans препаратом выбора является флуконазол (В-ІІ).
50. При выделении Candida spp., резистентных к флуконазолу, назначаются эхинокандины (каспофунгин, микафунгин либо анидулафунгин) (В-ІІI).
51. Больным, находящимся в критическом состоянии, рекомендуется начальная терапия эхинокандином вместо триазола (В-ІІ).
52. Амфотерицин В не рекомендуется для начальной терапии из-за высокой токсичности (В-ІІ).
53. У новорожденных при подозрении на инфекцию Candida spp. следует начинать эмпирическую антифунгальную терапию. При выделении Candida albicans препаратом выбора является флуконазол (В-ІІ).
Антиэнтерококковая терапия
54. Антимикробные препараты, активные в отношении энтерококков, назначают при выделении энтерококков у пациентов с инфекцией СОМП (В-ІІI).
55. Эмпирическая антиэнтерококковая терапия рекомендуется пациентам с ИАИ СОМП, в особенности лицам с послеоперационной инфекцией, больным, ранее принимавшим цефалоспорины или другие антимикробные препараты, ассоциирующиеся с селекцией Enterococcus spp., пациентам с иммунодефицитами, поражениями клапанов сердца либо с внутрисосудистыми протезами (В-ІІ).
56. Начальная эмпирическая антиэнтерококковая терапия должна быть активной в отношении Enterococcus faecalis. В зависимости от результатов определения антибиотикочувствительности выделенного изолята могут использоваться ампициллин, пиперациллин/тазобактам, ванкомицин (В-ІІI).
57. Не рекомендуется эмпирическая терапия, направленная против ванкомицинорезистентных Enterococcus faecium, если только пациент не относится к группе очень высокого риска инфекции, вызванной этим микроорганизмом, как, например, больные после трансплантации печени, у которых ИАИ исходит из гепатобилиарной системы, либо пациенты, о которых известно, что они колонизированы ванкомицинорезистентными E.faecium (В-ІІI).
Анти-MRSA терапия
58. Эмпирическая антимикробная терапия в отношении MRSA должна назначаться больным с ИАИ СОМП, о которых известно, что они колонизированы этим микроорганизмом либо же относятся к группе риска инфицирования MRSA вследствие предыдущего неэффективного лечения или длительного приема антибиотиков (В-ІІ).
59. Ванкомицин рекомендуется для лечения предполагаемой или подтвержденной ИАИ, вызванной MRSA (A-IІІ).
Краткое изложение доказательств
«Инфекция СОМП» — относительно недавний термин, под которым понимают инфекции у взрослых пациентов, посещающих клиники по оказанию неотложной медицинской помощи или пребывающих в учреждениях длительного ухода. В этих условиях увеличивается риск инфицирования множественно резистентными бактериями. В Рекомендациях используется определение инфекций СОМП, данное Klevens et al. (Klevens R.M., Morrison M.A., Nadle J. et al. Invasive methicillin-resistant Staphylococcus aureus infections in the United States // JAMA. — 2007. — 298. — 1763-71). Инфекции СОМП включают заболевания, начавшиеся во внебольничной и госпитальной среде. Под инфекциями СОМП с внебольничным началом понимают случаи с одним и более нижеследующими факторами риска инфекции СОМП: 1) наличием инвазивного устройства при поступлении; 2) анамнестическими указаниями на инфекцию или колонизацию MRSA; 3) анамнестическими указаниями на хирургическое вмешательство, стационарное лечение, диализ, пребывание в учреждениях длительного ухода на протяжении 12 месяцев, предшествующих дате микробиологического исследования. Госпитальное начало инфекции включает случаи заболевания пациентов с позитивными результатами микробиологических исследований образцов, взятых из стерильных в норме участков, полученные > 48 часов после поступления больного в стационар. У этих пациентов может быть 1 и более факторов риска внебольничного начала инфекции.
Инфекции СОМП обычно вызываются более резистентной флорой, в том числе неферментирующими грамотрицательными бактериями P.aerugnosa, Acinetobacter spp., продуцирующими b-лактамазы расширенного спектра действия Klebsiella spp. и E.coli, Enterobacter spp., Proteus spp., MRSA, энтерококками, Candida spp. Для лечения таких инфекций рекомендуется полимедикаментозный режим, так как адекватная эмпирическая терапия важна для предупреждения послеоперационных осложнений и летальности. Неудачное лечение инфекций СОМП других локализаций, вызванных резистентными микроорганизмами, ассоциировалось с увеличением смертности. Выбор эмпирической терапии определяется данными о локальной резистентности нозокомиальных возбудителей, выделенных в конкретном лечебном учреждении. Лечение должно корректироваться с учетом данных микробиологического исследования материала из очага инфекции.
При инфекциях, возникающих после плановых или неотложных операций, обычно выделяют более резистентную флору. Микроорганизмы подобны тем, которые выделяются при других нозокомиальных инфекциях; анаэробы редко являются важным источником резистентных организмов. Выбор антибиотиков производится в соответствии со знанием нозокомиальной флоры учреждения, в котором у пациента развилась инфекция.
C.albicans и другие грибы выделяются примерно у 20 % больных с острыми перфорациями желудочно-кишечного тракта (ЖКТ). Даже в случае выделения грибов антифунгальная терапия у взрослых больных не является необходимой, за исключением: 1) пациентов, получавших незадолго до этого иммуносупрессивную терапию по поводу онкологического заболевания; 2) перфорации язвы желудка у лиц, получавших терапию, направленную на снижение кислотности, либо вследствие малигнизации; 3) трансплантации; 4) воспалительного заболевания или 5) послеоперационной или рецидивирующей ИАИ. У новорожденных с некротизирующим энтероколитом нередко выделяют Candida spp. В отличие от ранее здоровых взрослых грибы в подобных случаях, скорее всего, представляют истинные патогены.
В таких условиях Candida spp. ассоциируются с высокой летальностью. У больных с инфекцией СОМП повышен риск кандидозных перитонитов, особенно у пациентов с рецидивирующими перфорациями ЖКТ и у лиц, перенесших хирургические вмешательства по поводу инфекций поджелудочной железы. У таких пациентов из группы высокого риска упреждающая антифунгальная терапия флуконазолом может снизить заболеваемость кандидозным перитонитом.
В этиологии кандидемии и кандидозного перитонита отмечается определенная эволюция. Из-за высокой чувствительности к флуконазолу распространенность C.albicans снизилась, а C.glabrata и другие виды стали более распространенными. Эти данные, дополненные частым профилактическим использованием флуконазола в отделении интенсивной терапии, свидетельствуют в пользу эмпирического использования эхинокандинов (каспофунгин, анидулафунгин, микафунгин).
Группы больных с наиболее высоким риском неблагоприятного исхода вследствие энтерококковой инфекции включают в себя: 1) пациентов с иммуносупрессией; 2) лиц с послеоперационными перитонитами СОМП; 3) пациентов с тяжелым сепсисом абдоминальной природы, получавших ранее цефалоспорины и другие антибиотики широкого спектра, способствующие селекции Enterococcus spp.; 4) больных с перитонитом и поражениями клапанов сердца (или протезированными клапанами сердца) — из-за высокого риска эндокардита.
Enterococcus spp. чаще выделяются у пациентов с ИАИ СОМП, особенно у лиц с послеоперационными инфекциями, и сам факт их выделения является фактором риска неудачного лечения и смерти. Поэтому больным с ИАИ СОМП, включая послеоперационные инфекции, показано эмпирическое назначение средств, активных в отношении энтерококков, вплоть до получения результатов микробиологического исследования. Ампициллин и ванкомицин проявляют активность в отношении энтерококков. Эти антибиотики могут добавляться к режимам антимикробной терапии с недостаточной антиэнтерококковой активностью. Ванкомицинорезистентнные энтерококки могут передаваться здоровым людям от колонизированных или инфицированных пациентов.
Изоляты MRSA выделяются у больных с послеоперационными инфекциями, инфекциями поджелудочной железы, третичным перитонитом. MRSA нечасто обнаруживают у больных с внебольничными ИАИ. В настоящее время обосновать превосходство тех или иных антибиотиков для лечения ИАИ, вызванных MRSA, не представляется возможным. Обычно для лечения MRSA-инфекций используют ванкомицин. Другие антибиотики, включая хинупристин/дальфопристин, линезолид, даптомицин, тигециклин, in vitro проявляют активность в отношении MRSA, однако данных об их эффективности при лечении больных с ИАИ опубликовано немного. Таким образом, ванкомицин остается препаратом выбора, а применение других средств ограничивается случаями, когда ванкомицин невозможно использовать из-за тяжелых побочных реакций или когда стартовая терапия ванкомицином оказывается неэффективной.
IX. Каковы диагностические мероприятия и антимикробная терапевтическая стратегия при остром холецистите и холангите?
60. Ультрасонография — первое визуализирующее исследование, которое должно быть сделано при подозрении на острый холецистит или холангит (А-І).
61. Пациенты с предполагаемой инфекцией и либо с острым холециститом, либо с холангитом должны получать антимикробную терапию, как представлено в табл. 4, хотя при наличии билиоэнтерального анастомоза антианаэробная терапия не показана (В-ІІ).
62. После холецистэктомии вследствие острого холецистита антимикробная терапия должна быть прекращена через 24 ч, если нет явлений инфицирования за пределами стенок желчного пузыря (В-ІІ).
63. При внебольничной билиарной инфекции не требуется, чтобы антибиотики были активными в отношении энтерококков, так как патогенность энтерококков не доказана. У отдельных пациентов с иммуносупрессивными состояниями, особенно после трансплантации печени, энтерококковая инфекция может быть значимой и потребовать лечения (В-ІІI).
Краткое изложение доказательств
С диагностической целью рекомендуется использование абдоминальной ультрасонографии и сцинтиграфии печени. Ультрасонография позволяет определить желчнокаменную болезнь примерно в 98 % случаев. Диагноз острого калькулезного холецистита верифицируется с помощью лучевой диагностики при наличии утолщенной стенки желчного пузыря (≥ 5 мм), наличии перивезикальной жидкости или появлении болезненности при прохождении зонда в желчный пузырь (ультрасонографический симптом Мерфи). В исследовании у 497 больных с подозрением на острый холецистит положительная прогностическая значимость наличия камней и положительного ультрасонографического признака Мерфи составила 92 %, а положительная прогностическая значимость наличия камней и утолщения стенок желчного пузыря равнялась 95 %. Отрицательная прогностическая значимость отсутствия камней в сочетании с нормальной стенкой желчного пузыря или отрицательным симптомом Мерфи оказалась равной 95 %. Гепатобилиарная сцинтиграфия включает внутривенное введение производного иминодиацетиловой кислоты, меченного технецием, который выделяется с желчью. Отсутствие заполнения желчного пузыря в течение 60 минут после введения радиоизотопов свидетельствует об обструкции протока желчного пузыря; чувствительность метода для диагностики острого холецистита составляет 80–90 %.
Обсуждение сроков вмешательства при остром холецистите или холангите выходит за рамки данных Рекомендаций. На сроки определяющее влияние должны оказывать острота процесса и подтверждение наличия инфекции. В любом случае, нет данных, подтверждающих улучшение исходов при использовании антибиотиков, экскретирующихся печенью.
X. Какие антимикробные режимы применяются у детей с внебольничными интраабдоминальными инфекциями?
64. Рутинное использование препаратов широкого спектра не показано всем детям с лихорадкой и абдоминальной болью, у которых низкая вероятность осложненного аппендицита или другой ИАИ (В-ІІI).
65. Выбор конкретного антимикробного препарата для детей с осложненной ИАИ должен основываться на учете происхождения инфекции (внебольничная или инфекция СОМП), тяжести заболевания, безопасности антимикробных препаратов у больных разных возрастных групп (А-ІІ).
66. Для лечения детей с осложненными ИАИ могут использоваться следующие схемы антимикробной терапии широкого спектра действия: режим, базирующийся на применении аминогликозидов, карбапенемов (имипенем, меропенем, эртапенем), b-лактама вместе с ингибитором b-лактамаз (пиперациллин/тазобактам, тикарциллин/клавуланат) либо цефалоспорина (цефотаксим, цефтриаксон, цефтазидим, цефепим) с метронидазолом (табл. 2, 5) (В-ІІ).
67. При наличии выраженных аллергических реакций на b-лактамные антибиотики рекомендуется ципрофлоксацин в комбинации с метронидазолом или режим терапии, основанный на аминогликозидах (В-ІІI).
68. Некротизирующий энтероколит у новорожденных требует проведения инфузионной терапии, назначения антибиотиков широкого спектра действия внутривенно (с возможным включением антифунгальных препаратов), кишечной декомпрессии. При наличии явлений перфорации кишечника следует предпринять неотложное или срочное оперативное вмешательство — лапаротомию или чрескожное дренирование. Интраоперативно следует произвести забор материала для окраски по Граму и культурального исследования (В-ІІI).
69. У новорожденных с некротизирующим колитом могут оказаться полезными следующие антибиотики широкого спектра: ампициллин, гентамицин и метронидазол; ампициллин, цефотаксим и метронидазол; меропенем. Ванкомицин можно использовать вместо ампициллина при подозрении на инфекцию MRSA или энтерококками, резистентными к ампициллину. Если результаты окраски по Граму либо культурального исследования образцов, полученных во время операции, указывают на наличие грибковой инфекции, следует назначить флуконазол или амфотерицин B (B-II).
Краткое изложение доказательств
Эти Рекомендации не распространяются на лечение билиарных инфекций у детей. Хотя кишечные грамотрицательные палочки и анаэробы, включая B.fragilis, являются наиболее частыми патогенами, увеличение роли Pseudomonas spp. документировано более чем у 35 % детей в ряде центров Северной Америки, Азии и Европы. Эмпирическая терапия антибиотиками широкого спектра действия у детей с клиническими или визуализирующими признаками перфорации аппендикса с перитонитом включает в себя карбапенемы (имипенем, меропенем), пиперациллин/тазобактам, тикарциллин/клавуланат либо цефалоспорины расширенного спектра действия (цефотаксим, цефтриаксон, цефтазидим или цефепим) с метронидазолом.
На протяжении десятилетий для лечения осложненных ИАИ у детей с успехом использовались режимы терапии, содержащие аминогликозиды. Наиболее распространенной была трехкомпонентная терапия гентамицином, ампициллином и клиндамицином (последний часто заменяли метронидазолом). Этот опыт контрастирует с таковым у взрослых, у которых трудности с достижением терапевтических концентраций при однократном дозировании аминогликозидов из расчета < 5–7 мг/кг/сут и развитие аминогликозид-индуцированной дисфункции почек ограничивают их использование.
Тем не менее сохраняется тенденция к отказу от использования режимов терапии на основе аминогликозидов у детей с аппендицитами. Это в большей мере обусловлено уменьшением количества инфузий при выборе других режимов. В ретроспективных исторических одноцентровых (по методу «случай — контроль») обзорах, в которых изучали многочисленные клинические и экономические исходы при использовании традиционных трехкомпонентных режимов на основе аминогликозидов и режимов терапии без аминогликозидов, была продемонстрирована по крайней мере сопоставимая эффективность. Недавно завершен крупный обзор диагнозов при выписке (всего 8545 случаев) в 32 детских больницах в США (база данных Pediatric Health Information). Установлено, что у детей, получавших монотерапию, по сравнению с теми, кто получал традиционную трехкомпонентную терапию, имело место значительное и существенное сокращение сроков пребывания в стационаре, расходов на медикаменты, госпитальных затрат, при этом количество повторных госпитализаций не увеличилось.
Дети часто жалуются на лихорадку и боли в животе, поэтому агрессивная антибактериальная терапия широкого спектра не является обоснованной для всех детей с подозрением на аппендицит. В подобных случаях в период наблюдения и диагностической оценки рекомендуется эмпирически использовать средства с менее широким спектром действия, например цефокситин. Такой терапии достаточно для целенаправленного лечения подтвержденных перфорированных аппендицитов, особенно при чувствительности всех выделенных микроорганизмов.
Вопросы безопасности ограничивают возможности лечения детей с осложненными ИАИ. Тетрациклины, например тигециклин, противопоказаны детям до 8 лет. Парентеральное введение фторхинолонов не рекомендуется для рутинного лечения инфекций в ситуациях, когда существуют в равной степени эффективные альтернативные схемы.
В некоторых детских центрах в настоящее время организуется парентеральная терапия в амбулаторных условиях пациентам, выздоравливающим после осложненного аппендицита, а именно тем, у кого, по мнению лечащего врача, имеется значительный риск остаточных инфицированных скоплений. Пероральная терапия у выздоравливающих детей охарактеризована хуже, но допускается в случаях, когда ребенок способен принимать антибиотики внутрь и это может принести ему пользу. Приемлема комбинация перорального цефалоспорина 2–3-го поколения с антианаэробным средством, таким как метронидазол. Из-за возросшей резистентности B.fragilis к клиндамицину этот препарат более не рекомендуется для рутинного назначения взрослым и детям. Пероральный прием ципрофлоксацина, при условии чувствительности к нему возбудителя, может использоваться на этапе выздоровления у детей с инфекциями, вызванными Pseudomonas spp., Enterobacter spp., Serratia spp., Citrobacter spp., так как нет других эффективных пероральных средств, изученных при ИАИ данной этиологии.
Некротизирующий энтероколит в первую очередь развивается у недоношенных детей и у детей, родившихся в срок, но с сопутствующими стрессовыми заболеваниями. Для возникновения заболевания необходимы 3 основных компонента: субстрат для роста бактерий (питание), инфекционный агент (обычно бактериальный), условия для повреждения кишечника (снижение кровотока в кишечнике или в сегменте кишечника; сосуды страдают вторично по отношению к сниженному кровотоку). Это может приводить к повреждению слизистой, интестинальному пневматозу, размножению бактерий и сепсису. В тяжелых случаях развиваются более обширные повреждения стенки кишечника с его перфорацией.
Клиническая картина включает в себя эпизоды апноэ и брадикардии, за которыми следуют вздутие живота, неоднократный кровавый стул, рвота желчью. На животе могут появляться эритематозные пятна. Среди других возможных симптомов заслуживают упоминания признаки сепсиса (тромбоцитопения, нейтропения) и ацидоз (при ишемии кишечника).
У детей с очень малым весом при рождении при перфорации кишечника вместо немедленной операции можно использовать перитонеальный дренаж.
Частота выживания после некротизирующего энтероколита достигает 95 %, однако при поражении всего кишечника, что встречается примерно в 25 % случаев, частота смертельных исходов составляет 40–90 %. Неоперативное лечение некротизирующего энтероколита эффективно приблизительно в 70 % случаев.
XI. Что следует понимать под адекватным дозированием антибиотиков?
70. При эмпирической терапии пациентов с осложненными ИАИ антибиотики используются в оптимальных дозах, чтобы обеспечить максимальную эффективность и минимальную токсичность и снизить антимикробную резистентность (табл. 5, 6) (В-ІІ).
71. Индивидуальное дозирование аминогликозидов с учетом мышечной массы и объема внеклеточной жидкости предпочтительно у пациентов с ИАИ, получающих эти препараты (В-ІІI).
Краткое изложение доказательств
Начальные режимы для внутривенного введения антибиотиков взрослым и детям с нормальной функцией почек и печени представлены в табл. 4, 5 соответственно. Рекомендации основаны на диапазонах доз, эффективность которых показана в клинических исследованиях, и применимы для лечения пациентов с внебольничными инфекциями легкой и средней степени тяжести. Однако эти режимы дозирования не были должным образом изучены при лечении тяжелых и/или нозокомиальных инфекций. У больных с нарушениями функции почек или печени дозы корректируются в соответствии с информацией на листах-вкладышах в упаковках препаратов и/или публикациями в научной печати.
Для выбора адекватной дозы учитываются фармакокинетические и фармакодинамические свойства антибактериальных средств. b-лактамные антибиотики проявляют время-зависимую бактерицидную активность и оказывают минимальное постантибиотическое действие (за исключением карбапенемов в отношении P.aeruginosa). Наилучшим предиктором микробиологического и клинического ответа на b-лактамные антибиотики является промежуток времени, в течение которого свободная (не связанная с белками плазмы) концентрация лекарства превышает минимальную подавляющую концентрацию (МПК) микроорганизма (Т > МПК). Оптимизация этого параметра для лечения тяжелых инфекций либо инфекций, вызванных бактериями с более высоким уровнем МПК, может потребовать изменения стратегии дозирования, а именно увеличения кратности введения антибиотика, увеличения разовой дозы, пролонгированного внутривенного (включая продленное или непрерывное) введения b-лактама с коротким периодом полувыведения по сравнению с рекомендованными выше дозами и интервалами введения. Напротив, фторхинолоны, аминогликозиды, метронидазол проявляют концентрация-зависимую бактериальную активность и оказывают умеренное или выраженное постантибиотическое действие. Наилучшими предикторами микробиологического и клинического ответа на эти средства являются параметры, которые описывают экспозицию не связанных концентраций лекарств и описываются отношением площади под фармакокинетической кривой (AUC) или максимальной концентрации препарата (Cmax) к МПК микроорганизма (AUC/МПК и Cmax/МПК). Введение антибиотиков внутривенно в высоких дозах через более длительные интервалы (например, каждые 24 ч) может оптимизировать эти параметры и облегчить использование медикаментов за счет сокращения числа инфузий в сутки.
Коррекция доз антимикробных препаратов также важна для больных в критическом состоянии и взрослых людей, страдающих ожирением. Физиологические отклонения могут встречаться у пациентов обеих групп и изменять объем распределения и/или клиренс традиционно используемых антибиотиков. Кроме того, если дозирование зависит от функции почек, точный расчет клиренса креатинина на основании концентрации креатинина в плазме крови и массы тела может быть затруднителен при использовании обычных формул и может потребоваться прямое измерение клиренса креатинина. Применительно к E.coli-лактамам и аминогликозидам, у пациентов в критическом состоянии на ранних стадиях сепсиса возможны изменения в распределении жидкостей в организме, и они могут находиться в гиперметаболическом состоянии, что приводит к увеличению объема распределения и клиренса и снижению плазменной концентрации антибиотиков. Аналогично, снижение плазменной концентрации цефалоспоринов и карбапенемов регистрировалось у лиц, страдающих ожирением. Меньшие тканевые концентрации цефалоспоринов также отмечались у пациентов с ожирением после периоперационной антибиотикопрофилактики в хирургии. Эти исследования говорят о том, что более высокие дозы и/или более частое назначение b-лактамов может потребоваться некоторым пациентам с ожирением и больным в критическом состоянии с нарушенным распределением и повышенным клиренсом антибиотиков, которые выводятся почками. Начальные дозы аминогликозидов и ванкомицина должны основываться на откорректированной массе тела и общей массе тела соответственно. В этой группе больных для индивидуального подбора дозы аминогликозидов и ванкомицина рекомендуется мониторирование плазменной концентрации препарата.
Накоплено много данных об эффективности меньшей частоты приема метронидазола. Нитроимидазолы оказывают бактерицидное действие путем образования внутри бактерий токсических метаболитов, вызывающих повреждение бактериальной ДНК. Резистентность — и клиническая, и микробиологическая — описывается редко. Заболевания печени приводят к снижению клиренса метронидазола; в этом случае рекомендуется снизить дозу.
XII. Как следует использовать результаты микробиологического исследования для коррекции антимикробной терапии?
72. Пациенты с внебольничной ИАИ группы низкого риска не требуют изменений в терапии, если в результате хирургического вмешательства и первоначальной терапии достигнут удовлетворительный клинический эффект, даже если в последующем при микробиологическом исследовании выделены неожиданные или нелеченные патогены (В-ІІI).
73. Если резистентная бактерия выделена на начальном этапе вмешательства и сохраняются признаки персистирующей инфекции, больным с нетяжелым заболеванием рекомендуется терапия, направленная на возбудителя (В-ІІI).
74. Результаты культурального исследования и определения чувствительности к антибиотикам для выбора антимикробной терапии у пациентов с тяжелой внебольничной инфекцией или ИАИ СОМП трактуют с учетом патогенности и концентрации выделенных микроорганизмов (В-ІІI).
75. Микроорганизмы, высеянные из крови, рассматриваются как значимые, если располагают ранее установленным патогенным потенциалом или выделены из і 2 образцов крови (A-I), либо содержатся в умеренных или значительных количествах в образцах материала, полученных путем дренирования (B-II).
Краткое изложение доказательств
У пациентов с внебольничной ИАИ эмпирическая антимикробная терапия, активная в отношении преобладающих патогенов, ассоциируется с благоприятным исходом. Если же стартовая антимикробная терапия не активна в отношении возможных возбудителей, вполне вероятно, что у такого пациента лечение окажется неэффективным. Тем не менее многие пациенты успешно лечатся с помощью адекватного контроля источника инфекции и эмпирической терапии, активной в отношении колиформных микроорганизмов и анаэробов. В проспективных исследованиях отсутствуют данные, которые бы свидетельствовали, что изменение антимикробной терапии на основании результатов культурального исследования улучшает исходы у пациентов c ИАИ, вызванными неучтенными или более резистентными патогенами. Тем не менее представляется разумным корректировать режим антимикробной терапии у больных группы высокого риска, у которых неудачное лечение может иметь значительные последствия, и у пациентов низкого риска, но с персистирующей инфекцией.
XIII. Какая оптимальная продолжительность терапии у пациентов с осложненной интраабдоминальной инфекцией?
76. Антимикробная терапия документированной инфекции ограничивается 4–7 сутками, за исключением случаев, когда затруднительно достичь адекватного контроля над очагом инфекции. Более продолжительная терапия не ассоциируется с улучшением исходов (В-ІІI).
77. При перфорациях желудка и проксимальной части тощей кишки, если контроль над очагом инфекции достигнут в течение 24 ч и при этом не проводится кислотоснижающая терапия и нет малигнизации, профилактическая антимикробная терапия в течение 24 часов, направленная на аэробных грамположительных кокков, вполне адекватна (В-ІІ).
78. В случаях задержки операции по поводу перфорации желудка и проксимальной части тощей кишки, малигнизации желудка или кислотоснижающей терапии, антимикробная терапия должна быть направлена на смешанную флору (как, например, при осложненных инфекциях ободочной кишки) (В-ІІI).
79. Повреждения кишечника, обусловленные пенетрацией, тупой или ятрогенной травмой, которые были устранены в течение 12 часов вместе с любой другой интраоперационной контаминацией операционного поля кишечным содержимым, должны лечиться антибиотиками і 24 часов (А-І).
80. Больные с острым аппендицитом без явлений перфорации, абсцесса или локального перитонита нуждаются только в профилактическом применении антибиотиков с узким спектром, активных в отношении аэробов и факультативных и облигатных анаэробов; лечение следует прекратить через 24 часа (А-І).
81. Профилактическое назначение антибиотиков пациентам с тяжелым некротизирующим панкреатитом до верификации инфекции не рекомендуется (А-І).
Краткое изложение доказательств
Для лечения осложненных ИАИ можно использовать широкий ряд антимикробных препаратов и их комбинаций. Имеются убедительные данные, что неадекватная эмпирическая и целенаправленная антибактериальная терапия или ее отсутствие приводит и к увеличению частоты клинических неудач, и к повышению смертности. И наоборот, излишнее, неоправданно широкое по спектру антибактериальной активности или чрезмерное по продолжительности лечение имеет свои недостатки, включая стоимость. Могут возникнуть специфичные для больного или препарата негативные последствия такой терапии, включая суперинфекцию, колиты, вызванные Clostridium difficile, повреждения органов.
Приобретение природнорезистентных микроорганизмов и селективное воздействие на развитие резистентности в отделении, госпитале или районе вызывает серьезную озабоченность.
В предыдущей редакции Рекомендаций были представлены доказательства того, что терапия длительностью не более 1 недели подходит для большинства пациентов с ИАИ, за исключением больных с неадекватным контролем над очагом инфекции. Исходя из этих соображений, разрешение клинических признаков инфекции следует использовать для принятия решения о завершении антимикробной терапии. Риск последующей клинической неудачи невелик у больных без клинических проявлений инфекции на момент прекращения антимикробной терапии. Как правило, это афебрильные пациенты с нормальным числом лейкоцитов в периферической крови, способные принимать пищу и лекарства внутрь.
В прежней редакции Рекомендаций также был приведен перечень состояний, при которых продолжительность терапии > 24 часов полагали излишней. У таких пациентов первичной целью лечения является профилактика инфекции в области хирургического вмешательства в отличие от терапии документированной инфекции. Эти состояния включают в себя травматические или ятрогенные повреждения кишечника, оперированные в первые 12 часов; перфорации верхних отделов ЖКТ, оперированные в первые 24 ч; локализованные процессы, такие как аппендицит без перфорации, холецистит, кишечная непроходимость и инфаркт кишечника, при которых очаг воспаления или инфекции полностью удаляется хирургическим путем и отсутствует распространение инфекции за пределы пораженного органа.
Некоторые клиницисты применяют антибиотики широкого спектра действия при лечении пациентов с некротическим панкреатитом для предотвращения инфекции в воспалительной флегмоне и улучшения исходов. Однако авторы рекомендаций по лечению тяжелых панкреатитов пришли к заключению, что данный подход не обоснован имеющимися данными. Метаанализ исследований, выполненных в этой области, показал, что положительные результаты обусловлены погрешностями в дизайне исследований, в то время как в хорошо спланированных исследованиях продемонстрировать преимущества указанного подхода не удалось. Поэтому у больных с некротизирующим панкреатитом применять антибиотики широкого спектра действия не рекомендуется без клинического или культурального подтверждения инфекции. У пациентов с документированной инфекцией поджелудочной железы предпочтение следует отдавать средствам, рекомендованным для лечения тяжелых внебольничных инфекций и инфекций СОМП (табл. 2, 3). Из-за трудностей с достижением адекватного контроля над очагом инфекции у пациентов с инфицированными панкреатической и перипанкреатической флегмонами может потребоваться более длительное лечение.
XIV. У каких больных возможна пероральная или амбулаторная антимикробная терапия и какие режимы следует использовать?
82. У взрослых и детей, у которых отсутствуют признаки и симптомы инфекции, продолжение антибактериальной терапии не требуется (В-ІІI).
83. У взрослых на этапе выздоровления после ИАИ допускается завершение антимикробного курса таблетированными формами моксифлоксацина, ципрофлоксацина с метронидазолом, левофлоксацина с метронидазолом, таблетированного цефалоспорина с метронидазолом либо амоксициллин/клавуланатом (В-ІІ) при условии, что пациент в состоянии принимать пищу внутрь, а также у больных, у которых при определении чувствительности к антибиотикам не были выявлены резистентные микроорганизмы.
84. Если возбудитель чувствителен только к внутривенным препаратам, такая терапия может назначаться на амбулаторном этапе (В-ІІI).
85. У детей возможно назначение антибиотиков парентерально на амбулаторном этапе, когда не требуется последующее дренирование, однако сохраняются симптомы интраабдоминального воспаления на фоне снижения температуры, контроля над болью, способности принимать жидкости внутрь и возможности передвигаться (В-ІІ).
86. Для проведения ступенчатой терапии у детей во время дренирования источника ИАИ рекомендуется проведение культурального исследования интраабдоминального образца с целью обоснования выбора препаратов для приема внутрь с наиболее узким спектром, с наилучшими переносимостью и безопасностью. Могут использоваться цефалоспорины второго или третьего поколения в комбинации с метронидазолом или амоксициллин/клавуланат — при чувствительности к ним выделенных возбудителей. Фторхинолоны ципрофлоксацин или левофлоксацин могут использоваться для лечения инфекций, вызванных чувствительными к ним Pseudomonas spp., Enterobacter spp., Serratia spp., Citrobacter spp. (В-ІІI). При назначении ципрофлоксацина или левофлоксацина к ним добавляется метронидазол.
87. Если доступны результаты определения чувствительности к антибиотикам выделенных грамотрицательных аэробных и факультативных микроорганизмов, их следует использовать для выбора антибиотиков у детей и взрослых (В-ІІI).
88. Многие пациенты, которым не проводилось хирургическое вмешательство, могут лечиться в амбулаторных условиях. В таких случаях можно также использовать режимы антибактериальной терапии для приема внутрь (см. Рекомендации 83 и 86) — либо с самого начала, либо в качестве ступенчатой терапии, следующей за внутривенной антимикробной терапией (В-ІІI).
Краткое изложение доказательств
Больных, выздоравливающих после осложненной ИАИ, можно лечить антибиотиками для приема внутрь. Такая терапия должна рассматриваться как часть краткого рекомендованного курса лечения, которая в общей сложности редко превышает 4–7 дней. Назначение антимикробной терапии афебрильным пациентам с нормальными показателями лейкоцитов в периферической крови и восстановленной функцией кишечника показано редко. Выбор антибиотика для приема внутрь опирается на данные о чувствительности выделенного изолята или, при отсутствии такового, типичных патогенов, включая E.coli, стрептококки и B.fragilis. Большинство таких режимов формально не изучены в клинических исследованиях, но предположительно активны в отношении большинства колиформных бактерий и анаэробов, встречающихся при этих инфекциях. Возрастающая резистентность E.coli к амоксициллин/клавуланату может ограничить дальнейшее использование данного антибиотика.
XV. Что делать при подозрении на неэффективность лечения?
89. У пациентов с персистирующими или рецидивирующими клиническими проявлениями ИАИ после 4–7 дней терапии следует провести соответствующие диагностические исследования. Они должны включать КТ или ультразвуковое исследование. Следует продолжать антимикробную терапию, активную в отношении ранее выделенных возбудителей (А-ІІI).
90. Следует исключить экстраабдоминальные источники инфекции и неинфекционные воспалительные состояния, если отсутствует удовлетворительный клинический ответ на микробиологически адекватную эмпирическую антимикробную терапию (А-ІІ).
91. У больных с сохраняющимся очагом инфекции, не ответивших на начальную терапию, следует провести культуральное исследование 1 образца на предмет выявления аэробных и анаэробных микроорганизмов, при условии, что он достаточного объема (не менее 1,0 мл жидкости или ткани) и доставлен в лабораторию в анаэробной транспортной среде (С-ІІI). Инокуляция 1–10 мл жидкости непосредственно в емкость с бульоном для выращивания анаэробных гемокультур может повысить результативность исследования.
Краткое изложение доказательств
Пациенты с персистирующими или рецидивирующими симптомами раздражения брюшины, недостаточностью функции кишечника, продолжающейся лихорадкой или лейкоцитозом относятся к группе высокого риска интраабдоминальной или другой инфекции, что может потребовать дополнительного хирургического вмешательства. В целом больных с персистирующей или новой ИАИ, инфекцией органов, поверхностными или глубокими инфекциями в области хирургического вмешательства можно выявить с помощью тщательного физикального обследования, дополненного соответствующими лабораторными и визуализирующими исследованиями. Наиболее точным методом постановки диагноза в случае продолжающейся или рецидивирующей ИАИ обычно оказывается КТ органов брюшной полости. Следует также рассматривать возможность экстраабдоминальной инфекции (в частности, нозокомиальной пневмонии, инфекции мочевыводящих путей), неинфекционные причины лихорадки или лейкоцитоза (например, венозный тромбоз или легочная эмболия) и заболевания, вызванные C.difficile, даже без диареи. Во время проведения диагностических исследований следует продолжать адекватную антимикробную терапию, особенно при явлениях сепсиса и полиорганной недостаточности. Режим антимикробной терапии должен корректироваться в соответствии с результатами диагностического обследования. У пациентов с документированной ИАИ может потребоваться расширение спектра антимикробного действия с включением препаратов, активных в отношении возбудителей инфекций СОМП, которые часто выделяются при инфекциях подобного рода. У пациентов с персистирующими жалобами и клиническими симптомами, у которых в результате тщательного обследования не получены доказательства новой или хронической инфекции, оправдано завершение антимикробной терапии.
XVI. Какие ключевые элементы следует рассмотреть при разработке локальных рекомендаций по ведению больных с аппендицитом?
92. В каждой больнице должны быть созданы клинические стандарты диагностики, внутригоспитального лечения, выписки и амбулаторного лечения (В-ІІ).
93. Стандарты должны разрабатываться на основе сотрудничества клиницистов, участвующих в лечении этих пациентов, включая хирургов, инфекционистов, семейных врачей, врачей приемного отделения, рентгенологов, медицинских сестер, фармацевтов, и должны отражать местные ресурсы и стандарты оказания медицинской помощи (В-ІІ).
94. Хотя нет бесспорных клинических данных для идентификации пациентов с аппендицитом, совокупность признаков, включая характерную боль в животе, локальную абдоминальную болезненность, лабораторные данные, характерные для острого воспалительного процесса, обычно позволяет диагностировать аппендицит (А-ІІ).
95. При подозрении на аппендицит рекомендуется спиральная КТ органов брюшной полости и малого таза с внутривенным, но не ректальным или пероральным, введением контраста (В-ІІ).
96. Диагностическую визуализацию следует произвести у всех женщин. У женщин детородного возраста до диагностической визуализации выполняется тест на беременность. Если пациентка находится в первом триместре беременности, вместо КТ следует произвести ультразвуковое исследование или магнитно-резонансную томографию (В-ІІ). Если эти исследования не позволяют диагностировать имеющуюся патологию, можно прибегнуть к лапароскопии или ограниченному КТ-исследованию (В-ІІІ).
97. Визуализацию следует выполнить у всех детей, особенно в возрасте до 3 лет, в случае сомнений в диагнозе аппендицита. Предпочтительнее КТ, хотя, чтобы избежать использования у детей ионизирующего излучения, ультразвуковое исследование является разумной альтернативой (В-ІІI).
98. Если диагноз аппендицита не подтверждается с помощью визуализирующих методов исследования, рекомендуется наблюдение в течение 24 часов до исчезновения симптомов из-за возможного риска ложноотрицательных результатов (В-ІІI).
99. За пациентами с подозрением на аппендицит, когда диагноз нельзя ни подтвердить, ни исключить с помощью диагностических исследований, рекомендуется пристальное наблюдение (А-ІІI).
100. При высокой вероятности заболевания пациенты могут госпитализироваться (А-ІІI).
101. Антимикробная терапия назначается всем больным с диагнозом аппендицита (А-ІІ).
102. Адекватными антибиотиками являются препараты, активные в отношении факультативных и аэробных грамотрицательных микроорганизмов и анаэробов, как представлено в табл. 2, для лечения пациентов с внебольничными ИАИ (А-І).
103. У больных с подозрением на аппендицит, у которых результаты диагностических исследований сомнительные, антимикробная терапия назначается вместе с анальгетиками и, при необходимости, с антипиретиками. Взрослым антибиотики назначаются минимум на 3 дня — до исчезновения клинических симптомов и признаков инфекции либо постановки окончательного диагноза (В-ІІI).
104. При остром аппендиците без перфорации оперативное вмешательство следует произвести как можно быстрее. Операция может быть отложена на короткое время, если такая тактика принята в лечебном учреждении (В-ІІ).
105. Приемлемыми являются и лапароскопия, и открытая аппендэктомия, использование того или иного подхода зависит от опыта хирурга (А-І).
106. У отдельных больных с острым неперфоративным аппендицитом допускается неоперативное лечение, если состояние пациента значительно улучшилось до операции (В-ІІ).
107. У мужчин допускается неоперативное лечение, при условии, что пациент госпитализирован до 48 часов и у него отмечается выраженное улучшение клинической симптоматики в течение 24 ч на фоне антимикробной терапии (А-ІІ).
108. Пациенты с перфоративным аппендицитом нуждаются в неотложном хирургическом вмешательстве для обеспечения адекватного контроля над очагом инфекции (В-ІІI).
109. Пациентам со сформировавшимся периаппендикулярным абсцессом проводят чрескожное дренирование или, при необходимости, оперативный дренаж. Аппендэктомию у таких больных обычно откладывают (А-ІІ).
110. У отдельных больных, поступивших спустя несколько дней после возникновения воспалительного заболевания, у которых диагностирована периаппендикулярная флегмона или небольшой абсцесс, не подлежащий чрескожному дренированию, можно отложить или не производить хирургическое вмешательство, чтобы предотвратить возможно более обширную операцию, чем простая аппендэктомия. Таким больным назначают антимикробную терапию и организуют тщательное наблюдение за ними в условиях стационара — по аналогии с пациентами с острым дивертикулитом (В-ІІ).
111. Целесообразность отсроченной аппендэктомии после чрескожного дренирования или неоперативного лечения перфоративного аппендицита точно не установлена, а ее выполнение может быть излишним.
Краткое изложение доказательств
В настоящее время убедительно доказано, что использование протоколов для лечения пациентов улучшает и уход за больными, и исходы. На местах должны внедряться адаптированные к местным условиям рекомендации. Выгоды от их внедрения суммируются за счет уменьшения использования ограниченных ресурсов, не предусмотренных протоколом, уменьшения потребности в госпитальных койках для наблюдения за больными; стандартизованной документации для наблюдения за пациентом в случаях, когда диагноз не был поставлен; трудноизмеримого, однако весьма вероятного снижения инфекционных и других послеоперационных осложнений; уменьшения длительности пребывания в стационаре; сокращения использования антибактериальных средств.
Локальные клинические протоколы, созданные для аппендицита и других заболеваний, призваны стандартизировать диагностику и лечение больных с подозрением на определенные заболевания. Для достижения эффекта все элементы протоколов должны представлять собой единое целое и гарантировать, что все этапы оказания помощи должным образом организованы и задокументированы. При таком подходе уменьшается необоснованная вариативность оказания помощи, предупреждается развитие заболеваний, которых можно было бы избежать, сокращается длительность пребывания в госпитале, улучшается исход заболевания. В целом протоколы, в которых излагаются принятие клинического решения, подтверждающие лабораторные и инструментальные обследования вкупе со стандартизированным подходом к лечению, приводят к уменьшению числа излишних операций, сокращению использования антибиотиков, уменьшению длительности пребывания в стационаре.
В данном разделе рассматриваются компоненты для построения локальных протоколов по диагностике, антимикробной терапии, хирургическому лечению пациентов с аппендицитом без перфорации.
Симптоматика острого аппендицита, чувствительность и специфичность тех или иных симптомов заболевания хорошо известны. Были разработаны соответствующие шкалы для содействия в принятии решения о немедленной операции, диагностическом обследовании, наблюдении в условиях стационара или вне его. Однако они не способны заменить клиническое суждение.
В настоящее время диагностическая визуализация является стандартной процедурой для большинства пациентов с подозрением на острый аппендицит. Она рекомендуется всем больным с острой болью в животе, похожей на боль при аппендиците, за исключением мужчин в возрасте до 40 лет с типичными анамнезом и физикальными данными.
Если при диагностическом обследовании диагноз аппендицита исключен, а другой диагноз не установлен, дальнейшее лечение основывается на ряде клинических и социальных факторов. Если клинические подозрения сохраняются, допускается продолжение наблюдения за больным в стационаре или в приемном отделении для оценки эволюции симптомов с течением времени. Может быть обоснованным также наблюдение за пациентами, за которыми в последующем организовать его будет проблематично. С больными, выписанными из стационара, следует связаться в течение ближайших 24 часов, даже если это будет в телефонном режиме. Во-первых, сохраняется возможность ложноотрицательных результатов диагностического обследования, во-вторых, в течение этого времени могут проявиться другие состояния, требующие медицинского вмешательства. Отсутствие улучшения может потребовать повторного осмотра и, возможно, повторного диагностического обследования или диагностической лапароскопии.
Важным компонентом комплексной медицинской помощи больным с аппендицитом является адекватная регидратация.
Клинические исследования, демонстрирующие эффективность одной только антимикробной терапии у мужчин с клиническим подозрением на аппендицит, обосновывают проведение антимикробной терапии без хирургического вмешательства у пациентов с сомнительными диагностическими находками как возможную альтернативу оперативному лечению и как средство превращения аппендэктомии из неотложной в срочную хирургическую процедуру. В клинических исследованиях, в которых изучали сроки наступления перфорации аппендикса, установлено, что в ранние сроки она наступает нечасто, что служит дополнительным аргументом в пользу менее агрессивного подхода к лечению.
Ценность обследования аппендикса с помощью ультразвукового исследования или КТ доказана временем. Согласно данным недавнего метаанализа, абсцесс или флегмону обнаруживают у 4 % больных с аппендицитом. Нехирургическое лечение неэффективно в 7,2 % случаев (95% доверительный интервал (ДИ) 4,0–10,5 %). Дренирование абсцесса в ранние сроки заболевания встречается у 20 % пациентов (95% ДИ 11,0–28,3 %). Немедленное хирургическое вмешательство ассоциируется с большей заболеваемостью по сравнению с нехирургическим лечением (отношение шансов (ОШ) 3,3; 95% ДИ 1,9–5,6; р < 0,001). После успешного нехирургического лечения в ходе последующего наблюдения злокачественное заболевание выявлено в 1,2 % случаев (95% ДИ 0,6–1,7 %), значимое доброкачественное заболевание — в 0,7 % случаев (95% ДИ 0,2–11,9 %). Риск рецидива оказался равным 7,4 % (95% ДИ 3,7–11,1 %).
Остается неясным, необходима ли отсроченная аппендэктомия после успешного консервативного лечения заболевания аппендикса. Основные дискуссии затрагивают частоту рецидивов, частоту осложнений в результате отсроченной аппендэктомии и вероятность злокачественного новообразования. Согласно двум обзорам, отсроченная аппендэктомия нецелесообразна в 75–90 % случаев.
Области будущих исследований
Некоторые вопросы требуют дальнейшего изучения. Один из них — вопрос о правилах получения адекватного образца для микробиологического исследования, включая роль рутинных тестов по определению чувствительности к антибиотикам. Для этого лучше всего подходят проспективные исследования. При их проведении можно также получить эпидемиологические данные по резистентности возбудителей внебольничных инфекций и специфичные для отдельных территорий микробиологические находки (например, непредвиденная частота выделения резистентных ко многим лекарствам микроорганизмов).
Необходимо изучить последствия отсроченной аппендэктомии. Одним из подходов к решению этой проблемы является анализ баз данных крупных госпиталей.
Существует настоятельная необходимость в изучении адекватной длительности антимикробной терапии. Влияние продолжительной терапии, в том числе связанной с наличием мощных пероральных антибиотиков, на развитие резистентности микроорганизмов во внебольничных условиях или в местах обслуживания хронических больных может быть значительным. С другой стороны, длительность терапии в значительной степени зависит от адекватности контроля над очагом инфекции. Спектр интраабдоминальных очагов инфекции варьирует от одного до множественных диссеминированных интраабдоминальных абсцессов, которые невозможно адекватно дренировать за 1 процедуру.
Что касается пациентов группы высокого риска, особенно с инфекцией СОМП, неблагоприятные клинические исходы все еще нередки. С учетом малого количества таких пациентов трудно ожидать проведения проспективных сравнительных рандомизированных исследований; следовательно, полезными могут быть другие подходы, включая проспективные обсервационные исследования. Этиологическая структура таких инфекций нуждается в подтверждении; следует выяснить и эффективность эмпирической терапии. Необходимо критически проанализировать гипотезу о преимуществах терапии антимикробными препаратами широкого спектра у таких пациентов. Кроме того, требует изучения длительность терапии при послеоперационных инфекциях.
Неотложной необходимостью является изучение фармакокинетических особенностей антимикробных препаратов у крайне тяжелых септических больных. Немногие антимикробные препараты изучались у крайне тяжелых пациентов, однако результаты этих исследований указывают на недостаточность сведений, содержащихся в листах-вкладышах к этим препаратам, по коррекции доз у больных в критическом состоянии.
Подготовили О.В. Дорошенко, к.м.н., И.Г. Березняков, профессор
1. Solomkin J.S., Mazuski J.E., Bradley J.S., Rodvold K.A., Goldstein E.J.C., Baron E.J. et al. Diagnosis and management of complicated intra-abdominal infection in adults and children: guidelines by the Surgical Infection Society and the Infectious Diseases Society of America // Clin. Infect. Dis. — 2010. — 50. — 133-64.