Международный эндокринологический журнал 2 (34) 2011
Вернуться к номеру
Операции малых доступов и оптимизация тактики хирургического лечения новообразований надпочечников
Авторы: Сергийко С.В., ГОУ ВПО «Челябинская государственная медицинская академия Министерства здравоохранения и социального развития Российской Федерации»
Рубрики: Эндокринология
Версия для печати
Введение
Новый этап развития хирургии надпочечников связан с внедрением эндовидеохирургической техники (M. Gagner et al., 1992). Лапароскопическая адреналэктомия в России была впервые выполнена Н.А. Майстренко и Ю.Н. Сухопарой в 1995 году. Безусловно, эндовидеохирургическая методика адреналэктомии позволила решить многие задачи, прежде всего значительно снизить операционный травматизм и уменьшить количество осложнений. В то же время высокая стоимость оборудования, необходимость специальных навыков оперирования, расходных материалов и другие ограничения не позволяют считать ее эффективным и широко доступным методом хирургического лечения патологии надпочечных желез. Возможности использования других малоинвазивных методик, в частности операций из малых доступов в хирургии надпочечников, не изучены вообще. Разработка новых эффективных способов хирургических вмешательств на надпочечниках, сохранивших принцип малоинвазивности и лишенных недостатков эндовидеохирургических методик, представляется необходимой.
Значительно снизить вероятность гемодинамических нарушений, особенно при феохромоцитоме, позволяет адекватная предоперационная подготовка и малотравматичный доступ. Большинство исследователей считают такую подготовку необходимой, однако тактика и объективные критерии оценки эффективности такой подготовки не разработаны. Возможности неинвазивных методов оценки параметров кровообращения для объективизации эффективности предоперационной подготовки не изучены.
Долгое время опухоли надпочечников считались редким заболеванием. С активным внедрением в практическую медицину современных методов диагностики с высокой разрешающей способностью количество выявляемых новообразований надпочечников значительно возросло. Некоторые авторы, с учетом последнего обстоятельства, в отношении увеличения выявляемых новообразований надпочечников используют термин «эндокринологический СПИД». В то же время в Международной классификации болезней (МКБ-10) случайно обнаруженные опухоли надпочечников не выделены в отдельную нозологическую группу.
Остаются спорными вопросы, касающиеся хирургической тактики при небольших, случайно обнаруженных опухолях надпочечников. С одной стороны, отсутствие жалоб и клинических проявлений, с другой — необходимость травматичной операции для их удаления являются веским аргументом сторонников динамического наблюдения за этой категорией больных. Онкологическая настороженность и способность таких опухолей вырабатывать про- и/или постгормоны, опосредованно негативно влияющие на гомеостаз, оправдывают активную хирургическую тактику.
Артериальная гипертензия (АГ) в настоящее время является одной из актуальных проблем медицины. По данным ВОЗ (1998), частота артериальной гипертензии в общей популяции составляет до 30 %. Около 6 % симптоматических артериальных гипертензий связаны с заболеваниями желез внутренней секреции [1].
Гиперфункция надпочечников способствует дисрегуляции сердечно-сосудистой системы с формированием характерных структурно-функциональных изменений сердца. Вместе с тем до настоящего времени остаются недостаточно изученными изменения сердечно-сосудистой системы, развивающиеся при гиперфункции надпочечников [2].
Исследования, направленные на оптимизацию тактики и разработку новых малоинвазивных способов лечения заболеваний надпочечников, позволят улучшить результаты лечения этой категории больных.
Цель исследования — улучшение результатов лечения больных с новообразованиями надпочечников на основе комплексного подхода и выбора оптимальной лечебной тактики, разработки и внедрения новых способов малоинвазивной хирургии надпочечников.
Материал и методы исследования
За период с 1986 по 2009 год проведено хирургическое лечение 298 больным с различными новообразованиями надпочечников. Динамическое наблюдение в сроки от 6 месяцев до 15 лет осуществлялось за 27 пациентами с небольшими гормонально-неактивными опухолями надпочечников, 12 из которых впоследствии были оперированы из-за увеличения размеров новообразований, они включены в группу оперированных больных. Самому младшему пациенту было 10 месяцев, старшему — 82 года. Средний возраст оперированных больных составил 43,3 ± 5,4 года. Соотношение мужчин и женщин (индекс Ленц-Бауэра) составило 1 : 2,3.
Подавляющее большинство больных было трудоспособного возраста. Наиболее часто заболевание встречалось у женщин в возрасте 41–50 лет.
Критерии включения. В исследование были включены больные с гормонально-активными и гормонально-неактивными новообразованиями надпочечников, при которых хирургическая операция является методом выбора.
Критерии невключения в исследование: местнораспространенные нерезектабельные опухоли надпочечников; заведомо вненадпочечниковые опухоли забрюшинного пространства; одномоментные двухсторонние адреналэктомии.
В 150 (50,4 %) случаях операции выполнялись по поводу так называемых гормонально-неактивных опухолей надпочечников (ГНОН).
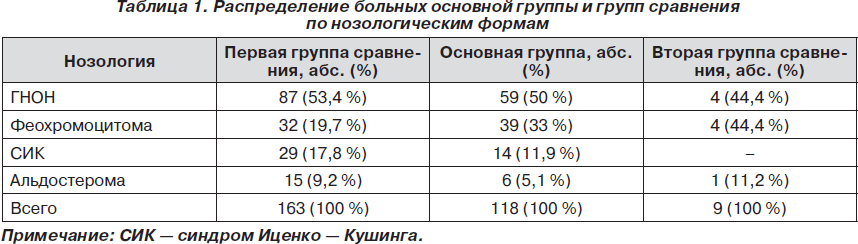
Гормонально-неактивными считали опухоли без клинических проявлений гиперфункции надпочечников при нормальных лабораторных показателях основных гормонов надпочечников. Больные с различными гормонально-активными опухолями в структуре хирургической патологии надпочечников составили чуть меньше половины — 148 (49,6 %) от общего числа прооперированных пациентов. В зависимости от способа адреналэктомии все больные были разделены на основную группу и две группы сравнения (табл. 1). Основную группу составили 118 пациентов, операции на надпочечниках у которых выполнялись через разработанные в клинике малые доступы. В первой группе сравнения 163 пациента оперированы с использованием модифицированного торакофренолапаротомного доступа (В.А. Крижановский с соавт., 1979), вторую группу сравнения составили 9 пациентов после лапароскопической адреналэктомии.
Средний возраст пациентов, оперированных из мини-доступа (основная группа), составил 46,7 ± 3,5 года, в первой группе сравнения (торакофренолапаротомный доступ) — 48,3 ± 2,3 года, во второй группе сравнения (лапароскопическая адреналэктомия) — 49,8 ± 12,1 года. Сравнивали основные показатели, отражающие степень операционной агрессии и травматичность операции (объем кровопотери, продолжительность операции, выраженность болевого синдрома, потребность в инфузионной терапии, течение раннего послеоперационного периода, длительность пребывания в реанимационном отделении, продолжительность стационарного лечения и др.). Для выполнения оперативных вмешательств на надпочечниках из малых доступов был усовершенствован базовый набор инструментов серии «мини-ассистент» для операций на желчном пузыре, предложенный М.И. Прудковым (М.И. Прудков, 1993).
Топографо-анатомические исследования. Для изучения возможности использования малых доступов в хирургическом лечении заболеваний надпочечников нами было проведено анатомо-топографическое исследование основных параметров хирургического доступа. Оценка пространственных условий в операционной ране проведена при прямом транс- абдоминальном мини-доступе и заднепоясничном внебрюшинном мини-доступе к левому и правому надпочечникам. Поочередно при помощи комплекта инструментов «мини-ассистент» осуществлялся внутрибрюшной доступ к правому, а затем к левому надпочечнику. Далее в положении трупа на животе, в углу между XII ребром и наружным краем мышцы, разгибающей позвоночник, при помощи того же комплекта инструментов поочередно осуществлялся внебрюшинный доступ к правому и левому надпочечникам. После формирования стабильного операционного пространства исследовались параметры доступов. Для объективной оценки качества операционного доступа по А.Ю. Созон-Ярошевичу (1954) оценивали следующие параметры: направление и угол наклонения (a) оси операционного действия (А), глубину раны (H), угол операционного действия (b), длину раны (L) и зону доступности (S).
Для создания многомерной модели возможной глубины операционной раны были использованы результаты антропометрических исследований 29 пациентов и с помощью программного комплекса SPSS-11 (А. Бююль, П. Цефель, 2002) произведены соответствующие расчеты. В основе расчетов использован метод стандартной многомерной линейной регрессии, который позволяет путем анализа степени взаимосвязи между всеми компонентами модели (вес, рост, окружность грудной клетки и другие) выбрать из их числа наиболее важные, влияющие на искомую величину, которой в нашем случае являлась прогнозируемая глубина раны. Вычисления проводились по формуле Н = Нo + Вi Xi, где Н — прогнозируемая глубина раны, Нo — постоянная величина, Вi — коэффициент регрессии (постоянная величина, найденная в ходе статистического анализа), Xi — анатомо-топографические параметры тела (вес, рост и др.). Созданная математическая модель прогнозирования глубины раны являлась основой для определения технических возможностей выполнения малоинвазивного вмешательства у конкретного пациента.
Гемодинамические исследования. Исследование параметров кровообращения проводилось пациентам после определения типа гормональной секреции опухоли надпочечника перед операцией. Кроме общепринятых методов исследования сердечно-сосудистой системы (ЭКГ, измерение артериального давления (АД) и частоты пульса) применялись современные неинвазивные методы с использованием эхокардиографии (ЭхоКГ), суточного мониторирования артериального давления (СМАД) и биоимпедансной реовазографии по технологии «Кентавр».
Критерии включения в исследование: больные с новообразованиями надпочечников с синдромом гиперфункции коры или мозгового слоя надпочечников; больные с новообразованиями надпочечников без клиники гормональной активности с наличием артериальной гипертензии и без нее; гипертонический анамнез не более 10 лет.
Критерии невключения в исследование: симптоматические артериальные гипертензии вненадпочечникового происхождения; ишемическая болезнь сердца, ментальные расстройства, затрудняющие продуктивный контакт с людьми, сахарный диабет, пороки сердца, хронический алкоголизм и наркомания, сопутствующие острые и хронические заболевания в активной фазе с органной недостаточностью выше 1-й степени.
Для оценки влияния предоперационной подготовки на кровообращение дополнительно изучена динамика показателей биоимпедансной реовазографии у больных феохромоцитомой до и после достижения клинического эффекта медикаментозной подготовки. Измерения проводились в положении больного лежа после 5-минутной адаптации к горизонтальному положению. Проводилась регистрация параметров кровообращения в режиме каждого удара сердца. Фиксировались все последовательные данные за каждый кардиоинтервал в объеме 500 ударов и рассчитывались их средние значения. В этом режиме проводился расчет ударного объема (УО), сократительного индекса, фракции выброса (ФВ), систолического индекса, симпатического сосудистого тонуса (S), амплитуды пульсации периферических сосудов (АФПГ), индекса общего периферического сопротивления (иОПСС), конечного диастолического индекса, сатурации тканей кислородом. Импедансометрически фиксировалось систолическое (САД) и диастолическое артериальное давление (ДАД), частота сердечных сокращений (ЧСС).
Статистические методы исследования. Математический и статистический анализ производили на персональном компьютере (IBM PC Pentium IV) с помощью программного комплекса SPSS-11 (А. Бююль, П. Цефель, 2002) и пакета прикладных программ Miсrosoft Word, Exсel (версия 2007) и «Биостат». Использовались традиционные параметрические методы вариационной статистики с вычислением средних величин, ошибки средней, среднеквадратичного отклонения. О достоверности различных показателей судили по критериям Стьюдента (t), при анализе качественных показателей — по точному критерию Фишера (использовался односторонний его вариант).
Результаты исследования и их обсуждение
Исследования показали, что структура новообразований надпочечников представлена в 50,4 % опухолями без клинических проявлений гормональной активности. Новообразования с гиперфункцией коркового или мозгового слоев надпочечника составляли чуть меньше половины (49,6 %) от всех новообразований этого органа. Среди гормонально-активных опухолей наибольшую часть составили феохромоцитомы (56,1 %), меньше — кортикостеромы (27,7 %) и альдостеромы (16,2 %). Установлено, что частота распространенности новообразований надпочечников в Челябинской области составляет 4,14 случая на 1000 тыс. населения в год. Среди них феохромоцитомы встречаются с частотой 1,2 случая, кортикостеромы — 0,57, альдостеромы — 0,33 случая на 1000 тыс. человек в год. Клинически «немые» гормонально-неактивные новообразования надпочечников встречаются с частотой 2,08 случая в год на 1000 тыс. человек. Соотношение мужчин и женщин (индекс Ленц-Бауэра) составило 1 : 2,3.
Появление компьютерной и магнитно-резонансной томографии в конце 90-х годов ХХ века привело к резкому увеличению (более чем в 4 раза) количества выявляемых и оперированных пациентов с новообразованиями этих желез.
Для обсуждения вопросов онкологической настороженности были изучены особенности морфологического строения гормонально-неактивных опухолей надпочечников у 150 больных. Размеры удаленных гормонально-неактивных новообразований надпочечников колебались от 2 до 23 см в диаметре, средний размер составил 5,56 ± 2,31 см. Большинство клинически «немых» опухолей надпочечников представлено новообразованиями, исходящими из коркового слоя надпочечника, — 107 (71,3 %). Среди них светлоклеточные адренокортикальные аденомы выявлены у 81 (54,0 %), смешанного строения — у 12 (8,0 %), темноклеточные аденомы — у 7 (4,7 %). Адренокортикальный рак надпочечника гистологически верифицирован у 7 (4,7 %) пациентов. Доброкачественные опухоли, исходящие из мозгового слоя, составили 4 (3 %) случая. Среди них бессимптомные феохромоцитомы выявлены у 5 (3,3 %), ганглионеврома — у 1 (0,6 %) пациента. Другие поражения надпочечников верифицированы у 29 (19,3 %) пациентов.
Таким образом, злокачественные опухоли надпочечников имели место у 16 (10,7 %) пациентов: первичные — у 9 (6,0 %), метастатические поражения надпочечников — у 7 (4,7 %) больных. Их следует относить к категории онкологического риска. Размеры злокачественных новообразований, как правило, превышали 6 см (средний размер 12,4 ± 4,8 см).
Динамическое наблюдение в сроки от 6 месяцев до 15 лет проведено нами за 27 пациентами с небольшими гормонально-неактивными опухолями надпочечников без признаков злокачественного роста. Более половины наблюдавшихся (17) составили пациенты пожилого возраста с тяжелой сопутствующей патологией, повышающей риск хирургического вмешательства. За время наблюдения в сроки от 6 до 36 месяцев у 12 (7,3 %) пациентов установлены показания к оперативному лечению: из-за увеличения размеров опухоли (8), изменения структуры опухоли (2), появления признаков гормональной активности (2). По нашим данным, рост опухоли надпочечника происходит в течение первых 2–3 лет наблюдения, признаки гиперфункции надпочечников проявляются, как правило, в течение первых 1,5–2 лет. Среди удаленных опухолей лишь у 1 пациентки верифицирована феохромоцитома надпочечника. Злокачественных опухолей не выявлено.
С целью уменьшения травматичности вмешательств на надпочечниках нами разработаны новые малоинвазивные доступы к надпочечникам. Базовой моделью для адреналэктомии из малых доступов послужил комплект инструментов «мини-ассистент» (медицинской компании SAN, г. Екатеринбург), предназначенный для хирургии желчнокаменной болезни.
Отмеченные в процессе анатомических исследований недостатки заставили нас искать пути оптимизации хирургических вмешательств на надпочечниках из малых доступов. В связи с этим возникла необходимость в модернизации хирургических инструментов и оперативной техники. Первоначально требовалось создать более глубокое стабильное операционное пространство с хорошей зоной доступности. Для этого в базовый комплект «мини-ассистент» было дополнительно введено 2 удлиненных (13 и 15 см) зеркала-ретрактора. Для облегчения манипуляций на надпочечной железе был разработан зажим-фиксатор, позволяющий удерживать и перемещать надпочечник в ране, не повреждая его капсулу. Конструктивной особенностью зажима-фиксатора ткани надпочечника являлось оптимально подобранное сочетание жесткости, геометрии и размеров рабочей поверхности инструмента. Внесенные конструктивные изменения позволили мягко и надежно удерживать, перемещать надпочечную железу во время операции, не раздавливая ее. Для обеспечения безопасной манипуляции на сосудах надпочечника были внесены конструктивные изменения и в зажим-диссектор. Дополнительно подверглись конструктивным изменениям и другие специальные инструменты из комплекта «мини-ассистент» для операций на почках и мочеточниках. Таким образом, был создан новый комплект инструментов «мини-ассистент» для хирургических вмешательств на надпочечниках и забрюшинном пространстве. Все инструменты совместно разработаны и изготовлены медицинской компанией SAN, г. Екатеринбург (патенты № 37308 и 37309).
С использованием методов статистического анализа было доказано, что глубину операционной раны при планировании хирургической операции на надпочечнике из трансабдоминального доступа можно прогнозировать с помощью математической модели, представляющей собой уравнение множественной линейной регрессии. Наиболее значимыми прогностическими факторами, определяющими глубину раны, являются окружность грудной клетки и величина межреберного угла. Значимость остальных факторов оказалась значительно слабее. Предельная величина (размер глубины раны) Н для «комфортного» оперирования была установлена опытным путем и составляла ≤ 15 см.
Пример. У пациента с длиной окружности грудной клетки, равной 81 см, и размером межреберного угла 100° возможно рассчитать предполагаемую глубину операционной раны (Н) до надпочечника, используя расчетные коэффициенты математической модели. Подставляя абсолютные величины в формулу Н = Нo + B3 81 см + B7 100° (Нo = –6,147, B3 = 0,179, B7 = 0,04087), получаем Н = –6,147 + + (0,179 81 см) + (0,04087 100°) = 12,43 см.
Таким образом, величина предполагаемой глубины операционной раны у больного (Н) равна 12,43 см. Этому пациенту возможно выполнение адреналэктомии из мини-доступа, что и было подтверждено во время операции.
На следующем этапе нашего исследования была разработана хирургическая техника операций из малых доступов и изучены возможности их практического применения. В процессе клинической разработки у 25 пациентов были исследованы интраоперационные характеристики доступа к надпочечникам и факторы, на них влияющие, а также отмечены его положительные и отрицательные стороны. При измерении параметров операционного доступа в процессе клинической апробации и практического применения трансабдоминального мини-доступа к надпочечнику отмечено заметное улучшение показателей доступа в сравнении с анатомическими исследованиями. Валик, используемый при операциях, позволяет на 1–2 см уменьшить глубину раны. Заметно увеличились угол операционного действия и угол наклона оси операционного действия, что достигнуто благодаря использованию технических приемов низведения надпочечников.
В результате клинической апробации разработана методика адреналэктомии из трансабдоминального мини-доступа и сформированы клинико-анатомические критерии отбора пациентов для подобных операций:
— отсутствие косвенных признаков злокачественного роста;
— размер опухоли надпочечника не более 8 см;
— глубина расположения надпочечника не более 15 см.
Недостатки трансабдоминального мини-доступа к левому надпочечнику послужили поводом для разработки другого малого доступа, лишенного этих недостатков. Основой для клинической разработки заднего мини-доступа к левому надпочечнику послужили ранее проведенные нами анатомические исследования.
В процессе клинической разработки доступа отмечены его положительные и отрицательные стороны.
Показанием к применению данного доступа являются небольшие (до 5 см в диаметре) доброкачественные гормонально-неактивные опухоли левого надпочечника у лиц нормостенического телосложения.
Для повышения эффективности и безопасности хирургического вмешательства в сложных клинических ситуациях разработан способ комбинированных операций, сочетающий в себе одновременное использование технологий малого доступа и лапароскопической адреналэктомии. Основной этап операции выполняется через трансабдоминальный мини-доступ, а при необходимости на этапе мобилизации центральной вены надпочечника и нижней полой вены используют эндовидеоскопическую поддержку. Использование данной методики позволяет сочетать технические приемы лапароскопической адреналэктомии с технологией малых доступов, что значительно расширяет возможности хирурга и облегчает выполнение основного этапа операции, особенно при интимном сращении опухоли надпочечника с нижней полой веной.
Таким образом, проведенные анатомические и клинические исследования, усовершенствованные инструменты, разработанная математическая модель и технология операций из малых доступов позволили создать новый способ хирургического лечения заболеваний надпочечников.
При сравнительном анализе показателей ЭхоКГ больных феохромоцитомой и пациентов контрольных групп выявлены достоверные различия. Гипертрофия миокарда правого желудочка сердца при феохромоцитоме более выражена, чем у больных с гипертонической болезнью (ГБ), но при этом меньше размеры левого предсердия и давление заклинивания легочных капилляров. У больных феохромоцитомой обращает на себя внимание выраженный гиперкинетический компонент по сравнению с гипертонической болезнью, а гипертрофия миокарда левого желудочка (ЛЖ) менее выражена, что, вероятно, объясняется пароксизмальным характером катехоламиновой стимуляции миокарда при феохромоцитоме.
Изменения сердца при гиперкортицизме характеризуются концентрической гипертрофией миокарда левого желудочка с достоверным увеличением относительной толщины стенок левого желудочка по сравнению с больными гипертонической болезнью и здоровыми людьми.
У больных с гиперкортицизмом достоверно больше индекс массы миокарда левого желудочка (ИММЛЖ) и относительная толщина стенок левого желудочка, толщина задней стенки левого желудочка и толщина миокарда правого желудочка в сравнении с пациентами, страдающими гипертонической болезнью, а также увеличены размеры левого предсердия с тенденцией к гипокинезии межжелудочковой перегородки (ЭксМЖП). В прогностическом плане подобные изменения миокарда наиболее неблагоприятны. У пациентов с гипертонической болезнью в отличие от больных гиперкортицизмом межжелудочковая перегородка гиперкинетична и увеличен просвет корня аорты.
При гиперальдостеронизме ремоделирование миокарда характеризуется гипертрофией обоих желудочков с увеличением размеров полостей левых отделов сердца, отмечается увеличение показателей индекса массы миокарда левого желудочка и относительной толщины стенок левого желудочка по сравнению со здоровыми людьми.
При сравнении с пациентами с гипертонической болезнью у больных гиперальдостеронизмом гипертрофия миокарда правого желудочка более выражена, что может косвенно свидетельствовать о наличии легочной гипертензии. При гиперальдостеронизме существенно увеличен ударный объем левого желудочка, более низкое давление заклинивания легочных капилляров, имеется тенденция к гипокинезии межжелудочковой перегородки.
Для оценки достоверности различий структурно-функциональных изменений сердца, выявленных при эхокардиографическом обследовании, проведено сравнение полученных данных у больных с кортикостеромой, альдостеромой и феохромоцитомой.
У больных гиперальдостеронизмом отмечается более выраженная гипертрофия миокарда правого желудочка и увеличение полости левого желудочка в сравнении с другими новообразованиями надпочечников. В то же время при феохромоцитоме и гиперкортицизме имеется более высокое давление заклинивания легочных капилляров, что косвенно свидетельствует о нарушении функции левого желудочка сердца. При кортикостероме гипертрофия миокарда правого желудочка менее выражена, чем при феохромоцитоме и альдостероме, вероятно, это связано с более высоким артериальным давлением в малом круге кровообращения, имеющимся при альдостерон- и катехоламинпродуцирующих опухолях надпочечников. В то же время при кортизолпродуцирующих опухолях надпочечников, в отличие от альдостеромы и феохромоцитомы, гипертрофия миокарда левого желудочка приобретает концентрический характер и имеет более неблагоприятный прогноз. При феохромоцитоме, в отличие от других опухолей надпочечников, более выражена гиперкинезия сердечной мышцы.
Для симптоматической артериальной гипертензии надпочечникового генеза характерны выраженная концентрическая гипертрофия левого желудочка и гипертрофия миокарда правого желудочка сердца, не характерные для ГБ; определяется гиперкинезия задней стенки левого желудочка при относительной гипокинезии межжелудочковой перегородки сердца.
Для комплексной оценки глобального гемодинамического статуса у больных с новообразованиями надпочечников помимо структурно-функциональных изменений сердца дополнительно изучены инотропная, волемическая и вазотоническая функции кровообращения по данным биоимпедансной реовазографии.
При сравнении показателей гемодинамики методом биоимпедансной реовазографии у больных с феохромоцитомой в межкризовый период, в отличие от здоровых людей, имелась умеренная систолическая (р = 0,01) и диастолическая артериальная гипертензия (р = 0,05) с выраженной тахикардией (р = 0,005). Показатели ударного объема сердца достоверно снижены (р = 0,05) при сохраненной фракции сердечного выброса. Значительно снижена (р = 0,001) амплитуда пульсации периферических сосудов больных. Обращает на себя внимание повышенная постнагрузка (р = 0,001) на фоне высокого индекса общего периферического сопротивления сосудов. Высокая постнагрузка на фоне некоронарогенной миокардиодистрофии может привести к развитию острой левожелудочковой недостаточности, что является фактором высокого риска внезапной сердечной смерти. Подобные нарушения гемодинамики при феохромоцитоме требуют медикаментозной коррекции при подготовке пациента к хирургическому лечению.
У пациентов с кортикостеромой в отличие от здоровых людей отмечается умеренная систолическая (р = 0,005) и диастолическая (р = 0,02) артериальная гипертензия с умеренной тахикардией (р = 0,05), снижение фракции выброса (р = 0,04) на фоне нормальных показателей ударного объема и сердечного индекса. Достоверно снижены (р = 0,03) показатели сатурации кислорода (SatO2) и существенно выше (р = 0,02) показатели базисного сопротивления грудной клетки (Z0), что указывает на перегрузку жидкостью ткани легких. Данные изменения указывают на тяжелые гемодинамические нарушения у больных с гиперкортицизмом. Анестезиологический риск у пациентов этой группы наиболее высок.
У пациентов с альдостеромой в отличие от здоровых людей имеется систолическая и диастолическая артериальная гипертензия с тахикардией (р = 0,04). Снижены показатели (р = 0,03) ударного объема сердца на фоне увеличения амплитуды пульсации периферических сосудов (р = 0,02) со снижением (р = 0,02) их симпатического тонуса (S). Подобные изменения указывают на тяжелое течение артериальной гипертензии при альдостероме и значительные нарушения периферической гемодинамики.
При сравнении различных форм симптоматической артериальной гипертензии при патологии надпочечников получены следующие результаты. Показатели САД и ДАД при различной патологии надпочечников во многом схожи. ЧСС у больных альдостеромой (88,0 ± 5,2 уд/мин) несколько выше (р = 0,04), чем у больных гиперкортицизмом (74,7 ± 4,3 уд/мин) и достоверно не отличается от показателей больных феохромоцитомой в межкризовый период (82,6 ± 13,2 уд/мин).
Таким образом, были получены достоверные различия в показателях системной гемодинамики у пациентов с катехоламиновой, минералокортикоидной и глюкокортикоидной гиперфункцией надпочечников.
Выявленные особенности структурно-функциональных изменений сердца и параметров кровообращения у больных с гормонально-активными новообразованиями надпочечников позволили использовать их для дифференциальной диагностики синдрома артериальной гипертензии у больных с гормонально-неактивными новообразованиями надпочечников. Наиболее частым симптомом у 64 (43 %) пациентов с ГНОН было повышение артериального давления. В связи с этим проведен ретроспективный анализ показателей ЭхоКГ и биоимпедансной реовазографии у пациентов с ГНОН с учетом динамики артериального давления в послеоперационном периоде.
При отсутствии эффекта от адреналэктомии у 36 (56,3 %) больных считали, что артериальная гипертензия имеет эссенциальное происхождение, то есть имеется сочетание ГНОН и ГБ. О синдромальном (надпочечниковом) генезе артериальной гипертензии у 28 (43,7 %) больных с так называемыми гормонально-неактивными опухолями надпочечников свидетельствовали нормализация артериального давления или более мягкое течение артериальной гипертензии после адреналэктомии.
При сравнительном ретроспективном анализе показателей ЭхоКГ у больных ГНОН с синдромом АГ и эссенциальной гипертензией (ГБ) отмечено, что при ГБ достоверно увеличены: экскурсия межжелудочковой перегородки, давление заклинивания легочных капилляров. ИММЛЖ и относительная толщина стенок левого желудочка у этих групп пациентов достоверных различий не имели. Подобные изменения могут свидетельствовать о более выраженном нарушении функции левого желудочка у больных с ГБ, нежели у пациентов с ГНОН и АГ.
Показатели ИММЛЖ у больных с ГНОН без АГ были достоверно выше, чем у здоровых людей, что может свидетельствовать о наличии скрытого негативного влияния этих опухолей на миокард.
Показатели ЭхоКГ у больных ГНОН с АГ сходны с таковыми при эссенциальной артериальной гипертензии (ГБ), при этом нарушения функции левого желудочка сердца более выражены при ГБ.
Течение артериальной гипертензии после операции у больных с гормонально-неактивными опухолями надпочечников различалось. Из 28 пациентов с синдромом артериальной гипертензии надпочечникового генеза, подтвержденным данными ЭхоКГ, в послеоперационном периоде нормализация артериального давления наступила у 22 (78,6 %), или же синдром артериальной гипертензии после операции приобретал более мягкое, чувствительное к гипотензивной терапии течение — у 6 (21,4 %).
У 36 пациентов с ГНОН, артериальную гипертензию у которых мы расценивали как сочетанную патологию, явного положительного эффекта от оперативного лечения не было. В то же время у 5 (13,9 %) из них эффективность гипотензивной терапии значительно улучшилась.
При оценке показателей биоимпедансной реовазографии у 13 пациентов с гормонально-неактивными опухолями надпочечников без артериальной гипертензии отмечено лишь снижение (р = 0,03) индекса общего периферического сопротивления сосудов по сравнению со здоровыми людьми, других достоверных различий не выявлено. Сходство показателей гемодинамики у здоровых и больных указывает на отсутствие негативного влияния этих опухолей на инотропную, волемическую и вазотоническую функции кровообращения.
В то же время при ретроспективном анализе исходных показателей биоимпедансной реовазографии у 17 пациентов с гормонально-неактивными опухолями надпочечников с артериальной гипертензией и с положительным эффектом от адреналэктомии выявлены отличия некоторых показателей гемодинамики от таковых у здоровых людей. У 10 (58,8 %) больных отмечалась систолическая и диастолическая артериальная гипертензия с тахикардией, были снижены УО, индекс кислородного обеспечения тканей и амплитуда пульсации периферических сосудов, а также было повышено общее периферическое сопротивление сосудов. При морфологическом исследовании удаленных новообразований надпочечников у 3 из них подтверждена феохромоцитома, в 7 случаях имели место адренокортикальные аденомы надпочечников. У 5 (29,4 %) пациентов показатели кровообращения были схожи с таковыми у больных кортикостеромой. У двух других пациенток на фоне систолической артериальной гипертензии имелось лишь повышение индекса общего периферического сопротивления. Морфологически у всех больных имели место адренокортикальные аденомы надпочечников.
Таким образом, артериальная гипертензия, отмечавшаяся у 64 пациентов с гормонально-неактивными новообразованиями надпочечников, имела надпочечниковое происхождение лишь у 28 (43,8 %) больных, в остальных 36 (56,2 %) случаях имелось сочетание гипертонической болезни и гормонально-неактивной опухоли надпочечника.
На основании комплексного обследования с изучением особенностей клинического течения у 165 пациентов с гормонально-неактивными новообразованиями надпочечников, морфологического строения у 150 и результатов динамического наблюдения за 27 больными из их числа нами выделены 3 группы риска, определяющие потенциальную опасность гормонально-неактивных опухолей надпочечников для жизни и здоровья пациентов.
— Группа низкого риска — 26 (15,8 %). Гормонально-неактивные новообразования надпочечников (до 4 см) являются доброкачественными и не представляют опасности для жизни и здоровья пациента. В этой группе пациентов оправдана консервативно-выжидательная тактика с комплексным динамическим обследованием.
— Группа умеренного риска — 90 (54,5 %). Доброкачественные новообразования надпочечников с различными неспецифическими клиническими проявлениями. У этой группы пациентов имеются показания к хирургическому лечению, при наличии соматических противопоказаний возможна консервативно-выжидательная тактика.
— Группа высокого клинического риска — 49 (29,7 %). Пациенты с симптоматической артериальной гипертензией надпочечникового происхождения; с «немыми» феохромоцитомами; первичными злокачественными новообразованиями надпочечников; с метастатическими поражениями надпочечников. В этой группе пациентов имеются абсолютные показания к хирургическому лечению независимо от размеров новообразования надпочечника.
Для дальнейшего изучения особенностей синдрома катехоламиновой артериальной гипертензии исследованы показатели суточного мониторинга артериального давления у 30 больных феохромоцитомой. Все они имели классическую клинику феохромоцитомы с наличием гемодинамических кризов. Пароксизмальная форма артериальной гипертензии отмечалась у 18 (60 %) из них, смешанная форма артериальной гипертензии — у 12 (40 %).
Нормальное снижение систолического артериального давления в ночное время (dipper по САД), характерное для здоровых людей, отмечено лишь в 20 % случаев у больных с феохромоцитомой и в 53 % случаев у пациентов, страдающих гипертонической болезнью. Нормальное снижение диастолического артериального давления в ночное время (dipper по ДАД) имело место у больных феохромоцитомой в 23 % случаев, при гипертонической болезни — в 44,1 %. Недостаточное (non-dipper) или избыточное (over-dipper) снижение ночного артериального давления достоверно чаще отмечено у больных с гипертонической болезнью — 23,5 и 32,5 % случаев соответственно. Наибольшую группу среди больных с феохромоцитомой (63 %) составили пациенты с ночными пароксизмами артериальной гипертензии (night-peaker). Подобные изменения свидетельствуют как о постоянно высоком тонусе сердечной мышцы с недостаточным расслаблением ее во время ночного сна, так и о высоком сосудистом сопротивлении на фоне повышенного артериального давления. Это подтверждают ранее проведенные исследования структурно-функциональных характеристик сердца и параметров кровообращения у больных феохромоцитомой. Подобные изменения миокарда и нарушения гемодинамики при феохромоцитоме требуют основательной медикаментозной коррекции при подготовке пациента к хирургическому лечению. Существующие критерии оценки эффективности предоперационной подготовки в подавляющем большинстве субъективны и основаны на оценке ее клинических эффектов. В связи с этим изучение влияния предоперационной подготовки на параметры кровообращения с использованием объективных современных методов исследования представляется интересным и необходимым.
Мы исследовали динамику показателей СМАД у 30 больных и биоимпедансной реовазографии у 17 больных феохромоцитомой до и после достижения клинического эффекта предоперационной медикаментозной подготовки. Клиническую оценку адекватности адренергической блокады во время предоперационной подготовки проводили на основании субъективных ощущений пациентов и данных аутометрии АД с учетом частоты и выраженности гипертензивных кризов.
Суточная доза доксазозина (кардуры) колебалась от 2 до 16 мг/сут (средняя доза 6 ± 2 мг/сут), продолжительность стабилизации АД — от 7 до 21 суток (среднее время 12,0 ± 3,8 суток).
После предоперационной подготовки установлено, что количество пациентов категории с нормальными показателями снижения САД и ДАД в ночное время, характерными для здоровых людей (dipper), увеличилось в 2 раза (по САД — с 20 до 43,3 %, р = 0,02; по ДАД — с 23 до 40 %, р = 0,04). Количество пациентов с недостаточным снижением ночного артериального давления (non-dipper) достоверно не изменилось, в то время как категория больных с избыточным снижением ночного САД и ДАД (over-dipper) увеличилась в 5 раз (с 6,7 до 33 %, р = 0,008). Наибольшую группу среди больных с феохромоцитомой — 19 (63 %) — составляли пациенты с устойчивым ночным повышением АД (night-peaker). После медикаментозной a-адреноблокады количество пациентов с устойчивым ночным повышением АД снизилось более чем в три раза (с 63,3 до 16,7 % по САД, р = 0,02; с 63,3 до 20 % по ДАД, р = 0,03). При сравнительном анализе установлено, что практически все показатели СМАД после предоперационной подготовки имели положительную динамику, за исключением возросшего количества пациентов с избыточным ночным снижением АД (over-dipper), что, вероятно, обусловлено побочным эффектом a-адреноблокаторов. Следующим этапом нашего исследования стал анализ показателей биоимпедансной реовазографии у больных феохромоцитомой и влияния предоперационной подготовки на изменение параметров кровообращения.
При сравнительном анализе показателей гемодинамики у больных феохромоцитомой до и после предоперационной a-адреноблокады выявлено достоверное снижение показателей САД и ДАД до целевого уровня — 113,25 ± 14,72 мм рт.ст. (р = 0,01) и 79,12 ± 7,12 мм рт.ст. (р = 0,02) соответственно. УО ЛЖ недостоверно возрастал, а показатели ФВ не изменились. В то же время значительно снизился (р = 0,01) иОПСС — с 2572,7 ± 205,1 до 1774,17 ± 216,24 дин • с • см–5 • м2 и существен- но увеличилась амплитуда фотоплетизмографии (АФПГ) — с 24,3 ± 5,2 до 81,12 ± 59,60 перф.ед. (р = 0,001). Уменьшилось базисное сопротивление грудной клетки — с 38,57 ± 3,50 Ом до 31,56 ± 4,48 Ом (р = 0,04).
Таким образом, наиболее значимыми объективными показателями для оценки эффективности предоперационной подготовки у больных феохромоцитомой являются САД, ДАД, иОПСС и амплитуда фотоплетизмографии. Нормализация этих показателей у больных феохромоцитомой свидетельствует о достижении эффекта a-адреноблокады и является критерием оценки ее эффективности. Достигнутые изменения параметров кровообращения после a-адреноблокады в целом свидетельствуют об улучшении функциональной работы сердца, уменьшении постнагрузки за счет снижения тонуса периферических сосудов, что снижает риск развития острой левожелудочковой недостаточности.
Сравнительная оценка результатов хирургического лечения проведена нами в 3 группах пациентов, оперированных различными способами. В основной группе из 118 пациентов адреналэктомии выполнены с использованием различных вариантов малых доступов к надпочечникам и видеоассистированных вмешательств.
Трансабдоминальный мини-доступ к надпочечникам использовался нами наиболее часто — у 97 (82 %) больных. Он обладает минимальной травматичностью, обеспечивает хорошую зону операционной доступности, что дает возможность при необходимости выполнять симультанные вмешательства на близлежащих органах. Центральная вена надпочечника как справа, так и слева при трансабдоминальном доступе легко доступна, что позволяет использовать его для удаления хромаффинных опухолей. Не требуется сложной укладки больного на операционном столе, что облегчает проведение наркоза и операции. Альтернативные внебрюшинные малые доступы к левому надпочечнику по своим характеристикам оказались менее эффективными и технически более сложными, что послужило причиной ограниченного их применения. Технические затруднения, потребовавшие конверсии доступа, возникли при заднем поясничном мини-доступе у 1 больного (11,1 %). Конверсия трансабдоминального мини-доступа потребовалась у 6 (4,8 %) пациентов при удалении опухолей надпочечников размером более 8 см в диаметре. Кровотечения, возникшие у 2 (1,7 %) пациентов на этапе освоения и клинической апробации доступа, явились следствием технических ошибок.
Таким образом, передний трансабдоминальный мини-доступ является оптимальным малым доступом для адреналэктомии при большинстве ново-образований надпочечников.
Показаниями к его применению являются: доброкачественные гормонально-активные и гормонально-неактивные опухоли надпочечников размером не более 8 см.
Ограничением к применению доступа можно считать: злокачественные новообразования надпочечников; опухоли надпочечников размером свыше 8 см в диаметре; гиперстенический тип телосложения; расчетная глубина расположения надпочечников более 15 см.
Внебрюшинные боковой и поясничные доступы показаны лишь при доброкачественных новообразованиях левого надпочечника до 5 см в диаметре у нормостеников. Противопоказано применение внебрюшинных малых доступов при феохромоцитоме из-за труднодоступности центральной надпочечниковой вены. Ограничены возможности применения внебрюшинных малых доступов у больных с гиперкортицизмом из-за выраженного развития забрюшинной клетчатки, затрудняющей поиск надпочечника.
Для оптимизации показаний к выбору способа адреналэктомии у больных с новообразованиями надпочечников проведен сравнительный анализ непосредственных результатов хирургического лечения больных в сравниваемых группах.
Длина разреза при традиционной торакофренолапаротомии колебалась от 15 до 30 см и составила в среднем 22,3 ± 3,1 см. При малых доступах длина разреза была значительно меньше, варьировала от 4 см до 6 см и в среднем составила 5,1 ± 0,4 см. Сопоставимой с этим была длина основного разреза при лапароскопической адреналэктомии (5 см), через который удалялся надпочечник, но следует отметить, что дополнительно приходилось выполнять еще 3–4 разреза от 0,5 до 1,0 см для введения троакаров. При этом необходимо отметить, что оценка инвазивности операции основывалась лишь на объеме местных механических повреждений тканей без учета негативного влияния пневмоперитонеума на гемодинамику и газообмен.
Продолжительность адреналэктомии при традиционной торакофренолапаротомии и с использованием мини-доступов была почти одинаковой и составила 93,1 ± 14,4 мин и 87,0 ± 15,0 мин соответственно.
Длительность лапароскопической адреналэктомии была вдвое больше и составляла 190,0 ± 33,2 мин, вероятно, это связано с отсутствием достаточного клинического опыта проведения лапароскопических операций. В то же время научные публикации, анализирующие аналогичную проблему, приводят примерно схожие данные — 160,4 ± 11,0 мин (В.О. Бондаренко с соавт., 2004; Д.Ю. Семенов с соавт., 2004).
Объем кровопотери во время адреналэктомии с использованием технологии малых доступов и лапароскопии не превышал 100 мл. В группе больных, оперированных с использованием торакофренолапаротомического доступа, кровопотеря была значительно больше и составляла около 500 мл.
В основной группе больных во время операции возникло одно (0,8 %) непрогнозируемое осложнение, которое явилось следствием технической ошибки на этапе освоения методики операции. Количество интраоперационных осложнений в группе больных, оперированных традиционным доступом, было большим — 6 (3,6 %), однако все они возникали при выполнении технически трудных адреналэктомий и чаще всего были прогнозируемыми. 2 (11,1 %) интраоперационных осложнения в виде диффузного кровотечения из ткани надпочечника возникли при выполнении лапароскопической адреналэктомии. По данным литературы, частота интраоперационных осложнений лапароскопических адреналэктомий в ведущих клиниках России колеблется от 1,4 до 4,7 % (Н.А. Майстренко с соавт., 2001; А.М. Казарян с соавт., 2003; В.О. Бондаренко с соавт., 2004).
Таким образом, наиболее частыми интраоперационными осложнениями при выполнении адренал- эктомий являются кровотечения из поврежденной нижней полой вены, почечной и центральной вены надпочечника, а также из его паренхимы. Технология операций из малых доступов включает в себя использование специальных инструментов и бережной прецизионной техники дистанционного оперирования, которая в большинстве случаев позволяет избежать подобных осложнений. Конверсия операционного доступа в основной группе больных поведена у 8 (6,8 %) пациентов, в том числе с целью устранения осложнений — только у одного больного. Во второй группе сравнения при лапароскопической адренал- эктомии необходимость в изменении способа адреналэктомии возникла в 3 (33,3 %) случаях, в том числе для устранения осложнений — у 2 больных.
Течение послеоперационного периода в сравниваемых группах оценивали по времени пребывания больного в реанимационном отделении, наличию и длительности пареза кишечника, состоянию гемодинамики, выраженности болевого синдрома, длительности стационарного лечения, наличию послеоперационных осложнений.
Средняя продолжительность пребывания больных основной и второй контрольной групп в реанимационном отделении после малоинвазивных адреналэктомий была около 1,0 ± 0,2 суток. У пациентов первой контрольной группы, перенесших традиционную адреналэктомию, это время было значительно больше и составило 2,8 ± 0,6 суток.
Послеоперационный парез кишечника, длившийся от 1 до 3 дней после традиционной адренал-эктомии, при использовании малоинвазивных способов адреналэктомии не превышал 1 суток.
Выраженность волемических нарушений при использовании малоинвазивных способов адренал-эктомии была минимальной. Вследствие этого потребность в заместительной инфузионной терапии у больных основной и второй контрольной групп была незначительной, а объем суточной инфузии не превышал 970 ± 200 мл. При использовании традиционного торакофренолапаротомного доступа для адреналэктомии у пациентов первой контрольной группы объем инфузионной терапии был значительно выше и составил 1950,0 ± 417,7 мл/сутки (р ≤ 0,05).
Интенсивность болевого синдрома после малоинвазивных операций была незначительной, наркотические анальгетики больным не назначались. Потребность в назначении наркотических анальгетиков для купирования болевого синдрома в средней суммарной дозе 1,8 ± 0,6 мл/курс лечения возникала у больных, перенесших адреналэктомию через торакофренолапаротомный доступ.
Количество и характер послеоперационных осложнений у пациентов основной и первой конт-рольной групп существенно отличались. После адреналэктомии из малых доступов было отмечено 1 (0,8 %) осложнение в виде раннего вторичного кровотечения из сосудов ложа надпочечника, явившееся следствием технической ошибки в период освоения методики операции. У пациентов первой контрольной группы после адреналэктомии через торакофренолапаротомный доступ было отмечено 14 (8,6 %) осложнений. Среди них раневые гнойно-септические осложнения составили 5 (35,7 %) случаев, легочно-сердечные осложнения возникли у 7 (50,0 %) пациентов и послеоперационные грыжи — у 2 (14,3 %) больных.
Таким образом, минимизация операционной травмы, достигаемая при использовании технологии малых доступов, способствует уменьшению количества послеоперационных осложнений более чем в 10 раз. Послеоперационная летальность в группе больных, оперированных традиционным доступом, составила 1,8 %. Среди больных, оперированных с использованием малоинвазивных технологий, летальных исходов не было. Длительность стационарного лечения после операций из малых доступов и лапароскопических вмешательств была вдвое короче (7,3 ± 0,5 суток), чем при торакофренолапаротомном доступе, где она составляла 12,3 ± 0,8 суток.
При оценке результатов хирургического лечения больных с новообразованиями надпочечников с позиций экономической эффективности очевидны преимущества операций малых доступов перед другими способами адреналэктомий. Комплект инструментов «мини-ассистент» для адреналэктомии в 10 раз дешевле телевидеоскопического комплекса и инструментов для эндоскопической адреналэктомии. Он не требует сервисного обслуживания и дополнительных расходных материалов, таких как газ, клипсы, контейнеры, необходимых для лапароскопической хирургии. Стабильное хирургическое пространство, формируемое комплектом «мини-ассистент», позволяет выполнять адреналэктомию с участием 2 хирургов, в то время как лапароскопическая и традиционная адреналэктомии требуют участия 3 хирургов. Для выполнения адреналэктомии из мини-доступа достаточно обладать опытом традиционных хирургических вмешательств на надпочечниках и навыками операций из малых доступов. Необходимость дистанционного оперирования, ограниченный перечень технических приемов, отсутствие тактильных ощущений и непрямой визуальный контроль при видеоскопических операциях требуют дополнительной подготовки хирурга для приобретения специальных мануальных навыков.
Результаты хирургического лечения больных с новообразованиями надпочечников с использованием технологии малых доступов свидетельствуют об эффективности и безопасности этих вмешательств при соблюдении принципа дифференцированного индивидуального подхода к выбору способа операции.
Таким образом, технология операций из малых доступов объединяет в себе преимущества малоинвазивных вмешательств с достоинствами традиционных хирургических доступов и на сегодняшний день может считаться операцией выбора для лечения подавляющего большинства новообразований надпочечников.
Выводы
1. Распространенность феохромоцитом в Челябинской области составляет 1,2 случая, кортикостером — 0,57, альдостером — 0,33 случая на 1000 тыс. населения. Клинически «немые» гормонально-неактивные новообразования надпочечников встречаются с частотой 2,08 случая на 1000 тыс. человек.
2. Среди новообразований надпочечников опухоли без клинических проявлений гормональной активности составляют 50,4 %. Опухоли с гиперфункцией коркового или мозгового слоев надпочечника составляют чуть меньше половины (49,6 %) и относятся к феохромоцитомам (28,0 %), кортикостеромам (14,0 %) и альдостеромам (8,0 %).
3. Гормонально-неактивные опухоли надпочечников представляют собой неоднородную группу заболеваний. Большую часть из них составляют адренокортикальные аденомы без клинических проявлений гормональной активности (71,3 %), субклинически или скрыто протекающие феохромоцитомы (3,3 %), а также образования неадреналовой природы (19,3 %) (кисты, псевдокисты, неврогенные опухоли и др.).
4. Среди больных с гормонально-неактивными объемными образованиями надпочечников следует выделять группу пациентов (29,7 %) высокого клинического риска, включающую пациентов с симптоматической артериальной гипертензией надпочечникового происхождения (17,0 %), с «немыми» феохромоцитомами (3,0 %), первичными злокачественными новообразованиями (5,5 %), метастатическими поражениями надпочечников (4,2 %), у которых показания к хирургическому лечению несомненно обоснованы.
5. Предоперационная подготовка больных с феохромоцитомой с использованием селективных a-адреноблокаторов приводит к улучшению показателей гемодинамики. Объективными показателями для оценки эффективности предоперационной подготовки у больных феохромоцитомой являются систолическое артериальное давление, диастолическое артериальное давление, индекс общего периферического сопротивления и амплитуда фотоплетизмографии. Нормализация этих показателей у больных феохромоцитомой свидетельствует о достижении эффекта a-адреноблокады и является критерием оценки ее эффективности.
6. Передний трансабдоминальный мини-доступ является наиболее оптимальным малоинвазивным доступом для адреналэктомии при большинстве новообразований надпочечников. Он обладает минимальной травматичностью, обеспечивает хорошую зону операционной доступности, дает возможность при необходимости выполнять симультанные вмешательства на близлежащих органах и позволяет снизить количество послеоперационных осложнений более чем в 10 раз. Задний поясничный внебрюшинный доступ предпочтителен для левосторонней адреналэктомии при объемных образованиях до 5 см в диаметре.
7. Технология операций из малых доступов объединяет в себе преимущества малоинвазивных вмешательств с достоинствами традиционных хирургических доступов и на сегодняшний день является альтернативой эндовидеохирургии.
1. Казанцева И.А., Калинин А.П., Полякова Г.А. и др. Клиническая морфология кортикальных опухолей гиперплазии надпочечников: Пособие для врачей.– М., 1998. — С. 3-18.
2. Калинин А.П., Давыдова И.В. Феохромоцитома и сердечно-сосудистая система // Тер. архив. — 1982. — Т. 54, № 5. — С. 143-148.
3. Керцман В.П. Клиника и лечение гормонпродуцирующих опухолей коры надпочечника. — Ереван: Айастан, 1977. — С. 319.
4. Фромен Л.А., Фелиг Ф., Бродус А.Е., Бакстер Дж.Д. Клинические проявления эндокринных заболеваний // Эндокринология и метаболизм / Под ред. Ф. Фелига, Дж.Д. Бакстера, А.Е. Бродуса, Л.А. Фромена. — М.: Медицина, 1985. — Т. 1. — С. 11-34.